Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (36): 7863-7871.doi: 10.12307/2025.553
Previous Articles Next Articles
Hematopoietic stem cell mobilization: advantages and disadvantages of different plans and improvements in predictive models and technologies
Han Mengjun1, Xu Fang2
- 1School of Medicine, University of Electronic Science and Technology of China, Chengdu 611731, Sichuan Province, China; 2Mianyang Central Hospital, Mianyang Hospital Affiliated to the School of Medicine of University of Electronic Science and Technology of China, Mianyang 621000, Sichuan Province, China
-
Received:2024-08-08Accepted:2024-09-21Online:2025-12-28Published:2025-03-24 -
Contact:Xu Fang, MD, Chief physician, Mianyang Central Hospital, Mianyang Hospital Affiliated to the School of Medicine of University of Electronic Science and Technology of China, Mianyang 621000, Sichuan Province, China -
About author:Han Mengjun, Master candidate, School of Medicine, University of Electronic Science and Technology of China, Chengdu 611731, Sichuan Province, China -
Supported by:Key Project of Sichuan Anti-Cancer Association Clinical Research, No. XH2023 5006 (to XF); Mianyang Central Hospital Level Project, No. 2023YJ004 (to XF)
CLC Number:
Cite this article
Han Mengjun, Xu Fang. Hematopoietic stem cell mobilization: advantages and disadvantages of different plans and improvements in predictive models and technologies[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7863-7871.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
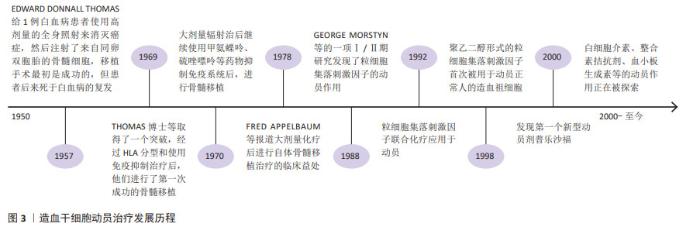
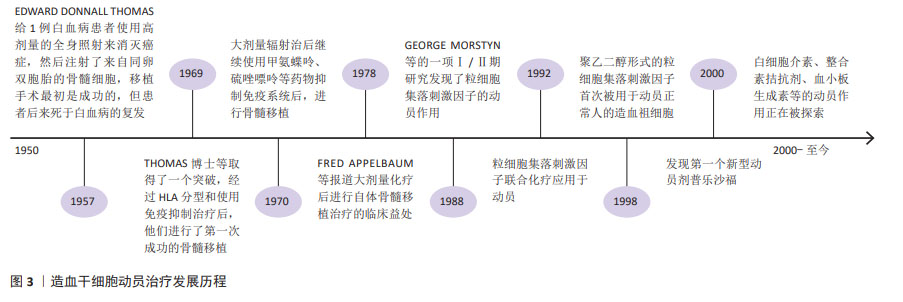
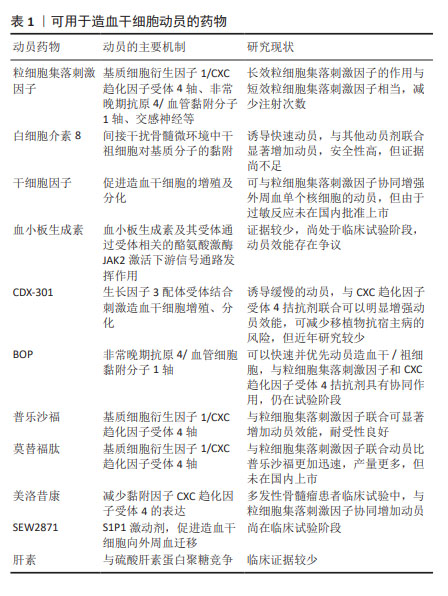
2.2 造血干细胞动员与骨髓微环境 造血干细胞移植已经广泛应用于血液及免疫系统疾病。研究表明,增加CD34+细胞移植的剂量不仅可缩短移植后粒细胞和血小板植入的时间,而且还可促进长期血小板植入的改善,有助于提高总生存率[1];而造血干细胞数量不足或个体间差异可导致血小板或中性粒细胞植入延迟或失败,增加感染的发生率,延长住院时间甚至死亡[2]。目前,2×106/kg CD34+细胞通常被认为是移植所需最小阈值,低于该标准的病例可能无法实现持续的造血功能恢复,≥5×106/kg CD34+细胞与更快的中性粒细胞和血小板植入相关,且患者之间的差异很小,因此该阈值被认为是自体移植的最佳靶点[3]。研究表明多发性骨髓瘤患者为实现成功移植,CD34+细胞的收集目标应满足至少2次移植的用量,理想目标为(8-10)×106/kg,为改善并克服单倍型不匹配移植的排斥反应,CD34+细胞剂量甚至需要超过10×106/kg;由于老年患者移植相关发病率和死亡率的风险增加,有研究表明高剂量的CD34+细胞可加速造血功能恢复,因此更高数量CD34+细胞对老年患者移植也很重要[4]。 通常情况下,造血干细胞位于骨髓特定的生态位即骨髓龛中,仅少部分存在于外周血中,不能满足移植需要。通过造血干细胞动员剂促使骨髓中造血干细胞迁移到外周血循环中,使外周血中的造血干细胞数量显著增加,此过程称为造血干细胞动员。抑制造血干细胞与基质细胞中黏附分子-配体的相互作用,可提高外周血干细胞的动员效果,在稳定状态下,造血干细胞可在外周血中暂时富集10-100倍。骨髓中的造血干细胞存在于一个高度结构化的三维微环境中,由不同的基质细胞、富含纤维连接蛋白、胶原和各种蛋白聚糖的细胞外基质组成,骨髓龛中的信号通路直接参与造血干细胞的维持。在骨髓龛中造血干细胞通过各种黏附分子的相互作用与成骨细胞、其他基质细胞和细胞外基质“相连”,包括:CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)、非常晚期抗原4、晚期抗原5、整合素α4β7(Integrin alpha4beta7,LPAM-1)、整合素α6、CD44、E-选择素、类似表皮生长因子的结构域(Tie-2)、骨桥蛋白、CD164、钙感应受体等。其中维持造血干细胞位于骨髓龛最重要的是基质细胞衍生因子1α/CXCR4轴及非常晚期抗原4/血管黏附分子1轴。造血干细胞动员的基本原理在于:促进造血干细胞的增殖,同时通过破坏各种黏附分子间的作用,促使造血干细胞从骨髓释放到外周血中。因此,可能影响造血干细胞增殖或各黏附因子相互作用的因素,均可能影响造血干细胞动员及采集的效率。用于造血干细胞动员的药物及作用机制见表1。 "
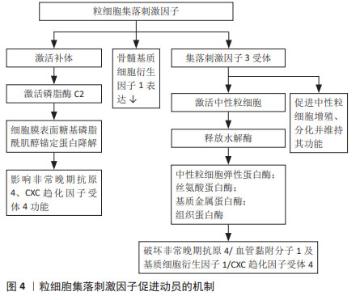
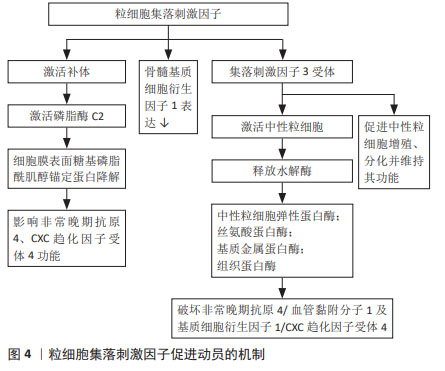
2.3 用于外周血干细胞动员的细胞因子 具有稳定、维持、促进造血干细胞生成的细胞因子常被用于动员,如粒细胞集落刺激因子是最常用的造血干细胞动员剂,白细胞介素、干细胞因子、血小板生成素、生长因子3配体等细胞因子的潜在动员作用也在不断被探索。 2.3.1 长效粒细胞集落刺激因子 粒细胞集落刺激因子是目前最常用的动员剂,可获得更多外周血造血干细胞,从而减少中性粒细胞及血小板的植入时间,提高移植安全性,并在一定临床环境下与更高的总生存率相关,其促进动员的机制见图4。患者对粒细胞集落刺激因子的耐受性通常良好,严重的不良反应如脾破裂、心肌梗死或脑缺血报道较少。重组人粒细胞集落刺激因子半衰期短,需要多天连续注射,通过糖基化或聚乙二醇化等可以延长粒细胞集落刺激因子的半衰期,由此开发出长效粒细胞集落刺激因子,包括聚乙二醇化粒细胞集落刺激因子(pegylated-granulocyte colony-stimulating fator,PEG-rhG-CSF)及其生物类似物(biosimilar Peg-flgrastim,bioPEG)。研究表明单剂量聚乙二醇化粒细胞集落刺激因子与粒细胞集落刺激因子相比,其动员效能及达到目标值的天数相当,具有相同的疗效及安全性,而且可避免多次注射[5]。硫培非格司亭是中国自主创新的新一代聚乙二醇化粒细胞集落刺激因子,已在中国、美国、日本、印度及欧洲等地获得发明专利,6 mg或12 mg固定剂量硫培非格司亭对造血干细胞的动员具有更加方便、高效和安全的优势,目前正在中国进行临床试验,文菁菁等[6]研究证明硫培非格司亭在血液肿瘤患者中动员外周血干细胞的效果与重组人粒细胞集落刺激因子相当,且联合普乐沙福动员可行、有效。bioPEG的动员效能与粒细胞集落刺激因子相当,可减少住院时间及输血需求[7-8]。聚乙二醇化粒细胞集落刺激因子生物类似物EP2006已在欧洲及美国上市,GASCóN等[9]总结了EP2006自上市以来在造血干细胞移植真实世界的数据,证实了EP2006具有较高的安全性、有效性及成本效应。越来越多的研究表明粒细胞集落刺激因子与新药联合,如普乐沙福、血小板生成素、EP80031、Me6、FG-4497和ML141等可以显著提高粒细胞集落刺激因子介导的造血干细胞动员效率,且联合用药可以减少粒细胞集落刺激因子的使用剂量,从而减少粒细胞集落刺激因子相关不良反应[10]。 "
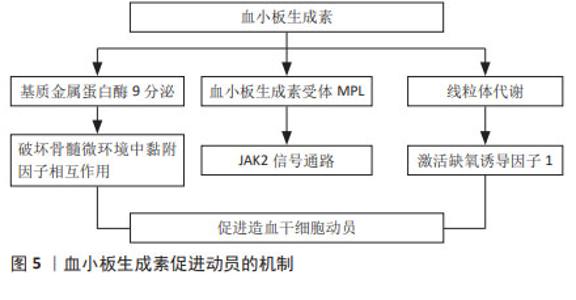
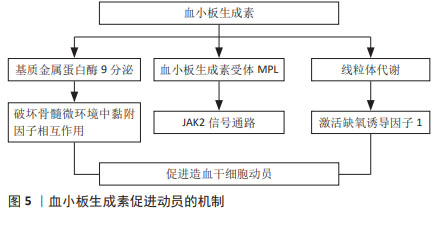
2.3.2 白细胞介素8 白细胞介素8是一种CXC趋化因子,研究表明白细胞介素8是一种快速的动员剂,不论剂量,造血干细胞均在30 min后达到高峰,且动员的造血干细胞数量呈剂量依赖性[11]。单独使用白细胞介素8动员的细胞总数虽不如集落刺激因子介导的动员[12],但白细胞介素8与其他几种造血生长因子如粒细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子、白细胞介素3和干细胞因子联合使用,可显著增加造血干细胞的动员效果[11]。白细胞介素8诱导快速动员的机制之一在于间接干扰骨髓微环境中干祖细胞对基质分子的黏附[11],抗基质金属蛋白酶9或抗淋巴细胞功能相关抗原抗体能显著抑制白细胞介素8诱导的动员,表明基质金属蛋白酶9和淋巴细胞功能相关抗原,即β2整合素(CD11a)是白细胞介素8动员作用的底物[12-13]。白细胞介素8作为急性期级联反应下游的一种细胞因子,已被证明不能在体内诱导其他急性期蛋白的释放,副反应少见,可与其他细胞因子联合使用促进干细胞的动员并且具有较高的安全性[11]。此外白细胞介素家族中白细胞介素33也能参与造血干细胞的动员,白细胞介素33在小鼠中动员造血干细胞和髓系祖细胞相比粒细胞集落刺激因子或AMD3100更有效,此外,与粒细胞集落刺激因子及AMD3100相比,白细胞介素33还能促进淋巴样祖细胞动员,移植后能够同时促进髓系及淋系重建,改善移植的结局,长效、抗氧化的白细胞介素33未来可能成为一种新的动员剂[14]。 2.3.3 干细胞因子 干细胞因子是一类多效性的造血生长因子,可作用于原始细胞、成熟祖细胞、肥大细胞等,能促进造血干细胞的增殖及分化[15]。在小鼠和灵长类动物模型中[16-17],与单独使用粒细胞集落刺激因子相比,低剂量的干细胞因子可与粒细胞集落刺激因子协同增强造血干/祖细胞的动员。在一项Ⅰ/Ⅱ期临床试验中,MOSKOWITZ等[18]比较分析了38例非霍奇金淋巴瘤患者使用重组甲硫酰人干细胞因子联合非格司亭或单独使用非格司亭动员造血祖细胞的能力,研究显示对既往化疗暴露导致骨髓毒性的患者,干细胞因子可能提高造血干细胞动员效能。一项Ⅱ期研究也表明,干细胞因子与粒细胞集落刺激因子联合用于淋巴瘤患者的造血干细胞动员时,其动员能力增强[13]。干细胞因子被批准用于动员后未能达到外周血干细胞最低阈值的患者,但考虑到干细胞因子可能导致由肥大细胞脱颗粒介导的过敏反应,目前仅在澳大利亚、加拿大和新西兰被允许使用[19]。 2.3.4 血小板生成素 血小板生成素主要来源于肝脏,是调节巨核细胞和血小板生成的重要生长因子,同时也是造血干细胞正常发育不可缺少的细胞因子。体外造血干细胞需要血小板生成素才能够存活,研究证明血小板生成素是维持CD150+造血干细胞数量所必需的[15],敲除血小板生成素或骨髓增殖白血病病毒癌基因(myeloproliferative leukemia virus oncogene,MPL)的小鼠可动员移植的造血干细胞减少约7倍[20]。动物实验证实血小板生成素与粒细胞集落刺激因子协同,可极大缩短血小板、红细胞和中性粒细胞的植入时间[21]。血小板生成素主要通过与其受体C-MPL结合发挥作用,见图5,C-MPL主要在造血干细胞、巨核细胞、髓系和红系祖细胞、早期和晚期巨核细胞以及成熟的血小板上表达[22]。血小板生成素与其受体结合,通过受体相关的酪氨酸激酶JAK2激活下游信号通路发挥作用[20,23],线粒体代谢可能在其中起重要作用[24]。 此外,血小板生成素可增加基质金属蛋白酶9的分泌,诱导骨髓来源内皮细胞的迁移[22];还有研究表明血小板生成素可下调骨髓细胞中基质金属蛋白酶9的表达和分泌,促进骨髓龛中基质细胞衍生因子1α水平升高,增强造血干细胞的归巢;骨髓移植后立即对受者进行单剂量血小板生成素治疗,可以显著改善造血干细胞的归巢,促进移植后造血重建[25]。已有研究证明血小板生成素对造血干细胞产生的不同效应可能与其浓度依赖、时间依赖或者与其他细胞因子的相互作用有关[26]。 "
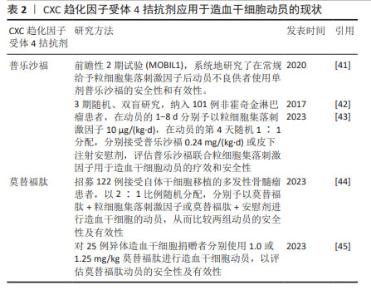
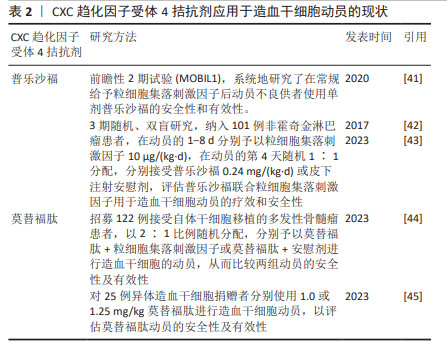
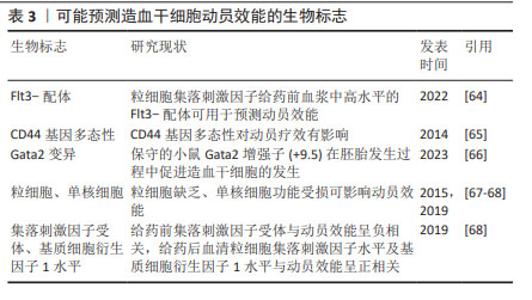
重组人血小板生成素(recombinant human thrombopoietin,rhTPO)是一种全长糖基化的血小板生成素,与内源性血小板生成素有相似的药理作用。体内外实验均证实,重组人血小板生成素不仅能有效提高血小板水平,而且能刺激造血祖细胞的生长,增加其多能性[27]。一些研究证明在传统的动员方案中加入重组人血小板生成素可以提高外周血的造血干细胞产量[28],重组人血小板生成素已被成功应用于多发性骨髓瘤患者的干细胞动员以及接受非清髓化疗的实体肿瘤患者,一般推荐在动员的第1天或第3天连续每天皮下注射15 000 U至动员结束[1]。赵瑾等[29]研究表明重组人血小板生成素联合大剂量依托泊苷和粒细胞集落刺激因子的方案应用于非霍奇金淋巴瘤患者自体外周血造血干细胞动员时,安全有效,总体成功率高。此外,ZHU等[30]研究表明血小板生成素与粒细胞集落刺激因子协同可增强难治性/复发性非霍奇金淋巴瘤患者及乳腺癌患者的干细胞动员。也有研究认为使用重组人血小板生成素在促进祖细胞动员方面没有显著的临床益处,但可促进高剂量化疗后的血小板恢复[31],目前有关重组人血小板生成素应用于临床动员的证据较少,重组人血小板生成素的动员效能尚有争议。 2.3.5 生长因子3配体(flt3-配体) flt3-配体是一种在早期造血过程中参与细胞存活、增殖和分化的细胞因子,其酪氨酸激酶Ⅲ型受体flt3/flk2主要表达于造血祖细胞和多能祖细胞。flt3-配体用于动物及人体造血干细胞动员的速度缓慢,一般在给药10 d后可达到最大的动员效果,并可与多种细胞因子协同提高造血功能[32]。可溶性重组flt3-配体(简称CDX-301)在人类中耐受性良好,连续予以25 μg/(kg·d)或75 μg/(kg·d)注射10 d后能够动员足够的造血干/祖细胞进行移植;CDX-301联合AMD3100可有效动员调节性T细胞,进而可能降低异体移植后发生移植物抗宿主病的概率;在异体移植环境中单独使用CDX-301或CDX-301联合AMD3100进行造血干细胞移植可提高移植生存率[33]。flt3-配体作为一种缓慢的动员剂,与CXCR4拮抗剂联合可明显增强动员效能,对于异体造血干细胞移植来说可能降低移植物抗宿主病的风险。但近年有关CDX-301用于动员的临床数据尚不足,其安全性及有效性有待进一步研究。 2.4 CXCR4拮抗剂 2.4.1 CXCR4拮抗剂的基础研究 CXCR4拮抗剂通过特异性破坏基质细胞衍生因子1/CXCR4轴,促使造血干细胞动员到外周血中,也有研究表明AMD3100能诱导基质金属蛋白酶9等水解酶的激活[34]。CXCR4拮抗剂是一种昂贵但快速且有效的动员剂,可与粒细胞集落刺激因子协同增强动员,在小鼠中2-4 h、人体中6-9 h达到动员高峰[35]。单独使用CXCR4拮抗剂得到的外周血干细胞数量少于粒细胞集落刺激因子介导的动员[10],大约1/3的患者无法动员异体移植所需的最低数量的CD34+细胞[2]。小鼠模型及非人灵长类动物证明单剂量CXCR4拮抗剂与粒细胞集落刺激因子联合位用可以明显增加动员效能[10,36-37]。 相比单独使用粒细胞集落刺激因子动员获得的造血干细胞,普乐沙福动员的造血干细胞更多处于生长阶段,可能具有更强的骨髓和免疫系统重建能力[38]。 2.4.2 普乐沙福及莫替福肽 当前全球仅有普乐沙福(AMD3100)和莫替福肽(Motixafortide,BL-8040,BKT140)两款CXCR4拮抗剂获批上市,作为与粒细胞集落刺激因子联合使用的动员剂用于接受高剂量化疗后进行自体干细胞移植的非霍奇金淋巴瘤和多发性骨髓瘤患者的造血干细胞动员[30,38-39]。普乐沙福动员骨髓造血干祖细胞的能力已在许多实验模型系统中得到证实[10,13,40],患者在使用普乐沙福进行干细胞动员时具有良好的耐受性、动员成功率及移植成功率[10,38-39]。多项研究表明普乐沙福联合粒细胞集落刺激因子动员效能优于单独使用粒细胞集落刺激因子,可用于动员不良患者的挽救性动员,且耐受性良好,一般推荐在采集干细胞的前1 d皮下注射普乐沙福25 mg或240 μg/kg;在动员失败的患者中,60%的非霍奇金淋巴瘤病例和71%的多发性骨髓瘤病例经普乐沙福取得成功动员[30,41-43]。但因其成本高而尚未作为一线动员剂,主要用于预测动员不良的患者或动员失败的挽救治疗。临床研究表明:在非霍奇金淋巴瘤和多发性骨髓瘤患者中使用包含普乐沙福在内的动员方案,仍分别有40%和25%的动员失败率[10]。莫替福肽是一种新型CXCR4拮抗剂,临床前和临床试验均证明莫替福肽可以快速动员足够数量的造血干细胞,莫替福肽单独或与其他动员剂联合使用,在1.0-1.25 mg/kg剂量范围内,干细胞动员效率呈剂量依赖性增加,且莫替福肽可优先动员更加原始的细胞[35,44]。莫替福肽与普乐沙福相比动员更加迅速、获得的造血干细胞更多,与粒细胞集落刺激因子联用效果显著优于普乐沙福+粒细胞集落刺激因子[35,45]。Ⅲ期试验(GENESIS trial)证实了早期临床试验结果:莫替福肽安全有效且与粒细胞集落刺激因子联用显著增强动员疗效[44]。但莫替福肽尚未在国内上市。普乐沙福和莫替福肽的应用现状见表2。 "
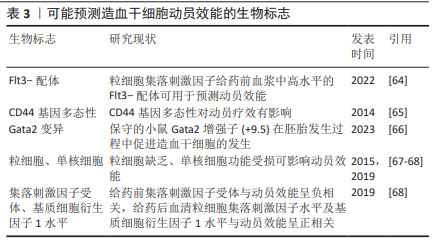
2.4.3 新型CXCR4拮抗剂 此外,一些很有前景的CXCR4拮抗剂尚处于临床开发阶段,包括POL6326、TG-0054、LY2510924、HF51116、POL5551、CX0714、T-140和T-134等[10,33]。LUO等[10]研究了7种新型CXCR4拮抗剂,发现与普乐沙福相比,T-140、POL5551和CX0714具有显著的动员能力。TG-0054已进入多发性骨髓瘤患者造血干细胞动员的临床试验,可以快速收集足够造血干细胞,患者的耐受性良好[8,46],而且研究显示在粒细胞集落刺激因子和TG-0054联合使用中添加普萘洛尔比粒细胞集落刺激因子和普乐沙福联合使用具有更强的干细胞动员能力,但仍处于临床试验阶段[24]。这几类新型CXCR4拮抗剂未来或可替代普乐沙福或莫替福肽,但在人体中的动员效能及安全性需进一步研究。 2.5 整合素拮抗剂 细胞黏附分子中整合素家族成员在造血系统中广泛表达,并在造血细胞与其微环境之间发挥决定性作用。非常晚期抗原4/血管黏附分子1轴对稳定造血干细胞于骨髓龛中至关重要[13,36]。通过中和抗体或特异性小分子抑制剂来抑制整合素α4β1和血管黏附分子1,可以有效动员小鼠和灵长类动物中的干细胞[36]。α4整合素基因缺陷小鼠的造血祖细胞在外周血中积累,造血干细胞的归巢出现延迟[47],这些研究表明整合素拮抗剂在干细胞动员中的应用潜能。临床研究显示:α4整合素拮抗剂那他珠单抗存在发生或增加致命性疾病的可能,如进行性多灶性白质脑病,故仅被批准应用于多发性硬化,未能应用于临床动员。高效选择性小分子α4β1拮抗剂BIO5192,可单独动员造血干/祖细胞,也可与粒细胞集落刺激因子和或AMD3100 联合使用,迄今没有发生进行性多灶性白质脑病的报道,但动员效能较弱,仍处于研究阶段[33]。双重α9β1/α4β1整合素抑制剂BOP,可以快速并优先动员造血干/祖细胞,与粒细胞集落刺激因子和CXCR4拮抗剂具有协同作用[24,48]。研究表明与粒细胞集落刺激因子和AMD3100相比,BOP与粒细胞集落刺激因子和AMD3100联合使用可能具有显著优势,且BOP可以特异性靶向造血干细胞,增强动员[36]。单剂量BOP与单剂量AMD3100联合使用,与粒细胞集落刺激因子动员4 d后得到的造血干/祖细胞数量相似。但与粒细胞集落刺激因子相比,BOP和AMD3100联合使用可显著增强小鼠的短期和长期移植,这表明联合使用BOP和AMD3100可能成为一种可替代粒细胞集落刺激因子的快速、有效方案,改善干细胞的动员[4],但其在人体动员中的疗效尚不清楚。总之,非常晚期抗原4拮抗剂用于造血干细胞动员仍在实验研究阶段。 2.6 化疗联合的动员方案 化疗是最早发现可以动员骨髓中造血干细胞至外周血的方案,在发现粒细胞集落刺激因子之前造血干细胞的动员仅依靠于化疗。化疗联合的动员方案机制在于化疗后骨髓抑制恢复时,干细胞可以出现反应性增生,而且若在恢复早期使用细胞因子如粒细胞集落刺激因子可以动员大量造血干细胞进入外周循环。环磷酰胺是最为常用的化疗动员方案,推荐剂量为4g/m2,低于4 g/m2不能获得足够的动员,而超过4 g/m2相关毒性增加且不能有效提升动员效能[38,49]。有临床研究探讨提升动员疗效的联合方案,将高剂量环磷酰胺或长春瑞滨联合环磷酰胺(Vino-Cy)用于多发性骨髓瘤患者干细胞动员,长春瑞滨联合环磷酰胺方案获得足够移植的干细胞的天数比环磷酰胺少,动员相关毒性更小[50]。依托泊苷通过促进骨髓基质细胞分泌白细胞介素8实现造血干细胞动员,李菁等[51]研究发现依托泊苷联合粒细胞集落刺激因子较环磷酰胺联合粒细胞集落刺激因子动员方案更为有效,不良反应可控。然而分泌的白细胞介素8也会损伤骨髓,长期使用依托泊苷会对骨髓间充质干细胞产生毒性作用[52],故需谨慎使用。在化疗恢复期予以粒细胞集落刺激因子或粒细胞巨噬细胞集落刺激因子可使造血祖细胞的数量增加,达到治疗前血液中造血祖细胞水平的1 000倍[13],许多临床研究提示化疗与细胞因子联合动员明显比单独使用生长因子更有效,但其安全性及动员效能尚存在争议,尤其是不推荐体能情况较差的老年患者。GIRALT等[38]研究表明联合化疗比粒细胞集落刺激因子单独使用能动员更多的干细胞,但动员失败率相似。一项Meta分析纳入18项研究,包括4项前瞻性研究和14项回顾性研究,对比了2 770例多发性骨髓瘤患者,发现环磷酰胺联合粒细胞集落刺激因子比单独使用粒细胞集落刺激因子具有更高的CD34+细胞产量、良好的无事件生存期和更好的3年无事件生存率[53]。YE等[54]证明依托泊苷联合阿糖胞苷、培非格司亭对动员不良的多发性骨髓瘤或淋巴瘤患者进行动员非常有效且具有可耐受的毒性;在一项单中心研究中,阿扎胞苷联合粒细胞集落刺激因子作为一线动员比环磷酰胺联合粒细胞集落刺激因子更有效,主要的不良反应是血小板减少[48]。粒细胞集落刺激因子联合化疗可以增加动员效能,但能否改善患者的移植结果,如完全缓解率、进展时间、无事件生存期或总生存期等仍存在争议,且化疗毒副反应带来的成本增加、不良反应、采集时间的不确定性限制了化疗为主的动员方案的应用。 2.7 潜在的动员靶点 除了以上较为常见的干细胞动员方案,还有一些潜在的动员靶点。MENENDEZ-GONZALEZ等[55]发现小鼠和人造血干细胞表面表达前列腺素E2受体,前列腺素E2与其受体结合后,增加黏附因子CXCR4的表达,进而促进造血干细胞的归巢,使用非类固醇抗炎药如美洛昔康可促进造血干细胞的动员。多发性骨髓瘤患者已接受美洛昔康联合粒细胞集落刺激因子进行动员,动员效能优于单独使用粒细胞集落刺激因子,患者结局相似[4,56]。1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)作为一种造血趋化剂,与造血干细胞表面的S1P1受体结合有助于造血干细胞进入外周血,且S1P/S1P1R轴在CXCR4拮抗剂的动员过程中发挥重要作用[57]。CXCR4拮抗剂与S1P1激动剂SEW2871联合可以增强干细胞的动员[57]。多种S1P激动剂已进入临床试验,但大都应用于风湿免疫性疾病的治疗,未来或可研究出靶向S1P的动员剂,与CXCR4拮抗剂联合使用或是作为粒细胞集落刺激因子联合CXCR4拮抗剂的补救措施。动物实验显示Notch信号可调节骨髓生成[34],阻断Notch配体受体黏附或阻断Notch2信号,均可诱导造血干/祖细胞的动员,且不会显著影响造血干细胞的稳态,短暂的Notch2阻断可获得更高的造血干细胞产量和更好的髓系重建[34],并可使造血干细胞对粒细胞集落刺激因子和普乐沙福的动员刺激敏感,导致动员增加三四倍[58]。肝素可与硫酸肝素蛋白聚糖竞争,从而促进干细胞动员,使用肝素可减少干细胞动员剂的需求[48,59]。ADAMIAK等[60]研究表明:ATP及其代谢物腺苷的嘌呤能信号通路可以调节造血干/祖细胞的动员,ATP可以促进动员,但腺苷可以通过负反馈起抑制作用,因此ATP或小分子拮抗剂抑制CD73与粒细胞集落刺激因子或AMD3100联合给药可能为更有效的动员策略提供基础。此外,EP80031、小分子物质Me6、脯氨酸羟化酶抑制剂FG-4497、细胞分裂控制蛋白42抑制剂ML141等,与粒细胞集落刺激因子或AMD3100联合不仅增加动员效能,还增强造血重建,其中Me6、POL5551单独作用可以取得比粒细胞集落刺激因子更好的效果,但相关毒性能否降低仍需进一步探究[10]。值得一提的是,中等强度的有氧运动也可能促进造血干细胞动员到血液中,可作为一种经济的辅助动员剂,但其中的机制尚不清楚,推测可能是由于运动带来的血流动力学变化、内源性粒细胞集落刺激因子释放或β2-肾上腺素能受体信号转导等引起[61]。此外,痛觉神经也参与干细胞动员的过程,给予小鼠含有辣椒素的食物可显著增强小鼠干细胞的动员[62]。未来针对以上潜在的靶点进行干细胞动员药物的开发,以及与现有动员药物联合方案的设计,可能进一步提升造血干细胞动员效率。 2.8 造血干细胞动员效能的预测 动员采集足够的CD34+细胞是移植成功的关键,通过影响动员的因素对动员效能进行预测,从而调整动员方案,可能改善患者预后。以往的研究显示疾病类型、患者年龄、性别、体质量、体质量指数、外周血基线白细胞、血小板、CD34+细胞计数、乳酸脱氢酶测定、吸烟状况、铁状态、疾病分期、既往化疗和治疗过程、既往放疗史、动员方案、肿瘤细胞是否侵犯骨髓等均与动员效能有关[1, 37,63],特别是以往化疗、放疗的数量和强度对干细胞动员效果的影响最大。但动员效果是显著可变的,在异体干细胞动员中通常有20%-30%的变异性不能由现有文献中的确定因素解释[63],目前尚未有模型能够对干细胞动员效能进行精准预测。然而,也有研究者使用不同的影响因素构建预测模型,动员前对患者进行评估有一定意义,但预测效能低[63]。 研究者们也在积极寻找能够预测动员效能的其他生物标志物,见表3。有研究显示高体质量指数与干细胞动员的程度呈正相关[64],可能与慢性全身炎症相关;SZMIGIELSKA-KAPLON等[65]发现CD44基因多态性对造血干细胞动员的疗效有影响;SOUKUP等[66]发现保守的小鼠Gata2增强子(+9.5)在胚胎发生过程中促进造血干细胞的发生,Gata2变异可能是动员效率的重要决定因素;WANG等[64]发现粒细胞集落刺激因子给药前血浆中高水平的flt3-配体可用于预测动员效率;胆固醇及低密度脂蛋白也是人类干细胞动员的重要生物学标记物,但也有研究表明胆固醇对动员效率的影响可以忽略不计[64];粒细胞缺乏、单核细胞功能受损可能影响造血干细胞的动员[67-68];GEBURA等[68]研究报道在粒细胞集落刺激因子介导的动员中,给药前粒细胞集落刺激因子受体与动员效能呈负相关,给药后血清粒细胞集落刺激因子水平及基质细胞衍生因子1水平与动员效能呈正相关。由此不难看出,影响造血干细胞动员效率的因素多,目前尚缺乏有效、共认的预测体系,纳入生物学标志物的预测模型未来值得进一步探讨。 "
| [1] GU J, LIU J, LI X, et al. Recombinant human thrombopoietin improved platelet engraftment after autologous hematopoietic stem cell transplantation in patients with newly diagnosed multiple myeloma. Cancer Med. 2021;10(21):7641-7649. [2] FANG X, FANG X, MAO Y, et al. A novel small molecule CXCR4 antagonist potently mobilizes hematopoietic stem cells in mice and monkeys. Stem Cell Res Ther. 2021;12(1):17. [3] WEI X, WEI Y. Stem cell mobilization in multiple myeloma: challenges, strategies, and current developments. Ann Hematol. 2023;102(5): 995-1009. [4] DE KRUIJF EFM, FIBBE WE, VAN PEL M. Cytokine-induced hematopoietic stem and progenitor cell mobilization: unraveling interactions between stem cells and their niche. Ann N Y Acad Sci. 2020;1466(1):24-38. [5] ABID MB, DE MEL S, ABID MA, et al. Pegylated Filgrastim Versus Filgrastim for Stem Cell Mobilization in Multiple Myeloma After Novel Agent Induction. Clin Lymphoma Myeloma Leuk. 2018;18(3):174-179. [6] 文菁菁,石林,许芳,等.硫培非格司亭在血液肿瘤患者外周血造血干细胞动员中的应用及采集影响因素分析[J].四川大学学报(医学版), 2023,54(3):625-630. [7] MARCHESI F, TERRENATO I, PAPA E, et al. Efficacy and safety of biosimilar Peg-filgrastim after autologous stem cell transplant in myeloma and lymphoma patients: a comparative study with biosimilar Filgrastim, Lenograstim, and originator Peg-filgrastim. Ann Hematol. 2024;103(3):947-956. [8] PRISCIANDARO M, SANTINELLI E, TOMARCHIO V, et al. Stem Cells Collection and Mobilization in Adult Autologous/Allogeneic Transplantation: Critical Points and Future Challenges. Cells. 2024;13(7):586. [9] GASCÓN P, HARBECK N, RAPOPORT BL, et al. Filgrastim biosimilar (EP2006): A review of 15 years’ post-approval evidence. Crit Rev Oncol Hematol. 2024;196:104306. [10] LUO C, WANG L, WU G, et al. Comparison of the efficacy of hematopoietic stem cell mobilization regimens: a systematic review and network meta-analysis of preclinical studies. Stem Cell Res Ther. 2021;12(1):310. [11] LATERVEER L, LINDLEY IJ, HEEMSKERK DP, et al. Rapid mobilization of hematopoietic progenitor cells in rhesus monkeys by a single intravenous injection of interleukin-8. Blood. 1996;87(2):781-788. [12] LAPIDOT T, PETIT I. Current understanding of stem cell mobilization: the roles of chemokines, proteolytic enzymes, adhesion molecules, cytokines, and stromal cells. Exp Hematol. 2002;30(9):973-981. [13] NERVI B, LINK DC, DIPERSIO JF. Cytokines and hematopoietic stem cell mobilization. J Cell Biochem. 2006;99(3):690-705. [14] ALT C, YUAN S, WU F, et al. Long-Acting IL-33 Mobilizes High-Quality Hematopoietic Stem and Progenitor Cells More Efficiently Than Granulocyte Colony-Stimulating Factor or AMD3100. Biol Blood Marrow Transplant. 2019;25(8):1475-1485. [15] BOZHILOV YK, HSU I, BROWN EJ, et al. In Vitro Human Haematopoietic Stem Cell Expansion and Differentiation. Cells. 2023;12(6):896. [16] MCNIECE IK, BRIDDELL RA, HARTLEY CA, et al. Stem cell factor enhances in vivo effects of granulocyte colony stimulating factor for stimulating mobilization of peripheral blood progenitor cells. Stem Cells. 1993;11 Suppl 2:36-41. [17] ANDREWS RG, KNITTER GH, BARTELMEZ SH, et al. Recombinant human stem cell factor, a c-kit ligand, stimulates hematopoiesis in primates. Blood. 1991;78(8):1975-1980. [18] MOSKOWITZ CH, STIFF P, GORDON MS, et al. Recombinant methionyl human stem cell factor and filgrastim for peripheral blood progenitor cell mobilization and transplantation in non-Hodgkin’s lymphoma patients--results of a phase I/II trial. Blood. 1997;89(9):3136-3147. [19] LARSEN SR, CHNG K, BATTAH F, et al. Improved granulocyte colony-stimulating factor mobilization of hemopoietic progenitors using cytokine combinations in primates. Stem Cells. 2008;26(11):2974-2980. [20] KIM AR, SANKARAN VG. Thrombopoietin: tickling the HSC’s fancy. EMBO Mol Med. 2018;10(1):10-12. [21] WAGEMAKER G, NEELIS KJ, HARTONG SC, et al. The efficacy of recombinant thrombopoietin in murine and nonhuman primate models for radiation-induced myelosuppression and stem cell transplantation. Stem Cells. 1998; 16(6):375-386. [22] LAMANUZZI A, SALTARELLA I, FRASSANITO MA, et al. Thrombopoietin Promotes Angiogenesis and Disease Progression in Patients with Multiple Myeloma. Am J Pathol. 2021;191(4):748-758. [23] QIAN J, CAO X, SHEN Q, et al. Thrombopoietin Promotes Cell Proliferation and Attenuates Apoptosis of Aplastic Anemia Serum-Treated 32D Cells via Activating STAT3/STAT5 Signaling Pathway and Modulating Apoptosis-Related Mediators. Cell Transplant. 2021;30:963689720980367. [24] CANCILLA D, RETTIG MP, KARPOVA D, et al. Targeting CXCR4, VLA-4, and CXCR2 for hematopoietic stem cell mobilization. Blood Adv. 2024;8(6): 1379-1383. [25] LIU Y, DING L, ZHANG B, et al. Thrombopoietin enhances hematopoietic stem and progenitor cell homing by impeding matrix metalloproteinase 9 expression. Stem Cells Transl Med. 2020;9(6):661-673. [26] KOVTONYUK LV, MANZ MG, TAKIZAWA H. Enhanced thrombopoietin but not G-CSF receptor stimulation induces self-renewing hematopoietic stem cell divisions in vivo. Blood. 2016;127(25):3175-3179. [27] WAGEMAKER G, HARTONG SC, NEELIS KJ, et al. In vivo expansion of hemopoietic stem cells. Stem Cells. 1998;16 Suppl 1:185-191. [28] HSU TL, TSAI CK, LIU CY, et al. Risk Factors and Outcomes of Stem Cell Mobilization Failure in Multiple Myeloma Patients. Transfus Med Hemother. 2022;50(1):39-50. [29] 赵瑾,苏丽萍,王江涛,等.重组人血小板生成素联合粒细胞集落刺激因子在非霍奇金淋巴瘤自体外周血干细胞动员中的应用[J].肿瘤研究与临床,2019,31(12):849-851. [30] ZHU J, HAO SG, HU J, et al. rhTPO combined with chemotherapy and G-CSF for autologous peripheral blood stem cells in patients with refractory/relapsed non-Hodgkin’s lymphoma. Cancer Manag Res. 2019;11:8371-8377. [31] MO H, LIU P, QIN Y, et al. Recombinant human thrombopoietin prior to mobilization chemotherapy facilitates platelet recovery in autologous transplantation in patients with lymphoma: Results of a prospective randomized study. Chronic Dis Transl Med. 2021;7(3):190-198. [32] WILLIAMS KM, MOORE AR, LUCAS PJ, et al. FLT3 ligand regulates thymic precursor cells and hematopoietic stem cells through interactions with CXCR4 and the marrow niche. Exp Hematol. 2017;52:40-49. [33] DOMINGUES MJ, NILSSON SK, CAO B. New agents in HSC mobilization. Int J Hematol. 2017;105(2):141-152. [34] ALBAKRI M, TASHKANDI H, ZHOU L. A Review of Advances in Hematopoietic Stem Cell Mobilization and the Potential Role of Notch2 Blockade. Cell Transplant. 2020;29:963689720947146. [35] CREES ZD, RETTIG MP, DIPERSIO JF. Innovations in hematopoietic stem-cell mobilization: a review of the novel CXCR4 inhibitor motixafortide. Ther Adv Hematol. 2023;14:20406207231174304. [36] CAO B, ZHANG Z, GRASSINGER J, et al. Therapeutic targeting and rapid mobilization of endosteal HSC using a small molecule integrin antagonist. Nat Commun. 2016;7:11007. [37] SHI H, DUAN Y, BU X. Analysis of Factors Affecting Hematopoietic Stem Cell Mobilization Efficiency and Early Hematopoietic Reconstruction Indicators during Autologous Peripheral Blood Hematopoietic Stem Cell Transplantation. Glob Med Genet. 2024;11(2):159-166. [38] GIRALT S, COSTA L, SCHRIBER J, et al. Optimizing autologous stem cell mobilization strategies to improve patient outcomes: consensus guidelines and recommendations. Biol Blood Marrow Transplant. 2014;20(3):295-308. [39] YUAN S, WANG S. How do we mobilize and collect autologous peripheral blood stem cells? Transfusion. 2017;57(1):13-23. [40] DE CLERCQ E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 2009;77(11):1655-1664. [41] HÖLIG K, SCHMIDT H, HÜTTER G, et al. Salvage treatment with plerixafor in poor mobilizing allogeneic stem cell donors: results of a prospective phase II-trial. Bone Marrow Transplant. 2021;56(3):635-645. [42] ZHU J, HUANG H, CHEN H, et al. Plerixafor and granulocyte-colony-stimulating factor for mobilization of hematopoietic stem cells for autologous transplantation in Chinese patients with non-Hodgkin’s lymphoma: a randomized Phase 3 study. Transfusion. 2018;58(1):81-87. [43] BITTRICH M, KRIEGSMANN K, TIETZE-STOLLEY C, et al. A German-Wide Systematic Study on Mobilization and Collection of Hematopoietic Stem Cells in Poor Mobilizer Patients with Multiple Myeloma prior to Autologous Stem Cell Transplantation. Transfus Med Hemother. 2023;50(6):475-490. [44] CREES ZD, RETTIG MP, JAYASINGHE RG, et al. Motixafortide and G-CSF to mobilize hematopoietic stem cells for autologous transplantation in multiple myeloma: a randomized phase 3 trial. Nat Med. 2023;29(4): 869-879. [45] CREES ZD, RETTIG MP, BASHEY A, et al. Hematopoietic stem cell mobilization for allogeneic stem cell transplantation by motixafortide, a novel CXCR4 inhibitor. Blood Adv. 2023;7(18):5210-5214. [46] SUKHTANKAR DD, FUNG JJ, KIM MN, et al. GPC-100, a novel CXCR4 antagonist, improves in vivo hematopoietic cell mobilization when combined with propranolol. PLoS One. 2023;18(10):e0287863. [47] SCOTT LM, PRIESTLEY GV, PAPAYANNOPOULOU T. Deletion of alpha4 integrins from adult hematopoietic cells reveals roles in homeostasis, regeneration, and homing. Mol Cell Biol. 2003;23(24):9349-9360. [48] DE ANDRADE KJS, BOTELHO LFB, CALIXTO RF, et al. Evaluation of efficacy and safety in the use of cytarabine for mobilization of hematopoietic stem cells in a reference hospital in northeastern Brazil. Hematol Transfus Cell Ther. 2024;46(4):428-433. [49] PARK Y, KIM DS, JEON MJ, et al. Single-dose etoposide is an effective and safe protocol for stem cell mobilization in patients with multiple myeloma. J Clin Apher. 2019;34(5):579-588. [50] DE MEL S, CHEN Y, LIN A, et al. Vinorelbine-Cyclophosphamide compared to cyclophosphamide in peripheral blood stem cell mobilization for multiple myeloma. Hematol Oncol Stem Cell Ther. 2018;11(4):225-232. [51] 李菁,张闰,陈丽娟,等.依托泊苷联合G-CSF与环磷酰胺联合G-CSF方案在新诊断多发性骨髓瘤患者自体外周造血干细胞动员中的比较[J].中华血液学杂志,2022,43(9):781-784. [52] KANG KW, LEE SJ, KIM JH, et al. Etoposide-mediated interleukin-8 secretion from bone marrow stromal cells induces hematopoietic stem cell mobilization. BMC Cancer. 2020;20(1):619. [53] WANG L, XIANG H, YAN Y, et al. Correction to: Comparison of the efficiency, safety, and survival outcomes in two stem cell mobilization regimens with cyclophosphamide plus G-CSF or G-CSF alone in multiple myeloma: a meta-analysis. Ann Hematol. 2021;100(2):575. [54] YE P, PEI R, LIAN J, et al. Higher efficacy of Etoposide + Cytarabine Plus Pegfilgrastim in poorly mobilizing Multiple Myeloma and lymphoma Patients. Cytotherapy. 2023;25(8):885-890. [55] MENENDEZ-GONZALEZ JB, HOGGATT J. Hematopoietic Stem Cell Mobilization: Current Collection Approaches, Stem Cell Heterogeneity, and a Proposed New Method for Stem Cell Transplant Conditioning. Stem Cell Rev Rep. 2021;17(6):1939-1953. [56] PATTERSON AM, ZHANG S, LIU L, et al. Meloxicam with Filgrastim may Reduce Oxidative Stress in Hematopoietic Progenitor Cells during Mobilization of Autologous Peripheral Blood Stem Cells in Patients with Multiple Myeloma. Stem Cell Rev Rep. 2021;17(6):2124-2138. [57] JUAREZ JG, HARUN N, THIEN M, et al. Sphingosine-1-phosphate facilitates trafficking of hematopoietic stem cells and their mobilization by CXCR4 antagonists in mice. Blood. 2012;119(3):707-716. [58] CHANG HH, LIOU YS, SUN DS. Hematopoietic stem cell mobilization. Tzu Chi Med J. 2021;34(3):270-275. [59] GUL HG, ERKURT MA, SARICI A, et al. An innovation in stem cell harvesting: Heparin use. Transfus Apher Sci. 2021;60(5):103240. [60] ADAMIAK M, BUJKO K, CYMER M, et al. Novel evidence that extracellular nucleotides and purinergic signaling induce innate immunity-mediated mobilization of hematopoietic stem/progenitor cells. Leukemia. 2018; 32(9):1920-1931. [61] KASRAVI K, GHAZALIAN F, GAEINI A, et al. A Comparison of the Effect of Two Types of Continuous and Discontinuous Aerobic Exercise on Patients’ Stem Cell Mobilization before Autologous Hematopoietic Stem Cell Transplantation. Int J Hematol Oncol Stem Cell Res. 2021;15(1):61-71. [62] GAO X, ZHANG D, XU C, et al. Nociceptive nerves regulate haematopoietic stem cell mobilization. Nature. 2021;589(7843):591-596. [63] PICCIRILLO N, PUTZULU R, METAFUNI E, et al. Peripheral Blood Allogeneic Stem Cell Mobilization: Can We Predict a Suboptimal Mobilization? Transfus Med Rev. 2023;37(2):150725. [64] WANG TF, LIOU YS, CHANG HH, et al. Correlation of Body Mass Index and Proinflammatory Cytokine Levels with Hematopoietic Stem Cell Mobilization. J Clin Med. 2022;11(14):4169. [65] SZMIGIELSKA-KAPLON A, SZEMRAJ J, HAMARA K, et al. Polymorphism of CD44 influences the efficacy of CD34(+) cells mobilization in patients with hematological malignancies. Biol Blood Marrow Transplant. 2014;20(7):986-991. [66] SOUKUP AA, BRESNICK EH. Gata2 noncoding genetic variation as a determinant of hematopoietic stem/progenitor cell mobilization efficiency. Blood Adv. 2023;7(24):7564-7575. [67] ADAMIAK M, PONIEWIERSKA-BARAN A, BORKOWSKA S, et al. Evidence that a lipolytic enzyme--hematopoietic-specific phospholipase C-β2--promotes mobilization of hematopoietic stem cells by decreasing their lipid raft-mediated bone marrow retention and increasing the promobilizing effects of granulocytes. Leukemia. 2016;30(4):919-928. [68] GĘBURA K, BUTRYM A, CHASZCZEWSKA-MARKOWSKA M, et al. G-CSF administration favours SDF-1 release and activation of neutrophils and monocytes in recipients of autologous peripheral blood progenitor cells. Cytokine. 2019;116:38-47. |
| [1] | Yu Shuai, Liu Jiawei, Zhu Bin, Pan Tan, Li Xinglong, Sun Guangfeng, Yu Haiyang, Ding Ya, Wang Hongliang. Hot issues and application prospects of small molecule drugs in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1913-1922. |
| [2] | Chen Shuai, Jin Jie, Han Huawei, Tian Ningsheng, Li Zhiwei . Causal relationship between circulating inflammatory cytokines and bone mineral density based on two-sample Mendelian randomization [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1556-1564. |
| [3] | Chen Yaodong, Ren Jiayi, Cao Jingwei, Fan Wenwen, Chen Wu. Near-infrared photoresponsive h-PCuNF nanoparticles mediate multimodal therapeutics against malignant tumors [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 780-788. |
| [4] | Guo Zhao, Zhuang Haoyan, Shi Xuewen. Role of exosomes derived from mesenchymal stem cells in treatment of colorectal cancer [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7872-7879. |
| [5] | Zhang Pulian, Liu Baoru, Yang Min . Mesenchymal stem cells for treatment of aplastic anemia: inhibiting or activating relevant targets in its pathological evolution [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(31): 6800-6810. |
| [6] | Wang Jianxu, Dong Zihao, Huang Zishuai, Li Siying, Yang Guang. Interaction between immune microenvironment and bone aging and treatment strategies [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6509-6519. |
| [7] | Liu Hanfei, Cai Zhencun, Zhou Xueting, Wen Hang, Chen Zhenjun. Mechanisms by which traumatic brain injury promotes bone callus formation and fracture healing [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(29): 6260-6268. |
| [8] | Lin Rongqin, Pan Xiuxie, Bian Lihong. Bioinformatic analysis on expression of Foxp3 in tumor microenvironment of ovarian cancer and its relationship with survival prognosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(29): 6343-6350. |
| [9] | Lin Meiyu, Zhao Xilong, Gao Jing, Zhao Jing, Ruan Guangping. Action mechanism and progress of stem cells against ovarian granulosa cell senescence [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(25): 5414-5421. |
| [10] | Fan Hongkai, Guan Yingying, Wang Lumin, Zeng Fanwei, Yin Yirui. Feasibility of gastric cancer organoid models for personalized drug screening [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(25): 5345-5350. |
| [11] | Guo Zhao, Zhuang Haoyan, Shi Xuewen. Crossroads of colorectal cancer progression and suppression: efficacy and challenges of mesenchymal stem cell therapy interventions [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(23): 5022-5030. |
| [12] | Wen Jianyun, Chen Libai, He Yuelin, Feng Xiaoqin, Liu Xuan, Xu Xiaoxiao, Li Xiu, Liu Qiujun, Wu Xuedong. Human leukocyte antigen matched sibling fresh cord blood transplantation for beta-thalassaemia major in children [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(23): 4899-4906. |
| [13] | Liu Fushui, Qian Jiaming, Fang Ting, Khaliunaa Tumurbaatar, Zhao Xiaolan, Zhu Jinchao, Wang Xiaole. Effects of acupotomy on the expression of fibroblast growth factor family and its receptor in the splenius capitis muscles of rats with cervical spondylosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(18): 3775-3783. |
| [14] | Shi Peili, Lin Sen, Zhao Wenteng, Peng Yali, Hu Yazhe. Effects of pressor stimulation at different times on rat skeletal muscle morphology and tumor necrosis factor alpha and nuclear factor kappaB [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3588-3595. |
| [15] | Tang Xiran, Chen Weijian, Jiang Tao, Tan Xianyun, Liu Wengang . Types and contents of fatty acids and the risk of knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3724-3731. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||