Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (26): 4234-4241.doi: 10.12307/2024.380
Previous Articles Next Articles
Application of MRI-based image navigation and target selection in transcranial magnetic stimulation treatment
Wang Li1, Chen Peng2, Wei Xiuying1, Lu Yangjia3, Lai Sijia1, Wang Kaihua1
- 1Department of Neurology, 2Department of Radiology, International Zhuang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530200, Guangxi Zhuang Autonomous Region, China; 3College of Acupuncture and Massage, Guangxi University of Chinese Medicine, Nanning 530200, Guangxi Zhuang Autonomous Region, China
-
Received:2023-05-23Accepted:2023-07-14Online:2024-09-18Published:2023-10-07 -
Contact:Wang Kaihua, MD, Chief physician, Master’s supervisor, Department of Neurology, International Zhuang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530200, Guangxi Zhuang Autonomous Region, China -
About author:Wang Li, MD, Associate chief physician, Department of Neurology, International Zhuang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530200, Guangxi Zhuang Autonomous Region, China -
Supported by:the Doctoral Research Foundation Project of Guangxi University of Chinese Medicine, No. 2020BS031 (to WL); the Self-funded Project of Traditional Chinese Medicine Bureau of Guangxi, No. 20210393 (to WL); the Basic Research Ability Improvement Project of Young and Middle-aged Teachers in Universities of Guangxi, No. 2021KY0308 (to WL); the Research Project of Chinese Society of Ethnic Medicine, No. 2022M1112-140201 (to WL); the Guangxi Key Discipline of Encephalopathy of Traditional Chinese Medicine, No. GZXK-Z-20-14 (to WKH); the Second Batch of “Qihuang Project” High-Level Talent Team Cultivation Project of Guangxi University of Chinese Medicine, No. 2021008 (to WKH)
CLC Number:
Cite this article
Wang Li, Chen Peng, Wei Xiuying, Lu Yangjia, Lai Sijia, Wang Kaihua. Application of MRI-based image navigation and target selection in transcranial magnetic stimulation treatment[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(26): 4234-4241.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 传统经颅磁刺激线圈定位和靶区选择 2.1.1 传统线圈定位方法 图3归纳了经颅磁刺激线圈定位方法的发展脉络,包括传统直接刺激定位、经验性脑图谱推测定位、国际脑电10-20系统定位方案,以及现代神经导航、移动式增强现实等辅助定位方案[7-18]。早在1985年,BARKER等[7]首次通过经颅磁刺激刺激大脑皮质诱发手部肌肉强直性收缩运动来定位初级运动皮质手部区域(M1-Hand区)的位置。采用类似方法,研究者在头部缓慢移动刺激线圈诱发语言停止、视光现象、拇指触觉等目标反应来定位语言皮质、视觉皮质及躯体感觉皮质刺激靶区[11,19]。此类方法简便、易行,但仅能定位能诱发躯体明确反应的目标脑区,但对于诸如抑郁、焦虑等症状的责任脑区无法作出明确判断。"

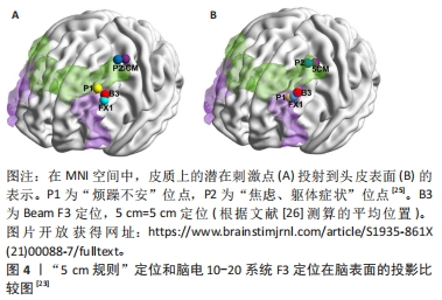
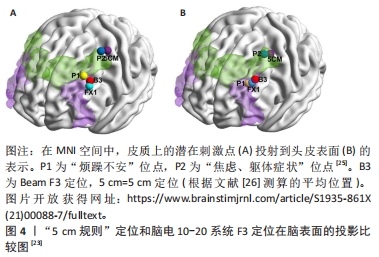
在1995年,GEORGE等[8]利用标准化Talairach脑图谱模板推算出焦虑、抑郁治疗相关常用治疗位点——背外侧前额叶皮质(dorsolateral prefrontal cortex,dlPFC)的头皮表面位置,它定位于M1-Hand区前5 cm平行于正中矢状线,又称“5 cm规则”。以此类推,后继研究者进一步推算出其他刺激位点位置,例如,腹侧前额叶(ventral prefrontal cortex,vPFC)位于dlPFC至正中矢状线的垂直线上向腹侧移动4 cm处[10],背内侧前额叶(dorsomedial prefrontal cortex,dmPFC)位于dlPFC至正中矢状线的垂直线上向内移动2 cm处[10],前运动皮质(premotor cortex)位于M1-Hand区前2 cm、靠内1 cm处[9],躯体感觉皮质(somatosensory cortex)位于M1-Hand区后3 cm处[11]。上述定位方法成本低廉、易于操作,但忽略了人脑存在巨大的个体差异,并且该方法极度依赖操作者的经验和医学知识,使得所定位的脑区与实际目标脑区极易存在操作者误差,出现定位不准确的情况。 目前,基层医疗单位常用国际脑电10-20系统定位法进行经颅磁刺激脑区定位[12]。该方法根据头部表面解剖标识,如鼻根、小翼和耳前点,将电极以10%或20%的步距连续放置于各点以定位脑区。其中,C3和C4定位点分别对应左/右侧初级运动皮质区,即M1-Hand区,F3和F4对应左/右侧dlPFC,Fz对应辅助运动区等。该方法的优点是考虑了人脑存在大小不一的差异,按头颅整体大小的百分比换算位点,提高了准确性。然而,仍有约10%的定位点可存在约20 mm的偏差[20]。并且,大脑宏观解剖测量发现,不同人脑前后中央沟的位置在Talairach标准脑模板上可存在15-20 mm的变异[21],还可能左右不对称[22],这提示脑电10-20系统的比例坐标系在准确标注出个体大脑表面的宏观解剖位点上还存在一定局限。 脑图谱推测法和脑电10-20系统是目前临床上最常用定位方案,但即便对于同一个目标脑区,上述两种方法的定位位点之间仍存在一定的距离。有研究发现,针对dlPFC的定位,常用的“5 cm规则”定位和脑电10-20系统F3定位在脑表面的投影存在明显偏差 [23-26] ,见图4,脑电定位比“5 cm规则”方法的定位更靠前,为其前外侧(2.6±1.0) cm [24]。如何提高经颅磁刺激治疗定位的准确性和一致性,尽量减少临床上可观察到治疗效果的差异,将具有重要研究意义。"

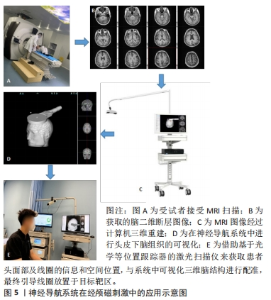
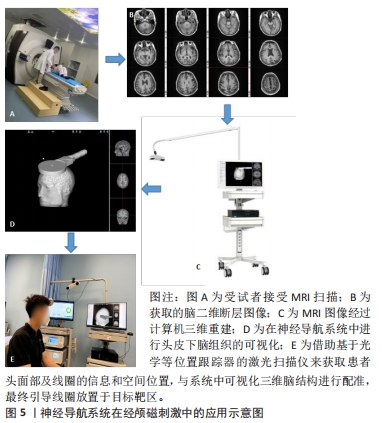
2.1.2 传统靶区选择策略 根据2020年发表的欧洲经颅磁刺激循证治疗推荐[1],经颅磁刺激已尝试用于治疗疼痛、运动障碍性疾病、脑卒中、多发性硬化、癫痫、抑郁、精神分裂症及成瘾等多种神经精神障碍疾病,目前取得相对明确疗效的治疗区域是:刺激左侧dlPFC治疗抑郁症;刺激疼痛对侧M1区治疗神经性疼痛;刺激健侧M1区改善急性脑卒中患者手运动功能障碍;刺激双侧M1区改善帕金森病运动障碍等。中国大多数医疗单位经颅磁刺激治疗靶区选择主要依赖于上述循证经验,但有研究显示,这种靶区选择策略存在一定局限性。SIDDIQI等[25]发现,具有“烦躁不安”倾向的抑郁症患者对前外侧靶点的刺激反应最好(靠近F3定位区域),具有“焦虑、躯体症状”倾向的抑郁症患者对靠后侧、内侧靶点的刺激反应好(靠近“5 cm规则”定位区域)。大量研究表明,不同临床亚型可涉及不同的脑网络回路障碍,对特定脑区进行准确刺激,建立临床相关脑功能、结构影像结果与经颅磁刺激治疗之间的桥梁,将有助于实现经颅磁刺激的精准治疗。 因此,传统经颅磁刺激线圈定位策略经历了直接刺激定位、脑图谱经验性推测定位、国际脑电10-20系统定位等这几种方法,但它们或存在阴性反应区难以定位、个体化不足、方法间存在一定差异等局限性。经颅磁刺激治疗靶区选择目前多依赖于临床循证治疗推荐,但这类方法未能考虑不同临床亚型背景下治疗靶区可能具有差异。因此,如何提高线圈定位策略的准确性、优化治疗靶区的选择是提高经颅磁刺激治疗疗效的关键环节。 2.2 基于MRI的影像导航定位 2.2.1 神经导航系统 基本机制:线圈传统定位方案的不足日益突显,研究者们试图不断优化经颅磁刺激线圈定位引导策略,由此发展出了利用神经导航系统、移动式增强现实技术辅助定位等方法,见表1。"

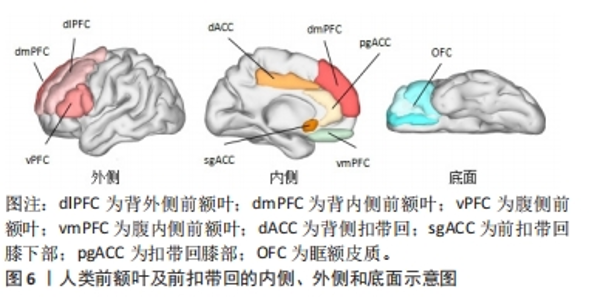
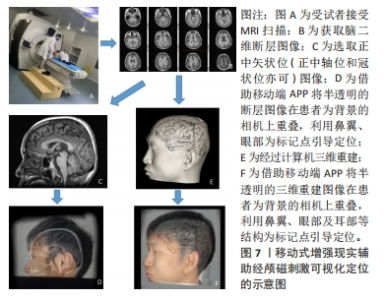
脑三维重建、头模配准及立体几何定位是计算机辅助神经导航的几个关键步骤。在进行脑三维重建之前需要对原始脑MRI图像进行分割,即提取脑脊液、灰质、白质等脑结构图像特征;随后,将上述分割好的二维断层图像经计算机辅助运算、重建成三维立体结构。常用的重建方法有基于采样点的分析重建、基于网格的分析重建、基于函数的分析重建、基于大脑结构骨架构建以及基于空间变形的构建[28]。针对近年来出现的高分辨率MRI,OSECHINSKIY等[29]还提出了一种新的基于偏微分方程(partial differential equation)的皮质自动重建方法,该方法改进了基于空间变性的构建方法,具有更高的计算效率和网格分辨率。随着图像分割技术、脑三维模型构建方法的不断完善,使得重建图像与真实脑之间的差别缩小到毫米级、甚至亚毫米级,新方法的出现亦提高了重建效率和分辨率,这为神经导航的精准定位打下了基础。将构建好的三维头模与患者真实解剖进行配准,使图像空间实时变换叠加到现实空间,即为头模空间配准。通过匹配两个空间中存在的一些共同特征可实现配准,分为成对点配准和曲面配准。 目前大多数经颅磁刺激计算机辅助神经导航系统采用的是曲面配准技术:使用专用设备(通常是配备基于光学、电磁技术或红外线位置跟踪器的激光扫描仪)来获取患者头部表面信息和空间位置,患者头部曲面信息通常用一组点来表示,这被称为点云(point cloud),然后与从影像图像空间中提取的面部表面数据特征进行匹配与识别,计算两个空间之间的坐标变换关系[30],即完成三维重建图像与真实解剖的配准重叠。 三维重建图像与真实解剖的配准、特定脑区的定位需借助立体定向原理来实现。常用的立体几何坐标系有:通过X、Y、Z坐标轴定位的笛卡尔坐标系(Cartesian coordinate system),和通过与水平面和垂直面的角度以及到参考点的距离来定位目标的弧坐标系。立体定向是借助欧几里得空间里多个笛卡尔坐标系的变换而实现的[31]。由一个坐标系xxyz转换到另一个坐标系x’xyz,可通过使用包含旋转矩阵R’、缩放矩阵S’和平移矩阵T’的数据换算实现[公式(1)]。脑三维重建空间到人脑解剖空间的转变亦可直接由矩阵变换完成。一般来说,人脑解剖空间建立在脑内标志点的基础上,如前连合(AC)、后连合(PC)和中线点(midline),即中线-前连合-后连合(midACPC)解剖坐标系。借助一个组合旋转矩阵Rxyz(包含冠状角ψ、矢状角φ、轴向角γ),midACPC坐标系中某一解剖位点Xc可校准到标准坐标系Δxn中心的解剖位点Xn[公式(2)]。以此类推,亦可推算出midAPCP坐标系中某个目标位点Xt在Δxn坐标系中的具体位置[公式(3)],通过计算机辅助运算即可定位出目标靶区。 xxyz=R’·S’·X’xyz+T’ 公式(1) Xn=Xc+Rxyz·Δxn 公式(2) Δxn=Rxyz·(Xn-Xc) 公式(3) 误差来源:神经导航系统的数据处理和导航过程中可存在多种不同类型的误差,产生这些误差的原因和结果也很复杂,需要了解什么时候可能发生误差、误差的大小,以及如何避免或减少其对最终应用准确度的影响。根据神经导航系统的工作原理,文章将所有误差分为两类:①由图像重建的解剖结构与真实解剖结构不同而产生的误差,包括物理成像过程和图像后处理所产生的误差。前者主要是与大多数功能MRI图像采用回波平面成像(the echo-planar imaging,EPI)扫描有关,因扫描磁场的不均匀性造成的一定的几何畸变扭曲,这在颞叶和额叶尤其明显,现在可采用多点EPI(multi-shot EPI)方法减少失真和模糊[32]。后者来源于导航系统图像的后处理,包括原始序列和参考序列之间的转换、脑图谱与患者图像之间的配准所产生的误差,以及白质纤维追踪过程中的偏差,这种误差几乎很难完全避免。②由不同头模配准方法导致的头模与真实患者头颅对齐而产生误差。针对配对点配准,误差主要来源于基准定位误差和基准配准误差[33]。对于曲面配准,误差来源于两个不同空间的匹配表面之间的平均距离,这种误差平均为(5.35±1.64) mm[34]。此外,头模与真实头颅对齐程度还与位置跟踪装置精确度有关,一般光学跟踪装置精确度(0.3-0.25 mm)比电磁跟踪装置的(0.9-1.4 mm)更高[35]。但无论如何,神经导航系统的导航误差基本维持在毫米级水平,相对于其他定位方案仍具有较大优势。 神经导航系统在经颅磁刺激中的应用价值:有证据表明,颅骨表面测量方法靶向脑区dlPFC的可重复性低,即使是有经验丰富的经颅磁刺激技术人员在场,颅骨表面测量定位dlPFC的差异可增加近7倍[36]。相比之下,神经导航系统引导的经颅磁刺激脑区定位中,目标脑区峰值电场的位置、方向和电场强度变异的平均准确度范围为1.5-5.0 mm、0.9°-4.8°、4.4%-8.5%[37]。这提示使用基于计算机辅助的神经导航系统可能比使用卷尺定位头皮上的治疗部位更优越[36]。此外,有研究直接比较了临床常用的弹性定位帽(基于脑电10-20系统)和神经导航系统在经颅磁刺激治疗上的准确性和精确度,结果发现:在与目标脑区位置偏离方面,定位帽可达(10.66±0.19) mm,神经导航系统仅为(0.3±0.03) mm;在滚动/俯仰轴上,定位帽在偏转可达(7.79±1.07) °,偏斜(5.99±0.12) °,神经导航系统偏转仅为(0.34±0.01) °,偏斜(0.22±0.004) °;操作者差异上,定位帽存在显著差异,但在神经导航系统中并未观察到此类显著差异;在刺激强度方面,在给予标准120% 运动阈值(motor threshold,MT)刺激下,定位帽定位的刺激靶区等效电场为110.7% MT(MT范围58.3%-127.4%),显著低于神经导航系统刺激靶区的等效电场119.9% MT(MT范围115%-123.3%,P < 0.001),这提示不管是在定位准确性、操作者差异及刺激强度稳定性上,神经导航系统相对定位帽方法均显示出治疗优势[38]。另有一项研究比较了“5 cm规则”、脑电F3法和神经导航系统在经颅磁刺激治疗中诱导电场的差异,结果显示以“5 cm规则”产生的电场最弱(46.0±17.4) V/m,其次是F3方法(87.4±35.4) V/m,MRI引导法相对较高(112.1±14.6) V/m,这提示利用神经导航系统实现MRI引导线圈定位相对另外两种颅测方法,可增强电磁场给药到治疗靶点的能力[39]。综上所述,神经导航系统相对传统定位方法,显示出脑区定位更加精确、对操作者依赖小、使刺激靶区获得更为稳健的预期刺激强度等优势。 尽管神经导航系统具有上述优势,且已开展的临床随机双盲研究提示神经导航系统引导下的经颅磁刺激在抑郁症、神经病理性疼痛和脑卒中后失语等多种疾病的治疗中取得一定临床疗效[40-42],有效改善疾病症状,但遗憾的是,在与传统定位方法治疗有效性比较上,神经导航系统目前尚未能证明具有明确的临床优势。最近一项单中心、随机、双盲研究比较了37例中度以上抑郁患者接受神经导航系统(n=16)或脑电F3(n=15)引导的经颅磁刺激治疗效果,经过 4周治疗后两组间的主要观察指标汉密尔顿抑郁评分改善率无显著差异,两组治疗应答率分别为60%与56%,无统计学差异[43]。这可能是由于经颅磁刺激治疗疾病的效果还取决于除了靶向方法之外的诸多因素(如靶点选择),同时这些研究可能也受到研究样本量偏小、无法排除一些高度异质的混杂因素的影响[36]。如果想要充分发挥精确定位策略的最大价值、提高治疗应答率,也许还需要借助多种不同模态磁共振扫描寻找更为精准的治疗目标。以抑郁症为例,如图6所示,dlPFC常是经颅磁刺激的首选治疗脑区,但目前大量的结构和功能MRI研究提示,内侧PFC亚区(例如vmPFC,dmPFC,dlPFC等)、前扣带回皮质(例如pgACC,sgACC,dACC等)、前内侧眶额皮质(OFC)等脑区的灰质体积变化及脑功能连通性改变分别与抑郁多种临床表型(如消极处理倾向、快感缺失和习得性无助等)相关[44]。然而,这些信息并没有转化成更好的经颅磁刺激治疗策略。神经导航系统的应用或可利用这些脑功能连通信息及脑结构特征性变化,为具有不同背景机制的临床表型提供独特的治疗机会,以此进一步提高经颅磁刺激的治疗应答率。"
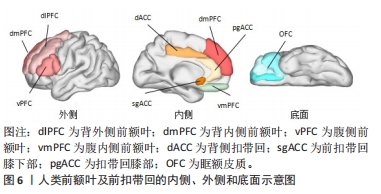
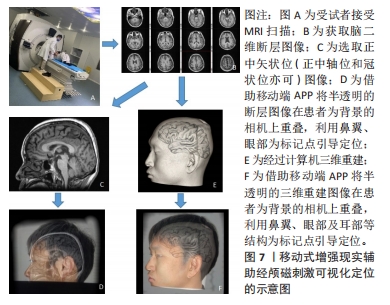
总之,神经导航系统利用立体定向原理,可视化引导刺激线圈到达MRI上预先选定的脑区,是目前准确度最高的经颅磁刺激线圈定位策略。然而,在临床观察中,可能由于疗效还取决于除了靶向方法之外的诸多因素(如靶点选择),神经导航系统定位策略的经颅磁刺激治疗应答率相对传统方案并未显现出明显优势。同时,由于神经导航系统设备昂贵、普及率低,目前仅适用于少部分大型医疗科研机构,一定程度上限制了神经导航系统的推广应用。 2.2.2 移动式增强现实 为了满足不同医疗机构对于经颅磁刺激脑区定位导航的需求,且不显著增加患者经济负担,移动式增强现实辅助脑区定位不失为一种极具潜力的替代方法,具有广泛应用前景。移动式增强现实是将计算机生成的虚拟物体、场景叠加到用户视觉的真实环境场景中,在视觉上为用户提供计算机模拟生成的附加信息,增强现实感官体验。其基本流程为采集数据进行建模形成模拟图像、将模拟图像与真实环境进行匹配、最终增强图像的显示[45]。智能手机等移动设备具有便携、低成本、可移动等优势,是移动式增强现实的良好平台。借助手持移动设备(如手机和平板电脑)中的移动式增强现实视图APP将MRI的2D断层成像或重建3D图像与人头部区域进行叠加,对头皮下的内部结构进行可视化,可帮助操作者直观地获得脑区结构在头颅表面的空间投射,提高操作准确性,同时降低了影像导航的可视化成本,见图7。目前,已有数种移动式增强现实应用程序可协助引导经颅磁刺激线圈的放置,下面将对它们进行简要介绍。"

在2015年,SOEIRO等[14]开发了一款专用于引导经颅磁刺激线圈放置的移动式增强现实应用软件,它提供3种模式:普通移动式增强现实模式、立体移动式增强现实模式和交互式虚拟现实(virtual reality,VR)模式,供操作者使用,具有较好交互性。但该应用需要预先使用专业性极强的Freesurferr (http://freesurfer.net/)和Blender(http://www.blender.org/)软件对影像数据进行预处理,增加了数据处理难度,限制了推广。相比之下,一些最初为神经外科手术辅助定位设计的移动式增强现实程序,MRI图像处理要求低,可直接应用于经颅磁刺激线圈可视化定位导航。例如,SINA(Sina Intraoperative Neurosurgical Assist)最早是由EFTEKHAR[15]开发用于神经外科手术辅助定位的应用程序。将患者CT或MRI二维断层图像上传到手机,SINA可将半透明断层图像在患者为背景的相机上重叠,利用鼻和眶缘作为定位引导,移动设备朝向或远离患者头部时,正确重叠图像,该方法定位浅表皮质靶区中心与标准神经导航系统定位的中心误差为(10.2±2) mm[15],定位小脑幕上靶区与神经导航系统定位误差为(13.6±0.55) mm[46]。 为了增加移动式增强现实对准灵敏度,HOU等[16]利用绘图工具将MRI矢状位2D图像上的目标区域抠出后在正中矢状位上做叠加绘制,保存该叠加图像后,利用FUSED应用将该叠加图像与患者为背景的相机上对齐,使得唇、鼻尖及额部曲线等解剖标志完全重叠,从而实现辅助定位,该方法与神经导航系统相比,靶区中心偏移误差下降为2.90-4.20 mm。与此同时,DOGAN等[47]则利用覆盖于颅骨外的人工标记,采用对准点配准来提高移动式增强现实对准的灵敏度。随后,ALSHOMER等[17]尝试采用3D重建图像进行移动式增强现实定位引导:他们将3D图像上传到智能手机,使用Camera Lucida程序将3D图像叠加在手机摄像头视图上,通过调整图像的透明度、倾斜、饱和度和投影图像的位置来实现与真实头颅的对齐和头皮下可视化[17]。 然而,上述APP尚不能提供图像的实时叠加配准,只能进行矢状位、冠状位或轴位投射,对于不同角度投射定位存在一定局限性。针对这个不足,SHU等[18]根据SLAM算法优化了手机应用的实时定位和空间映射功能,应用流程包括4个阶段:①在3D Slicer软件中进行图像分割和3D模型创建;②将3D模型上传到服务器;③3D模型下载和在智能手机上显示;④借助头面部解剖学特征(如耳、眼、鼻)人工手动注册对齐虚拟对象与真实对象。该移动式增强现实程序的准确性可满足> 15 mm靶区的头皮定位需求,与神经导航系统定位相比误差在(6.7±3.7) mm范围。 目前,移动式增强现实技术推广仍十分有限,且尚不能替代神经导航系统的定位方法,其准确性有待不断提高。上述移动式增强现实程序多使用移动设备中的相机叠加成像,操作者需在移动设备与经颅磁刺激设备间反复移动来确定刺激位置,影响了操作便捷性及体验,未来还需要不断设计、改进APP的操作方案,进一步增强用户操作体验。无论如何,在实际临床工作中,基于移动设备的移动式增强现实应用程序是一种简便、实用的工具,它不需要额外过高花费,操作者可通过叠加患者的影像图片进行目标脑区的可视化和辅助定位,有助于提高经颅磁刺激线圈放置的准确性和个体化程度。在无神经导航系统定位系统的医疗单位,使用移动式增强现实不失为一种经济、高效的辅助定位选择。 2.3 基于不同模态MRI数据分析的靶区选择 2.3.1 脑3D解剖成像 近年来,多种不同模态MRI扫描分析技术获得不断发展,可为经颅磁刺激治疗靶点的选择提供更多依据,利用这些脑影像学特征指导经颅磁刺激治疗,或可充分发挥影像导航定位优势,提高治疗有效率。采用脑3D-T1 MRI显示脑大体宏观解剖识别经颅磁刺激治疗脑区,是当前较为常用的经颅磁刺激靶区选择方法。脑3D-T1图像经三维重建后,在显示器上显示,操作者借助经验性的皮质表面特征解剖标志识别目标脑区,确认线圈瞄准位置。例如,中央前回上M1-Hand区的典型表现为在轴面呈现倒“Ω”或“ε”形状,矢状面上呈“钩子”状结构;dlPFC可定位额上沟(轴状面上起点位于中央前沟前方、后方或与之交叉,并向前走行连续)前部稍偏下之处等。此外,还可在神经导航系统中手动输入目标脑区的坐标来定位。例如,dlPFC在Brainsight系统中,MNI模板坐标为X=-46,Y=45,Z=38,Talairach模板坐标为X=-45,Y=45,Z=35[48]。也有研究推荐,对于dlPFC的治疗,可选择Braodman 46区和9区之间的边界区域作为治疗靶区[24]。上述方法可让操作者根据既往经验或脑模板坐标,将经颅磁刺激刺激线圈置于某个目标脑表面结构,不足之处是未能将目标靶区与个体化功能或结构异常的脑区关联起来。 2.3.2 脑功能成像 基于血氧水平依赖的功能MRI(the blood oxygen level dependent-functional MRI,BOLD-fMRI),可显示疾病人群静息状态(Resting state)和任务状态(Task based paradigm)下异常激活的大脑区域,有助于实现个体化经颅磁刺激治疗刺激靶区的选择。例如,ZHANG等[49]的研究中,对基于视觉任务中BOLD-fMRI激活的视觉皮质进行经颅磁刺激治疗,其静息态脑功能连接异常改善更佳。此外,还可借助注意力任务、语言任务、手指运动任务和吞咽动作和疼痛刺激等不同任务获取功能性脑区[50-54],作为经颅磁刺激治疗的目标靶区。相比之下,对于精神分裂症、抑郁症、焦虑症及睡眠障碍等难以使用任务来定位的异常脑区,通过静息状态下脑功能连接的特征性改变来锚定治疗靶区是另一种有效方法。 ROSCOE等[55]采用数据驱动的静息状态功能连接分析来识别与精神分裂症阴性症状严重程度相对应的连接网络,发现dlPFC-小脑网络连接的中断与阴性症状的严重程度明显相关,经过对小脑蚓部功能阳性亚区1周经颅磁刺激治疗后,异常的静息态脑功能连接得到恢复,阴性症状也显著改善。前期研究发现,前扣带回膝下部(the subgenual anterior cingulate cortex,sgACC)主要负责情绪加工,调节对应激事件的情绪反应、情绪表达,针对DLPFC的经颅磁刺激刺激效应可传播到sgACC,sgACC激活可作为经颅磁刺激治疗反应的生物标志物[26]。LUO等[56]通过刺激静息态fMRI扫描中与sgACC信号具有最强功能连接的dlPFC亚区,获得了相对刺激dlPFC传统定位处(“5 cm规则”法)更好的抗抑郁治疗效果。CAO等[57]提出了一种新的基于脑功能网络的经颅磁刺激病理网络靶向模型,该研究首先定义了两个网络,一个是刺激网络,即经颅磁刺激治疗直接调控的皮质区域(由刺激区域引发的全脑功能连接网络),另一个是疾病病理网络,即某种疾病状态下的脑功能连接异常网络。该靶向模型的原理是假设经颅磁刺激治疗的有效性是刺激网络可弥补病理网络不足,即经颅磁刺激治疗可使得刺激网络和疾病病理网络之间存在空间反相关性,那么通过计算机辅助运算,就能换算出特定疾病的靶向治疗区域。为了验证该靶向模型的有效性,该研究对两组抑郁症患者和一组伴有言语幻听的精神分裂症患者进行了靶向治疗和验证,结果提示靶向刺激与患者汉密尔顿抑郁评定量表总改善显著相关,与幻听评定量表的总改善及阳性症状变化存在显著相关性[57]。 上述治疗脑区的选择主要是基于组群内或组群间差异性,该方法有助于将刺激位点定位到组群中功能性脑区的亚区,但是否能将刺激位点再进一步定位到个体功能性脑区,尽可能发挥经颅磁刺激精准化治疗效果,是未来极具挑战的研究方向之一。个体大脑皮质功能连接在拓扑结构上是复杂的,包含了在群体平均数据集中无法观察到的小而可靠的特征。对脑功能网络,个体特异性具有与群体效应相当的影响效应,它们是影响脑功能网络最主要的2个不同因素[58]。然而,由于个体功能连接测量时间信噪比较低,使用每个受试者的少量fMRI数据(5-20 min)获得的结果并不能准确地描述大脑功能和组织[59],为获得稳健的个体间变异,使用传统方法至少需要数小时的采集时间[58],显著限制了个体功能连接测量在经颅磁刺激治疗上的临床应用。针对上述难题,近年来研究者们试图研发新的图像采集和数据处理方法。CASH等[60]开发了SEEDMAP联合CLUSTER方法用于经颅磁刺激个体化靶点定位,采用该方法只需对受试者同一天进行2次BOLD-fMRI扫描(时间分别为14 min 33 s),即可准确而可靠地定位个体化治疗目标,该个体化治疗目标在不同的2 d内重复扫描的平均精度误差约为2 mm,即使在1年后,坐标之间的个体距离偏差也只有2.7 mm。该研究为经颅磁刺激治疗群体层面的功能目标定位转移到个体化功能目标定位提供了可能性。 2.3.3 脑结构成像 经颅磁刺激临床上最常用的8字线圈,只能直接有效地刺激距离头部表面约3 cm的浅表皮质,尚缺乏有效的方法来识别皮质下瞄准的路线,指导经颅磁刺激线圈的放置以到达脑深部目标,这限制了经颅磁刺激在研究和治疗严重涉及内侧和深部结构疾病中的效用。有研究发现,经颅磁刺激的影响可通过结构连接向大脑其他部位传播[61-62]。一项经颅磁刺激-EEG结合静息态功能和扩散加权成像(difusion weighted imaging,DWI)研究发现,在经颅磁刺激诱导的脑电信号在DWI投影图(而非静息态fMRI)上传播得更多,提示经颅磁刺激效应优先传播到结构连接上而非功能连接上的大脑区域[61],该现象可能是因为对神经元施加电场时,它们的膜电位会发生改变,产生的动作电位可能会启动并优先沿着纤维束向更深、更广泛的大脑区域传播[63]。有研究发现这种结构连接的传播,往往依赖于脑功能网络水平的传播,而非目标区域内或全脑网络连接的水平的传播[62]。经颅磁刺激对浅表皮质目标的刺激可以在远端位置产生可测量的效果,但机制仍未清楚。目前针对基于结构连接的经颅磁刺激线圈定位的研究还十分有限,使用扩散加权MRI数据重现静息态fMRI的功能连接也存在诸多挑战,但基于DWI的传播模式预测有望用于估计经颅磁刺激治疗的脱靶情况,可进一步指导刺激目标选择,最大限度地提高治疗特异性和有效性。基于不同模态MRI数据的靶区选择相关研究见表2。"

| [1] DENG ZD, LISANBY SH, PETERCHEV AV. Electric field depth-focality tradeoff in transcranial magnetic stimulation: simulation comparison of 50 coil designs. Brain Stimul. 2013;6(1):1-13. [2] LEFAUCHEUR JP, ALEMAN A, BAEKEN C, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): an update (2014-2018). Clin Neurophysiol. 2020;131(2):474-528. [3] DE GOEDE AA, TER BRAACK EM, VAN PUTTEN M. Accurate coil positioning is important for single and paired pulse TMS on the subject level. Brain Topogr. 2018;31(6):917-930. [4] 万振宽.重复经颅磁刺激(含定位导航系统)技术及临床应用[J].中国医疗设备,2011,26(1):99-101. [5] 王辉.经颅磁刺激线圈定位方法研究[J].集成技术,2013,2(4):49-55. [6] 周天鹏,张广浩,吴昌哲,等.经颅磁刺激定位方法的研究进展[J].中国生物医学工程学报,2017,36(6):741-748. [7] BARKER AT, JALINOUS R, FREESTON IL. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1985;1(8437):1106-1107. [8] GEORGE MS, WASSERMANN EM, WILLIAMS WA, et al. Daily repetitive transcranial magnetic stimulation (rTMS) improves mood in depression. Neuroreport. 1995; 6(14):1853-1856. [9] SCHLUTER ND, RUSHWORTH MF, PASSINGHAM RE, et al. Temporary interference in human lateral premotor cortex suggests dominance for the selection of movements. A study using transcranial magnetic stimulation. Brain. 1998;121(5): 785-799. [10] MOTTAGHY FM, GANGITANO M, SPARING R, et al. Segregation of areas related to visual working memory in the prefrontal cortex revealed by rTMS. Cereb Cortex. 2002;12(4):369-375. [11] KOCH G, FRANCA M, ALBRECHT UV, et al. Effects of paired pulse TMS of primary somatosensory cortex on perception of a peripheral electrical stimulus. Exp Brain Res. 2006;172(3):416-424. [12] KLEM GH, LÜDERS HO, JASPER HH, et al. The ten-twenty electrode system of the international federation. the international federation of clinical neurophysiology. Electroencephalogr Clin Neurophysiol Suppl. 1999;52:3-6. [13] BOROOJERDI B, FOLTYS H, KRINGS T, et al. Localization of the motor hand area using transcranial magnetic stimulation and functional magnetic resonance imaging. Clin Neurophysiol. 1999;110(4):699-704. [14] SOEIRO J, CLÁUDIO AP, CARMO MB, et al. Visualizing the brain on a mixed reality smartphone application. Annu Int Conf IEEE Eng Med Biol Soc. 2015;2015:5090-5093. [15] EFTEKHAR B. A smartphone app to assist scalp localization of superficial supratentorial lesions--technical note. World Neurosurg. 2016;85:359-363. [16] HOU Y, MA L, ZHU R, et al. A low-cost iphone-assisted augmented reality solution for the localization of intracranial lesions. PLoS One. 2016;11(7):e159185. [17] ALSHOMER F, ALAZZAM A, ALTURKI A, et al. Smartphone-assisted augmented reality in craniofacial surgery. Plast Reconstr Surg Glob Open. 2021;9(8):e3743. [18] SHU XJ, WANG Y, XIN H, et al. Real-time augmented reality application in presurgical planning and lesion scalp localization by a smartphone. Acta Neurochir (Wien). 2022;164(4):1069-1078. [19] ROSSINI PM, BURKE D, CHEN R, et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clin Neurophysiol. 2015;126(6):1071-1107. [20] HERWIG U, SATRAPI P, SCHÖNFELDT-LECUONA C. Using the international 10-20 EEG system for positioning of transcranial magnetic stimulation. Brain Topogr. 2003;16(2):95-99. [21] STEINMETZ H, FÜRST G, FREUND HJ. Variation of perisylvian and calcarine anatomic landmarks within stereotaxic proportional coordinates. AJNR Am J Neuroradiol. 1990;11(6):1123-1130. [22] CYKOWSKI MD, COULON O, KOCHUNOV PV, et al. The central sulcus: an observer-independent characterization of sulcal landmarks and depth asymmetry. Cereb Cortex. 2008;18(9):1999-2009. [23] FITZGERALD PB. Targeting repetitive transcranial magnetic stimulation in depression: do we really know what we are stimulating and how best to do it? Brain Stimul. 2021;14(3):730-736. [24] TRAPP NT, BRUSS J, KING JM, et al. Reliability of targeting methods in TMS for depression: beam F3 vs. 5.5 cm. Brain Stimul. 2020;13(3):578-581. [25] SIDDIQI SH, TAYLOR SF, COOKE D, et al. Distinct symptom-specific treatment targets for circuit-based neuromodulation. Am J Psychiatry. 2020;177(5):435-446. [26] SHIRLY S, RAMESH K. Review on 2D and 3D MRI image segmentation techniques. Curr Med Imaging Rev. 2019;15(2):150-160. [27] FOX MD, BUCKNER RL, WHITE MP, et al. Efficacy of transcranial magnetic stimulation targets for depression is related to intrinsic functional connectivity with the subgenual cingulate. Biol Psychiatry. 2012;72(7):595-603. [28] TIAN Q, BILGIC B, FAN Q, et al. Improving in vivo human cerebral cortical surface reconstruction using data-driven super-resolution. Cereb Cortex. 2021;31(1): 463-482. [29] OSECHINSKIY S, KRUGGEL F. PDE-based reconstruction of the cerebral cortex from MR images. Annu Int Conf IEEE Eng Med Biol Soc.2010;2010:4278-4283. [30] FAN Y, YAO X, XU X. A robust automated surface-matching registration method for neuronavigation. Med Phys. 2020;47(7):2755-2767. [31] SEDRAK M, ALAMINOS-BOUZA AL, SRIVASTAVA S. Coordinate systems for navigating stereotactic space: how not to get lost. Cureus. 2020;12(6):e8578. [32] WANG F, DONG Z, REESE TG, et al. Echo planar time-resolved imaging (EPTI). Magn Reson Med. 2019;81(6):3599-3615. [33] MAURER CJ, FITZPATRICK JM, WANG MY, et al. Registration of head volume images using implantable fiducial markers. IEEE Trans Med Imaging. 1997;16(4):447-462. [34] MONGEN MA, WILLEMS P. Current accuracy of surface matching compared to adhesive markers in patient-to-image registration. Acta Neurochir (Wien). 2019; 161(5):865-870. [35] WANG MN, SONG ZJ. Classification and analysis of the errors in neuronavigation. Neurosurgery. 2011;68(4):1131-1143. [36] YOUNG IM, OSIPOWICZ K, MACKENZIE A, et al. Comparison of consistency between image guided and craniometric transcranial magnetic stimulation coil placement. Brain Stimul. 2022;15(6):1465-1466. [37] NIEMINEN AE, NIEMINEN JO, STENROOS M, et al. Accuracy and precision of navigated transcranial magnetic stimulation. J Neural Eng. 2022. doi: 10.1088/1741-2552/aca71a. [38] CAULFIELD KA, FLEISCHMANN HH, COX CE, et al. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimul. 2022;15(5):1192-1205. [39] DENG ZD, ROBINS PL, DANNHAUER M, et al. Comparison of coil placement approaches targeting dorsolateral prefrontal cortex in depressed adolescents receiving repetitive transcranial magnetic stimulation: an electric field modeling study. medRxiv. 2023. doi: 10.1002/cpt.1858. [40] PAN F, SHEN Z, JIAO J, et al. Neuronavigation-guided rTMS for the treatment of depressive patients with suicidal ideation: a double-blind, randomized, sham-controlled trial. Clin Pharmacol Ther. 2020;108(4):826-832. [41] ATTAL N, POINDESSOUS-JAZAT F, DE CHAUVIGNY E, et al. Repetitive transcranial magnetic stimulation for neuropathic pain: a randomized multicentre sham-controlled trial. Brain. 2021;144(11):3328-3339. [42] BARWOOD CH, MURDOCH BE, WHELAN BM, et al. The effects of low frequency Repetitive Transcranial Magnetic Stimulation (rTMS) and sham condition rTMS on behavioural language in chronic non-fluent aphasia: short term outcomes. NeuroRehabilitation. 2011;28(2):113-128. [43] HEBEL T, GÖLLNITZ A, SCHOISSWOHL S, et al. A direct comparison of neuronavigated and non-neuronavigated intermittent theta burst stimulation in the treatment of depression. Brain Stimul. 2021;14(2):335-343. [44] PIZZAGALLI DA, ROBERTS AC. Prefrontal cortex and depression. Neuropsychopharmacology. 2022;47(1):225-246. [45] SUTHERLAND J, BELEC J, SHEIKH A, et al. Applying modern virtual and augmented reality technologies to medical images and models. J Digit Imaging. 2019;32(1):38-53. [46] GUO Y, XU S, LI X, et al. Preliminary study on Sina (Sina Intraoperative Neurosurgical Assist) APP assisted localization of supratentorial lesions by smart phone. J Clin Neurosci. 2019;62:277-281. [47] DOGAN I, EROGLU U, OZGURAL O, et al. Visualization of superficial cerebral lesions using a smartphone application. Turk Neurosurg. 2018;28(3):349-355. [48] HOPMAN H, CHAN S, CHU W, et al. Personalized prediction of repetitive transcranial magnetic stimulation clinical response in medication-refractory depression data. Data Brief. 2021;37:107264. [49] ZHANG Z, ZHANG H, XIE CM, et al. Task-related functional magnetic resonance imaging-based neuronavigation for the treatment of depression by individualized repetitive transcranial magnetic stimulation of the visual cortex. Sci China Life Sci. 2021;64(1):96-106. [50] ALEXANDER B, LAYCOCK R, CREWTHER DP, et al. An fMRI-neuronavigated chronometric TMS investigation of V5 and intraparietal cortex in motion driven attention. Front Hum Neurosci. 2017;11:638. [51] HERWIG U, ABLER B, SCHÖNFELDT-LECUONA C, et al. Verbal storage in a premotor-parietal network: evidence from fMRI-guided magnetic stimulation. Neuroimage. 2003;20(2):1032-1041. [52] WU SW, MALONEY T, GILBERT DL, et al. Functional MRI-navigated repetitive transcranial magnetic stimulation over supplementary motor area in chronic tic disorders. Brain Stimul. 2014;7(2):212-218. [53] PITTS LL, ROGERS L, WANG X, et al. Functionally navigated transcranial magnetic stimulation to evoke lingual pressure in stroke survivors with dysphagia and healthy adults: a proof of concept trial. Top Stroke Rehabil. 2020;27(4):241-250. [54] SEIFERT F, FUCHS O, NICKEL FT, et al. A functional magnetic resonance imaging navigated repetitive transcranial magnetic stimulation study of the posterior parietal cortex in normal pain and hyperalgesia. Neuroscience. 2010;170(2):670-677. [55] ROSCOE O BRADY RJ, GONSALVEZ I, LEE I, et al. Cerebellar-prefrontal network connectivity and negative symptoms in schizophrenia. Am J Psychiatry. 2019; 176(7):512-520. [56] LUO X, HU Y, WANG R, et al. Individualized rTMS treatment for depression using an fMRI-based targeting method. J Vis Exp. 2021. doi: 10.3791/62687. [57] CAO Z, XIAO X, ZHAO Y, et al. Targeting the pathological network: feasibility of network-based optimization of transcranial magnetic stimulation coil placement for treatment of psychiatric disorders. Front Neurosci. 2022;16:1079078. [58] GRATTON C, LAUMANN TO, NIELSEN AN, et al. Functional brain networks are dominated by stable group and individual factors, not cognitive or daily variation. Neuron. 2018;98(2):439-452. [59] GORDON EM, LAUMANN TO, GILMORE AW, et al. Precision functional mapping of individual human brains. Neuron. 2017;95(4):791-807. [60] CASH R, COCCHI L, LV J, et al. Personalized connectivity-guided DLPFC-TMS for depression: Advancing computational feasibility, precision and reproducibility. Hum Brain Mapp. 2021;42(13):4155-4172. [61] MOMI D, OZDEMIR RA, TADAYON E, et al. Perturbation of resting-state network nodes preferentially propagates to structurally rather than functionally connected regions. Sci Rep. 2021;11(1):12458. [62] MOMI D, OZDEMIR RA, TADAYON E, et al. Network-level macroscale structural connectivity predicts propagation of transcranial magnetic stimulation. Neuroimage. 2021;229:117698. [63] GEETER ND, DUPRÉ L, CREVECOEUR G. Modeling transcranial magnetic stimulation from the induced electric fields to the membrane potentials along tractography-based white matter fiber tracts. J Neural Eng. 2016;13(2):26028. |
| [1] | Yin Yikun, Wang Jialin, Sun Junzhi. Therapeutic effect of different-frequency repetitive transcranial magnetic stimulations on post-stroke cognitive impairment: a Meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(20): 3274-3280. |
| [2] | Shan Sharui, Huang Xuming, Zhang Mingxing, Wang Xiukun, Zheng Xiang, Bao Sairong, Hong Feng. Three-dimensional gait analysis of low-frequency repetitive transcranial magnetic stimulation for post-stroke hemiplegia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(5): 762-767. |
| [3] | Song Ge, Liu Gang, Jiang Liang, Han Jiming, Zhang Guiqing. A Meta-analysis of repetitive transcranial magnetic therapy in patients with post-traumatic stress disorder [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(32): 5196-5200. |
| [4] | Xiao Xiang, Huang Dongfeng. Virtual reality training improves motor function of the upper limbs in stroke survivors: an evaluation using transcranial magnetic stimulation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(17): 2756-2761. |
| [5] | Zhang Jiaming, Tian Yanping, Zhang Yue, Zhong Dongling, Li Yuxi, Zheng Zhong, Li Juan, Jin Rongjiang. Visual analysis of literature on transcranial magnetic stimulation for stroke based on Citespace knowledge map [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(35): 5610-5618. |
| [6] | Jiang Yong, Chi Xiao-fei, Zou Xi-jun, Ci Yuan, Yao Qi, Yang Mao-wei. Combination of olfactory ensheathing cell transplantation and repetitive transcranial magnetic stimulation for the treatment of spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(1): 98-102. |
| [7] | Liu Pei, Liu Bao-bin. Repetitive transcranial magnetic stimulation in a rat model of middle cerebral artery occlusion: variation of nerve regeneration microenvironment in infarcted brain areas and recovery of rat neurological function [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(27): 4333-4338. |
| [8] | Zhu Yi, Yang Yu-jie, Gu Yi-huang, Xie Bin, Jin Hong-zhu. Efficiency of repetitive transcranial magnetic stimulation on rehabilitation of motor function in patients with stroke: A systematic review [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(50): 8759-8768. |
| [9] | Gu Ping, Zhang Zhong-xia, Ma Qin-ying, Geng Yuan, Wang Yan-yong, Zhang Li-na. Transcranial magnetic stimulation promotes proliferation of endogenous neural stem cells of Parkinson’s disease model mice [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(45): 7939-7946. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||