Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (20): 5321-5330.doi: 10.12307/2026.670
Previous Articles Next Articles
Biomaterials regulate microenvironment imbalance for treating spinal cord injury
Wang Zitong1, Wu Zijian2, Yang Aofei2, Mao Tian2, Fang Nan1, Wang Zhigang2
- 1College of Acupuncture and Orthopedics, Hubei University of Chinese Medicine, Wuhan 430061, Hubei Province, China; 2First Department of Orthopedics, Hubei Provincial Hospital of TCM, Wuhan 430061, Hubei Province, China
-
Accepted:2025-06-27Online:2026-07-18Published:2025-12-03 -
Contact:Wang Zhigang, Chief physician, Professor, First Department of Orthopedics, Hubei Provincial Hospital of TCM, Wuhan 430061, Hubei Province, China -
About author:Wang Zitong, Master candidate, College of Acupuncture and Orthopedics, Hubei University of Chinese Medicine, Wuhan 430061, Hubei Province, China Wu Zijian, MD, Attending physician, First Department of Orthopedics, Hubei Provincial Hospital of TCM, Wuhan 430061, Hubei Province, China -
Supported by:spinal cord injury; microenvironment; biomaterial; nanotechnology; 3D printing; multifunctional composite material; nerve; nerve regeneration
CLC Number:
Cite this article
Wang Zitong, Wu Zijian, Yang Aofei, Mao Tian, Fang Nan, Wang Zhigang. Biomaterials regulate microenvironment imbalance for treating spinal cord injury[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(20): 5321-5330.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
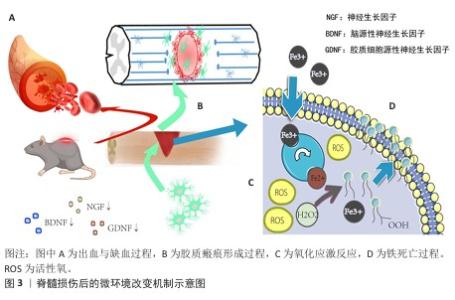
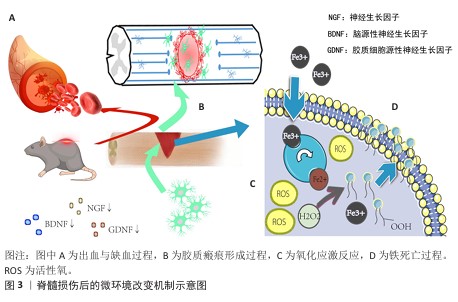
2.2 脊髓损伤后微环境的变化与机制通路 脊髓损伤后的微环境损伤机制是一个复杂且多方面的过程,涉及出血与缺血、胶质瘢痕形成、免疫反应与炎症以及神经营养因子变化等多个关键环节,见图 3。出血与缺血是脊髓损伤早期的主要病理特征之一[16],损伤发生时血管破裂导致凝血级联激活和微血栓形成,引发局部缺血。缺血带来的缺氧状态抑制线粒体氧化磷酸化,造成能量的急剧耗竭,能量危机破坏离子稳态,触发谷氨酸大量释放[17],从而产生大量活性氧物质,进一步加重氧化应激反应,通过脂质过氧化、DNA损伤、炎症反应及细胞死亡等一系列破坏性事件恶化了损伤部位微环境,导致神经功能障碍[18]。值得注意的是,出血释放的游离铁通过芬顿反应加剧羟基自由基生成,伤后的铁积累与脂质过氧化共同触发铁死亡,导致脂质活性氧物质堆积[19]。有研究认为核因子红系2相关因子2是抗氧化应激的关键信号通路,激活该信号通路能够有效抑制氧化应激过程,促进脊髓损伤后的神经功能恢复,因此被视为潜在的治疗靶点[20]。YAN等[20]通过应用褪黑素治疗脊髓损伤,发现增加了褪黑激素受体MT2表达并激活红系2相关因子2/Keap1信号通路,减轻了氧化应激、抑制了损伤区域的炎症反应,还证明使用褪黑激素受体拮抗剂阻断MT2部分逆转了褪黑素的神经保护作用,说明MT2/核因子红系2相关因子2/Keap1信号通路激活是褪黑素在脊髓损伤中的神经保护作用的关键机制。 脊髓损伤后的微环境中除局部缺氧、出血外,另一个关键问题是胶质瘢痕的形成。脊髓损伤后48 h内,反应性星形胶质细胞迅速增生并迁移至损伤区域,虽然早期形成物理屏障隔离了损伤核心,但脊髓损伤后期瘢痕中的细胞外基质成分会发生显著变化,硫酸软骨素蛋白多糖的持续沉积成为轴突再生的主要障碍[21-23]。胶质瘢痕在物理上阻断了轴突的延伸,并且会释放髓鞘相关抑制分子,包括神经突生长抑制因子、少突胶质细胞髓鞘糖蛋白和髓鞘相关糖蛋白 ,它们通过与轴突生长抑制蛋白66、含免疫球蛋白样结构域的蛋白1、Troy或p75受体结合,抑制中枢神经系统的再生能力,进一步限制了神经再生的可能性[24]。与此同时,血脊髓屏障的破坏导致免疫细胞的浸润,过度炎症反应导致炎性因子持续释放,如肿瘤坏死因子α、白细胞介素1β和白细胞介素6等,不仅加剧神经元的损伤,还会吸引更多的免疫细胞聚集于损伤部位,形成恶性循环[25]。对于脊髓损伤后微环境中加剧的炎症,丝裂原活化蛋白激酶和核因子κB信号通路是炎症枢纽,针对该信号通路,FANG等[26]利用网络药理学分析结合实验验证证明了从中药知母中提取的菝葜皂苷元可能通过靶向肿瘤坏死因子、RELA、JUN、丝裂原活化蛋白激酶14和丝裂原活化蛋白激酶8等关键靶点,调控丝裂原活化蛋白激酶/核因子κB信号通路减少炎性因子肿瘤坏死因子α、白细胞介素1β的释放,减少小胶质细胞浸润,改善脊髓损伤后的运动功能。 最后,神经营养因子的变化也是影响神经元存活和再生的关键因素。脊髓损伤后,局部神经营养因子如脑源性神经营养因子、神经生长因子和胶质细胞源性神经营养因子等水平显著下降,这不利于受损神经元的存活及新生轴突的生长[27]。补充外源性神经营养因子或利用生物材料缓释这些因子,为神经元提供持续的支持,也是当前研究的热点之一[28]。例如,SHA等[29]开发了一种仿生透明质酸/丝素蛋白/聚多巴胺涂层的水凝胶支架,通过聚多巴胺涂层增加了神经营养因子3的负载量,该支架移植到脊髓损伤模型中8周后显著促进了神经丝蛋白200阳性神经纤维穿过胶质瘢痕向损伤中心延伸,减少了损伤腔面积和炎症反应并改善了大鼠后肢运动功能。脊髓损伤后的修复过程是一个复杂且多方面的生物学事件,缺血性的能量崩溃、胶质瘢痕的形成、炎症风暴及神经营养因子的缺失共同构成了抑制性微环境,相关机制为治疗靶点设计提供了理论依据。"

2.3 脊髓损伤后细胞水平的变化及机制 2.3.1 内源性干细胞的活化 脊髓中存在少量的神经干细胞,它们通常处于静息状态;当发生损伤后,这些内源性神经干细胞会被激活并分化为多种神经细胞以促进内源性修复与再生[30]。有研究发现,损伤区域释放的多种信号分子(如生长因子和趋化因子)能够吸引并刺激这些干细胞增殖、分化,尝试替代受损或死亡的神经元和胶质细胞。尽管这种自我修复机制在一定程度上有助于缓解损伤,但成人脊髓中央管常有不同程度的阻塞,限制了内源性神经干细胞的激活与增殖,并且脊髓损伤后的微环境破坏也影响了内源性神经干细胞的功能,因此治疗效果往往有限[31]。如何有效激活并利用内源性神经干细胞进行脊髓损伤修复,成为当前研究的另一个重要方向;此外,利用生物材料构建适宜的支架,为内源性神经干细胞提供物理支撑和引导,也是促进脊髓损伤修复的有效策略之一。 2.3.2 小胶质细胞和巨噬细胞的作用 作为中枢神经系统中的主要免疫细胞,脊髓损伤后小胶质细胞和募集到损伤部位的巨噬细胞迅速反应,参与清除坏死组织碎片和病原体[32];此外,这些细胞还通过分泌多种信号分子调节炎症反应和组织修复。M1型巨噬细胞释放促炎因子,而M2型则倾向于分泌抗炎和促进修复的因子,适当调控这两种表型的比例对于减轻炎症反应、促进组织修复至关重要[33]。SHEN等[34]通过体内和体外实验发现,信号素3C蛋白在局部微环境中由巨噬细胞/小胶质细胞表达,诱导了神经炎症并促进促炎性巨噬细胞/小胶质细胞的转化,晚期糖基化终末产物受体/核因子κB是信号素3C的下游靶点,抑制信号素3C介导的晚期糖基化终末产物受体信号显著减少了促炎细胞因子的产生,并逆转了脊髓损伤后的巨噬细胞/小胶质细胞极化,保护轴突免受神经炎症的影响。这一发现首次揭示了脊髓损伤后信号素3C在免疫调节中的作用,为脊髓损伤治疗提供了新的靶点。 2.3.3 神经元与胶质细胞之间的相互作用 神经元与胶质细胞之间存在着复杂的交互作用,虽然星形胶质细胞在维持微环境离子平衡和提供营养支持方面发挥关键作用,同时在形成血-脊髓屏障中起重要作用[35],但在脊髓损伤后过度活化的星形胶质细胞会形成胶质瘢痕,阻碍轴突再生。同时,负责产生髓鞘、保护轴突并加速电信号传导的少突胶质细胞,在损伤后其前体细胞的数量减少,导致髓鞘再生能力下降,从而影响了神经功能恢复[36]。GAO等[37]将神经生长因子固定于具有分级各向异性微结构的丝蛋白纳米纤维水凝胶中,神经生长因子在水凝胶内能保持生物活性并调控神经干细胞的神经元与星形胶质细胞分化,减少瘢痕形成,促进神经运动功能的有效恢复,显示出生物材料通过定向调节神经元与胶质细胞在脊髓再生中的应用潜力。 总之,脊髓损伤后的微环境变化错综复杂,有着出血缺血、胶质瘢痕形成、氧化应激等病理变化,各种细胞参与进了这场级联反应风暴中,在应对这些难题时生物材料的应用展现出了巨大的前景。但当前的研究仍面临着挑战,比如如何从更多的角度入手,在厘清微环境中各种变化机制后有针对性地设计对应功能的生物材料、如何提高生物材料的安全性和有效性以及长期的稳定性、如何更好地让材料模拟体内微环境等,这些问题是未来的研究中需要进一步讨论的重点。 "


2.4 生物材料在调节脊髓损伤微环境中的应用 2.4.1 生物材料的基本要求、分类和特性 生物材料的设计和开发需要满足一系列基本要求和特性,以保证能够有效调节脊髓损伤后的微环境、促进神经再生和恢复,这些特性大致包括生物相容性、生物降解性、机械性能、可控释放能力以及智能响应性[38]。用于脊髓损伤治疗的生物材料主要可以分为天然衍生材料、合成聚合物类、导电材料、复合材料、智能响应材料、脱细胞基质、陶瓷及矿物质等[39], 每种类型的材料都有其独特的优势和适用范围,见表2。天然高分子材料往往具有较好的生物相容性,能提供有利细胞生长的生化信号,不过大多这类材料不能很好地满足机械性能[40]。合成聚合物材料通常被设计为可降解,意味着它们可以在体内逐渐分解并被代谢排出,避免了二次手术取出的需求。例如,聚乳酸和壳聚糖等天然或合成聚合物具有良好的生物降解性,并且可以根据具体需求调整降解速率,从而实现长期的组织支持和修复效果[41]。这些生物材料的应用不仅限于单一类型,很多时候会结合多种材料的特点来设计出更符合临床需求的复合型支架,旨在为受损的脊髓提供一个适宜的再生环境以促进神经细胞的生长和功能恢复,开发更加适用于接近人体内复杂环境的生物材料已成为接下来的重要研究热点。ZENG等[42]评估了三维明胶海绵支架在非人灵长类脊髓损伤模型中的生物安全性和有效性,结果显示三维明胶海绵支架植入恒河猴半切脊髓损伤部位8周观察期内未发现不良反应,未增加神经炎症或星形胶质细胞反应,显著减少了α-平滑肌肌动蛋白阳性细胞,促进了再生组织中的细胞迁移、细胞外基质分泌、神经纤维再生、髓鞘形成、血管生成及电生理改善,表明三维明胶海绵支架对接近人体环境的恒河猴脊髓损伤组织修复有效。 "

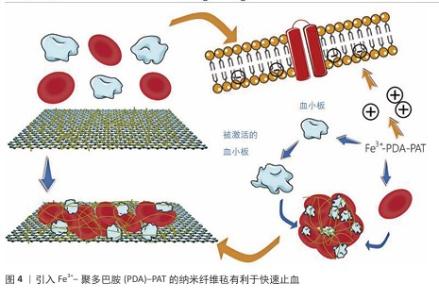
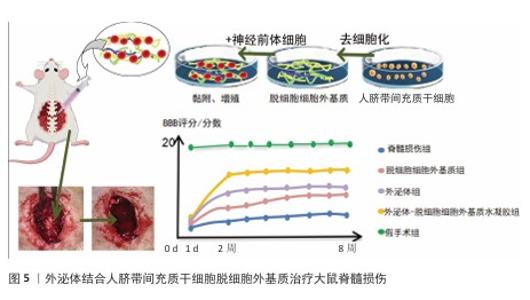
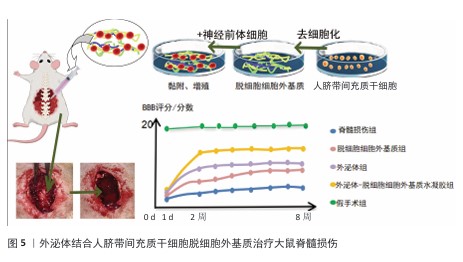
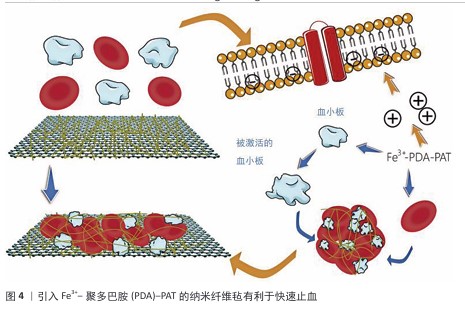
2.4.2 应用于脊髓损伤的生物材料前沿研究 根据脊髓损伤后微环境失衡的关键病理特征变化以及生物材料在脊髓损伤修复中的核心作用机制和设计特点,前沿研究可归纳为以下几类: 结构支撑与物理引导类材料:对于维持组织结构完整性和脊髓损伤后的修复是非常重要的。结构支撑与物理引导类材料主要针对损伤发生后的组织塌陷以及阻碍再生的物理屏障(胶质瘢痕),研究重点是在确保生物相容性和安全性的基础上强调材料的物理结构及其在维持空间、引导再生方向上的作用,它们不仅可以作为“空白框架”维持腔隙结构完整性,并且后续可进一步加载功能因子。例如,WALSH等[43]评估了甲基丙烯酰化明胶水凝胶在脊髓损伤免疫调节治疗中的应用潜力,通过体外实验确定了30 g/L甲基丙烯酰化明胶为最优配方,这种配比下的凝胶表现出最佳的力学性能和细胞相容性,并且不会改变BV2小胶质细胞或RAW264.7巨噬细胞的关键极化标志物表达;此外,30 g/L甲基丙烯酰化明胶支持原代小鼠脊髓切片体外培养14 d,不影响胶质纤维酸性蛋白阳性星形胶质细胞和Iba-1+小胶质细胞的反应性,为脊髓损伤的免疫治疗搭建起了一个可靠有效的物理平台。MUNGENAST等[44]还利用3D打印辅助电纺技术制备了去细胞化脊髓细胞外基质纤维支架,该支架结合生物化学和拓扑学以促进神经细胞的定向排列与迁移,体外实验证明了这种支架支持人神经细胞系的存活,并能指导细胞选择性分化为神经元;在脊髓损伤模型中,被设定定向排列的细胞外基质纤维支架达到了最快的损伤闭合效率。生物支架的物理结构特征会对细胞行为产生影响,通过改变支架的高度定向排列和随机分布的纤维影响细胞的生长、分化以及迁移,是结构支撑与修复引导类材料研究与改进的重要方面。 化学与免疫调节类材料:脊髓损伤治疗中,化学与免疫调节类材料在为受损脊髓提供物理支持的基础上,侧重于调节局部失衡的免疫微环境来发挥生物材料在抗炎、抗氧化应激以及清除毒性物质等方面的优势。某些特定的生物材料能够吸附并清除促炎递质,阻断炎症信号通路,从而缓解局部炎症。例如,JIANG等[45]利用聚多巴胺纳米粒子作为广谱免疫调节剂,不仅通过物理吸附作用有效降低了脊髓损伤后显著升高的多种促炎细胞因子水平,如白细胞介素1β、肿瘤坏死因子α等,还显著下调了23种细胞因子和趋化因子以改善损伤后微环境,起到保护神经元并促进运动功能恢复的作用。除了抗炎,这类生物材料还可以通过调控免疫细胞行为来调节微环境失衡。例如,LIU等[46]开发了一种简便的原位反应诱导自组装方法,制备了醛清除多肽-姜黄素结合纳米组装体,用于脊髓损伤的联合神经保护,该组装体能响应脊髓损伤氧化和酸性微环境释放醛清除多肽和姜黄素,有效清除神经元中的有毒醛类及活性氮氧物质,同时调节小胶质细胞M1/M2型极化下调炎症相关细胞因子,从而抑制神经炎症。该类材料通过多种机制共同作用,着眼于纠正微环境化学与免疫方面的失衡,不仅能有效减轻初期损伤后的炎症反应,还创造了有利的微环境条件以促进神经细胞的再生与修复。 神经营养与促再生微环境类材料:促进损伤后神经再生与功能恢复是脊髓损伤治疗与改善患者预后的重要课题。在缓解了局部炎症、微环境条件尚可的基础上,神经营养与促再生微环境类材料针对脊髓损伤后神经营养因子缺失、内源性干细胞激活不足的问题,通过承载并缓释神经营养因子来创造有利条件促进神经细胞再生,直接或间接地促进了神经细胞的再生和功能恢复。有研究使用直接搭载了神经营养物质的一种新型聚乳酸/聚多巴胺黏附性水凝胶负载有甲钴胺和碲纳米酶,在体内外实验中显示这种纳米酶水凝胶抗氧化、抗炎及神经生长促进的作用,显著提高了脊髓损伤修复效果[47]。此外,ZHANG等[48]利用逐步加成聚合和静电纺丝技术构建具有活性氧物质清除、抗炎及促神经再生功能的纳米纤维毡,并创新性地在其中搭载引入Fe3+-聚多巴胺-PAT螯合物以增强其亲水、抗氧化等特性,促进了血小板与红细胞黏附,同时螯合物提供的大量正电荷与细胞膜上的负电荷结合达到快速止血的目的,见图4;在植入大鼠完全横断脊髓损伤部位后还能募集内源性神经干细胞分化为神经元,促进了血管生成、再髓鞘化及神经功能恢复。值得注意的是,这类生物材料在与其他疗法结合时(如干细胞疗法、基因疗法)可以更全面地促进神经再生和功能恢复。例如,WANG等[49]使用来自人诱导多能干细胞皮质神经元分泌的外泌体与人脐带间充质干细胞脱细胞外基质制成黏附性水凝胶,这种水凝胶具有优异的细胞相容性,不仅促进了早期M2巨噬细胞极化,还减少了神经元凋亡,同时改善了脊髓损伤模型大鼠的下肢运动功能,见图5。WU等[50]利用原肌球蛋白受体激酶C修饰的人诱导多能干细胞来源的神经干细胞和CBD-神经营养因子3修饰的线性有序胶原支架相结合,设计了一种功能性神经网络组织,通过大鼠脊髓损伤模型验证了该移植物能再生神经元和突触,改善损伤区域微环境,促进细胞外基质重塑及后肢功能恢复。随着科学技术的进步,通过多学科融合促进神经细胞的再生和功能恢复,这类材料的应用前景日益广阔,正逐渐成为脊髓损伤治疗及改善患者运动功能的新方向。 电活性与导电材料:脊髓损伤后电信号传导障碍,神经回路中断,电活性生物材料不仅可以作为细胞黏附和结构支撑的支架,还可以作为调节细胞、组织行为和功能的调节剂,尤其是对于电可兴奋的细胞和组织效果显著,如今已引起越来越多的关注[51]。在电活性与导电材料类中,水凝胶因优良的生物相容性、可调节的机械性能、良好的渗透性和易于掺杂导电成分等特点,成为电活性与导电材料的理想载体,特别适用于神经组织工程领域的研究与应用[52]。SHAHEMI等[53]强调了导电水凝胶在脊髓损伤治疗中的潜力,通过整合导电材料、制造技术和交联相互作用,导电水凝胶不仅能够提供有利于再生的微环境,还能利用导电性进行非侵入性的电信号传导,以指导神经细胞行为。YANG等[54]设计了一种具备类似脊髓导电性的琼脂糖/明胶/聚吡咯(Aga/Gel/PPy,AGP3)水凝胶,该水凝胶具备可注射性,体内植入后完全覆盖了脊髓组织缺损并减少了受伤的空腔面积;体外培养显示该水凝胶具有良好的生物相容性,通过调节细胞内钙离子信号传导来促进神经发生相关基因的表达,同时抑制星形胶质细胞的过度增殖。这类材料的电学特性展现了它们在脊髓损伤治疗中发挥关键作用的独特性与唯一性。 整合递送系统类材料:该类生物材料作为高效载体,旨在实现损伤后局部恶劣微环境中的治疗性分子或细胞的可控装载、靶向递送、保护及缓释。目前诸多的药物存在着溶解度低、稳定性差、靶向困难等问题[55],整合递送系统类材料的研究核心在于如何将载物递送用于精确控制并释放。整合递送系统类材料常见的递送载体包括病毒、脂质体、聚合物及合成无机物等[56]。WU等[57]揭示了一种中性粒细胞膜囊泡通过类似“胞葬作用”的机制被巨噬细胞内吞后,促进氧化磷酸化并抑制核因子κB信号通路,将炎症巨噬细胞重编程为促再生表型;基于此构建了包含中性粒细胞膜囊泡和脑源性神经营养因子的“特洛伊木马”复合纤维支架药物递送工具,成功在体内实验中证实该材料有效调节了免疫炎症,持续促进了脊髓损伤后的神经再生。还有学者认为生物因子刺激对中枢神经系统轴突再生至关重要。为实现有利因子的局部持续释放,有研究将神经营养因子3负载于透明质酸/丝素蛋白基质并用聚多巴胺涂层修饰开发了一种仿生水凝胶支架,神经营养因子3从水凝胶支架中的释放延长至28 d,并在植入动物脊髓损伤模型8周后观察到显著的神经丝蛋白200阳性神经纤维穿过神经胶质瘢痕延伸至受伤区域中心[58]。强调材料的载体属性和递送控制能力、克服游离细胞/药物的局限性是实现精准、持续治疗的关键。 多功能复合与先进制造类材料:该类生物材料将多种材料和功能集成在一起,或利用先进的制造技术(如3D打印)实现包括初期的抗氧化应激保护、中期的机械支持以及后期的促进细胞迁移和神经元分化等在内的多种功能,以协同应对脊髓损伤的复杂性。VERSTAPPEN等[59]制备了基于猪脂肪组织衍生的细胞外基质和还原氧化石墨烯的多功能生物材料,植入动物体内6周未发生严重的不良影响,并且所有支架均被促再生型巨噬细胞浸润,说明此种生物材料具有良好的安全性和生物相容性,在治疗周围神经损伤方面具有新兴潜力。TANG等[60]将三维复合导管(包含胶原/透明质酸内海绵和电纺聚乳酸-羟基乙酸共聚物外管)与人脐带间充质干细胞来源外泌体移植于大鼠脊髓损伤造模后长段(10 mm)间隙的周围神经损伤,结果显示这种组合促进了神经再生和大鼠运动功能的恢复,并且效果接近于自体神经移植。这一创新策略展示了多功能复合材料在促进周围神经损伤修复方面的安全性与可靠性。3D打印技术的发展在多功能复合材料的制备中也有多样化的应用方式,例如,LI等[61]结合同轴3D打印技术开发了按照脊髓损伤恢复的时间程序线性分级结构支架,将由透明质酸衍生物和N-钙黏蛋白修饰改性海藻酸钠组成的双网络水凝胶(内层)封装在温度响应性的明胶/纤维素纳米纤维水凝胶中,构建了类似脊髓的同轴支架,集成了自由基清除剂和趋化因子N-钙黏蛋白,实现了对神经干细胞的时间编程保护和调控以及多因素按需修复。多功能复合材料通过整合多种生物活性成分和结构设计,设计思路超越了传统的单一功能材料,强调了材料的多功能性和定制化能力,可以根据治疗进程的不同阶段提供不同的支持作用,体现出对复杂动态微环境的智能响应能力,对脊髓损伤的临床治疗具有很高价值。 "
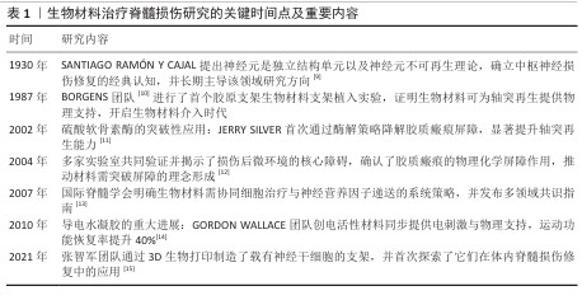
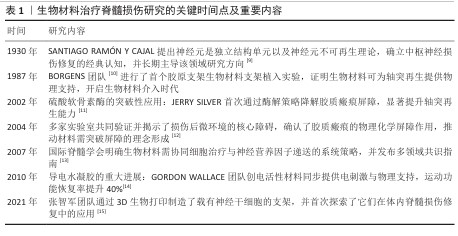
| [1] AHUJA CS, NORI S, TETREAULT L, et al. Traumatic Spinal Cord Injury-Repair and Regeneration. Neurosurgery. 2017; 80(3S):S9-S22. [2] LU Y, SHANG Z, ZHANG W, et al. Global incidence and characteristics of spinal cord injury since 2000-2021: a systematic review and meta-analysis. BMC Med. 2024;22(1):285. [3] HU S, WANG P, DONG Y, et al. Incidence, prevalence and disability of spinal cord injury in China from 1990 to 2019: a systematic analysis of the Global Burden of Disease Study 2019. Eur Spine J. 2023; 32(2):590-600. [4] HE X, LI Y, DENG B, et al. The PI3K/AKT signalling pathway in inflammation, cell death and glial scar formation after traumatic spinal cord injury: Mechanisms and therapeutic opportunities. Cell Prolif. 2022;55(9):e13275. [5] MA W, LI X. Spinal cord injury repair based on drug and cell delivery: From remodeling microenvironment to relay connection formation. Mater Today Bio. 2025;31:101556. [6] LI D, LU X, XU G, et al. Dihydroorotate dehydrogenase regulates ferroptosis in neurons after spinal cord injury via the P53-ALOX15 signaling pathway. CNS Neurosci Ther. 2023;29(7):1923-1939. [7] FAN B, WEI Z, YAO X, et al. Microenvironment Imbalance of Spinal Cord Injury. Cell Transplant. 2018;27(6):853-866. [8] FENG C, DENG L, YONG YY, et al. The Application of Biomaterials in Spinal Cord Injury. Int J Mol Sci. 2023;24(1):816. [9] D. B., D. Degeneration and Regeneration of the Nervous System. Nature. 1930;125: 230-231. [10] BORGENS RB, BLIGHT AR, MCGINNIS ME. Behavioral recovery induced by applied electric fields after spinal cord hemisection in guinea pig. Science. 1987;238(4825): 366-369. [11] BRADBURY EJ, MOON LD, POPAT RJ, et al. Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature. 2002;416(6881):636-640. [12] SILVER J, MILLER JH. Regeneration beyond the glial scar. Nat Rev Neurosci. 2004;5(2):146-156. [13] FAWCETT JW, CURT A, STEEVES JD, et al. Guidelines for the conduct of clinical trials for spinal cord injury as developed by the ICCP panel: spontaneous recovery after spinal cord injury and statistical power needed for therapeutic clinical trials. Spinal Cord. 2007;45(3):190-205. [14] THOMPSON BC, RICHARDSON RT, MOULTON SE, et al. Conducting polymers, dual neurotrophins and pulsed electrical stimulation--dramatic effects on neurite outgrowth. J Control Release. 2010;141(2):161-167. [15] LIU X, HAO M, CHEN Z, et al. 3D bioprinted neural tissue constructs for spinal cord injury repair. Biomaterials. 2021;272:120771. [16] LU Y, LIANG Z, WU Z, et al. Studying on the in vivo pathological evolution of spinal cord injury with the rat model by the method of integrated multispectral imaging and Raman spectroscopy. Talanta. 2024;279:126672. [17] HUANG Y, WANG J, YUE C, et al. An In Situ Assembled Trapping Gel Repairs Spinal Cord Injury by Capturing Glutamate and Free Calcium Ions. Small. 2023;19(16):e2206229. [18] LIU D, LU G, SHI B, et al. ROS-Scavenging Hydrogels Synergize with Neural Stem Cells to Enhance Spinal Cord Injury Repair via Regulating Microenvironment and Facilitating Nerve Regeneration. Adv Healthc Mater. 2023;12(18):e2300123. [19] XIAO CL, LAI HT, ZHOU JJ, et al. Nrf2 Signaling Pathway: Focus on Oxidative Stress in Spinal Cord Injury. Mol Neurobiol. 2025;62(2):2230-2249. [20] YAN L, HAN X, ZHANG M, et al. Melatonin exerts neuroprotective effects in mice with spinal cord injury by activating the Nrf2/Keap1 signaling pathway via the MT2 receptor. Exp Ther Med. 2023;27(1):37. [21] HUA R, ZHAO C, XU Z, et al. ROS-responsive nanoparticle delivery of ferroptosis inhibitor prodrug to facilitate mesenchymal stem cell-mediated spinal cord injury repair. Bioact Mater. 2024;38:438-454. [22] GONG L, GU Y, HAN X, et al. Spatiotemporal Dynamics of the Molecular Expression Pattern and Intercellular Interactions in the Glial Scar Response to Spinal Cord Injury. Neurosci Bull. 2023;39(2):213-244. [23] HUSSEIN RK, MENCIO CP, KATAGIRI Y, et al. Role of Chondroitin Sulfation Following Spinal Cord Injury. Front Cell Neurosci. 2020;14:208. [24] AKRAM R, ANWAR H, JAVED MS, et al. Axonal Regeneration: Underlying Molecular Mechanisms and Potential Therapeutic Targets. Biomedicines. 2022;10(12):3186. [25] ZHAO L, SHEN J, JIA K, et al. MicroRNA-24-3p Inhibits Microglia Inflammation by Regulating MK2 Following Spinal Cord Injury. Neurochem Res. 2021;46(4): 843-852. [26] FANG B, WANG L, LIU S, et al. Sarsasapogenin regulates the immune microenvironment through MAPK/NF-kB signaling pathway and promotes functional recovery after spinal cord injury. Heliyon. 2024;10(3):e25145. [27] MA J, LI J, WANG X, et al. GDNF-Loaded Polydopamine Nanoparticles-Based Anisotropic Scaffolds Promote Spinal Cord Repair by Modulating Inhibitory Microenvironment. Adv Healthc Mater. 2023;12(8):e2202377. [28] SOSNOVTSEVA AO, STEPANOVA OV, STEPANENKO AA, et al. Recombinant Adenoviruses for Delivery of Therapeutics Following Spinal Cord Injury. Front Pharmacol. 2022;12:777628. [29] SHA Q, WANG Y, ZHU Z, et al. A hyaluronic acid/silk fibroin/poly-dopamine-coated biomimetic hydrogel scaffold with incorporated neurotrophin-3 for spinal cord injury repair. Acta Biomater. 2023;167: 219-233. [30] LI J, LUO W, XIAO C, et al. Recent advances in endogenous neural stem/progenitor cell manipulation for spinal cord injury repair. Theranostics. 2023;13(12):3966-3987. [31] WANG YT, YUAN H. Research progress of endogenous neural stem cells in spinal cord injury. Ibrain. 2022;8(2):199-209. [32] HELLENBRAND DJ, QUINN CM, PIPER ZJ, et al. Inflammation after spinal cord injury: a review of the critical timeline of signaling cues and cellular infiltration. J Neuroinflammation. 2021;18(1):284. [33] 史旭,李瑞语,张兵,等.小胶质细胞极化介导炎症反应在脊髓损伤中的作用[J].中国组织工程研究,2023,27(1):121-129. [34] SHEN J, GONG L, SUN Y, et al. Semaphorin3C identified as mediator of neuroinflammation and microglia polarization after spinal cord injury. iScience. 2024;27(5):109649. [35] TANG H, GU Y, JIANG L, et al. The role of immune cells and associated immunological factors in the immune response to spinal cord injury. Front Immunol. 2023;13: 1070540. [36] SHU H, ZHANG X, PU Y, et al. Fucoidan improving spinal cord injury recovery: Modulating microenvironment and promoting remyelination. CNS Neurosci Ther. 2024;30(8):e14903. [37] GAO X, CHENG W, ZHANG X, et al. Nerve Growth Factor-Laden Anisotropic Silk Nanofiber Hydrogels to Regulate Neuronal/Astroglial Differentiation for Scarless Spinal Cord Repair. ACS Appl Mater Interfaces. 2022;14(3):3701-3715. [38] SENSHARMA P, MADHUMATHI G, JAYANT RD, et al. Biomaterials and cells for neural tissue engineering: Current choices. Mater Sci Eng C Mater Biol Appl. 2017;77: 1302-1315. [39] KAPLAN B, LEVENBERG S. The Role of Biomaterials in Peripheral Nerve and Spinal Cord Injury: A Review. Int J Mol Sci. 2022;23(3):1244. [40] 薛学鑫,刘哲鹏.静电纺纤维神经组织工程支架:材料、功能及结构设计策略[J].中国组织工程研究,2022,26(28): 4575-4580. [41] YU L, JIN H, XIA H, et al. Polylactic acid/chitosan-IKVAV Janus film serving as a dual functional platform for spinal cord injury repair. Nanoscale. 2024;16(47):21991-22000. [42] ZENG X, WEI QS, YE JC, et al. A biocompatible gelatin sponge scaffold confers robust tissue remodeling after spinal cord injury in a non-human primate model. Biomaterials. 2023;299:122161. [43] WALSH CM, WYCHOWANIEC JK, COSTELLO L, et al. An In Vitro and Ex Vivo Analysis of the Potential of GelMA Hydrogels as a Therapeutic Platform for Preclinical Spinal Cord Injury. Adv Healthc Mater. 2023; 12(26):e2300951. [44] MUNGENAST L, NIEMINEN R, GAISER C, et al. Electrospun decellularized extracellular matrix scaffolds promote the regeneration of injured neurons. Biomater Biosyst. 2023;11:100081. [45] JIANG D, DING Y, HU S, et al. Broad-spectrum downregulation of inflammatory cytokines by polydopamine nanoparticles to protect the injured spinal cord. Acta Biomater. 2025;193:559-570. [46] LIU Y, LIN F, WU C, et al. In Situ Reaction-Generated Aldehyde-Scavenging Polypeptides-Curcumin Conjugate Nanoassemblies for Combined Treatment of Spinal Cord Injury. ACS Nano. 2024; 18(10):7346-7362. [47] MENG J, SUN J, KANG J, et al. Multifunctional hydrogels loaded with tellurium nanozyme for spinal cord injury repair. Mater Today Bio. 2024;29:101339. [48] ZHANG Q, ZHENG J, LI L, et al. Bioinspired conductive oriented nanofiber felt with efficient ROS clearance and anti-inflammation for inducing M2 macrophage polarization and accelerating spinal cord injury repair. Bioact Mater. 2024;46:173-194. [49] WANG G, LI Q, LIU S, et al. An injectable decellularized extracellular matrix hydrogel with cortical neuron-derived exosomes enhances tissue repair following traumatic spinal cord injury. Mater Today Bio. 2024; 28:101250. [50] WU Z, ZHOU Y, HOU X, et al. Construction of functional neural network tissue combining CBD-NT3-modified linear-ordered collagen scaffold and TrkC-modified iPSC-derived neural stem cells for spinal cord injury repair. Bioact Mater. 2024;35:242-258. [51] LIU Z, WAN X, WANG ZL, et al. Electroactive Biomaterials and Systems for Cell Fate Determination and Tissue Regeneration: Design and Applications. Adv Mater. 2021; 33(32):e2007429. [52] GHANE N, BEIGI MH, LABBAF S, et al. Design of hydrogel-based scaffolds for the treatment of spinal cord injuries. J Mater Chem B. 2020, 21;8(47):10712-10738. [53] SHAHEMI NH, MAHAT MM, ASRI NAN, et al. Application of Conductive Hydrogels on Spinal Cord Injury Repair: A Review. ACS Biomater Sci Eng. 2023;9(7):4045-4085. [54] YANG B, LIANG C, CHEN D, et al. A conductive supramolecular hydrogel creates ideal endogenous niches to promote spinal cord injury repair. Bioact Mater. 2021;15: 103-119. [55] PENTLAVALLI S, COULTER S, LAVERTY G. Peptide Nanomaterials for Drug Delivery Applications. Curr Protein Pept Sci. 2020; 21(4):401-412. [56] ZHOU L, QIU T, LV F, et al. Self-Assembled Nanomedicines for Anticancer and Antibacterial Applications. Adv Healthc Mater. 2018;7(20):e1800670. [57] WU J, TANG J, ZHANG L, et al. Biomimetic “Trojan Horse” Fibers Modulate Innate Immunity Cascades for Nerve Regeneration. ACS Nano. 2025;19(1):781-802. [58] SHA Q, WANG Y, ZHU Z, et al. A hyaluronic acid/silk fibroin/poly-dopamine-coated biomimetic hydrogel scaffold with incorporated neurotrophin-3 for spinal cord injury repair. Acta Biomater. 2023;167: 219-233. [59] VERSTAPPEN K, KLYMOV A, CICUÉNDEZ M, et al. Biocompatible adipose extracellular matrix and reduced graphene oxide nanocomposite for tissue engineering applications. Mater Today Bio. 2024;26: 101059. [60] TANG H, LI J, WANG H, et al. Human umbilical cord mesenchymal stem cell-derived exosomes loaded into a composite conduit promote functional recovery after peripheral nerve injury in rats. Neural Regen Res. 2024;19(4):900-907. [61] LI Y, CHENG S, WEN H, et al. Coaxial 3D printing of hierarchical structured hydrogel scaffolds for on-demand repair of spinal cord injury. Acta Biomater. 2023;168: 400-415. [62] 文峰,周磊,李扬,等.通腑逐瘀法指导下抵当汤加减可抑制大鼠急性脊髓损伤后胶质瘢痕的形成[J].中国组织工程研究,2023,27(20):3180-3187. [63] RAO S, LIN Y, LIN R, et al. Traditional Chinese medicine active ingredients-based selenium nanoparticles regulate antioxidant selenoproteins for spinal cord injury treatment. J Nanobiotechnology. 2022;20(1):278. [64] MA W, LI X. Spinal cord injury repair based on drug and cell delivery: From remodeling microenvironment to relay connection formation. Mater Today Bio. 2025;31:101556. [65] SHEN H, FAN C, YOU Z, et al. Advances in Biomaterial - Based Spinal Cord Injury Repair. Advanced Functional Materials. 2022;32:2110628. |
| [1] | Liu Yang, Liu Donghui , Xu Lei, Zhan Xu, Sun Haobo, Kang Kai. Role and trend of stimuli-responsive injectable hydrogels in precise myocardial infarction therapy [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2072-2080. |
| [2] | Wang Qisa, Lu Yuzheng, Han Xiufeng, Zhao Wenling, Shi Haitao, Xu Zhe. Cytocompatibility of 3D printed methyl acrylated hyaluronic acid/decellularized skin hydrogel scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1912-1920. |
| [3] | Zhou Hongli, Wang Xiaolong, Guo Rui, Yao Xuanxuan, Guo Ru, Zhou Xiongtao, He Xiangyi. Fabrication and characterization of nanohydroxyapatite/sodium alginate/polycaprolactone/alendronate scaffold [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1962-1970. |
| [4] | Zhang Qiya, Tong Yixiang, Yang Shijiao, Zhang Yumeng, Deng Ling, Wu Wei, Xie Yao, Liao Jian, Mao Ling. In vitro biocompatibility of graded glass infiltrated ultra-translucent zirconia [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 443-450. |
| [5] | Jiang Kan, Alimujiang·Abudourousuli, Shalayiding·Aierxiding, Aikebaierjiang·Aisaiti, Kutiluke·Shoukeer, Aikeremujiang·Muheremu. Biomaterials and bone regeneration: research hotspots and analysis of 500 influential papers [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 528-536. |
| [6] | Yang Biao, , Wu Zhonghuan, , Jiang Fugui, , He Chenglong, , Li Tingdong, . Conductive hydrogel with cell-free fat extract repairs spinal cord injuries in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(14): 3652-3662. |
| [7] | Xiong Jiaying, Shen Jieyi, Lyu Jiahong. Characteristics and strategies of 3D-printed biomimetic bioceramic scaffolds for repairing jaw defects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(14): 3709-3716. |
| [8] | Yang Bin, Tao Guangyi, Yang Shun, Xu Junjie, Huang Junqing . Visualization analysis of research hotspots of artificial intelligence in field of spinal cord nerve injury and repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 761-770. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||