Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (10): 2653-2661.doi: 10.12307/2026.628
Previous Articles Next Articles
Analysis of thematic evolution pathways in the field of physical activity and neurogenesis
Jiao Jingya1, Zhang Yeting2
- 1Shanxi Medical University, Jinzhong 030600, Shanxi Province, China; 2Aviation Safety and Security College, Civil Aviation Flight University of China, Guanghan 618307, Sichuan Province, China
-
Received:2025-03-27Accepted:2025-06-17Online:2026-04-08Published:2025-09-01 -
Contact:Zhang Yeting, PhD, Associate professor, Aviation Safety and Security College, Civil Aviation Flight University of China, Guanghan 618307, Sichuan Province, China -
About author:Jiao Jingya, MS, Lecturer, Shanxi Medical University, Jinzhong 030600, Shanxi Province, China -
Supported by:Sichuan Provincial Science and Technology Department, No. 2020YFH0184 (to ZYT); the Fundamental Research Funds for the Central Universities, No. PHD2023-003 (to ZYT)
CLC Number:
Cite this article
Jiao Jingya, Zhang Yeting. Analysis of thematic evolution pathways in the field of physical activity and neurogenesis[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2653-2661.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
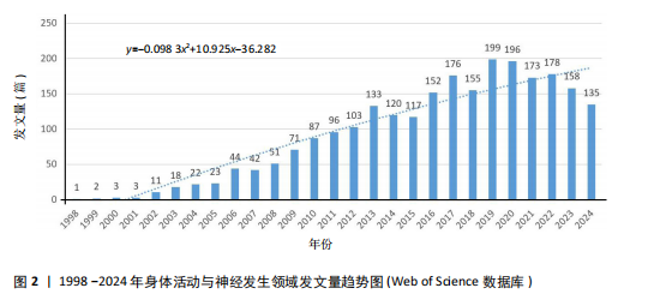
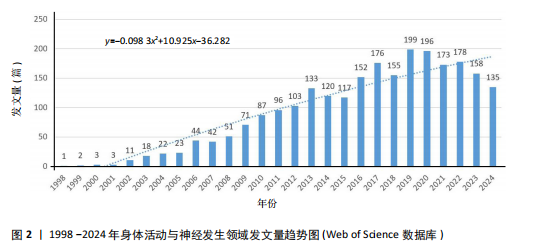
2.1 发文量分布 从1998-2004年,“身体活动与神经发生”领域的发文量呈现显著的增长趋势,尤其是在2005-2013年间,发文量快速上升,显示出该领域研究的蓬勃发展。根据拟合公式y=-0.098 3x2+10.925x-36.282可以看出“身体活动与神经发生”领域的发文量呈现出先快速增长后逐渐下降的趋势,符合开口向下的二次函数特性。初期增长迅速,可能受研究热点形成和技术进步的推动。通过计算顶点年份,发文量在2013年前后达到峰值,之后有所回落,这可能反映了领域研究逐渐趋于成熟,热点逐步向更细分或交叉领域转移。近年来,尽管发文量有所下降,但仍体现了研究的持续关注和重要性。这一趋势表明,探索身体活动与神经发生之间的关系逐步成为学术研究的热点领域,并可能在未来继续引发学术界的深度探讨,见图2。 2.2 关键词分析 关键词分析可揭示研究的核心主题[15]。为避免身体活动与神经发生领域关键词数量过多导致的信息冗余,通过设置精简阈值,去除次要信息,聚焦主要关联,从而获得更具代表性的分析结果[16]。 2.2.1 关键词主题覆盖图 关键词主题覆盖图通过关键词数量和数据流动态展示研究主题的更替与稳定性[17]。如图3所示,SciMAT生成的关键词覆盖图中,圆圈内的数字表示各时期的关键词总量;斜向上箭头标注消失的关键词数量,斜向下箭头标注新增关键词数量;水平箭头上方括号外数字表示相邻时期的共享关键词数量,括号内数字为重叠系数(共享关键词占"
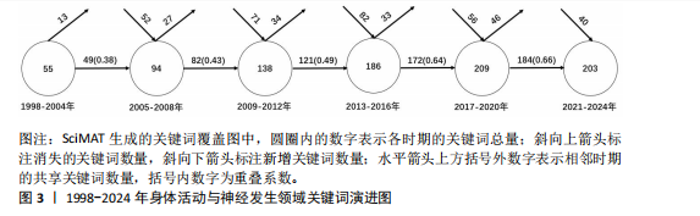
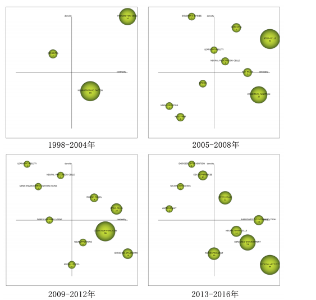
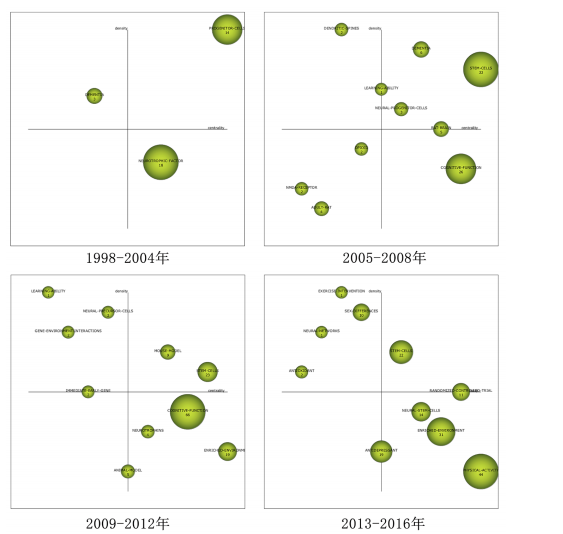
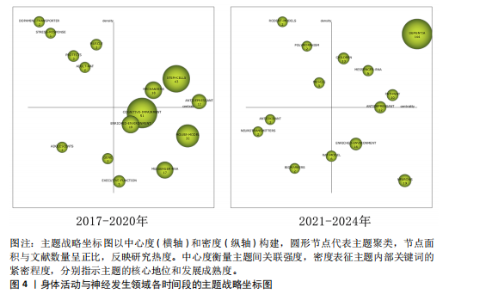
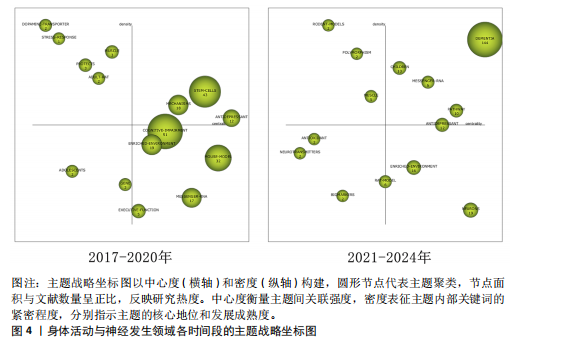
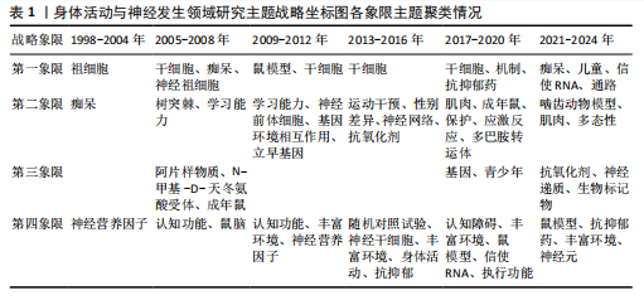
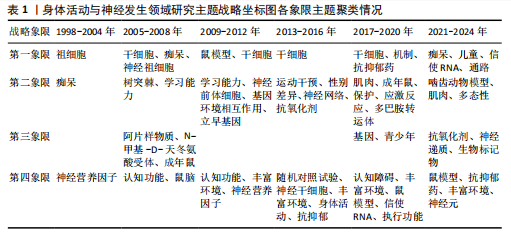
总量的比例),其高低反映了研究主题的继承性强度[14]。6个阶段的关键词数量从55增长至203,表明研究范围持续拓宽。共享关键词数量从49增至184,重叠系数由0.38升至0.66,表明研究继承性逐步增强,方向趋于稳定。从关键词更替来看,新生词数量始终高于消亡词,如2005-2008年新生52个、消亡13个,2013-2016年新生82个、消亡34个。尽管2021-2024年新生词降至40个,但此领域研究活跃度依然较高,新旧主题交替频繁。但值得注意的是,这也可能预示着该领域的研究逐渐成熟但缺乏新的创新与突破点。总体来说,身体活动与神经发生领域的研究呈现出蓬勃发展的态势,相关研究日趋深入,未来发展空间较大。 2.2.2 研究主题演化状态分析 图4展示了1998-2024年间6个阶段身体活动与神经发生领域研究主题的演化状态。战略坐标图的4个象限分别表征了主题聚类的不同特性[18]:第一象限(中心度与密度均为正)代表内部关联性强、发展水平高的核心主题;第二象限(中心度为负、密度为正)反映内部结构成熟但外部关联较弱的专业化主题;第三象限(中心度与密度均为负)指示边缘化或新兴/衰退主题;第四象限(中心度为正、密度为负)则预示具有发展潜力但尚未完全成熟的核心主题。基于此,60个研究主题聚类被划分为不同战略区域,详见表1。 (1)传统主题演化状态:在身体活动与神经发生研究领域发展的第一个时间段,也就是1998-2004年期间,共有PROGENITOR-CELLS(祖细胞)、NEUROTROPHIC-FACTOR(神经营养因子)和DEMENTIA(痴呆)3个主题聚类,通过分析这3个主题聚类的走向,可以理清传统主题演化的状态。这些主题反映了该领域早期的研究方向和热点,为后续研究奠定了理论基础,因此作者将这一时期的研究主题定义为“传统主题”。PROGENITOR-CELLS(祖细胞)是整个网络中的核心主题之一,该主题位于第一象限,中心度"
和密度均较高(中心度:72.56;密度:64.37),表明其在网络中的连接程度和内部关联性均较强,其发展潜力大,是该时期的引擎主题。在随后的演化过程中,该主题分裂并细化,产生了 NEURAL-PROGENITOR-CELLS(神经祖细胞) 聚类。研究重点从基础的祖细胞生物学拓展到特定应用领域,如神经退行性疾病和疾病模型等。NEUROTROPHIC-FACTOR(神经营养因子)在1998-2004年为最大主题聚类,发文量最多,该主题位于第四象限,该主题中心度较高而密度较低(中心度69.48;密度43.09),表明该主题虽然处在核心地位,发展潜力大,但成熟度不高,仍然对研究领域有很大的影响力。在随后的演化过程中,该主题演化为 COGNITIVE-FUNCTION(认知功能) 聚类,研究内容主要涉及运动对神经营养因子的影响和认知功能的提升。DEMENTIA(痴呆)主题位于第二象限,其中心度较低(4.21),表明其在整体网络中的影响较小,但其内部密度较高(53.33),表明该领域研究较为集中。该主题与NEUROTROPHIC-FACTOR(神经营养因子)主题存在交叉,其核心研究主要聚焦于生活方式干预在痴呆风险中的作用。在随后的演化过程中,痴呆主题从边缘向中心转移,在2005-2008年位于第一象限。PROGENITOR-CELLS和NEUROTROPHIC-FACTOR是该阶段研究的核心驱动力,展示了神经发生和神经营养因子在行为、环境和认知功能中的重要性。DEMENTIA则作为应用性主题,与上述核心主题存在间接的知识传递。 (2)现代主题演化现状:在身体活动与神经发生研究领域发展的最近一个时间段,也就是2021-2024年期间,共有DEMENTIA(痴呆)、CHILDREN(儿童)、MESSENGER-RNA(信使RNA)、PATHWAY(通路)、RODENT-MODELS(啮齿动物模型)、POLYMORPHISM(多态性)、MUSCLE(肌肉)、ANTIOXIDANT(抗氧化剂)、NEUROTRANSMITTERS(神经递质)、BIOMAKERS(生物标记物)、RAT-MODEL(鼠模型)、ANTIDEPRESSANT (抗抑郁药)、ENRICHED-ENVIRONMENT(丰富环境)和NEURONS(神经元)14个主题聚类,通过分析这14个主题聚类的走向,可以理清现代主题演化的现状。这些主题反映了当前研究的前沿方向,因此作者将这一时期的研究主题定义为“现代主题”。 位于第一象限的主题词包括痴呆、儿童、信使RNA和通路。这些主题其内部连接程度和外部连接程度都较高,有着较强的稳定性和向外扩散的能力,表明这些研究方向相对成熟,是此领域的核心主题,也是该领域未来研究的重要方向。在痴呆主题中,研究的重点领域主要涉及痴呆的预防与干预措施,尤其是通过身体活动促进神经可塑性、改善认知能力以及延缓神经退行性疾病等方面的研究[19-20]。 痴呆主题反映了研究方向由病理机制的探索逐渐向预防和干预措施转变的趋势。在儿童主题中,研究主要集中于身体活动(如体育锻炼)对儿童认知发展的促进作用,以及这些活动如何改善儿童的记忆能力、注意力和行为表现[21-22]。儿童主题不仅关注行为层面的改善,还开始深入探讨身体活动对儿童大脑发育的潜在机制。信使RNA主题的研究聚焦于信使RNA在神经发育和神经退行性疾病中的作用,尤其是在调控神经营养因子表达方面的重要作用[23-24]。信使RNA主题致力于从分子水平探索神经可塑性和认知功能的调控机制,这可能会为开发新的治疗策略提供理论基础。通路主题的研究主要包括细胞内通路的激活与调控(如炎症通路和代谢通路等)在神经疾病和心理健康中的作用[25]。通路主题从系统生物学角度探索神经发生和认知功能的调控机制,更加关注通路在神经再生和修复中的潜在应用。综上,这4个主题在2021-2024年期间,不仅体现了此领域的研究成熟度和稳定性,还展示了其多学科交叉和向外扩散的能力,预示着未来研究将更加聚焦于从分子到行为的多层次整合。 位于第二象限的主题词包括啮齿动物模型、多态性和肌肉。这些主题的外联度较高但内联度较低,表明其内部研究相对松散,但与其他研究方向的联系较为密切。此象限的主题往往容易游离或转变成其他相关方向的聚类,显示出它们作为次级研究主题的潜力。啮齿动物模型主题聚焦于利用啮齿动物模型进行运动科学、神经科学和心理学领域的实验研究,特别是在抑郁症、神经退行性疾病和脑损伤修复等领域[26]。如通过诱导啮齿动物出现抑郁症状来研究抑郁症的病理机制;探索不同干预方式对啮齿动物模型认知功能的改善等[27-28]。多态性主题聚焦于研究基因多态性对神经疾病风险的影响;探讨运动相关基因变异对身体适应和神经可塑性的影响;研究基因多态性如何通过表观遗传机制与外界环境产生交互作用等[29-31]。肌肉主题聚焦于肌肉功能在认知健康和神经可塑性中的作用,尤其是运动对肌肉和神经系统的双向影响,探索肌肉活动如何影响神经网络重塑,研究肌肉功能障碍在神经退行性疾病中的作用等[32-34]。综上,这些主题的共同特性是内部连接较松散,缺乏单一研究方向上的高度集中性,但它们为其他核心研究提供了支持性和跨学科的研究框架。未来这些主题可能通过与相关领域的融合,逐渐转变成新的核心研究方向。 位于第三象限的主题词包括抗氧化剂、神经递质和生物标记物。这些主题的内部连接程度和外部连接程度均较低,表明这些主题作为新演化出的研究方向,目前属于该领域在2021-2024年的边缘研究主题方向,研究尚未深入,且与其他领域的联系较少,未来有进一步扩展和融合的潜力。抗氧化剂主题的研究方向主要集中在抗氧化剂对神经保护、代谢应激和细胞功能调控方面的作用,探索其在神经退行性疾病中的潜在疗效等[35]。神经递质主题的研究方向聚焦于神经递质的信号传导机制及其与行为和神经系统疾病的关系,探索运动、压力、药物干预等外部因素如何通过神经递质调节神经网络活动,以及神经递质失衡在神经退行性疾病中的作用等[36]。生物标记物主题的研究主要围绕生物标记物在疾病诊断和疗效监测中的应用,重点研究生物标记物在血液、脑脊液中的表达水平及其与疾病状态的相关性,以及探索新型标记物在精神疾病中的作用[37]。综上,这些边缘研究主题可能会随着更多跨学科研究的推进,在未来逐渐融入领域核心研究范畴。 位于第四象限的主题词为鼠模型、抗抑郁药、丰富环境和神经元。这些主题的内部连接程度较高,但外部连接程度较低,表明这些研究方向在2021-2024年期间属于独立研究主题方向。虽然目前的外联度较低,但由于其内部稳定性强,这些主题很可能在未来演变为此领域的核心研究主题。在鼠模型主题中,鼠模型被广泛用于研究神经退行性疾病和神经保护机制的研究中[38]。由于鼠模型在机制研究和新药开发中的广泛应用,该主题有望进一步扩展至更精细的疾病建模与干预验证等方向。在抗抑郁药主题中,研究主要聚焦于抗抑郁药物对神经递质和大脑可塑性的影响,特别是在抑郁症相关的神经通路和分子机制上的作用[39]。在丰富环境主题中,主要研究丰富环境对神经发育和神经退行性疾病的保护作用,及环境刺激对神经可塑性和大脑功能的影响[40]。未来随着对环境刺激与大脑健康关系的深入研究,丰富环境有望成为神经退行性疾病的辅助干预手段,并进一步推动行为干预的标准化和个性化。在神经元主题中,研究主要围绕神经元结构、功能和与其他细胞类型的相互作用,研究神经元在神经发育、神经退行性疾病和神经修复中的作 用[41]。综上,位于第四象限的主题虽然当前的外联度较低,但其内部研究稳定性强,未来有可能演变为核心研究方向。 2.2.3 主题演化路径 图5展示了1998-2024年主题演化路径,节点代表聚类主题,其大小与文献量成正比。 实线表示主题继承,虚线表示分化,连线颜色深浅和粗细反映主题相似度,深色粗线表明关联强度高、演化能力强。孤立节点则代表成熟且专业性强的研究方向。从节点数量来看,各时期分别为3,10,10,10,15和14个,呈现显著增长趋势。路径交叉逐渐增多,演化关系趋于复杂,反映了研究领域的扩展与深化。根据各研究阶段演化情况,身体活动与神经发生研究领域可分为祖细胞、神经营养因子、痴呆、神经祖细胞、神经前体细胞、运动干预、抗氧化剂7个主要演化方向,并形成了25条子演化路径。 一是祖细胞演化路径,该演化路径包括17条子路径,见表2。其中子路径①②③④显示了祖细胞与干细胞和丰富环境的直接联系,强调了丰富环境对干细胞及其功能的影响。许多研究认为丰富环境不仅可以通过增强神经可塑性促进神经的正常发育,还可以通过脑内形态学和细胞分子的适应,恢复中枢神经系统损伤时的功能活动,起到神经修复的作用[42-43]。这些路径的延伸又进一步纳入了痴呆主题和认知障碍主题,表明此类研究正逐步向老年疾病领域拓展。这种演化趋势与老龄化社会的健康需求密切相关,尤其是通过身体活动干预延缓神"
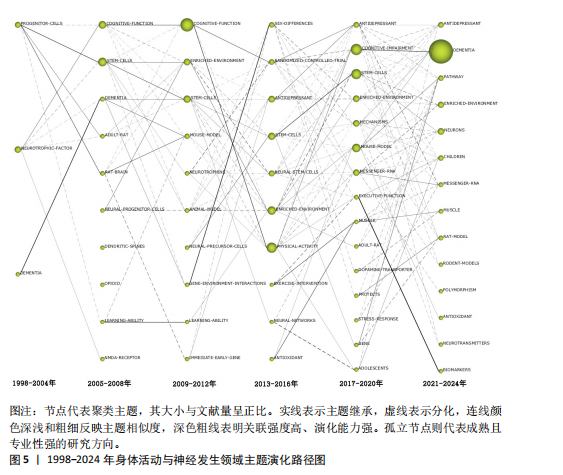
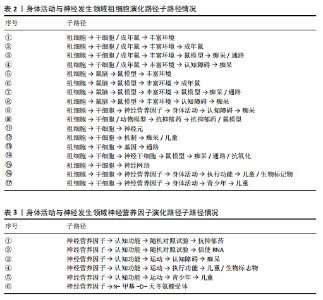
经退行性疾病的临床转化研究[19-20]。鼠脑和鼠模型(路径⑤-⑧)构成了以动物模型为核心的分化路径,揭示了动物模型在神经科学研究中的重要性,这些路径将干细胞研究与神经科学模型联系起来,反映了从细胞层面到复杂行为或疾病模型的研究扩展。路径⑦⑧中,鼠模型与痴呆主题的结合,提示了动物模型在探索痴呆病理机制和干预策略中的关键作用。这一趋势与近年来利用转基因小鼠模型研究阿尔茨海默病的分子机制和药物筛选的研究热潮相吻合[38]。祖细胞与干细胞分化的子路径⑨-?,突出了身体活动、痴呆、神经营养因子和儿童等主题,一方面说明此领域研究逐渐跨越年龄组,涉及儿童、青少年及老年人;另一方面说明此领域研究涉及了多种疾病领域,并形成了多样化的主题聚焦。另外,在一些子路径中,存在孤立的特定主题,如?的神经元主题和?的神经网络主题,表明这些领域可能已经形成了较为成熟的研究方向,不再高度依赖于祖细胞研究。 二是神经营养因子演化路径,该演化路径包括6条子路径,见表3。其中,多条路径(①②③④⑤)展现了神经营养因子在促进认知功能方面的重要性。运动能够释放对神经元发育和生长以及神经发生和血管生成至关重要的神经营养因子,包括脑源性神经营养因子、神经生长因子和神经营养素等[44]。随机对照试验的引入(路径①②)表明此领域研究向试验设计更加严谨的方向发展,同时延伸至抗抑郁药和信使RNA主题,这可能预示着神经营养因子在药物开发和分子生物学中的潜力。实际上,已有学者在关注将神经营养因子或其受体作为药物开发靶点的潜力[45]。路径③-⑤突出了身体活动的关键作用,并进一步与认知障碍、痴呆、执行功能等主题相关联。特别是路径④⑤中,研究逐步扩展到儿童和青少年群体,表明研究主题逐步覆盖不同生命周期的个体,并预示着早期干预的重要性[46]。这一趋势与近年来儿童认知发育研究的兴起密切相关,尤其是通过运动干预提升儿童执行功能和学业表现的研究[21-22]。在路径⑥中, N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDA)作为孤立点,表明"
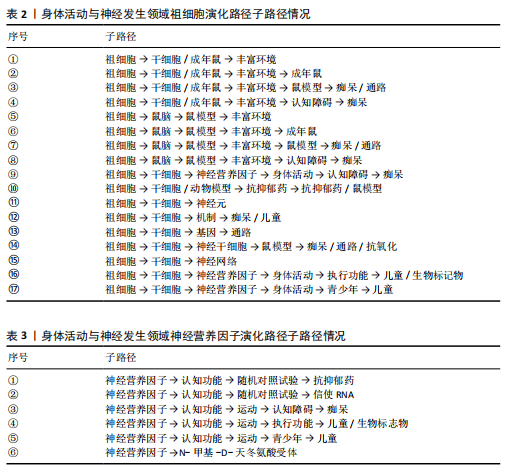

其较高的专业性和成熟度,NMDA受体研究与神经营养因子的关联在后续研究中关注度较低。 三是痴呆演化路径,其中包括一条相对独立的演化路径:痴呆→基因环境相互作用→性别差异→信使RNA。该路径逐步向基因环境交互研究过渡,特别是近年来表观遗传学研究的兴起,揭示了环境因素如何通过DNA甲基化、组蛋白修饰等机制影响基因表达,进而调控神经发生和认知功能[47]。其中,有研究认为运动可以通过调节脑源性神经营养因子基因的甲基化水平,增强海马神经发生,从而改善认知功能[44]。随后,该路径进一步向性别差异主题演化,表明性别在痴呆病理学中的特殊作用逐渐受到关注,例如男性与女性在认知衰退或大脑可塑性上的差异[48],这一发现为个性化干预策略的设计提供了重要依据。该路径最后演化为信使RNA主题,意味着研究逐渐聚焦于分子水平,特别是RNA调控在神经退行性疾病中的作用,而这可能为精准医学提供支持。另外痴呆→干细胞/鼠模型在2009-2012年间与祖细胞的演化路径相融合。该融合可能反映了祖细胞研究在理解和治疗痴呆中的重要性。 神经祖细胞在2009-2012年间融入丰富环境演化路径,该路径表明丰富环境对神经祖细胞功能的调控成为该时期的研究热点。研究表明,丰富环境(如复杂身体活动、社交互动和认知刺激等)可通过激活Notch信号通路,促进神经祖细胞的增殖与分化[42]。值得注意的是,丰富环境对神经祖细胞的调控具有“时间窗效应”,青春期前暴露于丰富环境的小鼠,其海马神经祖细胞的增殖能力显著增强,而成年期暴露的效果则相对有限[43]。这一发现为早期环境干预提供了理论依据,同时也提示了神经祖细胞可塑性的年龄依赖性。学习能力在2013-2016年间融入丰富环境演化路径,标志着研究重点从神经发生机制向行为学效应的转变。这一时期的研究揭示了丰富环境通过增强突触可塑性和树突复杂性,提升海马依赖的学习与记忆能力[43]。神经前体细胞在2013-2016年间融入干细胞演化路径,神经前体细胞是干细胞的重要分化方向,主要用于神经再生和修复研究。在此期间,该方向融合到更广泛的干细胞研究中,表明研究者逐渐认识到神经前体细胞在脑损伤修复、神经退行性疾病治疗中的临床潜力。立早基因在2013-2016年间融入抗抑郁药演化路径,立早基因是与神经活动、基因表达和药物效应密切相关的重要分子,该基因研究与抗抑郁药路径结合,表明抑郁症的分子机制和药物靶点研究成为这一时期的焦点。 2013-2016年间新生主题运动干预和抗氧化剂演化发展为骨骼肌主题。运动干预被广泛认为是改善肌肉健康、增强身体功能、预防慢性病的重要手段。该主题的研究迅速发展,集中于如何通过特定类型的运动干预改善肌肉功能及代谢健康[49]。抗氧化剂在减缓氧化应激对肌肉细胞的损伤中具有重要作用,被广泛应用于研究肌肉健康及其在运动干预和恢复中的保护作用[50]。骨骼肌主题不仅局限于运动生理学,还涉及到了营养学、分子生物学和慢性病预防等领域。另外,有研究发现骨骼肌诱导的外周因子能够在骨骼肌和大脑功能之间实现直接交流,并且有助于调节海马的功能,比如肌肉因子和运动诱导的肝因子和脂肪因子参与介导了运动诱导对神经发生、认知功能、食欲和代谢的有益影响[51]。"

| [1] PIERRET C, MORRISON J, RATH P, et al. Developmental cues and persistent neurogenic potential within an in vitro neural niche. BMC Dev Biol. 2010;10:5. [2] TIWARI V, MISHRA A, SINGH S, et al. Crosstalk between Adult Hippocampal Neurogenesis and Its Role in Alzheimer’s Disease. ACS Chem Neurosci. 2023;14(12): 2271-2281. [3] ALMULLA A, MOGULKOC R, BALTACI A, et al. Learning, Neurogenesis and Effects of Flavonoids on Learning. Mini Rev Med Chem. 2022;22(2):355-364. [4] SAHAY A, SCOBIE K, HILL A, et al. Increasing adult hippocampal neurogenesis is sufficient to improve pattern separation. Nature. 2011;472(7344):466-470. [5] YAU SY, GIL-MOHAPEL J, CHRISTIE BR, et al. Physical exercise-induced adult neurogenesis: a good strategy to prevent cognitive decline in neurodegenerative diseases? Biomed Res Int. 2014;2014:403120. [6] BAEK SS. Role of exercise on the brain. J Exerc Rehabil. 2016;12(5):380-385. [7] AUGUSTO-OLIVEIRA M, ARRIFANO GP, LEAL-NAZARÉ CG, et al. Exercise Reshapes the Brain: Molecular, Cellular, and Structural Changes Associated with Cognitive Improvements. Mol Neurobiol. 2023;60(12): 6950-6974. [8] VAN PRAAG H, KEMPERMANN G, GAGE FH. Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat Neurosci. 1999;2(3):266-270. [9] ZHAI K, MA W, HUANG T. Hot spots and trends in knee revision research since the 21st century: a bibliometric analysis. Ann Transl Med. 2021;9(5):388. [10] KIM Y, DELEN D. Medical informatics research trend analysis: A text mining approach. Health Informatics J. 2018;24(4): 432-452. [11] ZHONG D, LI Y, HUANG Y, et al. viaMolecular Mechanisms of Exercise on Cancer: A Bibliometrics Study and Visualization Analysis CiteSpace. Front Mol Biosci. 2021; 8:797902. [12] COBO MJ, LóPEZ-HERRERA AG, HERRERA-VIEDMA E, et al. SciMAT: A new science mapping analysis software tool. J Am Soc Inf Sci Technol. 2012;63(8):1609-1630. [13] 陈晓鹏, 严晓燕, 孙洋, 等. 基于SciMAT的防护服装研究动态演进分析[J]. 服装学报,2023,8(6):521-528. [14] 夏洋, 李文梅. 近20年国际学业情绪研究主题动态演化路径分析[J]. 当代外语研究,2023,23(5):94-102+132. [15] 李丽霞, 任卓明, 张子柯. 基于关键词的知识图谱挖掘信息技术学科演化趋势[J]. 电子科技大学学报,2020,49(5):780-787. [16] 陶文兵, 金海. 一种新的基于图谱理论的图像阈值分割方法[J]. 计算机学报, 2007,30(1): 110-119. [17] 董雪季, 王晓慧. 国际科学计量学研究主题动态演化路径分析[J]. 数字图书馆论坛,2018(10):9-17. [18] CARRASCO-GARRIDO C, DE-PABLOS-HEREDERO C, RODRíGUEZ-SáNCHEZ J. Exploring hybrid telework: A bibliometric analysis. Heliyon. 2023;9(12):e22472. [19] ISO-MARKKU P, KUJALA UM, KNITTLE K, et al. Physical activity as a protective factor for dementia and Alzheimer’s disease: systematic review, meta-analysis and quality assessment of cohort and case-control studies. Br J Sports Med. 2022;56(12):701-709. [20] DOMINGUEZ LJ, VERONESE N, VERNUCCIO L, et al. Nutrition, Physical Activity, and Other Lifestyle Factors in the Prevention of Cognitive Decline and Dementia. Nutrients. 2021;13(11):4080. [21] LATINO F, TAFURI F. Physical Activity and Cognitive Functioning. Medicina (Kaunas). 2024;60(2):216. [22] SINGH AS, SALIASI E, VAN DEN BERG V, et al. Effects of physical activity interventions on cognitive and academic performance in children and adolescents: a novel combination of a systematic review and recommendations from an expert panel. Br J Sports Med. 2019;53(10):640-647. [23] FERREIRA RN, DE MIRANDA AS, ROCHA NP, et al. Neurotrophic Factors in Parkinson’s Disease: What Have we Learned from Pre-Clinical and Clinical Studies? Curr Med Chem. 2018;25(31):3682-3702. [24] DE LA ROSA A, OLASO-GONZALEZ G, ARC-CHAGNAUD C, et al. Physical exercise in the prevention and treatment of Alzheimer’s disease. J Sport Health Sci. 2020;9(5):394-404. [25] VALENZUELA PL, CASTILLO-GARCíA A, MORALES JS, et al. Exercise benefits on Alzheimer’s disease: State-of-the-science. Ageing Res Rev. 2020;62:101108. [26] BASSO MA, BATISTA AP, CHANG SWC, et al. The Future of Nonhuman Primate Neuroscience: Peril or Possibilities? J Neurosci. 2024;44(37):e1458242024. [27] GUO JJ, CAO YZ, ZHANG T, et al. Multisensory Fusion Training and 7, 8-Dihydroxyflavone Improve Amyloid-β-Induced Cognitive Impairment, Anxiety, and Depression-Like Behavior in Mice Through Multiple Mechanisms. Neuropsychiatr Dis Treat. 2024;20:1247-1270. [28] YOKOYAMA R, AGO Y, IGARASHI H, et al. (R)-ketamine restores anterior insular cortex activity and cognitive deficits in social isolation-reared mice. Mol Psychiatry. 2024;29(5):1406-1416. [29] ZHU JW, GE FF, ZENG Y, et al. Physical and Mental Activity, Disease Susceptibility, and Risk of Dementia A Prospective Cohort Study Based on UK Biobank. Neurology. 2022;99(8):E799-E813. [30] SIMS SK, WILKEN-RESMAN B, SMITH CJ, et al. Brain-Derived Neurotrophic Factor and Nerve Growth Factor Therapeutics for Brain Injury: The Current Translational Challenges in Preclinical and Clinical Research. Neural Plast. 2022;2022:3889300. [31] VOGT C, FLOEGEL M, KASPER J, et al. Oxytocinergic modulation of speech production-a double-blind placebo-controlled fMRI study. Soc Cogn Affect Neurosci. 2023;18(1):nsad035. [32] ZHU XQ, CHEN WJ, THIRUPATHI A. Sprint Interval Training Improves Brain-Derived Neurotropic Factor-Induced Benefits in Brain Health-A Possible Molecular Signaling Intervention. Biology (Basel). 2024;13(8):562. [33] HAMILTON GF, RHODES JS. Exercise Regulation of Cognitive Function and Neuroplasticity in the Healthy and Diseased Brain. Prog Mol Biol Transl Sci. 2015;135:381-406. [34] LU Y, BU FQ, WANG F, et al. Recent advances on the molecular mechanisms of exercise-induced improvements of cognitive dysfunction. Transl Neurodegener. 2023;12(1):9. [35] PEKDEMIR B, RAPOSO A, SARAIVA A, et al. Mechanisms and Potential Benefits of Neuroprotective Agents in Neurological Health. Nutrients. 2024;16(24):4368. [36] TRISAL A, SINGH I, GARG G, et al. Gut-brain axis and brain health: modulating neuroinflammation, cognitive decline, and neurodegeneration. 3 Biotech. 2025;15(1):25. [37] MA C, LIN M, GAO J, et al. The impact of physical activity on blood inflammatory cytokines and neuroprotective factors in individuals with mild cognitive impairment: a systematic review and meta-analysis of randomized-controlled trials. Aging Clin Exp Res. 2022;34(7):1471-1484. [38] HUANG T, GONG XK, LIANG Z, et al. Exercised-enriched blood plasma rescues hippocampal impairments and cognitive deficits in an Alzheimer’s disease model. Biochim Biophys Acta Mol Basis Dis. 2024; 1870(5): 167197. [39] HANSON ND, OWENS MJ, NEMEROFF CB. Depression, antidepressants, and neurogenesis: a critical reappraisal. Neuropsychopharmacology. 2011;36(13): 2589-2602. [40] VAQUERO-RODRÍGUEZ A, ORTUZAR N, LAFUENTE JV, et al. Enriched environment as a nonpharmacological neuroprotective strategy. Exp Biol Med (Maywood). 2023; 248(7):553-560. [41] TERREROS-RONCAL J, MORENO-JIMéNEZ EP, FLOR-GARCíA M, et al. Impact of neurodegenerative diseases on human adult hippocampal neurogenesis. Science. 2021;374(6571):1106-1113. [42] HAN Y, YUAN M, GUO YS, et al. The role of enriched environment in neural development and repair. Front Cell Neurosci. 2022;16:890666. [43] HOSSEINY S, PIETRI M, PETIT-PAITEL A, et al. Differential neuronal plasticity in mouse hippocampus associated with various periods of enriched environment during postnatal development. Brain Struct Funct, 2015;220(6):3435-3448. [44] CHEN C, NAKAGAWA S. Physical activity for cognitive health promotion: An overview of the underlying neurobiological mechanisms. Ageing Res Rev. 2023;86:101868. [45] XIONG LL, CHEN L, DENG IB, et al. P75 neurotrophin receptor as a therapeutic target for drug development to treat neurological diseases. Eur J Neurosci. 2022;56(8):5299-5318. [46] DIAMOND A, LEE K. Interventions shown to aid executive function development in children 4 to 12 years old. Science. 2011;333(6045):959-964. [47] MIGLIORE L, COPPEDÈ F. Gene-environment interactions in Alzheimer disease: the emerging role of epigenetics. Nat Rev Neurol. 2022;18(11):643-660. [48] SULTANA OF, BANDARU M, ISLAM MA, et al. Unraveling the complexity of human brain: Structure, function in healthy and disease states. Ageing Res Rev. 2024;100:102414. [49] THYFAULT JP, BERGOUIGNAN A. Exercise and metabolic health: beyond skeletal muscle. Diabetologia. 2020;63(8):1464-1474. [50] POWERS SK, GOLDSTEIN E, SCHRAGER M, et al. Exercise Training and Skeletal Muscle Antioxidant Enzymes: An Update. Antioxidants (Basel). 2022;12(1):39. [51] PEDERSEN BK. Physical activity and muscle-brain crosstalk. Nat Rev Endocrinol. 2019; 15(7): 383-392. |
| [1] | Xu Canli, He Wenxing, Wang Yuping, Ba Yinying, Chi Li, Wang Wenjuan, Wang Jiajia. Research context and trend of TBK1 in autoimmunity, signaling pathways, gene expression, tumor prevention and treatment [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(在线): 1-11. |
| [2] | Sun Yaotian, Xu Kai, Wang Peiyun. Potential mechanisms by which exercise regulates iron metabolism in immune inflammatory diseases [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1486-1498. |
| [3] | Huang Jie, Zeng Hao, Wang Wenchi, Lyu Zhucheng, Cui Wei. Visualization analysis of literature on the effect of lipid metabolism on osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1558-1568. |
| [4] | Yang Zeyu, Zhi Liang, Wang Jia, Zhang Jingyi, Zhang Qingfang, Wang Yulong, Long Jianjun. A visualized analysis of research hotspots in high-frequency repetitive transcranial magnetic stimulation from the macroscopic perspective [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1320-1330. |
| [5] | Jiang Kan, Alimujiang·Abudourousuli, Shalayiding·Aierxiding, Aikebaierjiang·Aisaiti, Kutiluke·Shoukeer, Aikeremujiang·Muheremu. Biomaterials and bone regeneration: research hotspots and analysis of 500 influential papers [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 528-536. |
| [6] | Tang Zhuolin, Yin Mingyue, Bai Mingyang, Zheng Huakun, Yan Henghao, Xu Kai, Liu Qian. Effects of high-intensity interval training and moderate-intensity continuous training on cognitive function in patients with neurodegenerative diseases: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2594-2607. |
| [7] | Liu Tongyan, Li Yuan, Sun Wei, Yao Bing, Fang Shanshan, Zhou Lingyun. Current status and hotspot analysis of experimental research on electroacupuncture intervention for peripheral nerve regeneration: electroacupuncture parameters, acupuncture effects and molecular mechanisms [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2608-2617. |
| [8] | Huang Hailun, Wei Yatao, Liu Yongai, Wu Junzhe, Gao Heng, Sun Kui, Cao Zhenwen. Visualization analysis of lumbar spondylolisthesis treatment research from a bibliometric perspective [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2618-2628. |
| [9] | Zhao Qianwei, Sun Guangyuan . Intestinal organoids: a bibliometric analysis of the latest trends in tissue/organ biology, disease modeling, and clinical applications [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(1): 238-247. |
| [10] | Liang Haobo, Wang Zeyu, Ma Wenlong, Liu Hao, Liu Youwen. Hot issues in the field of joint revision: infection, rehabilitation nursing, bone defect, and prosthesis loosening [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1963-1971. |
| [11] | Zheng Huakun, Yin Mingyue, Liu Qian. Effects of interval and continuous training on the quality of life in physically inactive adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1727-1740. |
| [12] | Xie Liugang, Cui Shuke, Guo Nannan, Li Aoyu, Zhang Jingrui. Research hotspots and frontiers of stem cells for Alzheimer’s disease [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1475-1485. |
| [13] | Chang Jinxia, Liu Yufei, Niu Shaohui, Wang Chang, Cao Jianchun. Visualization analysis of macrophage polarization in tissue repair process [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1486-1496. |
| [14] | Li Huijun, Li Huangyan, Zhang Yeting. Physical activity and cognition in older adults: research hotspot and topic evolution [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1073-1080. |
| [15] | Dang Xiaowen, Huang Hailiang, Huang Lei, Wang Yajie . Research frontiers and hotspots of carbon nanomaterials in biomedical field over the past 10 years [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 752-760. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||