Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (32): 6955-6962.doi: 10.12307/2025.965
Previous Articles Next Articles
Monomeric traditional Chinese medicine in the treatment of rheumatoid arthritis: regulation of T cell balance
Zhu Jiaping1, Gao Bo1, Lou Chunbiao2, Yang Fengyong1, Yang Kun1
- 1Jinan City People’s Hospital, Jinan 271100, Shandong Province, China; 2The First Clinical Medical College of Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China
-
Received:2024-10-24Accepted:2024-12-25Online:2025-11-18Published:2025-04-29 -
Contact:Yang Kun, Associate chief physician, Jinan City People’s Hospital, Jinan 271100, Shandong Province, China -
About author:Zhu Jiaping, Master, Attending physician, Jinan City People’s Hospital, Jinan 271100, Shandong Province, China -
Supported by:Natural Science Foundation of Shandong Province (General Program), No. ZR2021MH329 (to YFY); 2023 Science and Technology Development Program of Jinan Municipal Health Commission, Shandong Province, China, No. 2023-1-22 (to ZJP)
CLC Number:
Cite this article
Zhu Jiaping, Gao Bo, Lou Chunbiao, Yang Fengyong, Yang Kun. Monomeric traditional Chinese medicine in the treatment of rheumatoid arthritis: regulation of T cell balance[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6955-6962.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
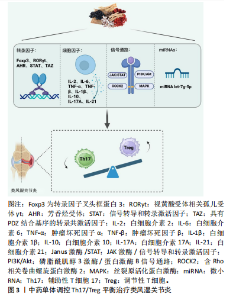
2.1 Th17和Treg细胞与类风湿关节炎 Th17和Treg细胞源自同一个前体细胞,即初始CD4+ T 细胞,它们在初始分化阶段依赖于转化生长因子β信号的共同作用[7-8]。然而,终末分化后,这两类细胞展现出截然不同的功能特性:Th17细胞促发自身免疫和炎症反应,而Treg细胞则有效抑制这些过程,维护免疫系统的稳态[9]。 Th17细胞是CD4+ T 细胞的一个独特炎症谱系,其分化依赖于CD28和诱导性共刺激因子的共刺激,并以视黄酸受体相关孤儿受体γt(retinoid-related orphan receptor gamma t,RORγt)为主要转录调节因子,该因子负责指导白细胞介素17编码基因的转录[10]。此外,信号转导和转录激活因子3(Signal transducer and activator of transcription 3,STAT3)在这一过程中与大多数相关基因结合,发挥关键作用[11-12]。Th17细胞的特点是白细胞介素17分泌水平高,同时也可以分泌白细胞介素17A、白细胞介素17F、白细胞介素21、白细胞介素22和半胱氨酸-半胱氨酸基序趋化因子配体20(cysteine-cysteine motif chemokine ligand 20,CCL20)[13]。自2005年发现以来,Th17细胞在炎症反应和自身免疫疾病中的作用机制引起了广泛关注,成为研究的热点[14]。Treg细胞是另外的一类重要的CD4+ T细胞,其主要功能是抑制免疫反应、维持免疫稳态和防止自身免疫[8]。Treg细胞的分化通常依赖于转化生长因子β和白细胞介素2,在白细胞介素2的信号刺激下,STAT5可以被磷酸化为pSTAT5,促进转录因子叉头框蛋白3基因的转录,转录因子叉头框蛋白3是Treg细胞特异性转录因子,负责维持其抑制性功能[15-16]。 类风湿关节炎的发病机制十分复杂,涉及多种免疫因子的相互作用及T细胞功能的异常。Th17细胞被认为是发病机制的重要驱动因素,它通过分泌白细胞介素17等促炎细胞因子激活中性粒细胞和其他炎性细胞,加重炎症反应并导致骨破坏[17-18]。Treg细胞的数量和功能减弱被认为是类风湿关节炎的重要病理因素,它主要通过分泌抗炎因子如白细胞介素10和转化生长因子β,抑制过度的免疫反应,维护免疫耐受性和自我耐受性[19]。Th17细胞增多和Treg细胞减少导致免疫系统的平衡被打破,炎症反应失控[4]。Th17细胞的增殖和促炎因子的过度表达加剧了关节的破坏和疾病的进展,而Treg细胞的功能缺陷则削弱了对免疫系统的负反馈调控[19-20]。因此,Th17/Treg平衡的失调被认为是类风湿关节炎发病和慢性炎症持续的重要机制之一[21]。通过恢复这种平衡,有助于缓解类风湿关节炎的症状并控制疾病进展。 2.2 中药单体调控Th17/Treg平衡治疗类风湿关节炎 近年来,大量研究表明中药单体在调控Th17与Treg细胞平衡方面展现出显著疗效,为类风湿关节炎的治疗提供了新的思路。通过靶向调节促炎性Th17细胞与抗炎性Treg细胞的比例,中药单体不仅有效缓解关节炎症,还能减缓疾病进展。现有研究发现,中药单体能够通过多种机制调节Th17与Treg平衡,包括调控细胞因子、调控转录因子、影响信号通路以及干预miRNA的表达,从而发挥治疗类风湿关节炎的作用。 中药单体调控Th17/Treg平衡治疗类风湿关节炎的机制图见图3。"
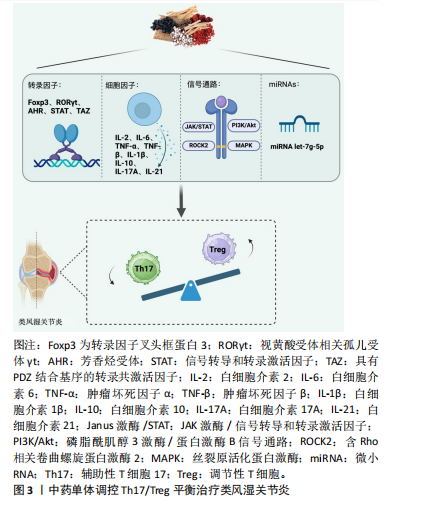
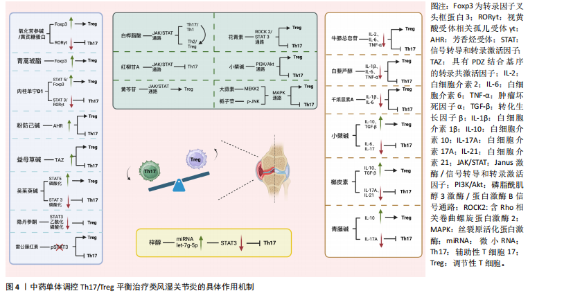
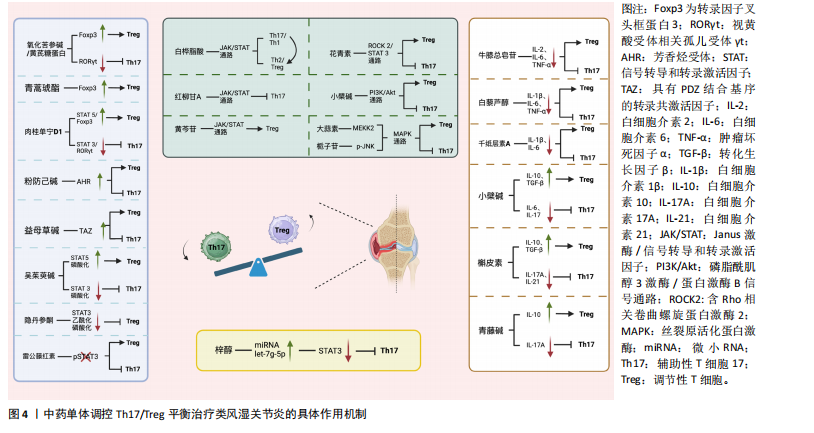
2.2.1 中药单体调控转录因子维持Th17/Treg平衡 在调控类风湿关节炎中Th17与Treg细胞平衡的研究中,转录因子发挥了至关重要的作用。转录因子是能够结合DNA特定序列并调控基因表达的蛋白质,从而控制细胞的发育、分化及响应外部信号的过程[22]。这些因子不仅调节免疫细胞的分化和功能,还在维持免疫稳态中扮演了关键角色,尤其是转录因子叉头框蛋白3、RORγt、芳香烃受体和STAT家族等转录因子,直接影响T细胞亚群的命运和功能。通过调节这些转录因子的表达和活性,中药单体能够有效调整Th17与Treg细胞的平衡,为类风湿关节炎的治疗提供新的生物学基础。氧化苦参碱是一种从中草药苦参中提取的单体生物碱,研究表明氧化苦参碱能够上调调节性T细胞相关转录因子——转录因子叉头框蛋白3,并下调促炎性Th17细胞相关转录因子RORγt,这一调控机制有效促进了Treg细胞的生成,并抑制了Th17细胞的增殖,从而恢复Th17/Treg细胞的平衡[23]。此外,有研究还发现氧化苦参碱能够通过重塑肠道菌群参与Th17/Treg平衡的调控,为其治疗类风湿关节炎提供了更广泛的机制支持[24]。青蒿琥酯是青蒿素的半合成衍生物,LIU等[25]发现青蒿琥酯能够显著增加CD4+ T淋巴细胞中转录因子叉头框蛋白3的表达,同时青蒿琥酯还能够降低促炎性细胞因子白细胞介素17水平,上调转录因子叉头框蛋白3的表达,有效逆转了Th17/Treg细胞失衡。同样的,中药黄芪中的有效生物活性成分黄芪糖蛋白也被发现能够上调转录因子叉头框蛋白3水平,并下调RORγt的表达,以此纠正Th17/Treg细胞的失衡[26]。肉桂中的主要成分肉桂单宁D1通过下调STAT3/RORγt抑制Th 17细胞分化,并通过上调STAT5/Foxp 3促进Treg分化,从而恢复Th17/Treg平衡。此外,肉桂单宁D1对Th17和Treg细胞的调节作用依赖于芳香烃受体的表达。当芳香烃受体被敲低时,肉桂单宁D1的调节作用减弱,而芳香烃受体的过表达则削弱了这种调控能力[27]。芳香烃受体是一种核转录因子,能够感知多种内源性和外源性配体,并在T细胞分化过程中发挥关键作用,特别是在调控Th17和Treg细胞平衡方面。无独有偶,防己中的成分粉防己碱也可以通过芳香烃受体恢复Th17/Treg平衡,发挥其抗关节炎的功效[28]。此外,还有一种转录共激活因子TAZ,它是Hippo信号通路中的一个重要共激活因子,通过与转录因子结合调节多种细胞功能。研究发现,益母草碱通过抑制TAZ,可以减少Th17细胞的活性,同时增强Treg细胞的免疫调节作用,从而恢复两者的平衡,减轻类风湿关节炎的炎症症状[29]。 STAT3和STAT5的磷酸化过程在调节Th17与Treg细胞分化中发挥着核心作用。STAT3磷酸化主要参与促炎性Th17细胞的分化,而STAT5磷酸化则在抗炎性Treg细胞的维持中至关重要,它们的动态平衡决定了免疫反应的强度和类型,因此,靶向调节STAT3和STAT5的磷酸化状态,成为调控免疫反应的有效策略[30]。有研究表明,吴茱萸碱作为吴茱萸中的活性成分,能够抑制关节炎大鼠中STAT3的磷酸化,同时诱导STAT5的磷酸化,调节Th17/Treg平衡[31]。隐丹参酮是从丹参中提取的一种水溶性有效成分,具有广泛的生物活性,如抗炎、抗菌、抗氧化、抗癌等作用。研究发现,隐丹参酮能够降低p300的表达并抑制p300与STAT3的结合,进而抑制STAT3的乙酰化和磷酸化,改善Th17/Treg的失衡,并抑制小鼠的免疫反应和关节损伤[32]。雷公藤红素是中药雷公藤中有效成分,研究表明,雷公藤红素的治疗不仅减少了关节中的Th17细胞数量,同时也增加了Treg细胞的比例,其机制涉及阻断pSTAT3的激活,从而抑制Th17细胞的分化。此外,雷公藤红素还在体外促进了Treg细胞的分化[33],进一步增强了其抗炎作用。值得注意的是,雷公藤红素还限制了与Th17细胞分化相关的细胞因子和趋化因子的产生,如CCL3和CCL5,这些因子的减少有助于减轻炎症反应[34]。综上所述,中药单体通过调控Th17/Treg细胞相关的关键转录因子,如转录因子叉头框蛋白3、RORγt、芳香烃受体、TAZ、STAT3、STAT5等,通过精准调控这些因子的表达和活性,不仅有助于逆转类风湿关节炎患者中Th17/Treg的失衡状态,还能够在更广泛的层面上影响整体免疫反应的调节,展现出中药单体在调节免疫平衡和类风湿关节炎中的巨大潜力。 2.2.2 中药单体调控细胞因子维持Th17/Treg平衡 在调节Th17与Treg细胞平衡的过程中,细胞因子发挥了重要的调控作用。许多中药单体通过调控促炎性和抗炎性细胞因子的表达,从而影响Th17和Treg细胞的分化与功能,进而恢复免疫平衡,减轻类风湿关节炎相关的炎症反应。这些调控作用为类风湿关节炎的治疗提供了新的潜在靶点和治疗策略。 牛膝总皂苷是牛膝中的主要活性成分,具有抗炎、抗氧化和抗衰老等多种作用[35]。牛膝总皂苷通过降低胶原诱导关节炎大鼠滑膜中白细胞介素2、白细胞介素6、肿瘤坏死因子α的水平,抑制Th17细胞的增多,促进Treg细胞的扩展,纠正Th17/Treg失衡,进而抑制炎性因子的分泌,从而发挥治疗类风湿关节炎的效果[36]。白藜芦醇是一种源自白藜芦醇衍生物的多酚化合物,具有显著的抗炎作用[37],它通过抑制炎性递质和细胞因子的生成与释放,发挥抗炎作用。研究表明,白藜芦醇能够减少胶原诱导关节炎小鼠血清中促炎因子肿瘤坏死因子α、白细胞介素6和白细胞介素1β的水平,恢复Th17/Treg细胞的平衡,并有效缓解胶原诱导关节炎小鼠的关节炎症状[38]。与之类似的,千层纸素A是黄芩中的活性成分之一,具有抗炎、抗肿瘤的特性[39]。WANG等[40]发现千层纸素A同样可以减少白细胞介素1β和白细胞介素6,使Th17细胞减少。小檗碱是中药黄连中的有效生物成分,又名黄连素,在抗关节炎方面展现出卓越的效果[41]。研究表明,小檗碱显著降低了促炎细胞因子白细胞介素6和白细胞介素17表达水平,同时升高了抗炎因子白细胞介素10和转化生长因子β表达水平[42]。槲皮素是一种广泛存在于多种中药中的黄酮类化合物,YANG等[43]研究发现槲皮素可以减少促炎细胞因子白细胞介素17A和白细胞介素21的表达,并增加抗炎因子白细胞介素10和转化生长因子β的表达,以此实现Treg细胞与Th17细胞之间的平衡,缓解类风湿关节炎的症状。青风藤具有祛风湿、通经络的功效,自古以来一直被应用于治疗风湿痹痛[44],青风藤有效的生物活性成分青藤碱被发现可以通过下调白细胞介素17A 并上调白细胞介素10维持Th17/Treg平衡[45]。 总的来说,中药单体通过调控多种关键细胞因子的表达,在维持Th17/Treg平衡方面展现了显著的作用。这些活性成分或是通过抑制促炎细胞因子,或是提升抗炎细胞因子的水平,有效地抑制了Th17细胞的分化和炎症反应,促进了Treg细胞的增殖和功能恢复。这种细胞因子的精细调控机制不仅为中药治疗类风湿性关节炎的应用提供了重要的理论基础,而且为未来开发多靶点、低不良反应的新型免疫疗法奠定了坚实的基础。 2.2.3 中药单体调控信号通路维持Th17/Treg平衡中药单体调控Janus激酶(Janus kinase,JAK)/STAT信号通路维持Th17/Treg平衡:中药单体通过调节多条信号通路的活性,可以影响Th17与Treg的平衡,从而在类风湿关节炎这样的自身免疫性疾病治疗中发挥作用。JAK/STAT信号通路与炎症和自身免疫性疾病的发病机制有关,包括类风湿关节炎[46]。白桦脂酸是从中药接骨木(Sambucus williamsii Hance)中提取的五环三萜类化合物,已在多种实验系统中展现出良好的抗炎和抗破骨活性,成为类风湿关节炎治疗研究中的潜在候选药物。在类风湿关节炎的治疗研究中,Chen等[47]发现白桦脂酸的衍生物SH479通过调节Th17/Th1与Th2/Treg细胞的平衡,发挥显著的抗炎作用。具体来说,SH479能够有效将促炎性的Th17/Th1反应转变为抗炎性的Th2/Treg表型,从而抑制炎症进展,这与JAK/STAT信号通路密切相关。同样的,杠柳是中国用于治疗类风湿关节炎的传统草药,临床上常用的香加皮就是杠柳的干燥根皮,其成分杠柳苷A也被发现在体外和体内均表现出免疫抑制活性,可以通过JAK/STAT途径调节Th17/Treg细胞的平衡,减轻关节炎的严重程度[48]。黄芩苷是黄芩根中的一种黄酮类化合物,具有抑制炎症、调节免疫功能的作用。黄芩苷治疗类风湿关节炎疗效好,不良反应少,可改善类风湿关节炎大鼠的症状。黄芩苷通过抑制JAK/STAT 3信号激活并将其转移至Treg细胞,调节胶原诱导关节炎大鼠的Th17/Treg免疫平衡,从而改善大鼠的关节炎症状[49]。这些研究表明,JAK/STAT信号通路确实是多种中药单体发挥抗炎和免疫调节作用的共同靶点。然而,这也引发了一个值得深入思考的问题,即这些药物是否可以联合使用以增强疗效或减少不良作用。由于白桦脂酸、杠柳苷A和黄芩苷都通过调控相同的信号通路来调节Th17/Treg细胞的平衡,联合使用这些药物可能具有协同效应,进一步抑制促炎反应并增强抗炎机制。但联合用药的效果不仅取决于各单体对JAK/STAT通路的调控作用,还取决于它们之间的相互作用、药代动力学以及可能产生的毒性反应。因此,虽然这些药物在调节免疫平衡方面展现出潜在优势,但其联合使用需要通过深入的机制研究和临床试验来确定最佳组合和剂量,以确保其安全性和有效性。这为未来开发多靶点、个体化的类风湿关节炎治疗策略提供了有价值的探索方向,为类风湿关节炎的治疗提供了新的思路。 中药单体调控磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路维持Th17/Treg平衡:当然不同中药单体也可以调控其他通路,小檗碱被发现能够有效地调控类风湿关节炎中的Th17/Treg失衡,主要通过抑制PI3K/Akt信号通路和RORγt,而对转录因子叉头框蛋白3具有促进作用[50]。 中药单体调控ROCK2/STAT3信号通路维持Th17/Treg平衡:花青素一类存在于多种天然药植物中的一种黄酮类化合物[51]。SAMARPITA等[52]发现花青素无论在体外和体内均可抑制佐剂性关节炎大鼠Th17细胞分化增加,提高Treg细胞数量,具体是通过抑制ROCK2/STAT3信号通路的激活来恢复Th17/Treg的平衡。 中药单体调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路维持Th17/Treg平衡:ZHANG等[53]发现来自中药葱白的大蒜素可以通过提高MAPK途径中丝裂原活化蛋白激酶激酶激酶2蛋白的表达,显著增强Foxp 3蛋白并减少RORγt蛋白,同样的,栀子苷也通过调控MAPK信号通路对免疫平衡产生影响,研究表明,栀子苷可能通过诱导Th17细胞的免疫耐受,并通过下调磷酸化c-Jun氨基末端激酶(phospho-c-Jun N-terminal kinases,p-JNK)的表达来增强Treg细胞的活性,从而抑制炎症反应[54],p-JNK是JNK的磷酸化活性形式,属于MAPK信号通路的一部分。通过不同中药单体针对不同信号通路的靶向调节,有可能实现更好的治疗作用,不过,深入了解这些通路的相互作用及药物间的潜在协同或拮抗效果,依然是未来研究和临床应用的重要方向。 2.2.4 中药单体调控miRNAs表达维持Th17/Treg平衡 近年来,miRNA在调节免疫细胞功能和命运中的作用逐渐被重视。中药单体能够通过影响特定miRNA的表达,间接调控Th17和Treg细胞的平衡,从而实现对免疫微环境的精细调控。有研究发现,地黄成分梓醇通过上调miRNA let-7g-5p,降低了促炎性转录因子STAT3的表达,从而抑制了Th17细胞的分化[55]。此外,研究发现,在特定炎症条件下,Treg细胞可以转分化为Th17细胞,进一步加剧炎症反应,梓醇通过调节let-7g-5p的表达,不仅能够阻止这种转分化过程,还能在复杂的炎症环境中恢复Th17/Treg平衡[55]。尽管目前关于中药单体调控miRNA的研究仍然处于起步阶段,梓醇是少数被明确揭示作用机制的单体之一,但其他中药复方和疗法,如甘草附子汤和艾灸[56-57],也展示了通过影响miRNA来调节免疫系统的潜在价值,中药复方对 Th17/Treg 平衡的调控也体现了单体间的协同作用,这再次为未来中医药在类风湿关节炎治疗中的应用提供了新的视角和思路。中药单体调控Th17/Treg平衡治疗类风湿关节炎的具体作用机制见图4,具体作用机制以及中药单体的分子结构汇总见表1。 2.3 中药单体治疗类风湿关节炎的优势与靶向机制 中药单体具有成分单一、不良反应少、价格低廉等优势,在治疗类风湿关节炎中的Th17/Treg失调方面,展示了独特的应用优势。与传统中药汤剂相比,中药单体因成分单一且具有明确的分子靶点,能够实现更加精准的免疫调节,中药单体的精准作用使其在治疗类风湿关节炎时具有显著优势,不仅疗效可控,还能减少传统中药汤剂中可能存在的药效波动和成分间相互作用带来的不确定性。除了精准的免疫调节作用,中药单体还可以通过现代靶向技术进一步提高其疗效。例如,利用纳米药物递送系统或脂质体技术,可以将中药单体更有效地输送到靶组织或特定的免疫细胞(如Th17和Treg细胞)。这些靶向递送系统不仅提高了中药单体的生物利用度,避免了全身性不良反应,还能够确保药物在关节等局部组织的高浓度积聚,从而增强药物的治疗效果。与现有药物治疗机制相比,中药单体具有显著的实用性优势。传统的药物如非类固醇抗炎药、生物制剂和免疫抑制剂,通常通过抑制整体免疫反应来减轻症状,长期使用可能引发不良反应和耐药性问题。而中药单体则能够通过更加精细的免疫调控,避免过度抑制免疫系统,从而减少不良作用的发生。中药单体这些靶向性治疗的特点以及持续的治疗效果,使得其在临床治疗中,特别是在个性化治疗中具有广阔的应用前景。"
| [1] SMOLEN JS, ALETAHA D, MCINNES IB. Rheumatoid arthritis. Lancet (London, England). 2016;388(10055): 2023-2038. [2] HUANG J, FU X, CHEN X, et al. Promising Therapeutic Targets for Treatment of Rheumatoid Arthritis. Front Immunol. 2021;12:686155. [3] VAN DER WOUDE D, VAN DER HELM-VAN MIL AHM. Update on the epidemiology, risk factors, and disease outcomes of rheumatoid arthritis. Best Pract Res Clin Rheumatol. 2018;32(2):174-187. [4] PARADOWSKA-GORYCKA A, WAJDA A, ROMANOWSKA-PRÓCHNICKA K, et al. Th17/Treg-Related Transcriptional Factor Expression and Cytokine Profile in Patients With Rheumatoid Arthritis. Front Immunol. 2020;11:572858. [5] BROWN P, PRATT AG, HYRICH KL. Therapeutic advances in rheumatoid arthritis. BMJ. 2024;384:e070856. [6] WANG T, WANG Z, QI W, et al. The role, targets and mechanisms of traditional Chinese medicine in regulating the balance of T helper type 17/regulatory Tcells in rheumatoid arthritis. Int J Rheum Dis. 2023;26(4):613-624. [7] YANG W, CHEN X, HU H. CD4+ T-Cell Differentiation In Vitro. Methods Mol Biol. 2020;2111:91-99. [8] YAN J, LUO M, CHEN Z, et al. The Function and Role of the Th17/Treg Cell Balance in Inflammatory Bowel Disease. J Immunol Res. 2020; 2020:8813558. [9] ZHANG S, GANG X, YANG S, et al. The Alterations in and the Role of the Th17/Treg Balance in Metabolic Diseases. Front Immunol. 2021; 12:678355. [10] WU B, WAN Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 2020;80:106187. [11] MOON J, LEE S, CHOI JW, et al. Metformin ameliorates scleroderma via inhibiting Th17 cells and reducing mTOR-STAT3 signaling in skin fibroblasts. J Transl Med. 2021;19(1):192. [12] BUTTRICK T, KHOURY SJ, ELYAMAN W. Opposite functions of STAT3 and Smad3 in regulating Tiam1 expression in Th17 cells. Small GTPases. 2020;11(1):62-68. [13] UENO A, JEFFERY L, KOBAYASHI T, et al. Th17 plasticity and its relevance to inflammatory bowel disease. J Autoimmun. 2018;87:38-49. [14] HARRINGTON LE, HATTON RD, MANGAN PR, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol. 2005;6(11):1123-1132. [15] WU X, ZHOU Z, CAO Q, et al. Reprogramming of Treg cells in the inflammatory microenvironment during immunotherapy: a literature review. Front Immunol. 2023;14:1268188. [16] ZHANG Z, SALGADO OC, LIU B, et al. An OGT-STAT5 Axis in Regulatory T Cells Controls Energy and Iron Metabolism. Front Immunol. 2022; 13:874863. [17] KUGYELKA R, KOHL Z, OLASZ K, et al. Enigma of IL-17 and Th17 Cells in Rheumatoid Arthritis and in Autoimmune Animal Models of Arthritis. Mediators Inflamm. 2016;2016:6145810. [18] YANG P, QIAN FY, ZHANG MF, et al. Th17 cell pathogenicity and plasticity in rheumatoid arthritis. J Leukoc Biol. 2019;106(6):1233-1240. [19] JIANG Q, YANG G, LIU Q, et al. Function and Role of Regulatory T Cells in Rheumatoid Arthritis. Front Immunol. 2021;12:626193. [20] WAGNER A, WANG C, FESSLER J, et al. Metabolic Modeling of Single Th17 Cells Reveals Regulators of Autoimmunity. Cell. 2021;184(16): 4168-4185.e21. [21] WANG X, SUN B, WANG Y, et al. Research progress of targeted therapy regulating Th17/Treg balance in bone immune diseases. Front Immunol. 2024;15:1333993. [22] BALENDRAN T, LIM K, HAMILTON JA, et al. Targeting transcription factors for therapeutic benefit in rheumatoid arthritis. Front Immunol. 2023;14:1196931. [23] MA A, YANG Y, WANG Q, et al. Anti‑inflammatory effects of oxymatrine on rheumatoid arthritis in rats via regulating the imbalance between Treg and Th17 cells. Mol Med Rep. 2017;15(6):3615-3622. [24] CAO G, LI J, MAO Z, et al. Oxymatrine Alleviates Collagen-Induced Arthritis in Mice by Regulating the Immune Balance of T Cells.Molecules. 2023;28(15):5879. [25] LIU J, HONG X, LIN D, et al. Artesunate influences Th17/Treg lymphocyte balance by modulating Treg apoptosis and Th17 proliferation in a murine model of rheumatoid arthritis. Exp Ther Med. 2017;13(5):2267-2273. [26] WANG ZH, QIN C, RAN T, et al. Effects of Astragalus glycoprotein on Th17/Treg cells in mice with collagen-induced arthritis. J Biol Regul Homeost Agents. 2018;32(4):951-957. [27] SHI C, ZHANG H, WANG X, et al. Cinnamtannin D1 attenuates autoimmune arthritis by regulating the balance of Th17 and treg cells through inhibition of aryl hydrocarbon receptor expression. Pharmacol Res. 2020;151:104513. [28] YUAN X, TONG B, DOU Y, et al. Tetrandrine ameliorates collagen-induced arthritis in mice by restoring the balance between Th17 and Treg cells via the aryl hydrocarbon receptor. Biochem Pharmacol. 2016;101:87-99. [29] DU YY, CHEN ZX, LIU MY, et al. Leonurine Regulates Treg/Th17 Balance to Attenuate Rheumatoid Arthritis Through Inhibition of TAZ Expression. Front Immunol. 2020;11:556526. [30] LI P, SPOLSKI R, LIAO W, et al. Complex Interactions of Transcription Factors in Mediating Cytokine Biology in T Cells. Immunol Rev. 2014; 261(1):141-156. [31] ZHANG H, YIN L, LU M, et al. Evodiamine attenuates adjuvant-induced arthritis in rats by inhibiting synovial inflammation and restoring the Th17/Treg balance. J Pharm Pharmacol. 2020;72(6):798-806. [32] JHUN J, LEE J, BYUN JK, et al. Red ginseng extract ameliorates autoimmune arthritis via regulation of STAT3 pathway, Th17/Treg balance, and osteoclastogenesis in mice and human. Mediators Inflamm. 2014;2014:351856. [33] ZHU BJ, QIAN ZQ, YANG HR, et al. Tripterine: A Potential Anti-Allergic Compound. Curr Pharm Biotechnol. 2021;22(1):159-167. [34] ASTRY B, VENKATESHA SH, LAURENCE A, et al. Celastrol, a Chinese herbal compound, controls autoimmune inflammation by altering the balance of pathogenic and regulatory T cells in the target organ.Clin Immunol. 2015;157(2):228-238. [35] 黄竞杰, 杨俊兴, 陈浩雄. 牛膝总皂苷治疗膝骨关节炎的药理研究进展[J]. 中药新药与临床药理,2021,32(4):592-595. [36] 宋献美, 许波, 张欢欢, 等. 牛膝总皂苷对类风湿关节炎大鼠Th17/Treg平衡和滑膜组织中IL-2、IL-6、TNF-α的影响[J]. 中医研究, 2020,33(3):70-73. [37] ZHOU DD, LUO M, HUANG SY, et al. Effects and Mechanisms of Resveratrol on Aging and Age-Related Diseases. Oxid Med Cell Longev. 2021;2021:9932218. [38] 姜冀, 方海川, 金晓畅, 等. 白藜芦醇通过重塑肠道菌群改善类风湿性关节炎的作用机制研究[J]. 新中医,2022,54(1):8-14. [39] SAJEEV A, HEGDE M, GIRISA S, et al. Oroxylin A: A Promising Flavonoid for Prevention and Treatment of Chronic Diseases. Biomolecules. 2022;12(9):1185. [40] WANG YL, GAO JM, XING LZ. Therapeutic potential of Oroxylin A in rheumatoid arthritis. Int Immunopharmacol. 2016;40:294-299. [41] CICERO AFG, BAGGIONI A. Berberine and Its Role in Chronic Disease. Adv Exp Med Biol. 2016;928:27-45. [42] WANG X, HE X, ZHANG CF, et al. Anti-arthritic effect of berberine on adjuvant-induced rheumatoid arthritis in rats. Biomed Pharmacother. 2017;89:887-893. [43] YANG Y, ZHANG X, XU M, et al. Quercetin attenuates collagen-induced arthritis by restoration of Th17/Treg balance and activation of Heme Oxygenase 1-mediated anti-inflammatory effect. Int Immunopharmacol. 2018;54:153-162. [44] 贾梦雪,朱静平,王振兴,等.青风藤化学成分、药理和临床应用研究进展[J].中华中医药学刊,2025,43(2):187-193+294. [45] TONG B, YU J, WANG T, et al. Sinomenine suppresses collagen-induced arthritis by reciprocal modulation of regulatory T cells and Th17 cells in gut-associated lymphoid tissues. Mol Immunol. 2015;65(1):94-103. [46] BANERJEE S, BIEHL A, GADINA M, et al. JAK–STAT Signaling as a Target for Inflammatory and Autoimmune Diseases: Current and Future Prospects. Drugs. 2017;77(5):521-546. [47] CHEN S, BAI Y, LI Z, et al. A betulinic acid derivative SH479 inhibits collagen-induced arthritis by modulating T cell differentiation and cytokine balance. Biochem Pharmacol. 2017;126:69-78. [48] YANG Y, HU X, CHENG L, et al. Periplocoside A ameliorated type II collagen-induced arthritis in mice via regulation of the balance of Th17/Treg cells. Int Immunopharmacol. 2017;44:43-52. [49] 吴峰淼, 叶凯丽, 刘曦. 黄芩苷对大鼠胶原诱导性关节炎JAK/STAT3信号通路及Th17/Treg免疫平衡的影响[J]. 中国药师,2020,23(2): 246-251. [50] DINESH P, RASOOL M. Berberine mitigates IL-21/IL-21R mediated autophagic influx in fibroblast-like synoviocytes and regulates Th17/Treg imbalance in rheumatoid arthritis. Apoptosis. 2019;24(7-8): 644-661. [51] SILVA S, COSTA EM, CALHAU C, et al. Anthocyanin extraction from plant tissues: A review. Crit Rev Food Sci Nutr. 2017;57(14):3072-3083. [52] SAMARPITA S, RASOOL M. Cyanidin restores Th17/Treg balance and inhibits T follicular helper cell differentiation via modulation of ROCK2 signaling in an experimental model of rheumatoid arthritis. Int Immunopharmacol. 2021;101(Pt B):108359. [53] ZHANG Y, GONG Y. Allicin regulates Treg/Th17 balance in mice with collagen-induced arthritis by increasing the expression of MEKK2 protein.Food Sci Nutr. 2021;9(5):2364-2371. [54] DAI MM, WU H, LI H, et al. Effects and mechanisms of Geniposide on rats with adjuvant arthritis. Int Immunopharmacol. 2014;20(1):46-53. [55] DI Y, ZHANG M, CHEN Y, et al. Catalpol Inhibits Tregs-to-Th17 Cell Transdifferentiation by Up-Regulating Let-7g-5p to Reduce STAT3 Protein Levels. Yonsei Med J. 2022;63(1):56-65. [56] ZHAO X, YI Y, JIANG C, et al. Gancao Fuzi decoction regulates the Th17/Treg cell imbalance in rheumatoid arthritis by targeting Foxp3 via miR-34a. J Ethnopharmacol. 2023;301:115837. [57] ZHAO C, LI X, YANG Y, et al. An analysis of Treg/Th17 cells imbalance associated microRNA networks regulated by moxibustion therapy on Zusanli (ST36) and Shenshu (BL23) in mice with collagen induced arthritis. Am J Transl Res. 2019;11(7):4029-4045. |
| [1] | Li Jiagen, Chen Yueping, Huang Keqi, Chen Shangtong, Huang Chuanhong. The construction and validation of a prediction model based on multiple machine learning algorithms and the immunomodulatory analysis of rheumatoid arthritis from the perspective of mitophagy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-15. |
| [2] | Zhang Yibo, Lu Jianqi, Mao Meiling, Pang Yan, Dong Li, Yang Shangbing, Xiao Xiang. Exploring the causal relationship between rheumatoid arthritis and coronary atherosclerosis: a Mendel randomized study involving serum metabolites and inflammatory factors [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [3] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [4] | Yu Shuai, Liu Jiawei, Zhu Bin, Pan Tan, Li Xinglong, Sun Guangfeng, Yu Haiyang, Ding Ya, Wang Hongliang. Hot issues and application prospects of small molecule drugs in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1913-1922. |
| [5] | Yu Jingbang, Wu Yayun. Regulatory effect of non-coding RNA in pulmonary fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1659-1666. |
| [6] | Wang Qiuyue, Jin Pan, Pu Rui . Exercise intervention and the role of pyroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1667-1675. |
| [7] | Yuan Weibo, Liu Chan, Yu Limei. Potential application of liver organoids in liver disease models and transplantation therapy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1684-1692. |
| [8] | Peng Hongcheng, Peng Guoxuan, Lei Anyi, Lin Yuan, Sun Hong, Ning Xu, Shang Xianwen, Deng Jin, Huang Mingzhi . Role and mechanism of platelet-derived growth factor BB in repair of growth plate injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1497-1503. |
| [9] | Wang Yuru, Li Siyuan, Xu Ye, Zhang Yumeng, Liu Yang, Hao Huiqin. Effects of wogonin on joint inflammation in collagen-induced arthritis rats via the endoplasmic reticulum stress pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1026-1035. |
| [10] | Han Haihui, Meng Xiaohu, Xu Bo, Ran Le, Shi Qi, Xiao Lianbo. Effect of fibroblast growth factor receptor 1 inhibitor on bone destruction in rats with collagen-induced arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 968-977. |
| [11] | Liu Haoyang, Xie Qiang, Shen Mengran, Ren Yansong, Ma Jinhui, Wang Bailiang, Yue Debo, Wang Weiguo . Application, research hotspots, and shortcomings of degradable zinc-based alloys in bone defect repair and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 839-845. |
| [12] | Guo Zhao, Zhuang Haoyan, Shi Xuewen. Role of exosomes derived from mesenchymal stem cells in treatment of colorectal cancer [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7872-7879. |
| [13] | Huang Haina, Yu Yanrong, Bi Jian, Huang Miao, Peng Weijie. Epigenetic characteristics of hepatogenic differentiation of mesenchymal stem cells in three-dimensional culture [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7848-7855. |
| [14] | Liu Lu, Zhong Chang, Yu Xin, Ren Chenyuan, Gong Yangyang, Zhou Ping, Wang Yingbin. Academic progress and clinical application of in vitro synthetic microenvironment to promote maturation of human pluripotent stem cell-derived cardiomyocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7856-7862. |
| [15] | Su Yongkun, Sun Hong, Liu Miao, Yang Hua, Li Qingsong. Development of novel antioxidants and antioxidant combination carried by nano-hydrogel systems in treatment of intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7376-7384. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||

