Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (30): 6499-6508.doi: 10.12307/2025.949
Previous Articles Next Articles
Regulatory mechanism of exercise promoting mitochondrial biogenesis in skeletal muscle
Zhang Zihan¹, Wang Jiaxin¹, Yang Wenyi², Zhu Lei¹
- ¹School of Sports Science, Qufu Normal University, Jining 273100, Shandong Province, China; ²Binzhou Sports Bureau, Binzhou 256600, Shandong Province, China
-
Received:2024-11-02Accepted:2024-12-17Online:2025-10-28Published:2025-03-28 -
Contact:Wang Jiaxin, MS, Associate professor, School of Sports Science, Qufu Normal University, Jining 273100, Shandong Province, China -
About author:Zhang Zihan, Master candidate, School of Sports Science, Qufu Normal University, Jining 273100, Shandong Province, China
CLC Number:
Cite this article
Zhang Zihan¹, Wang Jiaxin¹, Yang Wenyi², Zhu Lei¹. Regulatory mechanism of exercise promoting mitochondrial biogenesis in skeletal muscle[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6499-6508.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 骨骼肌线粒体生物合成概述 骨骼肌是人体重要的运动器官,线粒体则是其细胞中的“能量工厂”,负责生成维持细胞功能和运动所需的ATP。骨骼肌的线粒体生物合成是一个提升线粒体数量和功能的过程,主要通过调节线粒体DNA的复制、转录以及蛋白质合成,来适应能量需求的变化。在骨骼肌中,线粒体生物合成对于维持细胞代谢、增强运动表现以及应对代谢应激非常关键[6]。线粒体生物合成的调控涉及多种复杂的信号通路,骨骼肌线粒体生物合成的关键调控因子包括PGC-1α、AMPK、p38 MAPK和钙调素依赖的信号途径[3]。研究表明,PGC-1α作为线粒体生物合成的“主调控因子”,通过AMPK、p38 MAPK等途径受到激活,调控线粒体的数量和质量。AMPK在能量匮乏时激活,而p38 MAPK在机械应激时激活,这些信号通路协同作用调控线粒体功能[5]。运动是诱导骨骼肌线粒体生物合成的主要刺激因素之一[7]。运动时,细胞内的能量需求增加,代谢应激导致多条信号通路被激活,从而促进线粒体的生成与功能优化。通过运动诱导的线粒体生物合成,不仅能够提高肌肉的代谢能力,还能改善肌肉的抗疲劳性和整体运动表现[7]。 2.2 骨骼肌线粒体生物合成的相关信号通路 骨骼肌是人体运动的重要组织,而线粒体则是细胞内的“能量工厂”,负责生成供细胞活动所需的ATP。骨骼肌线粒体的生物合成对于维持肌肉功能、调节代谢以及适应运动训练至关重要。线粒体生物合成受到多个信号通路的调控,这些信号通路相互作用,协调肌肉中线粒体的生成和功能,主要包括AMPK、PGC-1α、MAPKs以及钙调信号通路。骨骼肌线粒体生物合成相关信号通路及其途径[8-22],见表2。"
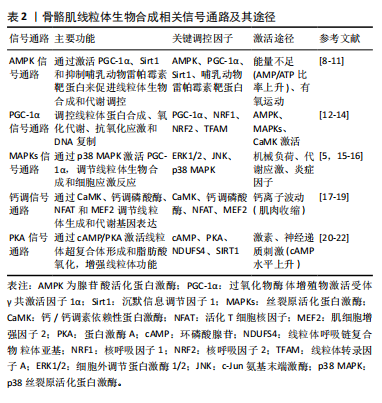
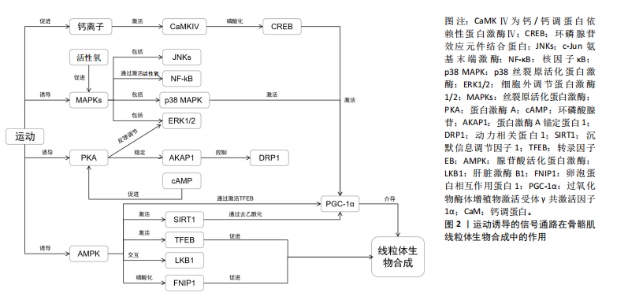
2.2.1 AMPK信号通路 AMPK是一种能量感应酶,当细胞内的AMP/ATP比率上升时,即能量供应不足时,AMPK被激活[23]。AMPK通过多种机制促进线粒体生物合成。AMPK能够通过多种机制直接激活PGC-1α,从而调控线粒体的基因表达[12]。AMPK通过直接磷酸化PGC-1α,促进其活化,该过程增强了PGC-1α的转录调控能力,从而上调与线粒体生物合成相关的基因表达[11]。此外,AMPK还能够通过激活Sirt1来去乙酰化PGC-1α,从而进一步增强其活性,这对线粒体功能的维持和生物合成起到了关键作用[10]。这些机制共同促进了线粒体的生物合成和质量控制,特别是在骨骼肌等代谢活跃的组织中[11],说明AMPK通过PGC-1α信号通路的调节,能够有效地增强线粒体基因的表达与功能。 AMPK还能够通过调节代谢相关基因来促进脂肪酸氧化和糖异生,从而提高细胞能量供给。具体来说,AMPK的激活可增加骨骼肌中脂肪酸氧化,其作用机制与过氧化物酶体增殖物激活受体α和PGC-1的表达增强有关[9]。通过这些调控,AMPK在长时间内促进能量代谢。此外,运动特别是有氧运动,能够显著激活AMPK信号通路,从而增加线粒体的数量和功能,进一步提高骨骼肌的代谢效率[9]。 AMPK不仅仅是一个能量传感器,还通过多种信号途径来调节细胞代谢,其中,AMPK能够通过抑制哺乳动物雷帕霉素靶蛋白信号通路来维持细胞的能量平衡。哺乳动物雷帕霉素靶蛋白信号通路主要在营养物质充足的条件下促进细胞生长和增殖,而在能量缺乏时,AMPK通过抑制哺乳动物雷帕霉素靶蛋白的活性,帮助细胞适应能量应激,恢复代谢平衡[8]。AMPK与哺乳动物雷帕霉素靶蛋白之间的这种相互作用不仅限于短期的磷酸化级联反应,还能够通过与转录因子和表观遗传机制的相互作用,产生长时间的细胞代谢调控效应[24]。 2.2.2 PGC-1α信号通路 PGC-1α是骨骼肌线粒体生物合成的关键调控因子,PGC-1α不仅是线粒体生成的核心调控因子,还通过与氧化代谢相关的多个信号通路调节基因表达[25]。AMPK、MAPKs、CaMK等信号通路都能激活PGC-1α,PGC-1α与核呼吸因子1,2相互作用,促进线粒体蛋白质合成,并通过线粒体转录因子A调控线粒体DNA的复制和表达[26]。此外,PGC-1α还通过调节氧化磷酸化相关基因,增强细胞的氧化代谢功能[13]。 此外,PGC-1α通过上调多种抗氧化酶的表达,增强细胞应对氧化应激的能力,其不仅调节线粒体生物合成,还能通过促进抗氧化酶如超氧化物歧化酶和谷胱甘肽过氧化物酶的表达,减少线粒体活性氧的产生,从而提升细胞的耐受性[12]。运动,特别是耐力训练,能够显著提高骨骼肌中PGC-1α的表达水平,随着PGC-1α表达的增加,线粒体的数量和功能亦随之增强。该过程是提高肌肉适应性的关键,因为线粒体不仅负责为细胞提供能量,还在调节代谢和抗氧化防御中发挥核心作用[14]。因此,PGC-1α 在线粒体功能、抗氧化防御和运动适应性之间发挥着至关重要的桥梁作用。 2.2.3 MAPKs信号通路 MAPKs信号通路在调节细胞生长、分化、应激反应和凋亡中起重要作用,同样,其在骨骼肌线粒体生物合成中亦发挥着关键作用。MAPKs家族中的核呼吸因子1,2、JNK和p38 MAPK是最常被研究的成员,其中p38 MAPK在线粒体生物合成中发挥了显著的作用,p38 MAPK通过激活PGC-1α来促进线粒体生成[27]。此外,p38 MAPK不仅调控PGC-1α的表达,还通过增加其磷酸化来维持线粒体功能和蛋白质表达,这对代谢活性组织如骨骼肌尤为重要[5]。MAPKs信号通路在多种外界刺激下发挥重要作用,包括机械负荷、代谢应激和炎症因子等,这些因素均能通过激活不同的MAPK信号通路来调控细胞内一系列生理过程,具体来说,机械负荷可通过ERK、JNK和p38等MAPKs途径影响肌肉细胞的功能和生长,从而促进或抑制线粒体的生成和功能[15]。代谢应激和炎症因子亦会通过MAPK通路对线粒体产生显著影响,如通过调控线粒体凋亡途径和氧化应激反应来保持细胞稳态[16]。 2.2.4 钙调信号通路 钙调信号通路通过调节胞内钙离子浓度对骨骼肌线粒体的生物合成产生影响。钙离子作为一种重要的第二信使,在细胞信号转导中发挥关键作用。特别是在骨骼肌中,钙信号通过CaMK和钙调素依赖的磷酸酶(如钙调神经磷酸酶)来调控线粒体的生物合成[19]。CaMK通过激活PGC-1α增强线粒体生成,进而促进与代谢相关的基因表达。此外,钙信号还通过调节多条转录通路,如活化T细胞核因子与肌细胞增强因子2,影响线粒体的基因表达[17]。 此外,钙信号在骨骼肌的收缩活动和代谢反应中起着关键作用,进而间接影响线粒体的功能和适应性。当肌肉收缩时,钙离子(Ca2?)的浓度在肌肉细胞内发生波动,这种波动通过激活钙调信号通路,调控多个与代谢和线粒体功能相关的基因表达[28]。具体来说,钙离子的升高激活了诸如CaMK和钙调蛋白依赖性磷酸酶的信号通路,这些途径可促进线粒体的生成与生物能量学提升[18]。在运动过程中,钙离子不仅直接参与肌肉的兴奋-收缩偶联,还通过调节线粒体的钙摄取,激活了参与三羧酸循环和氧化磷酸化的多种酶,增强ATP的生成以满足能量需求[29]。此外,钙信号亦能够通过调节钙调磷酸酶、CaMK及相关转录因子,如MEF2和NFAT,促进线粒体的生物合成及其功能优化[4]。 2.2.5 蛋白激酶A信号通路 蛋白激酶A信号通路在骨骼肌线粒体生物合成中发挥着关键作用,该通路依赖于环磷酸腺苷水平的变化,并通过磷酸化下游靶蛋白调控线粒体生成等生物过程,当细胞受到激素或神经递质的刺激时,环磷酸腺苷水平升高,激活蛋白激酶A[30]。蛋白激酶A的激活能够磷酸化多种线粒体相关的蛋白质,从而调节线粒体功能和结构。例如,蛋白激酶A可通过磷酸化线粒体呼吸链复合物Ⅰ的NDUFS4亚基,促进线粒体超复合体的形成,从而提升ATP的生成率并减少活性氧的产生[21]。此外,蛋白激酶A还能够在特定的线粒体微区,如线粒体基质和外膜,执行不同的信号调控任务,进一步细化对线粒体功能的调控[20]。此外,蛋白激酶A通过调节糖异生和脂肪酸氧化等代谢途径,间接影响线粒体的功能[31]。蛋白激酶A信号通路的激活与运动训练密切相关,能够增强骨骼肌的线粒体数量和代谢效率,蛋白激酶A可通过调控SIRT1/PGC-1α通路,促进骨骼肌的脂肪酸氧化并改善代谢适应性,这些过程对于骨骼肌应对能量需求的变化至关重要,在提高肌肉耐力和代谢能力方面发挥重要作用[22]。 2.3 运动诱导的信号通路在骨骼肌线粒体生物合成中的作用 运动诱导不同信号通路在骨骼肌线粒体生物合成具有重要作用,其中运动诱导的AMPK在骨骼肌线粒体生物合成中发挥重要作用,AMPK通过感知局部能量状态调控线粒体的自噬与更新。AMPK不仅在运动的能量代谢中发挥关键作用,还通过磷酸化特定蛋白如FNIP1,激活相关的线粒体生物生成信号通路。研究表明,AMPK与钙信号、LKB1等通路相互作用,进一步促进线粒体功能的提升。虽然AMPK在运动诱导线粒体生物合成中的作用机制已初步表明,但其与其他信号通路的具体协调机制尚需深入研究。图2展示了运动诱导的信号通路在骨骼肌线粒体生物合成中的作用。 2.3.1 运动诱导AMPK在骨骼肌线粒体生物合成中的作用 运动诱导AMPK在骨骼肌线粒体生物合成中的作用研究取得了重要进展,特别是AMPK亚型在亚细胞水平上的特异性反应。DRAKE等[32]报道,这种线粒体靶向的AMPK能够在运动过程中通过感知局部能量状况,减缓骨骼肌线粒体自噬的发生,该发现强调了AMPK作为能量代谢调节器的关键作用,特别是在高能量需求的运动状态下。此外,赵永才[33]发现,AMPKα2敲除抑制低氧训练诱发的骨骼肌线粒体更新信号,同时微循环功能适应被抑制,这说明AMPK能够参与低氧训练增强骨骼肌线粒体更新及微循环功能的适应过程。 此外,AMPK调控线粒体生物发生具有全新机制。MALIK等[34]指出,线粒体破坏后,AMPK通过磷酸化FNIP1,进而激活转录因子EB,增加PGC-1α的表达,从而促进线粒体生物发生[19]。该机制的发现拓展了对AMPK在细胞能量应激和线粒体功能维持中的认知,显示AMPK不仅在能量感应中发挥重要作用,还通过调控线粒体和溶酶体功能促进细胞适应能量需求。然而,FNIP1磷酸化在不同类型运动中的具体调控机制仍不清楚,需要进一步探讨。此外,钙调节信号通路与AMPK在调控骨骼肌线粒体生物合成中的相互作用亦得到了较多的关注。钙作为细胞内重要的信号分子,参与了许多与线粒体功能相关的过程。研究表明,钙信号通过钙调磷酸酶A和CaMKⅣ激活PGC-1α,从而促进线粒体生物发生[35]。CaMKⅣ通过磷"
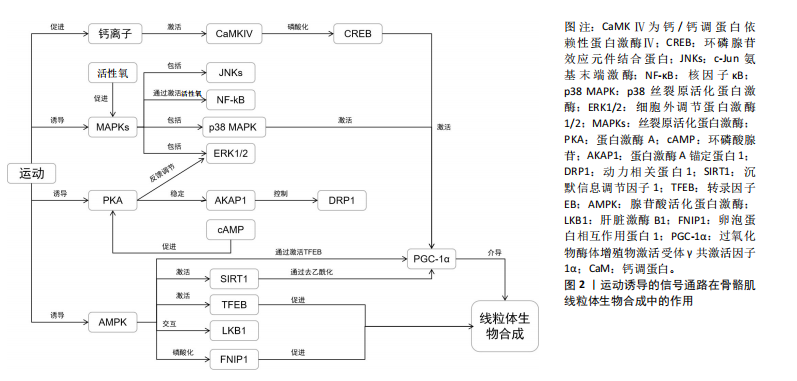

酸化环磷酸腺苷反应元件结合蛋白进一步激活PGC-1α,形成了钙信号与线粒体生物合成之间的桥梁[36]。 EGAN等[37]研究发现,运动强度的增加显著激活了CaMKII信号通路,这表明钙信号与AMPK调控骨骼肌代谢的动态关系,且钙信号与AMPK的交互作用,可能为更复杂的骨骼肌线粒体生物合成调控机制提供了新的线索。然而,钙信号与AMPK之间的确切协调机制,特别是在不同运动状态下的精确作用模式,仍然需要进一步的研究。此外,LKB1作为AMPK的上游激酶在运动诱导的骨骼肌代谢调控中亦发挥着重要作用。Koh等[38]的研究表明,LKB1在骨骼肌收缩引起的葡萄糖运输中起着关键作用,这表明LKB1不仅是AMPK激活的重要因素,还通过AMPK进一步调节骨骼肌的能量代谢。然而,LKB1的核-质转位在维持基础线粒体酶活性方面的具体作用机制尚不完全清楚,未来的研究需要更深入地探讨其在运动诱导AMPK激活中的功能。 总之,这些研究揭示了AMPK在骨骼肌线粒体生物合成中的核心作用,特别是在运动诱导的条件下。然而,AMPK如何与其他信号通路(如钙信号、LKB1等)的协同作用依然存在很多未解之谜。因此,后续的研究应重点关注AMPK与其他信号通路的相互调控机制,以期更全面地理解骨骼肌适应运动的生物学过程。 2.3.2 运动诱导MAPKs在骨骼肌线粒体生物合成中的作用 运动诱导的MAPKs在骨骼肌线粒体生物合成中的作用近年来得到了广泛关注。MAPKs作为应激激酶,在机械应激(例如运动过程中肌肉收缩)时被激活,并调控多个生物过程,包括代谢调节和下游基因表达[39]。迄今为止,MAPKs主要包括3类运动响应激酶:核呼吸因子1,2、c-Jun氨基末端激酶和p38亚型[40]。研究表明,运动后MAPK信号通路特别是核呼吸因子1,2和p38 MAPK,能够迅速增加至7倍[41],这表明MAPK信号级联与运动后骨骼肌基因表达的下游调节有关。 MAPK信号通路在运动引发的骨骼肌适应中发挥关键作用,特别在维持全身葡萄糖稳态和调节活性氧生成方面[42]。运动诱导的活性氧会激活包括JNK、p38 MAPK和核因子κB在内的多种信号通路[43]。具体来说,p38 MAPK和JNK信号通路在运动诱导的线粒体生物合成中起着重要作用[44]。运动还导致活性氧生成暂时增加,从而激活骨骼肌中的MAP激酶[45]。这说明活性氧在运动中不仅引发了应激反应,还通过MAPK途径调控线粒体的生成。 然而,关于不同类型运动对这些信号通路激活的影响仍有不确定性。研究表明,冲刺间歇训练在运动后立即引起了更强的核因子κB磷酸化,而JNK和p38 MAPK的磷酸化水平在不同强度的运动中差异不大[46],但这些差异对长期骨骼肌适应的影响尚未完全明确。因此,后续研究需要重点关注不同运动类型对MAPK信号途径的长短期影响及其在骨骼肌线粒体生物合成中的具体作用机制。此外,研究还表明,AMPK激活与p53的磷酸化之间存在关联,在细胞应激条件下,p38 MAPK可能成为p53的靶点[47]。BARTLETT等[48]的研究展示了人类运动引起的p53磷酸化,表明急性高强度间歇训练和中等强度连续训练均能显著增加骨骼肌中的AMPK和p38 MAPK磷酸化。这进一步支持了AMPK、p38 MAPK和p53在调控骨骼肌线粒体生物合成中的协同作用。 总之,运动诱导的MAPKs信号通路在骨骼肌线粒体生物合成中的作用得到了较为充分的研究,特别是在不同类型运动对AMPK和p38 MAPK的激活方面。然而,关于不同运动模式如何通过这些通路调控骨骼肌线粒体生成的具体机制仍有待进一步探索。未来的研究应更加关注不同运动强度和类型对MAPK信号的长短期影响,特别是在改善骨骼肌代谢和功能适应中的潜在应用价值。 2.3.3 运动诱导PGC-1α在骨骼肌线粒体生物合成中的作用 运动诱导的PGC-1α在骨骼肌线粒体生物合成中的作用是一个备受关注的研究领域。已有研究表明,运动能够通过激活细胞内信号通路,促进调控蛋白(如PGC-1α)的转运至细胞核,从而协调整体核基因与线粒体基因的表达调控[49]。PGC-1α在骨骼肌线粒体含量及其功能调控中起到了关键作用,是骨骼肌代谢调控中的重要因子[50]。然而,目前对其在不同类型运动和不同组织环境中的具体调节机制尚不完全明确。因此,未来的研究应进一步探讨不同运动模式下PGC-1α的动态调控过程及其对骨骼肌线粒体功能的影响。 运动能够显著增加核内PGC-1α的含量,从而激活线粒体生物合成[51]。该调控过程依赖于复杂的细胞信号级联反应,PGC-1α通过后翻译修饰被激活,例如被激酶直接磷酸化,从而启动其调节功能[52]。然而,虽然PGC-1α在骨骼肌运动适应和线粒体生物合成的调控中发挥着重要作用,但这些调控过程可能受到其他调节因子的影响[53]。研究发现,PGC-1α与核呼吸因子2共同形成一个由AMPK驱动的调控回路,该回路在骨骼肌适应过程中起到了关键作用[54-55]。AMPK作为能量感应器,能够通过增加NAD+水平激发一系列信号级联反应,其中包括SIRT1的磷酸化[56]。SIRT1的活化能够去乙酰化PGC-1α,促进线粒体生物合成的同时亦进一步激活p38 MAPK途径,而急性运动后p38 MAPK的水平可增加2倍[44]。然而,尚不清楚这种信号级联反应的时空动态变化如何影响不同类型运动对骨骼肌线粒体生物合成的调节。因此,后续研究需要重点关注AMPK-SIRT1-p38 MAPK信号轴在不同运动强度和时程中的作用。 此外,PGC-1α在磷酸化后亦会受到糖原合酶激酶3β的调控,该过程能够抑制PGC-1α的功能,并促进其在细胞核内的蛋白酶体降解[57]。这表明PGC-1α不仅受到激活信号的调控,还受到抑制性信号的精细调控,这种双重调控确保了骨骼肌对不同生理状态的适应。然而,目前尚不清楚不同类型运动在糖原合酶激酶3β介导的PGC-1α抑制中的具体机制。因此,未来的研究应聚焦于如何在运动中平衡PGC-1α的激活与抑制,以优化线粒体生物合成。此外,PGC-1α与转录因子EB之间的相互作用亦在运动诱导的线粒体生物合成中发挥了重要作用,在磷酸酶钙调神经蛋白的介导下,PGC-1α和转录因子EB共同进入细胞核,激活线粒体生物合成相关基因的表达,从而增强骨骼肌线粒体底物利用能力[58]。这进一步说明运动不仅通过PGC-1α调控线粒体合成,还通过其他分子信号通路的整合作用,全面提升骨骼肌的代谢功能。 综上所述,运动通过激活PGC-1α调控骨骼肌线粒体生物合成,其核心机制涉及一系列复杂的信号调控网络,如AMPK-SIRT1-p38 MAPK轴及糖原合酶激酶3β和转录因子EB的参与。然而,这些机制在不同类型运动和不同个体中的表现仍有待进一步验证和细化研究。因此,后续研究不仅需要深入揭示这些信号通路的交互机制,还需探索如何通过运动干预优化PGC-1α的活化,从而更有效地促进骨骼肌线粒体的适应性生物合成。 2.3.4 运动诱导蛋白激酶A在骨骼肌线粒体生物合成中的作用 在骨骼肌中,蛋白激酶A是线粒体动态变化及运动诱导适应性反应的关键调节因子。蛋白激酶A主要通过磷酸化多种细胞内靶点来实现其功能,表明蛋白激酶A在骨骼肌线粒体生物合成中发挥了广泛的调控作用[5]。运动过程中,通过β-肾上腺素能受体的刺激,糖原分解被启动,进而导致细胞内环磷酸腺苷的积累,该过程直接激活蛋白激酶A及其下游信号通路[59]。多个研究观察到了该信号通路在运动后代谢反应中的重要性,揭示了蛋白激酶A在调节骨骼肌代谢适应过程中的关键作用。 有文献表明,运动开始后,环磷酸腺苷水平迅速升高至正常值的2倍左右,而该反应的强度受到肌肉纤维类型、运动持续时间及强度的调控[60],说明环磷酸腺苷-PKA信号通路在运动诱导线粒体功能变化中的潜在作用。然而,关于该通路的具体机制仍未完全明晰,不同类型肌纤维中的调控差异尚需进一步研究。此外,蛋白激酶A在细胞中的亚细胞定位亦对其信号传递至关重要。已有证据表明,蛋白激酶A定位于线粒体基质和内膜,并在此发挥作用,影响线粒体的信号传导和生物合成[61],该定位特征揭示了蛋白激酶A在线粒体功能调节中的独特作用,说明蛋白激酶A的亚细胞定位不仅影响其功能,还可能决定其对线粒体的特异性调控。还有研究发现,A-激酶锚定蛋白1通过将蛋白激酶A和其他信号蛋白招募至线粒体外膜,在整合多个第二信使通路的过程中,调节了线粒体分裂调节蛋白1的磷酸化[62],该机制表明,A-激酶锚定蛋白1通过精准定位蛋白激酶A在线粒体上的活性,对线粒体形态和功能的维持起到了关键作用。然而,A-激酶锚定蛋白1如何精细调控蛋白激酶A在不同生理状态下的作用,仍有待进一步探讨。此外,运动后抑制蛋白激酶A的活性会显著提高MAPK通路中细胞外信号调节激酶1,2的信号传递[63],说明蛋白激酶A在调控不同信号通路之间的交互中可能具有复杂的反馈机制。因此,未来的研究需要重点关注蛋白激酶A与其他信号通路的交互作用及其在运动适应中的具体机制,以进一步表明其在骨骼肌线粒体生物合成中的功能。 综上所述,蛋白激酶A在运动诱导的骨骼肌线粒体生物合成过程中发挥着至关重要的调节作用。通过对多种下游靶点的磷酸化,蛋白激酶A不仅在调控线粒体功能和代谢适应中发挥作用,还与其他信号通路交互,形成复杂的调控网络,其亚细胞定位及与锚定蛋白A-激酶锚定蛋白1的相互作用揭示了蛋白激酶A在线粒体动力学调节中的精细控制机制。然而,蛋白激酶A在不同肌纤维类型和运动条件下的具体调控模式以及与其他信号通路的交互机制,仍有待进一步深入研究。未来的研究应集中于揭示这些机制,以全面理解蛋白激酶A在骨骼肌线粒体生物合成中的功能。 2.3.5 运动诱导FNIP1在骨骼肌线粒体生物合成中的作用 近年来,运动诱导的FNIP1在骨骼肌线粒体生物合成中的作用逐渐引起关注。FNIP1作为线粒体功能调控的关键节点,主要通过与AMPK及相关信号通路的交互作用,参与调节线粒体生物合成及功能适应[34]。FNIP1能够通过响应能量状态的变化影响线粒体自噬与更新,从而在骨骼肌适应运动诱导的应激环境中发挥重要作用[11]。 已有文献表明,磷酸化是FNIP1调节功能的关键机制之一。研究指出,运动引起的AMPK活化能够直接磷酸化FNIP1,从而激活转录因子EB,进而通过增强PGC-1α表达促进线粒体生物合成[11]。该机制表明,FNIP1不仅是AMPK下游的重要靶点,亦是连接AMPK与线粒体生物合成核心调控网络的重要枢纽。然而,目前关于FNIP1在不同运动模式下的特异性调控仍然不完全清楚。例如,FNIP1的磷酸化是否具有运动类型或强度的依赖性,以及其对其他线粒体相关信号通路的交互作用仍需进一步探讨。此外,FNIP1还被发现与溶酶体功能密切相关。研究表明,FNIP1通过促进溶酶体-线粒体相互作用,加速线粒体质量控制的动态更新[64]。该作用可能是FNIP1在运动状态下优化线粒体功能的重要途径之一[64]。然而,FNIP1如何在不同能量状态和运动强度下实现溶酶体和线粒体的协同调控,尚需进一步研究。此外,FNIP1与钙信号通路的潜在交互为其调控骨骼肌线粒体生物合成提供了新的视角。钙作为重要的细胞内信号分子,不仅能够激活CaMKⅣ从而促进PGC-1α表达,还可能通过调节FNIP1的活性参与线粒体功能调控[11]。相关研究显示,钙信号可能通过间接作用于FNIP1影响其与AMPK或其他通路的交互[11],但该假设仍有待实验验证。 总之,运动诱导的FNIP1在骨骼肌线粒体生物合成中的作用为进一步理解骨骼肌适应运动的分子机制提供了新的视角。FNIP1在AMPK信号轴及线粒体自噬调控中的核心作用已经得到初步表明,但FNIP1与其他信号通路的交互机制、磷酸化调控的动态特性以及在不同运动状态下的具体作用模式仍需深入研究。未来的工作应进一步聚焦于FNIP1在骨骼肌能量代谢与线粒体功能适应中的多层面调控作用,以揭示其在运动干预中的潜在应用价值。 2.3.6 运动诱导PERM1(PGC-1 and estrogen-related receptor (ERR)-induced regulator,muscle 1)在骨骼肌线粒体生物合成中的作用 运动诱导的PERM1作为近年来新发现的重要调控因子,在骨骼肌线粒体生物合成中的作用逐步被揭示。PERM1特异性表达于骨骼肌和心肌,因在调控线粒体功能和能量代谢中的关键作用使其成为运动诱导线粒体适应的潜在研究热点[65]。 研究表明,PERM1能够通过调控PGC-1α的功能,参与线粒体生物合成的调控[5]。运动引起的PERM1表达上调,能够显著增强线粒体相关基因的转录水平,进而促进线粒体生物合成[5]。与AMPK类似,PERM1亦通过感知运动诱导的代谢信号而激活PGC-1α,该过程在骨骼肌代谢适应中具有重要意义[5,65]。然而,PERM1在调控PGC-1α功能过程中是否依赖于特定的信号通路(如AMPK或p38 MAPK)尚不完全清楚,未来研究应进一步表明其分子机制。此外,PERM1在运动诱导的线粒体适应过程中可能通过与钙信号和其他代谢信号通路的交互作用发挥作用。已有研究显示,PERM1能够通过调节线粒体相关基因的表达,增强线粒体的氧化磷酸化功能[5,66]。然而,PERM1是否通过与钙信号调控相关的分子(如CaMKⅣ或CREB)相互作用影响PGC-1α的活性,仍需进一步探索。此外,PERM1不仅调控线粒体的数量,还可能通过调节线粒体的形态和功能适应运动引起的代谢需求。相关研究发现,PERM1能够影响线粒体网络的动态变化,包括分裂与融合的平衡[5,67],该作用可能通过调节线粒体动力学蛋白(如Mfn1和Drp1)的活性实现,但具体机制仍需深入研究。此外,PERM1的亚细胞定位及其对线粒体功能调控的时空特性亦值得进一步关注。 总之,运动诱导的PERM1在骨骼肌线粒体生物合成中的作用为理解运动适应的分子机制提供了新的研究方向。PERM1通过调控PGC-1α和线粒体动态过程,在骨骼肌代谢调控中发挥了多层次作用;然而,PERM1在与其他信号通路的交互机制及在不同运动模式下的具体功能仍需进一步研究。未来的研究应重点探讨PERM1在调控骨骼肌线粒体功能适应中的分子网络,以期揭示其在运动生理学中的潜在应用价值。"

| [1] JUN L, KNIGHT E, BRODERICK TL, et al. Moderate-Intensity Exercise Enhances Mitochondrial Biogenesis Markers in the Skeletal Muscle of a Mouse Model Affected by Diet-Induced Obesity. Nutrients. 2024; 16(12):1836. [2] PERIASAMY M, HERRERA JL, REIS FCG. Skeletal Muscle Thermogenesis and Its Role in Whole Body Energy Metabolism. Diabetes Metab J. 2017;41(5):327-336. [3] VARGAS-ORTIZ K, PÉREZ-VÁZQUEZ V, MACíAS-CERVANTES MH. Exercise and Sirtuins: A Way to Mitochondrial Health in Skeletal Muscle. Int J Mol Sci. 2019;20(11):2717. [4] GROENNEBAEK T, VISSING K. Impact of Resistance Training on Skeletal Muscle Mitochondrial Biogenesis, Content, and Function. Front Physiol. 2017;8:713. [5] SOARES MENEZES E, WU Z, RENWICK JRM, et al. PERM1-An Emerging Transcriptional Regulator of Mitochondrial Biogenesis: A Systematic Review. Genes (Basel). 2024;15(10):1305. [6] PELLEGRINO A, TIIDUS PM, VANDENBOOM R. Mechanisms of Estrogen Influence on Skeletal Muscle: Mass, Regeneration, and Mitochondrial Function. Sports Med. 2022;52(12):2853-2869. [7] CRAIG DM, ASHCROFT SP, BELEW MY, et al. Utilizing small nutrient compounds as enhancers of exercise-induced mitochondrial biogenesis. Front Physiol. 2015;6:296. [8] AUDET-WALSH É, VERNIER M, VIOLLET B. Editorial: AMPK and mTOR Beyond Signaling: Emerging Roles in Transcriptional Regulation. Front Cell Dev Biol. 2020;8:641552. [9] LEE WJ, KIM M, PARK HS, et al. AMPK activation increases fatty acid oxidation in skeletal muscle by activating PPARalpha and PGC-1. Biochem Biophys Res Commun. 2006;340(1):291-295. [10] LONG YC, ZIERATH JR. AMP-activated protein kinase signaling in metabolic regulation. J Clin Invest. 2006;116(7):1776-1783. [11] XIAO L, LIU J, SUN Z, et al. AMPK-dependent and -independent coordination of mitochondrial function and muscle fiber type by FNIP1. PLoS Genet. 2021;17(3):e1009488. [12] ABU SHELBAYEH O, ARROUM T, MORRIS S, et al. PGC-1α Is a Master Regulator of Mitochondrial Lifecycle and ROS Stress Response. Antioxidants (Basel). 2023;12(5):1075. [13] CHEN L, QIN Y, LIU B, et al. PGC-1α-Mediated Mitochondrial Quality Control: Molecular Mechanisms and Implications for Heart Failure. Front Cell Dev Biol. 2022;10:871357. [14] HALLING JF, PILEGAARD H. PGC-1α-mediated regulation of mitochondrial function and physiological implications. Appl Physiol Nutr Metab. 2020;45(9):927-936. [15] MOENS U, KOSTENKO S, SVEINBJØRNSSON B. The Role of Mitogen-Activated Protein Kinase-Activated Protein Kinases (MAPKAPKs) in Inflammation. Genes (Basel). 2013;4(2):101-133. [16] SHI J, JIANG Q, DING X, et al. The ER stress-mediated mitochondrial apoptotic pathway and MAPKs modulate tachypacing-induced apoptosis in HL-1 atrial myocytes. PLoS One. 2015;10(2):e0117567. [17] CHIN ER. The role of calcium and calcium/calmodulin-dependent kinases in skeletal muscle plasticity and mitochondrial biogenesis. Proc Nutr Soc. 2004;63(2):279-286. [18] GEHLERT S, BLOCH W, SUHR F. Ca2+-dependent regulations and signaling in skeletal muscle: from electro-mechanical coupling to adaptation. Int J Mol Sci. 2015;16(1):1066-1095. [19] 钱帅伟,孙易,漆正堂,等.运动对线粒体稳态调控机制的研究述评:基于运动介导TFEB调节线粒体质量控制的关键机制探讨[J].体育科学,2020,40(2):70-82. [20] LEFKIMMIATIS K, LERONNI D, HOFER AM. The inner and outer compartments of mitochondria are sites of distinct cAMP/PKA signaling dynamics. J Cell Biol. 2013;202(3):453-462. [21] SIGNORILE A, PACELLI C, PALESE LL, et al. cAMP/PKA Signaling Modulates Mitochondrial Supercomplex Organization. Int J Mol Sci. 2022;23(17):9655. [22] YANG H, YANG L. Targeting cAMP/PKA pathway for glycemic control and type 2 diabetes therapy. J Mol Endocrinol. 2016;57(2):R93-R108. [23] 靳丹,代新宇,刘淼,等.肌肉骨骼减少症发病机制及其运动防治效果[J]. 生物化学与生物物理进展,2024,51(5):1105-1118. [24] CORK GK, THOMPSON J, SLAWSON C. Real Talk: The Inter-play Between the mTOR, AMPK, and Hexosamine Biosynthetic Pathways in Cell Signaling. Front Endocrinol (Lausanne). 2018;9:522. [25] 李兆进, 郑鹏程, 孔健达, 等. 基于不同组织和器官角度回顾PGC-1α在运动抗衰老中的作用[J]. 中国组织工程研究,2024,28(29): 4717-4725. [26] TRINH D, AL HALABI L, BRAR H, et al. The role of SIRT3 in homeostasis and cellular health. Front Cell Neurosci. 2024;18:1434459. [27] BORODKINA A, SHATROVA A, ABUSHIK P, et al. Interaction between ROS dependent DNA damage, mitochondria and p38 MAPK underlies senescence of human adult stem cells. Aging (Albany NY). 2014;6(6):481-495. [28] YANG Z, KIRTON HM, AL-OWAIS M, et al. Epac2-Rap1 Signaling Regulates Reactive Oxygen Species Production and Susceptibility to Cardiac Arrhythmias. Antioxid Redox Signal. 2017;27(3):117-132. [29] MOSQUEIRA M, BRINKMEIER H, JAIMOVICH E. Editorial: Calcium Homeostasis in Skeletal Muscle Function, Plasticity, and Disease. Front Physiol. 2021;12:671292. [30] MESQUITA PHC, VANN CG, PHILLIPS SM, et al. Skeletal Muscle Ribosome and Mitochondrial Biogenesis in Response to Different Exercise Training Modalities. Front Physiol. 2021;12:725866. [31] RAMATCHANDIRIN B, PEARAH A, HE L. Regulation of Liver Glucose and Lipid Metabolism by Transcriptional Factors and Coactivators. Life (Basel). 2023;13(2):515. [32] DRAKE JC, WILSON RJ, LAKER RC, et al. Mitochondria-localized AMPK responds to local energetics and contributes to exercise and energetic stress-induced mitophagy. Proc Natl Acad Sci U S A. 2021;118(37): e2025932118. [33] 赵永才. AMPK在低氧训练干预骨骼肌线粒体更新及微循环变化中的作用[D]. 上海:上海体育学院, 2020. [34] MALIK N, FERREIRA BI, HOLLSTEIN PE, et al. Induction of lysosomal and mitochondrial biogenesis by AMPK phosphorylation of FNIP1. Science. 2023;380(6642):eabj5559. [35] MCGEE SL, HARGREAVES M. AMPK-mediated regulation of transcription in skeletal muscle. Clin Sci (Lond). 2010;118(8):507-518. [36] THIEL G, AL SARRAJ J, STEFANO L. cAMP response element binding protein (CREB) activates transcription via two distinct genetic elements of the human glucose-6-phosphatase gene. BMC Mol Biol. 2005;6:2. [37] EGAN B, CARSON BP, GARCIA-ROVES PM, et al. Exercise intensity-dependent regulation of peroxisome proliferator-activated receptor coactivator-1 mRNA abundance is associated with differential activation of upstream signalling kinases in human skeletal muscle. J Physiol. 2010;588(Pt 10):1779-1790. [38] KOH HJ, BRANDAUER J, GOODYEAR LJ. LKB1 and AMPK and the regulation of skeletal muscle metabolism. Curr Opin Clin Nutr Metab Care. 2008;11(3):227-232. [39] COMBES A, DEKERLE J, WEBBORN N, et al. Exercise-induced metabolic fluctuations influence AMPK, p38-MAPK and CaMKII phosphorylation in human skeletal muscle. Physiol Rep. 2015;3(9):e12462.
[40] ROUX PP, BLENIS J. ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions. Microbiol Mol Biol Rev. 2004;68(2):320-344. [41] YU M, STEPTO NK, CHIBALIN AV, et al. Metabolic and mitogenic signal transduction in human skeletal muscle after intense cycling exercise. J Physiol. 2003;546(Pt 2):327-335. [42] 任翔宇, 沈飞, 金玲, 等. 运动促进骨骼肌健康的新视角:基于Rac1/PAK1/p38 MAPK信号通路改善肌生成和糖代谢的研究进展与展望[J].中国体育科技,2023,59(5):79-87. [43] TIGANIS T. Reactive oxygen species and insulin resistance: the good, the bad and the ugly. Trends Pharmacol Sci. 2011;32(2):82-89. [44] AKIMOTO T, POHNERT SC, LI P, et al. Exercise stimulates Pgc-1alpha transcription in skeletal muscle through activation of the p38 MAPK pathway. J Biol Chem. 2005;280(20):19587-19593. [45] KRAMER HF, GOODYEAR LJ. Exercise, MAPK, and NF-kappaB signaling in skeletal muscle. J Appl Physiol (1985). 2007;103(1):388-395. [46] PARKER L, TREWIN A, LEVINGER I, et al. The effect of exercise-intensity on skeletal muscle stress kinase and insulin protein signaling. PLoS One. 2017;12(2):e0171613. [47] SALEEM A, CARTER HN, IQBAL S, et al. Role of p53 within the regulatory network controlling muscle mitochondrial biogenesis. Exerc Sport Sci Rev. 2011;39(4):199-205. [48] BARTLETT JD, HWA JOO C, JEONG TS, et al. Matched work high-intensity interval and continuous running induce similar increases in PGC-1α mRNA, AMPK, p38, and p53 phosphorylation in human skeletal muscle. J Appl Physiol (1985). 2012;112(7):1135-1143. [49] SCARPULLA RC. Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network. Biochim Biophys Acta. 2011;1813(7):1269-1278. [50] KIM SH, KOH JH, HIGASHIDA K, et al. PGC-1α mediates a rapid, exercise-induced downregulation of glycogenolysis in rat skeletal muscle. J Physiol. 2015;593(3):635-643. [51] 郭辉, 孔健达, 田春兰. 线粒体自噬相关受体蛋白和信号通路在运动防治肌少症中的作用[J]. 中国组织工程研究,2024,28(27):4397-4404. [52] LITTLE JP, SAFDAR A, BISHOP D, et al. An acute bout of high-intensity interval training increases the nuclear abundance of PGC-1α and activates mitochondrial biogenesis in human skeletal muscle. Am J Physiol Regul Integr Comp Physiol. 2011;300(6):R1303-1310. [53] LIN J, WU H, TARR PT, et al. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres. Nature. 2002; 418(6899):797-801. [54] GUREEV AP, SHAFOROSTOVA EA, POPOV VN. Regulation of Mitochondrial Biogenesis as a Way for Active Longevity: Interaction Between the Nrf2 and PGC-1α Signaling Pathways. Front Genet. 2019; 10:435. [55] HANDSCHIN C. Regulation of skeletal muscle cell plasticity by the peroxisome proliferator-activated receptor γ coactivator 1α. J Recept Signal Transduct Res. 2010;30(6):376-384. [56] CANTó C, GERHART-HINES Z, FEIGE JN, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity. Nature. 2009;458(7241):1056-1060. [57] ANDERSON RM, BARGER JL, EDWARDS MG, et al. Dynamic regulation of PGC-1alpha localization and turnover implicates mitochondrial adaptation in calorie restriction and the stress response. Aging Cell. 2008;7(1):101-111. [58] LI A, GAO M, LIU B, et al. Mitochondrial autophagy: molecular mechanisms and implications for cardiovascular disease. Cell Death Dis. 2022;13(5):444. [59] JENSEN J, RUSTAD PI, KOLNES AJ, et al. The role of skeletal muscle glycogen breakdown for regulation of insulin sensitivity by exercise. Front Physiol. 2011;2:112. [60] LAURENS C, BERGOUIGNAN A, MORO C. Exercise-Released Myokines in the Control of Energy Metabolism. Front Physiol. 2020;11:91. [61] OULD AMER Y, HEBERT-CHATELAIN E. Mitochondrial cAMP-PKA signaling: What do we really know? Biochim Biophys Acta Bioenerg. 2018;1859(9):868-877. [62] MERRILL RA, STRACK S. Mitochondria: a kinase anchoring protein 1, a signaling platform for mitochondrial form and function. Int J Biochem Cell Biol. 2014;48:92-96. [63] MELLING CW, KRAUSE MP, NOBLE EG. PKA-mediated ERK1/2 inactivation and hsp70 gene expression following exercise. J Mol Cell Cardiol. 2006;41(5):816-822. [64] FREEMANTLE JB, HARDIE DG. AMPK promotes lysosomal and mitochondrial biogenesis via folliculin: FNIP1. Life Metab. 2023;2(5): load027. [65] OKA S, SREEDEVI K, SHANKAR TS, et al. PERM1 regulates energy metabolism in the heart via ERRα/PGC−1α axis. Front Cardiovasc Med. 2022;9:1033457. [66] CHO Y, HAZEN BC, GANDRA PG, et al. Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB J. 2016;30(2):674. [67] PREMINGER N, SCHULDINER M. Beyond fission and fusion-Diving into the mysteries of mitochondrial shape. PLoS Biol. 2024;22(7):e3002671. |
| [1] | Sun Yundi, Cheng Lulu, Wan Haili, Chang Ying, Xiong Wenjuan, Xia Yuan. Effect of neuromuscular exercise for knee osteoarthritis pain and function: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1945-1952. |
| [2] | Li Jun, Gong Jingjing, Sun Guobin, Guo Rui, Ding Yang, Qiang Lijuan, Zhang Xiaoli, Fang Zhanhai . miR-27a-3p promotes the proliferation of human hypertrophic scar fibroblasts by regulating mitogen-activated protein kinase signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1609-1617. |
| [3] | Wang Qiuyue, Jin Pan, Pu Rui . Exercise intervention and the role of pyroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1667-1675. |
| [4] | Wang Juan, Wang Guanglan, Zuo Huiwu. Efficacy of exercise therapy in the treatment of anterior cruciate ligament reconstruction patients: #br# a network meta-analysis #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1714-1726. |
| [5] | Zheng Huakun, Yin Mingyue, Liu Qian. Effects of interval and continuous training on the quality of life in physically inactive adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1727-1740. |
| [6] | Lou Guo, Zhang Min, Fu Changxi. Exercise preconditioning for eight weeks enhances therapeutic effect of adipose-derived stem cells in rats with myocardial infarction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1363-1370. |
| [7] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [8] | Zhao Xiaoxuan, Liu Shuaiyi, Li Qi, Xing Zheng, Li Qingwen, Chu Xiaolei. Different exercise modalities promote functional recovery after peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1248-1256. |
| [9] | Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275. |
| [10] | Ma Haoyu, Qiao Hongchao, Hao Qianqian, Shi Dongbo. Causal effects of different exercise intensities on the risk of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1305-1311. |
| [11] | Wang Dongyang, Yang Qiaohui, Lin Xinchao. Relationship between vitamin D levels and reproductive characteristics and exercise dietary situation in postmenopausal women [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1021-1025. |
| [12] | Yu Qinghe, Cai Ziming, Wu Jintao, Ma Pengfei, Zhang Xin, Zhou Longqian, Wang Yakun, Lin Xiaoqin, Lin Wenping. Vanillic acid inhibits inflammatory response and extracellular matrix degradation of endplate chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6391-9397. |
| [13] | Fan Jiaxin, Jia Xiang, Xu Tianjie, Liu Kainan, Guo Xiaoling, Zhang Hui, Wang Qian . Metformin inhibits ferroptosis and improves cartilage damage in osteoarthritis model rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6398-6408. |
| [14] | Zhou Ying, Tian Yong, Zhong Zhimei, Gu Yongxiang, Fang Hao. Inhibition of tumor necrosis factor receptor associated factor 6 regulates mTORC1/ULK1 signaling and promotes autophagy to improve myocardial injury in sepsis mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6434-6440. |
| [15] | Wang Jiaqian, , Jiang Changjun, Peng Yi, Ma Mi, Li Junhan. Study on the role of aerobic exercise in regulating the CNPY2-mediated AKT/GSK3β pathway for improving non-alcoholic fatty liver [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6441-6448. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||