Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (15): 3235-3243.doi: 10.12307/2025.174
Previous Articles Next Articles
Role of neutrophils in fracture healing and the promoting effect on healing after intervention
Gu Xinbo, Liu Zemin, Sun Haiyu
- Shanxi Medical University, Taiyuan 030000, Shanxi Province, China
-
Received:2024-03-14Accepted:2024-04-30Online:2025-05-28Published:2024-11-05 -
Contact:Sun Haiyu, MD, Chief physician, Shanxi Medical University, Taiyuan 030000, Shanxi Province, China -
About author:Gu Xinbo, Shanxi Medical University, Taiyuan 030000, Shanxi Province, China
CLC Number:
Cite this article
Gu Xinbo, Liu Zemin, Sun Haiyu. Role of neutrophils in fracture healing and the promoting effect on healing after intervention[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(15): 3235-3243.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
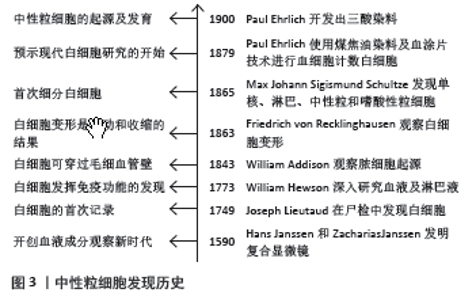
2.1 中性粒细胞的概述 2.1.1 发现中性粒细胞的历史 1590年Hans Janssen和Zacharias Janssen发明了复合显微镜,开创血液成分观察的新时代。早期因血液中白细胞数量少且透明,很少受到关注。直到1749年,Joseph Lieutaud在尸检中首次发现白细胞。1773年William Hewson对血液及淋巴液深入研究,发现白细胞可能通过胸导管进入淋巴系统发挥免疫功能。1843年William Addison观察到脓细胞起源自穿过毛细血管壁的白细胞。1863年Friedrich von Recklinghausen发现白细胞变形特性是由于运动和收缩的结果。1865年Max Johann Sigismund Schultze首次将白细胞细分,对应现在的单核细胞、淋巴细胞、中性粒细胞和嗜酸性粒细胞,同时发现4种细胞的运动及吞噬能力存在差异。1879年,Paul Ehrlich报道了使用煤焦油染料及血涂片技术进行血细胞计数的方法,预示现代血液白细胞研究的开始。然而最初的研究重点在嗜酸性粒细胞,对于中性粒细胞的重要性仍认识不足。随着研究深入,Paul Ehrlich发现大多数白细胞中的颗粒对酸性或碱性染料均不表现亲和力。最终于1900年,他开发出一种三酸染料区别酸性、碱性及中性颗粒,并准确描述了多核的中性粒细胞通过单核形态细胞渐进变态而发育[10-11]。见图3。"


2.1.2 中性粒细胞的产生与功能 中性粒细胞又称为多形核白细胞,成熟的中性粒细胞由骨髓产生并储存,数量约为循环内的20倍,其在骨髓中发育大约需要14 d,起源于造血干细胞[12]。前体细胞经历6次分裂,从成髓细胞经过早幼粒细胞分化为中性粒细胞,具体为成髓细胞、早幼粒细胞、中幼粒细胞、晚幼粒细胞、带状中性粒细胞和成熟中性粒细胞。成髓细胞是中性粒细胞早期的前体细胞,存在于骨髓中,具有分化为各种白细胞的潜能。早幼粒细胞的细胞核开始出现分叶,胞浆中出现原始颗粒,是中性粒细胞分化过程中的关键转折点。中幼粒细胞是中性粒细胞发育的中间阶段,细胞核分叶及粒状物质增多,开始表现中性粒细胞的特征。晚幼粒细胞是中性粒细胞发育的后期阶段,细胞核呈杆状或弧形,形态接近成熟中性粒细胞。带状中性粒细胞是中性粒细胞发育的最后阶段,细胞核呈带状,在骨髓中准备进入血液循环。成熟中性粒细胞的细胞核完全分叶,在体内完成免疫防御和应答的功能。成熟的中性粒细胞产生后2 d内释放到循环中,感染期间释放加快,血液半衰期为6- 10 h[13]。调节中性粒细胞产生的主要细胞因子是粒细胞集落刺激因子,作用包括诱导骨髓分化、粒细胞前体增殖及促进骨髓释放成熟的中性粒细胞[14]。 自从发现中性粒细胞后,人们对其进行了深入的研究,最先发现中性粒细胞是参与先天免疫的重要成分,是机体抵抗病原体入侵的第一道免疫防御。生理状态下,骨髓内中性粒细胞产生后进入循环系统,迁移到组织,完成功能后被巨噬细胞清除。例如迁移到淋巴结的中性粒细胞与T淋巴细胞相互作用,携带抗原并介导T细胞激 活[15];非血管组织在缺氧环境下募集中性粒细胞诱导血管生成[16];脾脏边缘区富含中性粒细胞,诱导边缘B淋巴细胞产生抗体[17]。疾病状态下,循环中的中性粒细胞捕获并杀死入侵的病原体,或者迁移到感染组织发挥防御作用,主要依赖其3种抗菌功能:吞噬作用、脱颗粒及中性粒细胞胞外陷阱。最近的研究发现,中性粒细胞的功能不仅限于杀灭微生物,它们也可表现出多种表型执行不同的细胞功能。例如在炎症及癌症中均检测到不同特征的中性粒细胞亚群[18-20]。 2.2 中性粒细胞在骨折愈合中的作用 2.2.1 中性粒细胞侵入血肿促进骨折愈合 骨折愈合的生物学过程包括初始的炎症阶段及组织修复重塑,炎症反应是愈合的第一步。最初的炎症始于骨折断端血肿形成,血肿充当干细胞及免疫细胞支架,启动修复过程[21]。中性粒细胞或其祖细胞可直接从受损的骨髓侵入血肿,介导炎症相关的骨修复和再生级联反应。中性粒细胞侵入血肿的过程受血肿内强效诱导剂调节[22-23]。CHRISTOFFERSSON等[24]发现一种具有血管生成特征的新中性粒细胞亚群,特点是高表达趋化因子受体4,此类中性粒细胞经血管内皮生长因子募集到组织内,并释放基质金属蛋白酶9促进血运重建。血管新生对于骨折愈合不可或缺,中性粒细胞血管生成相关亚群可能在骨折愈合中发挥重要作用,目前尚缺少相关的基础研究。 中性粒细胞不仅通过侵入血肿释放细胞因子参与成骨,同时对血肿自身的形成与维持具有重要作用。血肿形成可为早期成骨提供良好的局部微环境。血肿内富含纤维蛋白,骨折后48 h内,损伤部位中性粒细胞合成含有纤连蛋白的细胞外基质[25]。纤连蛋白结合纤维蛋白,并为其他细胞外基质蛋白、细胞和生长因子提供结合位点[26]。中性粒细胞通过促进血肿内纤维支架形成,为骨折愈合提供有利条件。同时,中性粒细胞通过调节细胞外基质矿化,影响骨再生过程。BASTIAN等[27]发现中性粒细胞数量较多或较少都会抑制细胞外基质矿化。总之,中性粒细胞不仅刺激细胞外基质形成,还可调节细胞外基质矿化,但具体通过何种方式作用,仍有待进一步研究。 2.2.2 N1/N2中性粒细胞表型对骨折愈合的影响 中性粒细胞除了在骨折早期血肿内参与炎症反应外,还可凭借其再生能力参与骨折愈合的其他阶段[23,28]。尤其在癌症的发生与进展中,N1中性粒细胞发挥抗肿瘤特性,而N2中性粒细胞表现出肿瘤支持和免疫抑制功能。N1型中性粒细胞抑制肿瘤生长和扩散,激活免疫系统攻击肿瘤细胞。具体方式为,N1型中性粒细胞受到外部刺激(如细胞因子、化疗药物等)后,通过释放炎症递质,激活T细胞、自然杀伤细胞等免疫细胞,促使其攻击肿瘤细胞,促进肿瘤细胞的凋亡。N2型中性粒细胞促进血管生成、肿瘤生长和转移,同时抑制免疫细胞攻击肿瘤细胞。N2型中性粒细胞促进肿瘤生长与其释放的免疫抑制因子(如白细胞介素10、转化生长因子β等)抑制了免疫应答有关,使肿瘤细胞无法被免疫系统识别。因此在癌症的治疗中,治疗策略是如何促进N1型中性粒细胞的活性,以及抑制N2型中性粒细胞的功能,以增强免疫系统对肿瘤的攻击和遏制肿瘤的生长及转移[29-30]。中性粒细胞的这种特性与M1/M2型巨噬细胞的不同表型相似,其在骨折愈合过程中的作用是否归因于单一表型目前仍未可知。OHMS等[31]使用CD54和CD95作为N1生物标志物,CD182作为N2生物标志物,在体外诱导人类中性粒细胞极化为N1和N2表型。这为中性粒细胞表型的进一步研究提供了理论基础。同时,中性粒细胞在不同刺激下可出现N1和N2表型的转化。转化生长因子β是促进N1表型中性粒细胞转化为N2表型的转换因子,有助于形成骨折愈合的再生微环境[31-32]。目前尚不清楚中性粒细胞N1/N2表型对骨折愈合的影响,明确中性粒细胞N1/N2表型分别对骨折愈合的具体作用机制是未来研究的重点。 2.3 中性粒细胞通过分泌细胞因子调节骨折愈合 骨折血肿内的中性粒细胞有助于清除病原体相关分子模式和损伤相关分子模式,形成中性粒细胞胞外陷阱,以及释放活性氧、中性粒细胞丝氨酸蛋白酶和各种细胞因子,包括肿瘤坏死因子α、白细胞介素6、白细胞介素10、成纤维细胞生长因子2(fibroblast growth factor-2,FGF-2)、单核细胞趋化蛋白1、血小板源性生长因子等[9,23]。这些物质释放形成的微环境促进了骨组织形成和重塑。 见表2。 "


2.3.1 肿瘤坏死因子α 骨折造成局部血管损伤,新血管形成促进周围组织再生。许多细胞类型有助于新生血管及侧支循环建立,其中包括白细胞,其在损伤部位大量积聚[33]。根据中性粒细胞产生血管内皮生长因子及基质金属蛋白酶9的能力,可将其分为具有或不具有血管生成活性的亚组[24,34-35]。L?RCHNER等[36]研究发现,肿瘤坏死因子α激活肿瘤坏死因子受体1刺激血管内皮细胞中C-C基序趋化因子配体20表达,同时介导中性粒细胞表面骨髓源性CC趋化因子受体6易位,募集血管生成相关的中性粒细胞至缺血部位,促进新血管形成。因此,骨折后血肿内募集的中性粒细胞通过产生肿瘤坏死因子α,介导骨折断端血管新生,促进骨折愈合。 2.3.2 白细胞介素6 白细胞介素6是一种功能多样、与生长分化相关的细胞因子,具有促炎与抗炎的双重作用。白细胞介素6反式信号传导主要负责促炎活性,而经过膜结合白细胞介素6受体信号传导负责抗炎活性[37]。白细胞介素6与骨代谢密切相关,其可通过增强成骨细胞前体分化和避免成骨细胞凋亡来促进骨形成[38]。中性粒细胞产生白细胞介素6还可通过减少破骨细胞中核因子κB的表达抑制骨吸收[39]。同时,白细胞介素6调节骨内骨保护素的表达,抑制破骨细胞生成[40]。JOHNSON等[41]发现在小鼠破骨细胞培养中,白细胞介素6与破骨细胞表面的白细胞介素6受体及辅助受体gp130结合,释放破骨细胞衍生的“偶联因子”和促进成骨细胞活性来促进骨形成。 2.3.3 白细胞介素10 白细胞介素10是一种35 kD二聚体细胞因子,由多种细胞类型产生。骨折时,在早期血肿形成阶段,募集的中性粒细胞大量产生白细胞介素10[6]。白细胞介素10的作用是激活单核/巨噬细胞系统功能,减少促炎细胞因子的产生,调节纤维形成相关的细胞因子,促进组织的修复再生[42]。白细胞介素10对骨代谢的影响主要分为两方面,一方面白细胞介素10抑制破骨细胞形成,另一方面白细胞介素10促进成骨细胞分化[43]。GAO等[44]研究发现白细胞介素10可能通过调节长链非编码RNA母源表达基因3及干扰素调节因子8表达来抑制破骨细胞分化。XIONG等[45]研究发现注射白细胞介素10导致骨形成增加,进一步研究发现白细胞介素10通过负向调节miR-7025-5p增强成骨细胞分化。 2.3.4 FGF-2 中性粒细胞产生FGF-2,促进骨再生修复。在大鼠闭合性股骨骨折模型中,FGFR2在骨折愈伤组织中的炎症细胞、骨膜细胞、软骨细胞、成骨细胞和破骨细胞中表达[46]。在小鼠长骨骨折模型中,FGF-2在整个愈合过程中表达,其中在血肿炎症阶段和骨痂形成阶段达到峰值。FGF-2主要通过诱导血管生成和增强成骨细胞谱系的增殖能力来促进骨损伤的修复[47]。KAWAGUCHI等[48]发现搭载FGF2的明胶水凝胶可以剂量依赖性方式促进截骨患者的骨愈合,对人体安全有效。FGF-2/FGFR2基因修饰小鼠的骨骼表型以及骨折愈合过程中FGF-2/FGFR2的表达模式表明FGF-2信号在骨再生中发挥着不可或缺的作用。 2.3.5 其他细胞因子 中性粒细胞还可产生血小板源性生长因子及单核细胞趋化蛋白1等细胞因子调节骨代谢,促进骨损伤的修复。血小板源性生长因子是一种双链多肽,最初在血小板中被发现,有促进血管生成的能力。骨折早期,除了中性粒细胞外,间充质干细胞也大量募集到断端参与骨修复。中性粒细胞产生的血小板源性生长因子可能通过激活ERK1/2信号通路增加间充质干细胞成骨分化,抑制成脂分化,同时增强血管内皮细胞的迁移和血管生成[49],表明血小板源性生长因子是骨形成和修复过程中血管生成和骨生成的有效调节剂。中性粒细胞通过产生单核细胞趋化蛋白1募集巨噬细胞,参与巨噬细胞的活化及分化,促进骨再生。进一步,M1型巨噬细胞通过产生细胞因子募集更多中性粒细胞放大响应,促进骨折修复的早期启动愈合级联反应[50]。 2.4 中性粒细胞与骨折愈合中不同细胞成分的相互作用 骨折愈合过程涉及骨折断端中多种类型的细胞参与。中性粒细胞除了自身分泌细胞因子参与骨愈合调节,还可与愈合各阶段的多种细胞类型相互作用,在不同但重叠的愈合过程中调节骨再生。骨折的血肿炎症阶段发生在人类骨折后的1-5 d内。骨折后24 h内,血肿被中性粒细胞浸润,产生细胞因子募集其它免疫细胞,例如单核/巨噬/树突状细胞、淋巴细胞。损伤修复阶段包括纤维骨痂形成及骨性骨痂形成,通常发生在骨折后5-21 d。中性粒细胞在此阶段主要发挥清除受损的细胞和碎片,以及清除血栓的作用。此阶段主要参与的细胞是间充质干细胞、成骨细胞、软骨细胞。骨折的重建阶段长达18周至1年,骨痂塑形阶段主要参与的细胞有自然杀伤细胞、破骨细胞、成骨细胞、骨细胞[21]。见表3。"

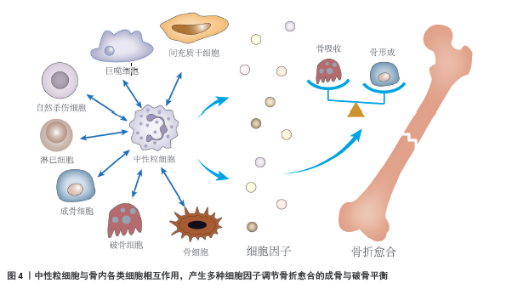
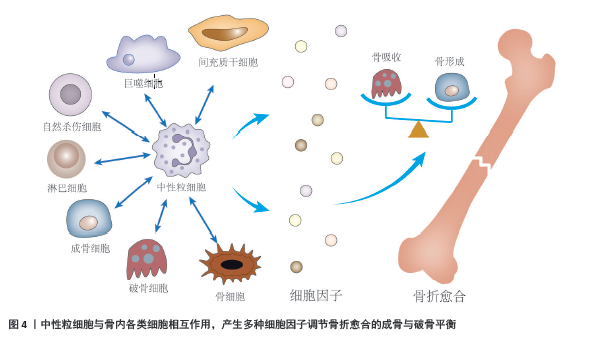
2.4.1 单核/巨噬/树突状细胞 中性粒细胞通过产生单核细胞趋化蛋白1募集单核细胞,单核细胞进一步分化为巨噬细胞、树突状细胞。树突状细胞存在于骨折愈合早期阶段,表达炎症细胞因子(白细胞介素6、白细胞介素12、肿瘤坏死因子α、白细胞介素10),发挥抗原提呈作用并参与炎症反应。巨噬细胞是血肿中最早出现的细胞之一,并存在于整个愈合过程之中,在骨稳态和骨折修复中发挥着不可或缺的作用[50]。虽然巨噬细胞存在于整个愈合过程中,但巨噬细胞耗竭实验发现,巨噬细胞在损伤后的早期炎症阶段最为关键[51]。巨噬细胞的极化发生在一个谱系中,简化为 3个亚型:幼稚表型(M0)、促炎表型(M1)或促再生表型(M2)。M1和M2型巨噬细胞通过调节愈合早期和晚期阶段在骨修复中发挥重要作用,M1型巨噬细胞在急性期浸润骨折部位,而M2型巨噬细胞在亚急性期数量增加。M1型巨噬细胞参与炎症反应的早期阶段,具有促炎性特性,释放一系列炎性因子和细胞毒素,如白细胞介素1β、白细胞介素6、肿瘤坏死因子α等,以及氧化剂和氮氧化物。M1型巨噬细胞产生细胞因子加速了骨折早期炎症的进展,促进间充质干细胞及其他免疫细胞的募集。M2型巨噬细胞在愈合的后期阶段发挥作用,具有抗炎和修复特性,释放抗炎因子和生长因子,如白细胞介素10、转化生长因子β、血管内皮生长因子等,诱导基质合成和细胞增殖,有助于减轻炎症反应,促进组织修复和再生[52]。VI等[53]耗竭急性期或亚急性期巨噬细胞导致骨折愈合延迟的实验,证实了这一观点。骨折早期的急性炎症阶段,活化的中性粒细胞分泌NET和蛋白酶,这些酶也参与了急性炎症期间M1巨噬细胞的功能。在炎症消退阶段,中性粒细胞凋亡,NET和蛋白酶被降解,巨噬细胞负责吞噬中性粒细胞和死亡组织[54]。中性粒细胞和巨噬细胞相互作为,共同维持骨折愈合早期断端微环境,为下一步修复阶段做准备。 2.4.2 自然杀伤细胞 自然杀伤细胞是来自先天免疫的大颗粒淋巴细胞,有助于骨折断端坏死组织清除及巨噬细胞的募集[21]。自然杀伤细胞可抑制或促进血管生成过程,发挥调节血管生成的双重作用。中性粒细胞可以激活或抑制自然杀伤细胞的细胞毒功能,进一步调节血管生 成[55]。骨折损伤部位,血管内皮细胞释放血管内皮生长因子增加细胞间黏附分子1和血管细胞黏附分子1的表达,进而通过与中性粒细胞表达的CD18以及自然杀伤细胞表达的CD49d相互作用,分别介导中性粒细胞和自然杀伤细胞的募集,修复血管损伤[55-57]。 2.4.3 淋巴细胞 中性粒细胞与淋巴细胞分别作为先天性免疫与适应性免疫的标志物,外周血中两者计数比值中性粒细胞与淋巴细胞比率常被用作免疫系统稳态的标 志[58]。中性粒细胞与淋巴细胞比率对复杂骨折后继发的感染具有辅助诊断价值[59]。GOLSORKHTABARAMIRI等[60]最近的研究发现中性粒细胞与淋巴细胞比率无法预测骨折术后早期不良结果,但结合其他危险因素综合评估,可作为术后并发症二次入院的危险因素。骨折愈合过程中,T淋巴细胞与B淋巴细胞浸润骨折部位,可促进成骨细胞成熟。K?NNECKE等[61]发现淋巴细胞在骨折愈伤组织的软骨区域不存在,而存在于编织骨区域,证实淋巴细胞的促成骨功能;进一步他们发现B细胞还可通过产生骨保护素来减少破骨细胞而减少骨吸收。EL KHASSAWNA等[62]发现T淋巴细胞通过分泌肿瘤坏死因子α促进成骨,是骨折愈合过程中成骨细胞正常沉积Ⅰ型胶原所必须的。 2.4.4 间充质干细胞 间充质干细胞的来源包括骨髓和骨膜,募集到骨折损伤部位后,间充质干细胞分化为软骨细胞和成骨细胞。骨折愈合过程中,间充质干细胞对中性粒细胞以外多种免疫细胞的功能具有抑制作用,可能与间充质干细胞作用的发挥需要抑制炎症程度有关[63]。间充质干细胞抑制中性粒细胞凋亡,并改变其趋化性,增强中性粒细胞呼吸爆发能力。间充质干细胞产生白细胞介素6、γ-干扰素和粒细胞-巨噬细胞集落刺激因子共同调节,延缓中性粒细胞的死亡[64]。间充质干细胞存在时,中性粒细胞活性会增加,中性粒细胞的活细胞数增加和死细胞数减少[65]。炎症消退后组织修复阶段,骨折断端细胞因子水平降低,促使中性粒细胞极化为N2亚型,促进骨再生。CAI等[66]发现N2亚型中性粒细胞表达抗炎信号,将其他免疫细胞从促炎表型(M1巨噬细胞、Th1、Th2、Th17细胞)转化为抗炎表型(M2巨噬细胞、Treg细胞),抗炎免疫细胞通过分泌细胞因子抑制炎症,并介导间充质干细胞成骨分化。修复阶段中性粒细胞与间充质干细胞的相互调节,控制了局部炎症反应,避免了过度的炎症损伤,并维持有利于组织修复的局部微环境。 2.4.5 成骨细胞 成骨细胞来源于间充质干细胞,合成致密、交联的胶原蛋白和骨钙素、骨桥蛋白等,构成骨骼的有机基质。HERATH等[8]开展的中性粒细胞、内皮细胞和成骨细胞的体外共培养模型表明,中性粒细胞诱导成骨细胞中成骨标志物的表达,包括碱性磷酸酶、骨钙素、Ⅰ型胶原、骨形态发生蛋白和转化生长因子β;同时,成骨细胞产生基质的沉积增加,表明骨中中性粒细胞可能具有成骨作用。最近的研究发现,牙周炎疾病中的中性粒细胞通过产生制瘤素M诱导成骨细胞中核因子κB配体受体激活剂表达促进破骨细胞的骨吸收,同时抑制骨细胞中硬化蛋白的表达[67]。表明持续炎症状态下中性粒细胞具有抑制骨形成的作用,骨折愈合时避免感染引起的过度炎症是治疗的重点。 2.4.6 破骨细胞 破骨细胞是骨髓造血干细胞谱系的多核细胞,可直接由单核细胞分化而来,也可由巨噬细胞产生。破骨细胞是骨内唯一吸收骨基质的细胞,负责软骨愈伤组织、骨性愈伤组织的吸收,扩展脉管系统及神经所需骨髓道,与成骨细胞共同平衡骨代谢。骨髓炎的患者骨组织活检中发现活化的中性粒细胞,中性粒细胞浸润和破骨细胞数量增多与白细胞介素8高表达有关,白细胞介素8被证实可诱导破骨细胞的形成[68]。NUMAZAKI等[69]最近的研究发现,中性粒细胞钙离子载体诱导的中性粒细胞胞外陷阱抑制核因子κB配体受体激活剂介导的破骨细胞生成,可能会抑制炎症过程中过度骨吸收。这些发现为骨折愈合炎症后期修复重建阶段中性粒细胞与破骨细胞的作用方式提供合理解释,即持续炎症状态中性粒细胞过度激活破骨细胞引起骨吸收,短暂炎症状态下中性粒细胞抑制破骨细胞功能,使骨代谢的平衡转向骨形成。 2.4.7 骨细胞 骨细胞是骨骼数量最多的细胞,占到90%-95%,其功能是响应微环境的变化,通过调节核因子κB配体受体激活剂/骨保护素的产生来影响成骨细胞和破骨细胞的活性,进一步影响骨重塑[70]。AZAB等[71]发现骨细胞中敲除G蛋白的小鼠(Dmp1-GsaKO)表现出严重的骨质减少,特点是小梁骨和皮质骨显著减少,以及中性粒细胞增多的表型。进一步研究发现,粒细胞集落刺激因子和硬化素是Dmp1-GsaKO小鼠中促进中性粒细胞增多和骨质减少的2种G蛋白依赖性因子。XIAO等[72]研究发现,骨细胞产生白细胞介素19,通过刺激白细胞介素19受体/信号转导及转录激活蛋白3信号传导促进中性粒细胞祖细胞扩张。见图4。 2.5 干预中性粒细胞促进骨折愈合 骨折修复是一个由免疫细胞和骨细胞谱系协调促进骨组织再生的复杂过程。中性粒细胞通过分泌细胞因子,以及和愈合各阶段细胞相互作用调节骨代谢,促进骨再生修复。这些调节方式,为通过干预中性粒细胞治疗骨折愈合提供了新的思路。既往巨噬细胞在骨折愈合过程中作用的机制研究多见,尤其明确巨噬细胞存在促炎/抗炎(M1/M2)表型后,如何在骨折愈合不同阶段调整巨噬细胞表型使其适应损伤修复,成为开发治疗手段的重点。类似地,中性粒细胞也存在N1/N2表型的转化,但目前对于两种表型的研究集中在肿瘤机制与治疗研究中,尚未明确其在骨折愈合过程中的具体作用。N1和N2表型转化可以通过给予转化生长因子β实现[31-32]。N2型中性粒细胞最初在骨再生的过程中被提到,它可被白细胞介素8吸引到骨折部位来促进骨折愈合。N1型中性粒细胞在骨修复中的作用逐渐受到重视[23]。目前常使用的针对中性粒细胞靶向治疗的方式有:局部或全身给予分子(主要为生长因子或炎症调节剂)或生物材料治疗,旨在调节中性粒细胞的分化或极化;中性粒细胞前体的局部移植。 靶向中性粒细胞的治疗,目前应用较多的是将其作为药物载体,以及中性粒细胞产生的外泌体作为载体,介导药物递送,以此为思路扩展其在骨折愈合中的治疗具有创新性。中性粒细胞搭载药物治疗骨折愈合的方法,针对中性粒细胞的募集特性,将药物递送到骨折局部,促进了骨组织再生,具有精准靶向和个性化治疗的特点。"
| [1] XIANG M, YIN M, XIE S, et al. The molecular mechanism of neutrophil extracellular traps and its role in bone and joint disease. Heliyon. 2023;9(12):e22920. [2] ZINDEL J, KUBES P. DAMPs, PAMPs, and LAMPs in Immunity and Sterile Inflammation. Ann Rev Pathol. 2020;15:493-518. [3] NAKKALA JR, LI Z, AHMAD W, et al. Immunomodulatory biomaterials and their application in therapies for chronic inflammation-related diseases. Acta Biomater. 2021;123:1-30. [4] KOVTUN A, BERGDOLT S, WIEGNER R, et al. The crucial role of neutrophil granulocytes in bone fracture healing. Eur Cell Mater. 2016; 32:152-162. [5] XIAO B, ADJEI-SOWAH E, BENOIT DSW. Integrating osteoimmunology and nanoparticle-based drug delivery systems for enhanced fracture healing. Nanomedicine. 2024;56:102727. [6] KOVTUN A, MESSERER DAC, SCHARFFETTER-KOCHANEK K, et al. Neutrophils in Tissue Trauma of the Skin, Bone, and Lung: Two Sides of the Same Coin. J Immunol Res. 2018;2018:8173983. [7] TSCHAFFON-MÜLLER MEA, KEMPTER E, STEPPE L, et al. Neutrophil-derived catecholamines mediate negative stress effects on bone. Nat Commun. 2023;14(1):3262. [8] HERATH TDK, LARBI A, TEOH SH, et al. Neutrophil-mediated enhancement of angiogenesis and osteogenesis in a novel triple cell co-culture model with endothelial cells and osteoblasts. J Tissue Eng Regen Med. 2018;12(2):e1221-e1236. [9] HERATH TDK, SAIGO L, SCHALLER B, et al. In Vivo Efficacy of Neutrophil-Mediated Bone Regeneration Using a Rabbit Calvarial Defect Model. Int J Mol Sci. 2021;22(23):13016. [10] KAY AB. Paul Ehrlich and the Early History of Granulocytes. Microbiol Spectr. 2016;4(4). doi: 10.1128/microbiolspec.MCHD-0032-2016. [11] CAVAILLON JM. The historical milestones in the understanding of leukocyte biology initiated by Elie Metchnikoff. J Leukoc Biol. 2011; 90(3):413-424. [12] ROSALES C. Neutrophil: A Cell with Many Roles in Inflammation or Several Cell Types? Front Physiol. 2018;9:113. [13] MCKENNA E, MHAONAIGH AU, WUBBEN R, et al. Neutrophils: Need for Standardized Nomenclature. Front Immunol. 2021;12:602963. [14] MARTIN KR, WONG HL, WITKO-SARSAT V, et al. G-CSF - A double edge sword in neutrophil mediated immunity. Semin Immunol. 2021;54: 101516. [15] JAKOVIJA A, CHTANOVA T. Neutrophil Interactions with the Lymphatic System. Cells. 2021;10(8):2106. [16] SBIERSKI-KIND J, MROZ N, MOLOFSKY A B. Perivascular stromal cells: Directors of tissue immune niches. Immunol Rev. 2021;302(1):10-31. [17] LO LW, CHANG CW, CHIANG MF, et al. Marginal Zone B Cells Assist With Neutrophil Accumulation to Fight Against Systemic Staphylococcus aureus Infection. Front Immunol. 2021;12:636818. [18] YANG F, FENG C, ZHANG X, et al. The Diverse Biological Functions of Neutrophils, Beyond the Defense Against Infections. Inflammation. 2017;40(1):311-323. [19] YANG P, LI Y, XIE Y, et al. Different Faces for Different Places: Heterogeneity of Neutrophil Phenotype and Function. J Immunol Res. 2019;2019:8016254. [20] QUAIL DF, AMULIC B, AZIZ M, et al. Neutrophil phenotypes and functions in cancer: A consensus statement. J Exp Med. 2022;219(6): e20220011. [21] CAPOBIANCO CA, HANKENSON KD, KNIGHTS AJ. Temporal dynamics of immune-stromal cell interactions in fracture healing. Front Immunol. 2024;15:1352819. [22] BASTIAN OW, MROZEK MH, RAABEN M, et al. Serum from the Human Fracture Hematoma Contains a Potent Inducer of Neutrophil Chemotaxis. Inflammation. 2018;41(3):1084-1092. [23] LU F, VERLEG SMNE, GROVEN RVM, et al. Is there a role for N1-N2 neutrophil phenotypes in bone regeneration? A systematic review. Bone. 2024;181:117021. [24] CHRISTOFFERSSON G, VÅGESJÖ E, VANDOOREN J, et al. VEGF-A recruits a proangiogenic MMP-9-delivering neutrophil subset that induces angiogenesis in transplanted hypoxic tissue. Blood. 2012;120(23): 4653-4662. [25] BASTIAN OW, KOENDERMAN L, ALBLAS J, et al. Neutrophils contribute to fracture healing by synthesizing fibronectin+ extracellular matrix rapidly after injury. Clin Immunol. 2016; 164: 78-84. [26] SINGH P, CARRAHER C, SCHWARZBAUER JE. Assembly of fibronectin extracellular matrix. Annu Rev Cell Dev Biol. 2010;26:397-419. [27] BASTIAN OW, CROES M, ALBLAS J, et al. Neutrophils Inhibit Synthesis of Mineralized Extracellular Matrix by Human Bone Marrow-Derived Stromal Cells In Vitro. Front Immunol. 2018;9:945. [28] GARCÍA-CULEBRAS A, DURÁN-LAFORET V, PEÑA-MARTÍNEZ C, et al. Role of TLR4 (Toll-Like Receptor 4) in N1/N2 Neutrophil Programming After Stroke. Stroke. 2019;50(10):2922-2932. [29] ZHANG J, GU J, WANG X, et al. Engineering and Targeting Neutrophils for Cancer Therapy. Adv Mater. 2024;36(19):e2310318. [30] DE LOS REYES AA, KIM Y. Optimal regulation of tumour-associated neutrophils in cancer progression. R Soc Open Sci. 2022;9(2):210705. [31] OHMS M, MÖLLER S, LASKAY T. An Attempt to Polarize Human Neutrophils Toward N1 and N2 Phenotypes in vitro. Front Immunol. 2020;11:532. [32] FRIDLENDER ZG, SUN J, KIM S, et al. Polarization of tumor-associated neutrophil phenotype by TGF-beta: “N1” versus “N2” TAN. Cancer Cell. 2009;16(3):183-194. [33] ANNEX BH, COOKE JP. New Directions in Therapeutic Angiogenesis and Arteriogenesis in Peripheral Arterial Disease. Circ Res. 2021;128(12): 1944-1957. [34] MASSENA S, CHRISTOFFERSSON G, VÅGESJÖ E, et al. Identification and characterization of VEGF-A-responsive neutrophils expressing CD49d, VEGFR1, and CXCR4 in mice and humans. Blood. 2015;126(17): 2016-2026. [35] TURNER TC, SOK MCP, HYMEL LA, et al. Harnessing lipid signaling pathways to target specialized pro-angiogenic neutrophil subsets for regenerative immunotherapy. Sci Adv. 2020;6(44):eaba7702. [36] LÖRCHNER H, CAÑES ESTEVE L, GÓES ME, et al. Neutrophils for Revascularization Require Activation of CCR6 and CCL20 by TNFα. Circ Res. 2023;133(7):592-610. [37] ROSE-JOHN S. Interleukin-6 Family Cytokines. Cold Spring Harb Perspect Biol. 2018;10(2):a028415. [38] SELLIN ML, KLINDER A, BERGSCHMIDT P, et al. IL-6-induced response of human osteoblasts from patients with rheumatoid arthritis after inhibition of the signaling pathway. Clin Exp Med. 2023;23(7): 3479-3499. [39] YOSHITAKE F, ITOH S, NARITA H, et al. Interleukin-6 directly inhibits osteoclast differentiation by suppressing receptor activator of NF-kappaB signaling pathways. J Biol Chem. 2008;283(17):11535-11540. [40] CAI L, LV Y, YAN Q, et al. Cytokines: The links between bone and the immune system. Injury, 2024;55(2):111203. [41] JOHNSON RW, MCGREGOR NE, BRENNAN HJ, et al. Glycoprotein130 (Gp130)/interleukin-6 (IL-6) signalling in osteoclasts promotes bone formation in periosteal and trabecular bone. Bone. 2015;81:343-351. [42] KING A, BALAJI S, LE LD, et al. Regenerative Wound Healing: The Role of Interleukin-10. Adv Wound Care (New Rochelle). 2014;3(4):315-323. [43] MARUYAMA M, RHEE C, UTSUNOMIYA T, et al. Modulation of the Inflammatory Response and Bone Healing. Front Endocrinol (Lausanne). 2020;11:386. [44] GAO X, GE J, ZHOU W, et al. IL-10 inhibits osteoclast differentiation and osteolysis through MEG3/IRF8 pathway. Cell Signal. 2022;95:110353. [45] XIONG Y, YAN C, CHEN L, et al. IL-10 induces MC3T3-E1 cells differentiation towards osteoblastic fate in murine model. J Cell Mol Med. 2020;24(1):1076-1086. [46] RUNDLE CH, MIYAKOSHI N, RAMIREZ E, et al. Expression of the fibroblast growth factor receptor genes in fracture repair. Clin Orthop Relat Res. 2002;(403):253-263. [47] XIE Y, SU N, YANG J, et al. FGF/FGFR signaling in health and disease. Signal Transduct Target Ther. 2020;5(1):181. [48] KAWAGUCHI H, JINGUSHI S, IZUMI T, et al. Local application of recombinant human fibroblast growth factor-2 on bone repair: a dose-escalation prospective trial on patients with osteotomy. J Orthop Res. 2007;25(4):480-487. [49] ZHANG M, YU W, NIIBE K, et al. The Effects of Platelet-Derived Growth Factor-BB on Bone Marrow Stromal Cell-Mediated Vascularized Bone Regeneration. Stem Cells Int. 2018;2018:3272098. [50] FRADE BB, DIAS RB, GEMINI PIPERNI S, et al. The role of macrophages in fracture healing: a narrative review of the recent updates and therapeutic perspectives. Stem Cell Investig. 2023;10:4. [51] DIPIETRO LA, WILGUS TA, KOH TJ. Macrophages in Healing Wounds: Paradoxes and Paradigms. Int J Mol Sci. 2021;22(2):950. [52] CHOW SKH, WONG CHW, CUI C, et al. Modulating macrophage polarization for the enhancement of fracture healing, a systematic review. J Orthop Translat. 2022;36:83-90. [53] VI L, BAHT GS, WHETSTONE H, et al. Macrophages promote osteoblastic differentiation in-vivo: implications in fracture repair and bone homeostasis. J Bone Miner Res. 2015;30(6):1090-1102. [54] SU Y, GAO J, KAUR P, et al. Neutrophils and Macrophages as Targets for Development of Nanotherapeutics in Inflammatory Diseases. Pharmaceutics. 2020;12(12):1222. [55] PALANO MT, GALLAZZI M, CUCCHIARA M, et al. Neutrophil and Natural Killer Cell Interactions in Cancers: Dangerous Liaisons Instructing Immunosuppression and Angiogenesis. Vaccines (Basel). 2021;9(12): 1488. [56] MEDRANO-BOSCH M, SIMÓN-CODINA B, JIMÉNEZ W, et al. Monocyte-endothelial cell interactions in vascular and tissue remodeling. Front Immunol. 2023;14:1196033. [57] HARJUNPÄÄ H, LLORT ASENS M, GUENTHER C, et al. Cell Adhesion Molecules and Their Roles and Regulation in the Immune and Tumor Microenvironment. Front Immunol. 2019;10:1078. [58] BUONACERA A, STANCANELLI B, COLACI M, et al. Neutrophil to Lymphocyte Ratio: An Emerging Marker of the Relationships between the Immune System and Diseases. Int J Mol Sci. 2022;23(7):3636. [59] CHEN P, LIU Y, LIN X, et al. Diagnostic Value of the Blood Neutrophil-to-Lymphocyte Ratio and Monocyte-to-Lymphocyte Ratio in Tibia Fracture-Related Infection. Dis Markers. 2022;2022: 6119583. [60] GOLSORKHTABARAMIRI M, MCKENZIE J, POTTER J. Predictability of Neutrophil to Lymphocyte Ratio in preoperative elderly hip fracture patients for post-operative short-term complications: a retrospective study. BMC Musculoskelet Disord. 2023;24(1):227. [61] KÖNNECKE I, SERRA A, EL KHASSAWNA T, et al. T and B cells participate in bone repair by infiltrating the fracture callus in a two-wave fashion. Bone. 2014;64:155-165. [62] EL KHASSAWNA T, SERRA A, BUCHER CH, et al. T Lymphocytes Influence the Mineralization Process of Bone. Front Immunol. 2017; 8:562. [63] CHEN R, HAO Z, WANG Y, et al. Mesenchymal Stem Cell-Immune Cell Interaction and Related Modulations for Bone Tissue Engineering. Stem Cells Int. 2022;2022:7153584. [64] FENG B, FENG X, YU Y, et al. Mesenchymal stem cells shift the pro-inflammatory phenotype of neutrophils to ameliorate acute lung injury. Stem Cell Res Ther. 2023;14(1):197. [65] SONG N, SCHOLTEMEIJER M, SHAH K. Mesenchymal Stem Cell Immunomodulation: Mechanisms and Therapeutic Potential. Trends Pharmacol Sci. 2020;41(9):653-664. [66] CAI B, LIN D, LI Y, et al. N2-Polarized Neutrophils Guide Bone Mesenchymal Stem Cell Recruitment and Initiate Bone Regeneration: A Missing Piece of the Bone Regeneration Puzzle. Adv Sci (Weinh). 2021; 8(19):e2100584. [67] ANDO Y, TSUKASAKI M, HUYNH NCN, et al. The neutrophil-osteogenic cell axis promotes bone destruction in periodontitis. Int J Oral Sci. 2024;16(1):18. [68] FISCHER V, HAFFNER-LUNTZER M. Interaction between bone and immune cells: Implications for postmenopausal osteoporosis. Semin Cell Dev Biol. 2022;123:14-21. [69] NUMAZAKI K, TADA H, NISHIOKA T, et al. Neutrophil extracellular traps inhibit osteoclastogenesis. Biochem Biophys Res Commun. 2024;705: 149743. [70] DELGADO-CALLE J, BELLIDO T. The osteocyte as a signaling cell. Physiol Rev. 2022;102(1):379-410. [71] AZAB E, CHANDLER KB, UDA Y, et al. Osteocytes control myeloid cell proliferation and differentiation through Gsα-dependent and -independent mechanisms. FASEB J. 2020;34(8):10191-10211. [72] XIAO M, ZHANG W, LIU W, et al. Osteocytes regulate neutrophil development through IL-19: a potent cytokine for neutropenia treatment. Blood. 2021;137(25):3533-3547. |
| [1] | Yu Shuai, Liu Jiawei, Zhu Bin, Pan Tan, Li Xinglong, Sun Guangfeng, Yu Haiyang, Ding Ya, Wang Hongliang. Hot issues and application prospects of small molecule drugs in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1913-1922. |
| [2] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [3] | Chen Shuai, Jin Jie, Han Huawei, Tian Ningsheng, Li Zhiwei . Causal relationship between circulating inflammatory cytokines and bone mineral density based on two-sample Mendelian randomization [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1556-1564. |
| [4] | Li Kaiying, Wei Xiaoge, Song Fei, Yang Nan, Zhao Zhenning, Wang Yan, Mu Jing, Ma Huisheng. Mechanism of Lijin manipulation regulating scar formation in skeletal muscle injury repair in rabbits [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1600-1608. |
| [5] | Bai Jing, Zhang Xue, Ren Yan, Li Yuehui, Tian Xiaoyu. Effect of lncRNA-TNFRSF13C on hypoxia-inducible factor 1alpha in periodontal cells by modulation of #br# miR-1246 #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 928-935. |
| [6] | Zhi Fang, Zhu Manhua, Xiong Wei, Lin Xingzhen. Analgesic effect of acupuncture in a rat model of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 936-941. |
| [7] | Wang Yuru, Li Siyuan, Xu Ye, Zhang Yumeng, Liu Yang, Hao Huiqin. Effects of wogonin on joint inflammation in collagen-induced arthritis rats via the endoplasmic reticulum stress pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1026-1035. |
| [8] | Zheng Yitong, Wang Yongxin, Liu Wen, Amujite, Qin Hu. Action mechanism of intrathecal transplantation of human umbilical cord mesenchymal stem cell-derived exosomes for repair of spinal cord injury under neuroendoscopy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7743-7751. |
| [9] | Yu Hui, Yang Yang, Wei Ting, Li Wenli, Luo Wenqian, Liu Bin. Gadd45b alleviates white matter damage in chronic ischemic rats by modulating astrocyte phenotype [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7797-7803. |
| [10] | Han Mengjun, Xu Fang. Hematopoietic stem cell mobilization: advantages and disadvantages of different plans and improvements in predictive models and technologies [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7863-7871. |
| [11] |
Li Zhipeng, Xing Rongxin, Hu Lianghong.
Roles of SOX5 in bone metabolism and prevention of bone diseases and the relationship with exercise#br#
#br#
[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7589-7600.
|
| [12] | Zhang Yixuan, Li Dongna, Liu Chunyan. Pathological processes, inflammatory responses, and related biomarkers of periodontitis: a multi-omics analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7601-7610. |
| [13] | Pan Chun, Fan Zhencheng, Hong Runyang, Shi Yujie, Chen Hao. Effect and mechanism of polystyrene microplastics on prostate in male mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7353-7361. |
| [14] | Su Yongkun, Sun Hong, Liu Miao, Yang Hua, Li Qingsong. Development of novel antioxidants and antioxidant combination carried by nano-hydrogel systems in treatment of intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7376-7384. |
| [15] | Wu Qingyun, Su Qiang. Antioxidant nanomedicine-mediated targeted therapy for myocardial ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7431-7438. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||