Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (13): 2114-2119.doi: 10.12307/2024.155
Previous Articles Next Articles
Factors influencing allogeneic platelet concentrate in chronic refractory wounds
Li Jiao1, Li Xiaofeng1, Li Jianping1, 2, 3
- 1Liaoning Institute of Transfusion Medicine, Liaoning Blood Center, Shenyang 110044, Liaoning Province, China; 2Harbin Blood Center, Harbin 150056, Heilongjiang Province, China; 3School of Pharmacy, China Medical University, Shenyang 110122, Liaoning Province, China
-
Received:2023-04-18Accepted:2023-06-01Online:2024-05-08Published:2023-08-29 -
Contact:Li Jianping, MD, Chief physician, Liaoning Institute of Transfusion Medicine, Liaoning Blood Center, Shenyang 110044, Liaoning Province, China; Harbin Blood Center, Harbin 150056, Heilongjiang Province, China; School of Pharmacy, China Medical University, Shenyang 110122, Liaoning Province, China Li Xiaofeng, Master, Chief technician, Liaoning Institute of Transfusion Medicine, Liaoning Blood Center, Shenyang 110044, Liaoning Province, China -
About author:Li Jiao, Master, Technician-in-charge, Liaoning Institute of Transfusion Medicine, Liaoning Blood Center, Shenyang 110044, Liaoning Province, China -
Supported by:Weigao Scientific Research Foundation of China Blood Transfusion Association, No. CSBT-MWG-2021-01 (to LJP); Natural Science Foundation of Liaoning Province, No. 2020-MS-354 (to LXF); Research Project of Shenyang Municipal Health Commission, No. 2022096 (to LJ)
CLC Number:
Cite this article
Li Jiao, Li Xiaofeng, Li Jianping. Factors influencing allogeneic platelet concentrate in chronic refractory wounds[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(13): 2114-2119.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 血小板临床应用的发展 1842年,Donne在血细胞中发现了除了红细胞和白细胞以外的结构[6]。Julius Bizzozero将这种新结构命名为“血小板”,1882年,他发现血小板具有使血液凝固的作用[7]。20世纪初,临床医生发现血小板输入可治疗血小板减少症,并在外科手术中通过补充血小板浓缩物预防患者出血。1954年,Kingsley等首次使用“PRP”一词代表用于输注的血小板浓缩物[8]。在20世纪60年代,第一个血库PRP制剂出现,并在20世纪70年代开始流行[9]。1972年,Matras首次在外科手术过程中使用血小板作为密封剂来建立血液稳态[10]。20世纪80年代,研究者发现血小板不止在血液系统里发挥凝血相关的作用,还能够释放多种生物活性分子修复受损组织,先后发现了表皮生长因子、血小板衍生生长因子、血管内皮生长因子[11]。至此,血小板促进组织修复的作用逐渐引起关注。1986年,Knighton等是第一批描述血小板浓缩制备方案并将其命名为自体血小板衍生的伤口愈合因子的科学家[12]。自20世纪80 年代末以来,PRP在再生医学领域开始广泛应用,普通外科、心脏外科、颌面外科、骨科、美容皮肤科、妇科、泌尿科以及眼科等许多医学领域均开展了自体PRP的应用[9]。由于自体血小板的应用受到患者诸多个人条件的限制,国内外研究者开始尝试异体血小板的非输注性应用研究,国内异体血小板的拓展应用研究最早可追溯到2008年,广州军区广州总医院单桂秋主任开展了异体血小板凝胶对难治性糖尿病足溃疡的治疗研究[13]。总之,在PRP 大约70年的应用历史中,异体PRP的应用研究至少有15年了,在临床的非输注性应用特别是针对难治性皮肤损伤修复是可行和有效的。 2.2 WBPC在慢性难愈性创面治疗中的临床应用 关于慢性难愈性创面目前尚无统一的定义,国际创伤愈合学会将其定义为无法通过正常、有序、及时修复而造成的或经修复但无法恢复解剖及功能状态完整的创面[14]。 伤口愈合是一个动态过程,包括止血阶段、炎症反应阶段、增殖阶段(血管生成和细胞外基质形成)以及重构阶段。与愈合的伤口相比,慢性伤口中基质金属蛋白酶浓度明显更高[15]。在这种情况下,同源异体PRP被认为是一种治疗选择[16]。尽管对PRP促进伤口愈合的分子基础还不完全清楚,但一些临床证据表明,这种策略可以促进伤口修复[17-26],见表1。在慢性难愈性创面的治疗中,WBPC主要以激活后的凝胶形式应用,在凝血酶和/或氯化钙/葡萄糖酸钙等激活剂的作用下血小板被激活,血小板的α颗粒与血小板膜融合,释放出多种促生长细胞因子,对表达PRP中相关生长因子受体的细胞具有一定的调控作用:激活细胞内信号蛋白,引起基因序列的表达,指导细胞增殖、基质形成,促进组织修复与再生。同时血浆中可溶性的纤维蛋白原转化为不可溶的纤维蛋白,形成富含生长因子的纤维蛋白网状凝胶,不仅可粘合组织缺损,还可使血小板在局部长时间缓慢释放生长因子,更好地发挥组织修复作用。研究认为包括糖尿病足创面、压疮、下肢静脉溃疡等难愈性皮肤损伤,应用异体WBPC凝胶治疗后,溃疡面积缩小、伤口愈合时间缩短,特别是在使用的前2周,加速肉芽组织形成,促愈合效果显著。一项关于“异体和自体PRP对糖尿病性下肢溃疡治疗的比较研究”认为,异体WBPC可以替代自体PRP作为糖尿病患者溃疡创面的治疗方案[19]。在10例异体WBPC作为慢性难愈性创面干预措施的文献中,未见明显不良反应(发热、水肿、疼痛、皮肤瘙痒、皮疹等)的报告,其中1例开展了血小板抗体检测,未检出血小板抗体[19],异体WBPC的免疫原性可以忽略不计,原因如下:首先,用于伤口愈合的异体WBPC是一种外用产品,不进入血液循环系统,凝胶中的HLA和HPA抗原与患者接触面积有限;第二,血小板活化后形成凝胶,活化血小板的表面抗原结构和表达水平均发生改变,免疫原性降低;第三,PRP可以在几周内被完全降解和吸收,从而消除了慢性免疫反应的可能性。刘鸿雁等[17-18]在“同种异体富血小板对糖尿病足等慢性难愈合创面的研究”指出,促愈合机制可能与降低白细胞介素1β、肿瘤坏死因子α、C-反应蛋白等炎症因子水平并提高血清透明质酸、血管内皮生长因子、血清促红细胞生成素及转化生长因子β1表达水平有关。但由于病例数量较少,WBPC制备参数、血小板的浓度以及WBPC使用量未详尽描述,未来还需要开展大规模的随机对照试验,更进一步确定异体WBPC对慢性难愈性创面的利弊。"

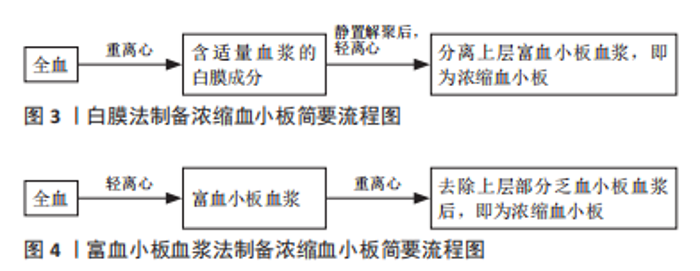
2.3 WBPC的制备方法 输血性血小板制品仅可由血液中心、血站或单采血浆站等采供血机构采集供应,包括APC和WBPC,APC是使用血细胞分离机,在全封闭的条件下自动将符合要求的献血者血液中的血小板成分分离并悬浮于一定量血浆中的一种单采成分血。WBPC是使用血袋制备,将采集后置于室温保存和运输的全血于采集后6 h内,或采集后置于20-24 ℃保存和运输的全血于24 h内,在室温条件下将血小板分离出,并悬浮于一定量血浆内的成分血,包括白膜法和PRP法,见图3,4。依据《血站技术操作规程》,两者的主要区别在于轻离心和重离心的先后顺序,将采集后于室温保存和运输6 h内的全血或于20-24 ℃保存和运输24 h内的全血,先重离心转移出适量血浆和白膜层,再轻离心获得上层PRP的方法即为白膜法,而PRP法是先轻离心获得上层PRP,再重离心去除上层部分乏血小板血浆的方法。在WBPC的制备研究中,白膜法因较高的血小板质量、较低的白细胞残余率、较低的血小板活化率而备受国内外研究者的青睐,2005年欧洲大部分国家就已经采用白膜法替代PRP法制备WBPC[27]。目前,除了美国采用PRP法制备WBPC外,大多数国家都采用白膜法制备WBPC[28]。国内采供血机构制备WBPC也从PRP法逐渐向白膜法过渡,在2018年,中国向临床供应WBPC的55家采供血机构中,大多数血站以白膜法为主[29],但由于不同采供血机构制备WBPC所使用的仪器设备、离心条件、装罐方法、血袋结构不同,WBPC的质量存在很大的差异。WBPC的质量对慢性难愈性创面的临床疗效具有一定的影响,下面主要从中国采供血机构制备WBPC的实际情况,论述白膜法制备WBPC的影响因素。"

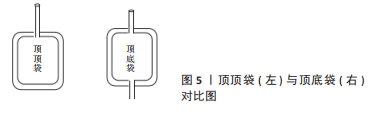
2.4 白膜法制备WBPC的影响因素 2.4.1 WBPC制备原料的保存条件 WBPC的质量(血小板浓度和活性)受多种因素影响,其中原料全血的保存和运输条件是非常关键的一个环节。室温保存和运输的全血于采集后6 h内,或采集后置于20-24 ℃保存和运输的全血于24 h内均可用于制备WBPC。但采集的全血当天制备WBPC与全血过夜后再制备WBPC,血小板的数量高低不一,绝大部分研究认为全血经室温放置过夜更易分离血小板,全血室温过夜制备的血小板数平均高于当天制备所得的血小板数的18.60%-33.00%[30-31],也有与此结果不一致的报道[32],但因为样本、离心参数等诸多条件不同,导致各结果间无可比性。但室温保存全血过夜不利于其他血液成分的保存,制备WBPC后的其他血液成分如悬浮红细胞、血浆凝血因子的质量受到一定的影响[33],特别是对Ⅷ因子的影响较大(降低约20%)[34]。因此,可以控制在血液采集6 h内完成全血室温静置和白膜层分离,通过全血静置1.0-2.0 h来促进血小板在血液运输、交接过程中发生的可逆性聚集解聚,从而实现在不影响其他血液成分质量的基础上制备出血小板回收率更高的WBPC。全血分离出白膜层后,白膜层的保存条件也是影响血小板回收率的关键因素。一般将白膜层在(22±2) ℃静置1.0-2.0 h后再制备WBPC,白膜层静置有利于使血小板和白细胞形成的微聚体解聚,从而提高血小板回收率。研究表明,白膜层不同静置时间对制备WBPC的血小板回收率也会产生影响,静置2 h血小板回收率最高[35-36]。若白膜层静置后不能及时制备WBPC,可将白膜层保存12 h内制备WBPC,但也会因保存温度较高造成红细胞破裂,导致游离血红蛋白含量增加[37]。因此,在条件允许的情况下,采集全血室温保存6 h内制备出白膜层,将白膜层于(22±2) ℃静置2 h制备WBPC的方式更有利于获得高质量的血液成分;如若受场地、工作人员等因素限制无法达到制备条件,可将白膜层静置2 h后振荡过夜再制备WBPC,血小板的回收率及其他血液成分质量也较白膜层静置过夜保存更具优势[38]。以往的研究表明,血小板浓度约为5倍以上,非输注性临床应用即可获得令人满意的结果[39]。若将WBPC应用在慢性难愈性创面,不止需要考虑血小板的浓度,还需要关注WBPC中血小板的活性,释放生长因子的能力等指标。 2.4.2 离心条件 影响WBPC质量的离心条件主要包括离心参数和装罐方式。白膜法制备WBPC最早可追溯到1969年[40],后来研究者为提高血小板的回收率从离心参数方面对白膜法提出了多种改良。目前,中国采供血机构制备WBPC的离心参数,一般为(22±2) ℃时,第1次重离心力为(1 642-2 620)×g,离心时间在12-19 min,第2次轻离心力为(163-400)×g,离心时间控制在5-10 min,离心时通常是慢降速,以避免分界处不同密度的血液成分移位混合。不同的离心力往往导致血小板的回收率不同,若离心力过高会使大量的血小板混入红细胞界面,若离心力过低又会造成红细胞沉降率降低,两者均导致血小板分离率降低,而且过高的离心力可能也会导致血小板的早期活化,从而导致生长因子丧失或WBPC治疗无效。在WBPC的制备中,需要根据所用离心机的品牌、型号等情况设置离心参数,目前关于WBPC制备离心参数的绝大多数研究集中在提高血小板回收率,对于调整离心参数对血小板活性的影响也应是WBPC非输注性临床应用需要重点关注的方向。此外,白膜成分袋离心时装罐配平方法对WBPC质量也会产生较大影响,因白膜成分袋内白膜层血量较少,袋体软而薄,在离心过程中由于袋体与离心杯内壁之间存在空隙,易下坠和折叠,一方面导致有形成分滞留在袋体折叠处,造成血液成分回收率低。研究表明,当新鲜全血离心后,也会有一些灰白色层牢牢地黏附在血袋褶皱的内壁上,并且即使在挤压血浆过程中血液成分向顶部的流动也无法完全被去除,从而造成血小板回收率降低[41]。另一方面下坠折叠的袋体因垂直悬挂后,导致白膜层液面扰动移位,进而达不到预期的分离效果,影响WBPC质量。血液成分制备的一线工作人员提出,在离心杯内增加离心隔板支撑夹紧白膜成分袋,避免袋体产生褶皱,使血液能更紧密的贴合在离心杯内,可有效防止血液因离心旋转出现滑动移位,离心后袋体仍处于平整竖直状态且血液分层清晰[42-43]。装罐时空腔距离在0-1 cm之内,即可高效回收血小板的同时降低血小板2次回离概率[44]。除此之外,为避免血液红细胞层泛起影响WBPC质量,需动作轻柔,平稳放置。总之,避免白膜成分袋折叠是保证离心效果好的前提条件。 2.4.3 血袋结构 塑料血袋作为血液及血液成分采集、处理、转移、分离、贮存和输注必不可少的医用耗材,直接影响血液成分的质量。目前,中国采供血机构主要采用传统联袋采集制备WBPC的全血,包括四联袋、五联袋和六联袋。传统联袋的血液转移管在采血袋顶端(简称TT袋),见图5,制备WBPC时,血液成分需经同一出口和转移管转移,血小板的回收率较低(50%-70%不等)。白膜袋和采血主袋连接管长,白膜袋和血小板转移袋尺寸/容积大,常使白膜层附着在管路和血袋壁,导致血小板回收率低。研究发现,六联袋因转移管更短,较四联袋血小板的回收率更高,可达80%[45]。白膜成分袋的尺寸由15 cm×12 cm优化为11 cm×9 cm后,血小板的回收率由(55.03±0.06)%提高到(79.23±0.09)%[46]。除了TT袋,也有采用顶底袋制备WBPC(简称TB袋),提高血小板回收率的研究报道[47-48],见图5,顶底袋组制备WBPC中血小板的回收率(91.0%)高于传统血袋对照组(69.0%),并且差异有显著性意义(P < 0.01)[47]。TB袋是在不改变TT袋的材料、性能和转移袋结构的基础上,将主袋袋体的进、出口分别置于袋体的顶部和底部。当抗凝全血离心后,血浆从血袋袋体的顶部转移,浓缩红细胞从袋体的底部出口转移,上下层之间的一层富含血小板和白细胞的成分(白膜层)留在血袋袋体中,即可用于制备WBPC。白膜层保留在TB袋内能够降低细胞黏附损失,从而提高血小板回收率,通过不同出口转移血液成分还可避免因多次转移操作导致血小板活化。国外已广泛使用顶底袋制备随机捐赠者的WBPC,同时所得的悬浮红细胞的质量及血浆量也有所提高[49-50]。随着血袋结构的优化,血液成分分离机的普及,血小板保存袋及血小板型去白细胞滤器等的应用,WBPC的制备将更加高效和快速。"
| [1] RAVES N, PHILLIPS CJ, HARDING K. A narrative review of the epidemiology and economics of chronic wounds. Br J Dermatol. 2022;187(2):141-148. [2] TIAN J, LEI XX, XUAN L, et al. The effects of aging, diabetes mellitus, and antiplatelet drugs on growth factors and anti-aging proteins in platelet-rich plasma. Platelets. 2019;30(6):773-792. [3] SETHI D, MARTIN KE, SHROTRIYA S, et al. Systematic literature review evaluating evidence and mechanisms of action for platelet-rich plasma as an antibacterial agent. J Cardiothorac Surg. 2021;16(1):277. [4] ANITUA E, ZALDUENDO M, TROYA M, et al. Platelet-Rich Plasma as an Alternative to Xenogeneic Sera in Cell-Based Therapies: A Need for Standardization. Int J Mol Sci. 2022;23(12):6552. [5] MASTROGIACOMO M, NARDINI M, COLLINA MC, et al. Innovative Cell and Platelet Rich Plasma Therapies for Diabetic Foot Ulcer Treatment: The Allogeneic Approach. Front Bioeng Biotechnol. 2022;10:869408. [6] HAJDU SI. A note from history: The discovery of blood cells. Ann Clin Lab Sci. 2003;33(2):237-238. [7] STASSEN JM, NYSTRÖM A. A historical review of hemostasis, thrombosis, and antithrombotic therapy. Ann Plast Surg. 1997;39(3):317-329. [8] ION H, CARMEN D, LILIANA HL, et al. Platelet derivatives with dental medicine applications. J Oral Rehabil. 2020;12:142-152. [9] MOŚCICKA P, PRZYLIPIAK A. History of autologous platelet-rich plasma: A short review. J Cosmet Dermatol. 2021;20(9):2712-2714. [10] KHAN FA, PARAYARUTHOTTAM P, ROSHAN G, et al. Platelets and Their Pathways in Dentistry: Systematic Review. J Int Soc Prev Community Dent. 2017;7(Suppl 2):S55-S60. [11] SÁNCHEZ-GONZÁLEZ DJ, MÉNDEZ-BOLAINA E, TREJO-BAHENA NI. Platelet-rich plasma peptides: key for regeneration. Int J Pept. 2012; 2012:532519. [12] GHANAATI S, HERRERA-VIZCAINO C, AL-MAAWI S, et al. Fifteen Years of Platelet Rich Fibrin in Dentistry and Oromaxillofacial Surgery: How High is the Level of Scientific Evidence? J Oral Implantol. 2018;44(6):471-492. [13] 单桂秋,林放,张爽,等.血小板拓展应用研究的认识与思考[J].中国输血杂志,2016,29(6):555-557. [14] 杨彪,刘克,李世超,等.富血小板血浆在慢性难愈性创面中的研究进展[J].实用骨科杂志,2019,25(4):338-343. [15] QIAN LW, FOURCAUDOT AB, YAMANE K, et al. Exacerbated and prolonged inflammation impairs wound healing and increases scarring. Wound Repair Regen. 2016;24(1):26-34. [16] AKBARZADEH S, MCKENZIE MB, RAHMAN MM, et al. Allogeneic Platelet-Rich Plasma: Is It Safe and Effective for Wound Repair? Eur Surg Res. 2021; 62(1):1-9. [17] 刘鸿雁,黄文炼,李竺憬,等.同种异体富血小板血浆凝胶治疗慢性难愈性创面的疗效分析[J].中国美容整形外科杂志,2021,32(12):741-744,755. [18] 刘鸿雁,黄文炼,李竺憬,等.同种异体富血小板对糖尿病足创面的愈合再生情况分析[J].中国输血杂志,2021,34(4):358-361. [19] HE M, GUO X, LI T, et al. Comparison of Allogeneic Platelet-rich Plasma With Autologous Platelet-rich Plasma for the Treatment of Diabetic Lower Extremity Ulcers. Cell Transplant. 2020;29:963689720931428. [20] SEMENIČ D, CIRMAN T, ROŽMAN P, et al. Regeneration of chronic wounds with allogeneic platelet gel versus hydrogel treatment: a prospective study. Acta Clin Croat. 2018;57(3):434-442. [21] OLIVEIRA MG, ABBADE LPF, MIOT HA, et al. Pilot study of homologous platelet gel in venous ulcers. An Bras Dermatol. 2017;92(4):499-504. [22] ASADI M, ALAMDARI DH, RAHIMI HR, et al. Treatment of life-threatening wounds with a combination of allogenic platelet-rich plasma, fibrin glue and collagen matrix, and a literature review. Exp Ther Med. 2014;8(2): 423-429. [23] GREPPI N, MAZZUCCO L, GALETTI G, et al. Treatment of recalcitrant ulcers with allogeneic platelet gel from pooled platelets in aged hypomobile patients. Biologicals. 2011;39(2):73-80. [24] CHEN TM, TSAI JC, BURNOUF T. A novel technique combining platelet gel, skin graft, and fibrin glue for healing recalcitrant lower extremity ulcers. Dermatol Surg. 2010;36(4):453-460. [25] JEONG SH, HAN SK, KIM WK. Treatment of diabetic foot ulcers using a blood bank platelet concentrate. Plast Reconstr Surg. 2010;125(3):944-952. [26] SCEVOLA S, NICOLETTI G, BRENTA F, et al. Allogenic platelet gel in the treatment of pressure sores: a pilot study. Int Wound J. 2010;7(3):184-190. [27] MURPHY S. Platelets from pooled buffy coats: an update. Transfusion. 2005;45(4):634-639. [28] PHILIP J, SAMANTHA K, CHATTERJEE T, et al. Evaluation of Random Donor Platelets Produced from Buffy Coat Stored for 24 h at Ambient Temperature: Should This be Implemented in India? Indian J Hematol Blood Transfus. 2015;31(2):264-268. [29] 傅雪梅,洪缨,李荫,等.中国血液成分制备现状与展望[A]//载何涛,耿鸿武,付涌水. 输血服务蓝皮书:中国输血行业发展报告(2019)[M].武汉:社会科学文献出版社,2019:94-108. [30] VAN DER MEER PF, CANCELAS JA, VASSALLO RR, et al. Evaluation of the overnight hold of whole blood at room temperature, before component processing: platelets (PLTs) from PLT-rich plasma. Transfusion. 2011;51 Suppl 1:45S-49S. [31] LU FQ, KANG W, PENG Y, et al. Characterization of blood components separated from donated whole blood after an overnight holding at room temperature with the buffy coat method. Transfusion. 2011;51(10):2199-2207. [32] 周静.全血采集后即时制备与贮存过夜后制备的浓缩血小板质量比较[J].中国输血杂志,2020,33(5):526-528. [33] 刘凤君,蒋秋容,王泽蓉,等.白膜放置时间对制备手工浓缩血小板质量的影响[J].中国输血杂志,2012,26(2):120-122. [34] 卢发强,康炜,彭昱,等.全血(22±2)℃保存24 h对白膜法分离血小板体外激活和血浆凝血因子活性的影响[J].中国输血杂志,2012,26(6): 551-553. [35] 连晓征,陈玉燕,陈惠民.不同血小板含量血液在不同静置时间对浓缩血小板第2次分离回收率影响分析[J].医学理论与实践,2019,32(9): 1408-1410. [36] 陈永婷.室温静置对制备血小板方法的影响[J].中国输血杂志,2019, 32(9):887-889. [37] 徐国胜,黄可君,范斌,等.白膜袋放置不同时间制备手工浓缩血小板比较[J].深圳中西医结合杂志,2017,27(10):125-126. [38] 刁荣华,王泽蓉,王世春,等.不同方式放置白膜制备浓缩血小板质量指标比较[J].临床输血与检验,2019,21(1):24-27. [39] TAMBELLA AM, ATTILI AR, DUPRÉ G, et al. Platelet-rich plasma to treat experimentally-induced skin wounds in animals: A systematic review and meta-analysis. PLoS One. 2018;13(1):e0191093. [40] MURPHY S, HEATON WA, REBULLA P. Platelet production in the Old World--and the New. Transfusion. 1996;36(8):751-754. [41] CERELLI E, NOCERA M, DI BARTOLOMEO E, et al. Effect of adhesive properties of buffy coat on the quality of blood components produced with Top & Top and Top & Bottom bags. Blood Transfus. 2015;13(2):265-273. [42] 罗曼华,康美艳,李津,等.改良白膜层离心装罐方法提高浓缩血小板质量的效果观察[J].中国输血杂志,2023,36(2):193-195. [43] 熊志高,刘昕晨,杨小罗,等.新改良白膜法制备浓缩血小板的应用效果探讨[J].中国临床新医学,2022,15(8):717-721. [44] 王承琳,王丽鸽,崔靖怡,等.浓缩血小板离心参数与装罐方法的标准化研究[J].中国输血杂志,2020,33(9):972-974. [45] 王泽蓉,刁荣华,王世春,等.六联采血袋制备浓缩血小板制剂的质量分析[J].中国输血杂志,2012(S1):50. [46] 肖达玲,杨坤,韦家寿,等.调整优化采血联袋后制备浓缩血小板的质量分析[J].中国输血杂志,2021,34(5):535-537. [47] 余凤秀,周载鑫,沈秋,等.两种血袋白膜法制备浓缩血小板质量研究[J].实用临床医药杂志,2020,24(22):87-89,92. [48] 阎兵,邹元国,谈维.应用顶底袋保留白膜法制备浓缩血小板[J].临床输血与检验,2014,16(2):182-185. [49] BHARDWAJ G, TIWARI AK, AGGARWAL G, et al. Evaluation of quality matrix when practice changed from triple bags to quadruple (top and bottom) bags: In vitro analysis of blood components! Asian J Transfus Sci. 2021;15(1):30-36. [50] LOTENS A, NAJDOVSKI T, CELLIER N, et al. New approach to ‘top-and-bottom’ whole blood separation using the multiunit TACSI WB system: quality of blood components. Vox Sang. 2014;107(3):261-268. [51] PAPAIT A, CANCEDDA R, MASTROGIACOMO M, et al. Allogeneic platelet-rich plasma affects monocyte differentiation to dendritic cells causing an anti-inflammatory microenvironment, putatively fostering wound healing. J Tissue Eng Regen Med. 2018;12(1):30-43. |
| [1] | Liu Zhilun, Guan Zhiyu, Jiang Taiping, Li Chengxi, Liu Zhaoming. Mechanism of stone balm on the healing of infected refractory wounds in rats [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(26): 4126-4131. |
| [2] | Jiang Hongying, Zhu Liang, Yu Xi, Huang Jing, Xiang Xiaona, Lan Zhengyan, He Hongchen. Effect of platelet-rich plasma on pressure ulcers after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1149-1153. |
| [3] | Gan Lili, Xiong Na, Liu Yanfei. Hydrogel as drug scaffold in skin wound repair: challenges of clinical application possibilities [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3578-3583. |
| [4] | Xiu Yiping, Zhang Liyan, Qian Xueyi, Li Yan, Li Wantong. The clinical application of platelet-rich plasma to repair chronic refractory wounds: a retrospective study and literature retrieval evidence analysis [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(8): 1231-1237. |
| [5] |
Gu Yingxuan, Huang Linfeng, Hu Xiaohui, Quan Xiaoming, Kang Liangqi, Zhou Linghan, Wang Xiaojun.
Platelet-rich plasma combined with negative pressure for chronic refractory wounds: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(26): 4257-4264. |
| [6] | Ma Hongwei, Liu Panyun, Zhang Yaqiong. Ginsenoside-induced bone marrow mesenchymal stem cell intervention can affect healing and Wnt/beta-catenin signaling in rats with diabetic skin ulcer [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(33): 5300-5306. |
| [7] | Yang Biao,Wang Shan, Zhang Yan, Liang Chunyu. Treatment of chronic refractory wounds with negative pressure wound therapy and platelet-rich plasma: accelerating the re-epithelialization of wounds and increasing [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(26): 4181-4186. |
| [8] | Li Mao, You Cheng-dong, Huang Wen. Transplantation of human umbilical cord mesenchymal stem cells for mouse skin ulcer [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(33): 5315-5320. |
| [9] | Bai Ming, Zhao Ru, Wang Zhi, Long Xiao, Zeng Ang, Zhang Hai-lin, Wang Xiao-jun. Outcomes of negative pressure wound therapy versus conventional dressing change in repair of wound on the body surface [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(2): 322-328. |
| [10] | Yan Long-zong, Chen Bin. Cell therapy of chronic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(46): 8096-8101. |
| [11] | Bai Ming, Zhao Ru, Wang Zhi, Long Xiao, Zeng Ang, Zhang Hai-lin, Wang Xiao-jun. Meta-analysis on the effect of negative pressure therapy in body surface wound treatment [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(46): 8108-8115. |
| [12] | Gao Yan-ming, Zhang Lu. Expression of vascular endothelial growth factor in the treatment of diabetic foot using bone marrow mesenchymal stem cell transplantation [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(40): 7169-7174. |
| [13] | Wang Fang, Li Yong, Su Ying-jun, Wang Na, Xu Chen, Zhou Bo. Application of low-dose insulin in diabetes refractory wound healing: Epithelialization, collagen deposition and angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(20): 3650-3657. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||