Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (14): 3736-3744.doi: 10.12307/2025.881
Previous Articles Next Articles
Application of quantitative light-induced fluorescence technology in diagnosis of oral diseases
Du Huijing1, Chen Shichun1, Liu Yinuo1, Yang Yutong1, Wang Ruohan1, Yang Xueying1, Ma Zhe2, Yan Rui1
- 1School of Stomatology, Jining Medical University, Jining 272000, Shandong Province, China; 2Hospital of Stomatology, Hebei Medical University, Shijiazhuang 050017, Hebei Province, China
-
Received:2024-09-26Accepted:2024-10-25Online:2026-05-18Published:2025-09-15 -
Contact:Yan Rui, MS, School of Stomatology, Jining Medical University, Jining 272000, Shandong Province, China -
About author:Du Huijing, School of Stomatology, Jining Medical University, Jining 272000, Shandong Province, China -
Supported by:2020 Government Funding for the Outstanding Clinical Medicine Excellent Talent Training Project Leader (Team), No. MXZB00349 (to MZ); Jining Medical University Student Innovation Training Program, No. cx2023097z (to DHJ)
CLC Number:
Cite this article
Du Huijing, Chen Shichun, Liu Yinuo, Yang Yutong, Wang Ruohan, Yang Xueying, Ma Zhe, Yan Rui. Application of quantitative light-induced fluorescence technology in diagnosis of oral diseases[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(14): 3736-3744.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
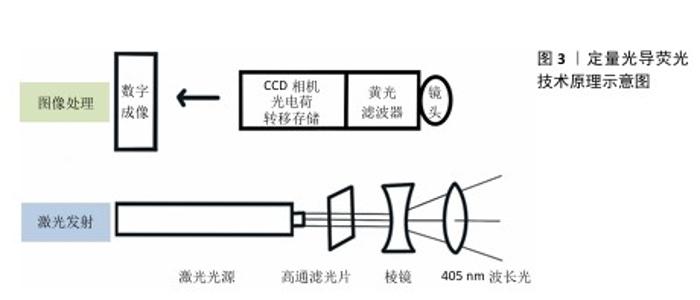
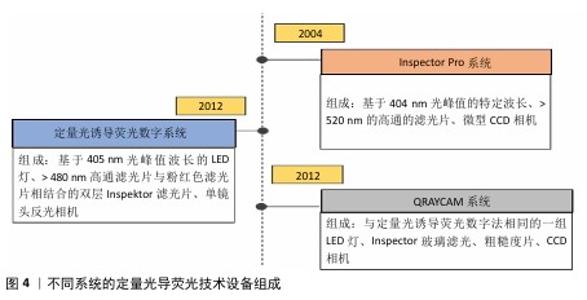
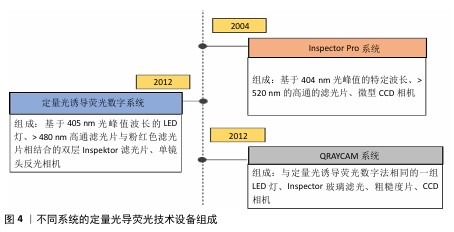
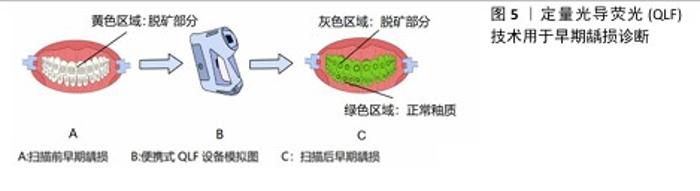
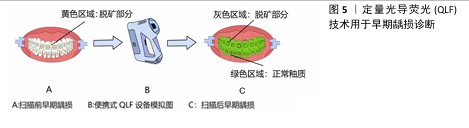
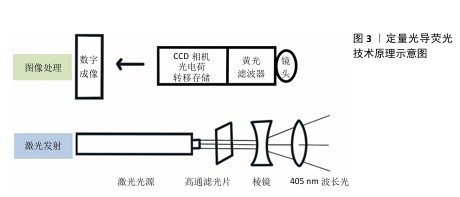
2.1 定量光导荧光技术原理及背景 2.1.1 定量光导荧光技术原理 定量光导荧光技术是一种新型光学技术,该系统中先由光源发出的白光经过高通滤光片形成405 nm的蓝色光,继而由棱镜全反射于牙面,产生的荧光通过黄光滤波器传送波长≥520 nm的荧光,以排除牙面散射的蓝光[4-5],最后由CCD相机拍摄并存入计算机进行图像分析,计算绿色荧光的最大损失量(ΔFmax)和红色荧光的最大增加量(ΔRmax),见图3。由于健康牙体组织釉质层矿物质含量较高、透明度较高,在蓝色光穿经釉质层到达釉牙本质界的过程中大部分光线被捕捉,发出绿色光谱段的荧光。而当牙体组织发生脱矿改变时,病变区牙釉质表现为富含唾液的多孔状结构,使光的散射增强,阻碍蓝色光到达下层的正常牙体组织,同时也阻碍产生的绿色荧光到达牙齿表面[6],导致绿色荧光强度减低,从而显示为区别于正常牙体组织绿色荧光的暗区。而口腔内由细菌构成的牙菌斑生物膜也会因为卟啉素的存在对蓝色光产生红色荧光反应,牙菌斑越成熟红色荧光强度越高[7]。从组织病理学角度来看,ΔFmax与病变深度和矿物质流失程度有关,ΔRmax表明口腔中细菌的代谢产物卟啉量,可评估细菌活性水平[8]。 2.1.2 定量光导荧光技术背景 最初,研究人员注意到在特定波长的光照射下牙齿会发出荧光。健康牙体组织与龋损牙体组织在荧光特性上存在差异,这一现象引起了科学界的兴趣[9]。随着研究的深入,科学家们开始探索如何利用这一现象进行口腔疾病的诊断。20世纪末,定量光导荧光技术逐渐被开发出来,相关定量光导荧光技术设备逐渐开始面世、发展和完善[6]。不同代的定量光导荧光技术设备虽使用相同波长的可见光,但有着不同的相机、捕获方法和滤光片[10],具体组成见图4。未来定量光导荧光技术有望继续发展,与人工智能等技术科学结合,能够自动检测和分类牙齿表面的病变,提供更灵敏和准确的诊断建议,与无线连接功能结合,使得诊断结果可以实时传输到其他设备或云端进行进一步的分析和存储[11]。 "

(1)咬合面龋和邻面龋:咬合面龋也称为窝沟龋,是发生在磨牙咬合面上的龋齿,这些区域由于窝沟的存在容易滞留食物和细菌,并且不易清洁,因此成为龋齿好发的部位[14]。以往多项研究证实了定量光导荧光技术在体内外检测乳牙和恒牙咬合龋的可靠性。SILVA等[4]使用定量光导荧光技术在体外检测了60颗恒牙咬合面在渗透树脂治疗前后牙釉质的矿化改变程度,并制成组织切片进行偏光显微镜分析,结果显示各组在渗透树脂处理后所有的定量光导荧光技术参数(龋损面积、ΔFmax和荧光损失积分)均降低,且存在显著统计学差异。一项检测定量光导荧光技术对乳牙龋齿诊断效果的研究表明,定量光导荧光技术对所有类型乳牙龋齿检测均有一定的可靠性,与传统的大体检查或影像学检查方法相似或略高于临床水平,并且可以更好地提供视觉图像及定量分析龋齿病损[15]。OH等[8]通过对153例患者的297颗牙齿拍摄定量光导荧光图像发现,定量光导荧光技术在检测咬合面龋齿和裂纹方面比传统目视检测方法具有更高的检测能力,而邻面龋在咬翼射线方法中的检出率较高。JALLAD等[16]使用定量光导荧光技术等不同检测方法对60颗牙齿咬合面进行龋病检测,证实了定量光诱导荧光数字系统和国际龋齿检测与评估系统检测标准的可靠性。此外,FELIX等[17]对565名儿童牙齿拍摄定量光导荧光图像以进行为期4年的纵向研究,结果证明定量光导荧光图像上的红橙色荧光可以作为龋病病变进展的指标,这也进一步提示定量光导荧光技术可以用来监测早期龋病。 龋齿最常发生的部位除了咬合面还有邻面,由于邻面解剖位置隐蔽,检测邻面龋病变较咬合面困难。CHO等[15]认为定量光导荧光技术对咬合面龋损的检测能力较高,但很难检测到邻面病变荧光的微小变化。然而,KO等[18]通过对95个离体恒牙进行体外实验,评估了定量光诱导荧光数字技术检测不同阶段邻面龋齿的能力,以组织学检查作为金标准,并与其他检测方法(如国际龋齿检测与评估系统和数字射线照相)的性能进行比较,得出结论:定量光诱导荧光数字系统不仅能够检测邻面龋损,而且在检测邻面龋损方面表现出与视觉检查和影像检查类似的性能。另一项研究表明,定量光导荧光技术可作为筛查工具,早于放射线检查检测出牙本质水平的邻面龋齿[19]。 (2)正畸脱矿:研究表明,正畸固定矫治过程中由于患者清洁措施不当、疼痛等原因易导致牙齿脱矿而形成早期龋齿,因此对这类患者预防和治疗是至关重要的[20]。BOERSMA等[21]采用定量光导荧光技术和视诊分别测定了正畸患者的龋病患病率,结果发现定量光导荧光技术检测出的病变数目远超过视诊。KANG等[22]使用定量光诱导荧光数字系统对正畸治疗后发生的龋白斑进行检测,结果证实定量光诱导荧光数字系统是评估去除正畸矫治器后龋损中小水平矿物质变化的敏感工具。MILLER等[23]比较了33例正畸患者在定量光导荧光图像和白光图像中去矿化和菌斑积累方面的差异,进一步肯定了定量光诱导荧光数字系统在正畸过程中检测脱矿和菌斑的作用,同时通过问卷调查发现患者更喜欢定量光导荧光图像呈现的效果。 (3)技术创新:定量光导荧光技术检测早期龋齿的方法还可以结合多种技术来提高其高效性和准确性。如染色强化定量光导荧光技术是一种通过荧光染料在龋病损害处成像和定量荧光的方法,可以帮助临床医生对早期龋病的病变活动进行直观和定量的评估[24]。定量光导荧光技术和数码照片是检测脱矿区的有效方法,两者结合可能有利于早期病变的评估[25]。随着技术的发展,基于人工智能的龋齿自动检测似乎有望实现快速、准确的龋齿检测。PARK等[11]通过一种叫做卷积神经网络的人工智能技术来识别定量光导荧光图像,以此进行龋齿分类和诊断,结果显示该技术使用原始定量光导荧光图像进行诊断分析的准确度为83.2%、精确度为85.6%、灵敏度为86.9%,并且应用牙齿区域分割处理后所有性能指标都得到了提高,提示医师可通过人工智能技术识别定量光导荧光图像,以实现准确、高效的数字医疗。 目前,临床上主要以视诊、探诊和影像学检查来诊断分析早期龋,与这些方法相比,定量光导荧光技术不仅能够检测到容易遗漏的无影像改变的早期龋损,还能非破坏性地定量牙体矿化程度,捕获口腔内定量光导荧光图像可以数字化并立即在计算机监视器中可视化[11,15],在某些情况下定量光导荧光技术可以作为临床决策的辅助手段,但目前尚未确定定量光导荧光技术等方法是否可以成为日常实践中检测龋齿的有用工具[26]。 "

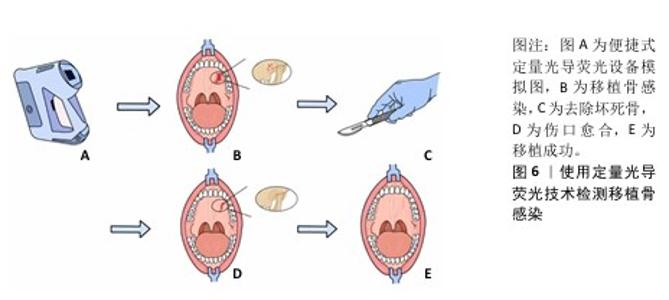
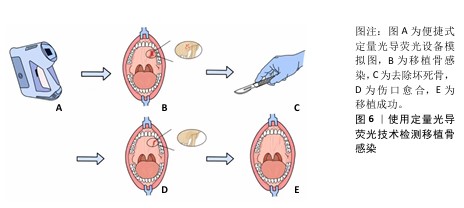
2.2.2 颌骨骨髓炎的诊断 颌骨骨髓炎是指包括骨髓、骨松质、骨皮质及骨膜等全颌骨的炎症。颌骨骨髓炎的发生与多种因素有关,草绿色链球菌、金黄色葡萄球菌、结核杆菌、梅毒螺旋体等病原体引起的感染以及物理因素、化学因素均可引起颌骨骨髓炎[27]。据统计,颌骨骨髓炎在世界范围内的发病率为(3-4人)/10万[28]。颌骨骨髓炎病史较长、治疗费用较高,治疗效果不甚理想,有时会出现进食困难、张口受限等并发症,严重影响患者的生活质量,因此积极有效的治疗对患者尤为重要[29]。颌骨骨髓炎主要采用抗生素、非类固醇抗炎止痛药、手术、高压氧等多种治疗方法[27]。现在依旧使用影像分析判断是否需要进行手术治疗,可单纯的影像分析无法在术中实时观察需要切除的颌骨情况,存在局限性。而应用基于定量光导荧光技术的引导手术,可以帮助医生在术中判断颌骨切除范围以及进行骨感染切除的术后监测[30-32]。 药物相关性颌骨坏死是颌骨骨髓炎中具有挑战性的一种疾病,随着其发病率的持续上升,缺乏明确的手术指南使得治疗过程变得更加复杂。最新的研究成果显示,定量光导荧光技术能够在手术中针对性地显示出红色荧光的骨组织区域,这些区域通常代表坏死的骨组织,健康骨基质不会发出类似的荧光,因此可以被保留下来[30]。这种区分能力对减少不必要的组织损伤和提高手术精确性至关重要。另一项研究通过对螯合物的组织学分析发现,定量光导荧光技术在螯合物上表现出非红光荧光、高红荧光和低红荧光3种荧光现象,这些荧光现象分别指示着不同的骨组织状态:非红色荧光代表硬化和层状骨组织,高红荧光指示细菌侵袭和骨质溶解的感染状态,低红色荧光则显示微脓肿和炎症细胞浸润[31]。此外,对于医生来说,术后判断患者身体状况和病情是否复发是治疗中不可或缺的步骤。在术后监测方面,定量光导荧光技术可用于评估患者伤口裂开后移植骨暴露是否存在感染或移植失败,见图6。相关数据表明,当检测到红色荧光时则一定程度上证明需要去除钛网来规避感染,虽然目前没有明确指标来肯定暴露钛网的去除时间和去除受污染骨移植的程度,但定量光导荧光技术可通过从卟啉中检测出红色荧光来评估暴露的自体骨移植物上的细菌感染,从而判断是否该去除钛网,为术后监测患者身体状况提供了参考[32]。 综上所述,定量光导荧光技术可能是药物相关性颌骨坏死手术中有用的实时诊断工具。定量光导荧光技术引导的手术通过荧光检测区分视觉上相似的层状骨和感染骨,进行保留非红色荧光区域、去除高红和低红荧光区域的微创手术,有望降低颌骨坏死的复发率。这一发现为药物相关性颌骨坏死的治疗提供了新的视角和方法,预示着定量光导荧光技术作为一种诊疗工具在颌骨骨髓炎特别是药物相关性颌骨坏死中具有巨大潜力,但这方面的研究相对匮乏,仍需要更充分的实验研究和临床试验证实其临床应用的可行性。 "

2.2.3 口腔恶臭的诊断 临床上根据气味来源分为口腔内口臭和口腔外口臭,其中90%的口臭为口腔内口臭[33]。口腔内定植的革兰阴性菌如连翘拟杆菌、牙龈卟啉单胞菌和放线杆菌等经过代谢产生挥发性硫化物,这是造成口腔恶臭的主要气体[34]。 口腔恶臭主要来源是舌头,其次为牙龈和牙周区域[35]。利用定量光导荧光技术可以将口腔细菌产生的内源性卟啉表示为红色荧光,进而检测和量化舌涂层牙菌斑的活性,作为口腔恶臭的辅助诊断[36]。 研究已验证了定量光导荧光技术间接检测口腔恶臭的可行性。有研究检查了103名以口腔异味为主诉的健康受试者,通过感官评分和挥发性硫化物水平测量口腔恶臭水平,同时将定量光诱导荧光数字系统捕获的荧光舌涂层图像乘以荧光强度和面积量化为综合荧光评分,结果显示舌苔综合荧光评分评分与感官评分(r=0.54,P < 0.01)和挥发性硫化物水平(r=0.49,P < 0.01)呈显著正相关,说明通过定量光诱导荧光数字系统检测到的综合荧光评分,可作为用于诊断口腔恶臭的有效方法并评估其严重程度[37]。LEE等[38]将舌和牙间斑块的荧光特性量化并将2个区域的分数相加得到组合斑块荧光评分,得到组合斑块荧光评分与感官评分(r=0.64)和挥发性硫化物水平(r=0.54)中度相关,这进一步证实定量光导荧光技术检测到的舌部和牙间斑块红色自荧光与口腔恶臭水平有显著相关性。因此,口腔生物膜综合荧光特性的斑块荧光评分可定量分析口腔恶臭水平并辅助口腔恶臭诊断。KIM等[39]选择了89名受试者,通过测定H2S和CH3SH气体浓度值分为非口腔恶臭组(挥发性硫化物=0 ng/10 mL)和口腔恶臭组(H2S≥1.5 ng/mL和CH3SH≥0.5 ng/mL),利用分析仪程序将舌部图像分为6个区域(A、B、C、D、E、F),并定量分析定量光导荧光图像呈现的各区域舌涂层分布和细菌活性,结果显示细菌活性和舌苔的分布显示出非常强烈的关联(r=0.937,P < 0.01),并且在舌中后段舌荧光面积最大。但有必要使用更准确和客观的方法收集参与者的数据,进行额外的调查以扩大年龄组。尽管如此,这项研究的意义在于它证实了在临床实践中使用数字定量光导荧光设备诊断舌苔和细菌活动的可能性,这对于口腔恶臭的管理至关重要。因此,可以通过积极使用数定量光导荧光图像和口腔恶臭测量来实现舌苔的系统管理和减少口腔恶臭。 综上所述,在初步判断气味来源于口腔后,辅以定量光导荧光技术可通过检测和量化舌涂层细菌分布和活跃性,从而帮助诊断口腔恶臭。上述研究为临床实践中使用定量光导荧光技术进行口腔恶臭诊断和舌苔情况管理提供了可能性,有助于减少口腔恶臭问题[40]。但定量光导荧光技术仅适用于分析口腔内细菌情况,针对其他来源的口臭无法做出诊断;并且在应用定量光导荧光技术时,为了方便和准确,需要改进算法和配合其他装置。目前关于定量光导荧光技术应用于口腔恶臭的研究较少,无法确定该技术是否可以在临床工作中推广使用。 2.2.4 牙齿裂纹的诊断 2020年版美国齿科医师协会牙髓术语词汇汇表中指出裂纹是“牙釉质和牙本质,可能还涉及到牙骨质的,未知深度和范围的浅表破坏”[41]。HASAN等[42]首先提出了“牙裂综合征”一词,后被定义为起源于牙冠的未知深度的折裂面,穿过牙齿结构并延伸至龈下,并可能进展为与牙髓和/或牙周膜连接。在初始阶段,牙髓有活力,咀嚼或进食冷食时可出现刺痛,随着裂纹的进展,它可能会进展到牙髓,引起牙髓坏死或牙齿的垂直折裂[43],因此,如何通过各种检查方法与技术及时地诊断出牙齿裂纹是临床工作中的重点与难点。 目前有许多裂纹诊断方法,如目视检查、亚甲基蓝染色、显微镜检查、交叉照明、锥形束CT成像等[44-47]。其中目视检查和交叉照明更为准确,最常用的方法是使用光纤光源和放大镜进行交叉照明试验,以增强可视化[48],但这种方式不能测量裂纹深度,不能显示所有裂纹,如细小裂纹。在显示垂直牙齿折裂线时,锥形束CT成像比根尖周X射线摄像更有用,然而锥形束CT成像的辐射暴露是一个问题[49]。因此,需要更加准确、安全的方法去诊断牙齿裂纹,同时争取测量裂纹深度。 定量光导荧光技术是使用波长为405 nm的可见蓝光照射牙齿,健康牙齿被这种波长的可见光照射,可到达釉牙本质界并产生绿色自发荧光;在产生裂纹的牙齿中,光被牙齿内的裂纹散射,透射受阻,导致产生的荧光降低。JUN等[50]采用定量光导荧光技术分析了96颗疑似有裂纹的牙齿,发现牙釉质裂纹的存在和深度与ΔFmax之间有强烈相关性。OH等[8]选取153例患者297颗牙齿,分别用定量光导荧光技术、X射线和视觉标准对牙合裂纹进行评估和评分,结果显示定量光导荧光技术检测牙合裂纹的评分高于常规方法,可以直观地显示牙合裂纹程度。以上报道通过实际分析有裂纹的牙齿,论证了利用定量光导荧光技术应用于牙齿裂纹诊断的可行性。此外,RICUCCI等[51]在裂纹线和周围牙本质小管的组织学分析中总是观察到细菌定植,细菌代谢产物如卟啉等在可见蓝光照射下可产生红色荧光,作为细菌在病变部位沉积的指标,可诊断陈旧性裂纹。LEE等[52]的回顾性研究报道了牙齿裂纹的临床叩诊痛与裂纹线深度和定量光导荧光技术参数之间可能存在的相关性。通过定量光导荧光技术可将牙齿裂纹这一概括性的疾病通过患者的发病时间、临床症状进行细致划分,在临床中可更加针对性地给予患者治疗方案,实用性高。SON等[53]研究发现嵌体修复后患者出现不可逆性牙髓炎症状,大体检查时裂纹线的存在不明显,利用定量光导荧光技术观察到了清晰的红色裂纹线,ΔFmax和ΔRmax在磨除隐裂线后下降。 综上所述,定量光导荧光技术相比传统技术可以更有效地诊断出牙齿裂纹,并探讨了定量光导荧光技术参数与牙齿裂纹深度之间的相关性,在临床中可帮助医师针对性和个体化的给出诊疗方案。但在实际应用时,定量光导荧光图像不能总是以恒定的角度和距离拍摄,在不同的光线角度下分析结果不同,在对裂纹线进行水平照射时才可获得最准确的结果,这在临床中是很难实现的,从而限制了其发展与应用。因此,如何利用定量光导荧光技术在不同的个体、牙位上以正确角度进行准确的拍摄,是尚待思考解决的问题之一。其次,当裂纹发生在根部时,由于完好的牙冠和牙龈、黏膜等的阻挡,定量光导荧光技术的蓝光无法直接照射到发生裂纹的根面上,无法获得荧光图像和变量数据,所以,此时X射线片和锥形束CT对于裂纹的诊断更具有优越性,定量光导荧光技术仍存在局限性。 2.2.5 牙齿磨损的诊断 牙齿磨损是指正常的咀嚼运动之外,高强度、反复机械摩擦造成的牙体硬组织快速丧失,通常由刷牙不当、不良咬合习惯等造成,多数患者常因牙齿磨损出现牙本质敏感、食物嵌塞及牙髓根尖周病等,因此早发现并进行相应治疗显得尤为重要[54]。由于该病临床表现的特殊性,是一种牙体硬组织的进行性丧失,最客观的诊断方法在临床上是有限的[55]。利用定量光导荧光设备对牙齿硬组织部分进行定期阶段性观测,利用无害的可见光在口腔中无创地获取荧光图像,实现微观图像可视化来确认牙齿磨损的趋势。 通过对近10年的病例研究发现,定量光导荧光技术可有效地估计牙釉质厚度,以用于监测牙齿磨损进展。KIM等[55]使用了16个前磨牙,每颗牙齿在牙合面的顶端方向上被逐步磨平,在每个研磨深度采集的定量光导荧光数字图像转换为8位灰度图像以计算荧光强度,最后对这些样本进行评估,发现在定量光导荧光图像中牙齿的荧光强度与磨削深度呈强烈相关。KIM等[56]通过分析73例成人的牙齿(具有不同的牙齿磨损程度,没有修复体,龋齿或牙折)定量光导荧光图像,对牙釉质磨损与使牙本质暴露磨损值进行比较,证实了使用定量光导荧光技术检测使牙本质暴露的牙齿磨损值并根据年龄提出最佳阈值的可行性,从而证实了使用定量光导荧光图像数据进行客观且具有成本效益的流行病学调查和远程口腔应用的可能性,并且对临床医师进行牙齿磨损诊断及治疗工作具有良好的辅助作用。此外,定量光导荧光技术还可以联合其他技术来提高对牙齿磨损检测的准确性。如光学相干断层扫描是一种成像技术,可以在没有X射线照射的情况下显示内部生物结构。激光光学相干断层扫描是最新版本的光学相干断层扫描之一,这种光学相干断层扫描利用波长可变的激光光源发射不同波长的光波,实现实时成像[57]。目前临床上并没有评估咬合面磨损的金标准方法来估计剩余牙的厚度。但是,WADA等[58]使用激光光学相干断层扫描在口腔中测量咬合面釉质的损失,证明激光光学相干断层扫描能够估计咬合面磨损的剩余牙釉质厚度。ALGHILAN等[59]使用交叉偏振光学相干断层扫描测量牙釉质厚度,以显示其与显微CT结果的良好吻合。研究表明,定量光导荧光技术和光学相干断层扫描联合应用有利于医师更好地对牙齿磨损进行诊断。 目前,临床上对牙齿磨损的诊断方法有直观视觉检查法和冷热检查法等,此类方法在对病情的诊断方面多有局限性,相比较而言,定量光导荧光技术能通过对牙釉质及牙本质厚度等荧光图像的观测,更为准确地分析出牙齿磨损进展情况以及牙本质暴露风险的磨损阈值,使牙齿磨损程度得以可视化,但关于定量光导荧光技术应用于牙齿磨损的相关研究较少,尚无法做到诊断的全覆盖。 "

| [1] 王守涛,陈庆光,林斌,等.光学技术在早期龋齿检测中的应用[J].激光生物学报,2009,18(6):846-852. [2] 杜亚鑫.定量光激发荧光技术在龋病诊断中的应用研究进展[J].口腔医学,2022, 42(11):1052-1056. [3] DE JOSSELIN DE JONG E, SUNDSTRÖM F, WESTERLING H, et al. A new method for in vivo quantification of changes in initial enamel caries with laser fluorescence. Caries Res. 1995;29(1):2-7. [4] SILVA FG, FREITAS PM, MENDES FM, et al. Monitoring enamel caries on resin-treated occlusal surfaces using quantitative light-induced fluorescence: an in vitro study. Lasers Med Sci. 2020;35(7):1629-1636. [5] 李新尚,赵今.定量光敏荧光技术用于釉质脱矿与再矿化的研究进展[J].重庆医学,2010,39(24):3435-3437. [6] 陈艳艳,彭显,周学东,等.定量光导荧光技术在龋病及牙周疾病诊治中的应用[J].国际口腔医学杂志,2019,46(6):699-704. [7] 胡德渝,冯岩,尹伟,等.龋病早期诊断方法的进展及评价[J].实用医院临床杂志,2007,4(2):19-21. [8] OH SH, LEE SR, CHOI JY, et al. Detection of Dental Caries and Cracks with Quantitative Light-Induced Fluorescence in Comparison to Radiographic and Visual Examination: A Retrospective Case Study. Sensors (Basel). 2021;21(5):1741. [9] KEALLEY C, ELCOMBE M, VANRIESSEN A, et al. Development of carbon nanotube-reinforced hydroxyapatite bioceramics. Physica B: Condensed Matter. 2006: 385-386:496-498. [10] PARK SW, KIM SK, LEE HS, et al. Comparison of fluorescence parameters between three generations of QLF devices for detecting enamel caries in vitro and on smooth surfaces. Photodiagnosis Photodyn Ther. 2019;25:142-147. [11] PARK EY, JEONG S, KANG S, et al. Tooth caries classification with quantitative light-induced fluorescence (QLF) images using convolutional neural network for permanent teeth in vivo. BMC Oral Health. 2023;23(1):981. [12] 郭欣欣,李涛.早期龋病防治方法的应用研究进展[J].山东医药,2023,63(30): 111-115. [13] LEE JW, LEE ES, KIM BI. Optical diagnosis of dentin caries lesions using quantitative light-induced fluorescence technology. Photodiagnosis Photodyn Ther. 2018;23: 68-70. [14] LITZENBURGER F, SCHÄFER G, HICKEL R, et al. Comparison of novel and established caries diagnostic methods: a clinical study on occlusal surfaces. BMC Oral Health. 2021;21(1):97. [15] CHO KH, KANG CM, JUNG HI, et al. The diagnostic efficacy of quantitative light-induced fluorescence in detection of dental caries of primary teeth. J Dent. 2021; 115:103845. [16] JALLAD M, ZERO D, ECKERT G, et al. In vitro Detection of Occlusal Caries on Permanent Teeth by a Visual, Light-Induced Fluorescence and Photothermal Radiometry and Modulated Luminescence Methods. Caries Res. 2015;49(5):523-530. [17] FELIX GG, ECKERT GJ, FERREIRA ZA. Orange/Red Fluorescence of Active Caries by Retrospective Quantitative Light-Induced Fluorescence Image Analysis. Caries Res. 2016;50(3):295-302. [18] KO HY, KANG SM, KIM HE, et al. Validation of quantitative light-induced fluorescence-digital (QLF-D) for the detection of approximal caries in vitro. J Dent. 2015; 43(5):568-575. [19] KIM ES, LEE ES, KANG SM, et al. A new screening method to detect proximal dental caries using fluorescence imaging. Photodiagnosis Photodyn Ther. 2017;20: 257-262. [20] SHANKARAPPA S, BURK JT, SUBBAIAH P, et al. White spot lesions in fixed orthodontic treatment: Etiology, pathophysiology, diagnosis, treatment, and future research perspectives. J Orthod Sci. 2024;13:21. [21] BOERSMA JG, VANDERVEEN MH, LAGERWEIJ MD, et al. Caries prevalence measured with QLF after treatment with fixed orthodontic appliances: influencing factors. Caries Res. 2005;39(1):41-47. [22] KANG SM, JEONG SH, KIM HE, et al. Photodiagnosis of White Spot Lesions after Orthodontic Treatment with a Quantitative Light-induced Fluorescence-Digital System: A Pilot Study. Oral Health Prev Dent. 2017; 15(5):483-488. [23] MILLER CC, BURNSIDE G, HIGHAM SM, et al. Quantitative Light-induced Fluorescence-Digital as an oral hygiene evaluation tool to assess plaque accumulation and enamel demineralization in orthodontics. Angle Orthod. 2016;86(6):991-997. [24] PARK SW, KANG SM, LEE HS, et al. Lesion activity assessment of early caries using dye-enhanced quantitative light-induced fluorescence. Sci Rep. 2022;12(1):11848. [25] TATANO R, BERKELS B, EHRLICH EE, et al. Spatial agreement of demineralized areas in quantitative light-induced fluorescence images and digital photographs. Dentomaxillofac Radiol. 2018;47(8):20180099. [26] GOMEZ J. Detection and diagnosis of the early caries lesion. BMC Oral Health. 2015;15 Suppl 1(Suppl 1):S3. [27] 朱瑞文,张道楔.颌骨骨髓炎的诊断与治疗[J].中级医刊,1958(3):31-32. [28] BRONKHORST MA, VANDAMME PA. Osteomyelitis of the jaws. Ned Tijdschr Tandheelkd. 2006;113(6):222-225. [29] 刘向东.30例颌骨骨髓炎临床分析[J].中国中西医结合耳鼻咽喉科杂志,2022, 30(4):283-285. [30] KIM Y, KU JK. Quantitative light-induced fluorescence-guided surgery for medication-related osteomyelitis of the jaw. Photodiagnosis Photodyn Ther. 2024;45:103867. [31] KIM Y, JUNG HI, KIM YK, et al. Histologic analysis of osteonecrosis of the jaw according to the different aspects on quantitative light-induced fluorescence images. Photodiagnosis Photodyn Ther. 2021;34:102212. [32] KU JK, KIM JY, KIM BI, et al. Evaluation of wound dehiscence after vertical bone graft by using quantitative light-induced fluorescence. Photodiagnosis Photodyn Ther. 2021;36:102470. [33] BERNARDI S, KARYGIANNI L, FILIPPI A, et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients’ tongue biofilm. Microbiologyopen. 2020;9(2):e958. [34] MOGILNICKA I, BOGUCKI P, UFNAL M. Microbiota and Malodor-Etiology and Management. Int J Mol Sci. 2020; 21(8):2886. [35] KRESPI YP, KIZHNER V, WILSON KA, et al. Laser tongue debridement for oral malodor-A novel approach to halitosis. Am J Otolaryngol. 2021;42(1):102458. [36] LEE ES, DE JOSSELIN DJE, KIM BI. Detection of dental plaque and its potential pathogenicity using quantitative light-induced fluorescence. J Biophotonics. 2019;12(7): e201800414. [37] LEE ES, YIM HK, LEE HS, et al. Clinical assessment of oral malodor using autofluorescence of tongue coating. Photodiagnosis Photodyn Ther. 2016;13: 323-329. [38] LEE ES, YIM HK, LEE HS, et al. Plaque autofluorescence as potential diagnostic targets for oral malodor. J Biomed Opt. 2016;21(8):85005. [39] KIM YR, KANG HK. Analysis of Quantitative Light-Induced Fluorescence Images for the Assessment of Bacterial Activity and Distribution of Tongue Coating. Healthcare (Basel). 2023;11(2):217. [40] BICAK DA. A Current Approach to Halitosis and Oral Malodor- A Mini Review. Open Dent J. 2018;12:322-330. [41] CAMERON CE. Cracked tooth syndrome. J Am Dent Assoc. 1964;68:405-411. [42] HASAN S, SINGH K, SALATI N. Cracked tooth syndrome: Overview of literature. Int J Appl Basic Med Res. 2015;5(3):164-168. [43] BERMAN LH, KUTTLER S. Fracture necrosis: diagnosis, prognosis assessment, and treatment recommendations. J Endod. 2010;36(3):442-446. [44] EHRMANN EH, TYAS MJ. Cracked tooth syndrome: diagnosis, treatment and correlation between symptoms and post-extraction findings. Aust Dent J. 1990; 35(2):105-112. [45] IMAI K, SHIMADA Y, SADR A, et al. Noninvasive cross-sectional visualization of enamel cracks by optical coherence tomography in vitro. J Endod. 2012;38(9): 1269-1274. [46] KALYAN CP, TELANG LA, NERALI J, et al. Cracked tooth: a report of two cases and role of cone beam computed tomography in diagnosis[. Case Rep Dent. 2012;525364. [47] LYNCH CD, MCCONNELL RJ. The cracked tooth syndrome. J Can Dent Assoc. 2002; 68(8):470-475. [48] SADASIVA K, RAMALINGAM S, RAJARAM K, et al. Cracked tooth syndrome: A report of three cases. J Pharm Bioallied Sci. 2015; 7(Suppl 2):S700-S703. [49] WANG P, YAN XB, LUI DG, et al. Detection of dental root fractures by using cone-beam computed tomography. Dentomaxillofac Radiol. 2011;40(5):290-298. [50] JUN MK, KU HM, KIM E, et al. Detection and Analysis of Enamel Cracks by Quantitative Light-induced Fluorescence Technology. J Endod. 2016;42(3):500-504. [51] RICUCCI D, SIQUEIRA JJ, LOGHIN S, et al. The cracked tooth: histopathologic and histobacteriologic aspects. J Endod. 2015; 41(3):343-352. [52] LEE JI, JEON MJ, DE JONG EJ, et al. Evaluation of the clinical efficacy of quantitative light-induced fluorescence technology in diagnosing cracked teeth. Photodiagnosis Photodyn Ther. 2023;41:103299. [53] SON SA, KIM JH, PARK JK. Clinical applications of a quantitative light-induced fluorescent (QLF) device in the detection and management of cracked teeth: A case repor. Photodiagnosis Photodyn Ther. 2023; 43:103735. [54] 赵亚鹏,牛一山.牙齿磨损的研究现状[J].内蒙古医科大学学报,2016, 38(3): 268-272. [55] KIM SK, LEE HS, PARK SW, et al. Quantitative light-induced fluorescence technology for quantitative evaluation of tooth wear. J Biomed Opt. 2017;22(12):1-6. [56] KIM SK, JUNG HI, KIM BI. Detection of dentin-exposed occlusal/incisal tooth wear using quantitative light-induced fluorescence technology. J Dent. 2020;103: 103505. [57] SHIMADA Y, YOSHIYAMA M, TAGAMI J, et al. Evaluation of dental caries, tooth crack, and age-related changes in tooth structure using optical coherence tomography. Jpn Dent Sci Rev. 2020;56(1):109-118. [58] WADA I, SHIMADA Y, IKEDA M, et al. Clinical assessment of non carious cervical lesion using swept-source optical coherence tomography. J Biophotonics. 2015;8(10):846-854. [59] ALGHILAN MA, LIPPERT F, PLATT JA, et al. In vitro longitudinal evaluation of enamel wear by cross-polarization optical coherence tomography. Dent Mater. 2019;35(10): 1464-1470. [60] NAM SM, KU HM, LEE ES, et al. Detection of pit and fissure sealant microleakage using quantitative light-induced fluorescence technology: an in vitro study. Sci Rep. 2024; 14(1):9066. |
| [1] | Kang Zirui, Wu Yang, Song Hailong, Yang Qiaoyun, Zang Lixiang, Xu Dongliang. Finite element analysis of implants with different crown-to-implant ratios under different bone conditions [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 319-328. |
| [2] | Zhang Qiya, Tong Yixiang, Yang Shijiao, Zhang Yumeng, Deng Ling, Wu Wei, Xie Yao, Liao Jian, Mao Ling. In vitro biocompatibility of graded glass infiltrated ultra-translucent zirconia [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 443-450. |
| [3] | Wang Zhuo, Sun Panpan, Cheng Huanzhi, Cao Tingting. Application of chitosan in repair and regeneration of oral hard and soft tissues [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 459-468. |
| [4] | Jin Hui, Chen Hui. Preparation and mechanical properties of zirconia ceramic composites for stomatology [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(14): 3548-3556. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||