Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (15): 3227-3234.doi: 10.12307/2025.177
Previous Articles Next Articles
Applications and prospects of tissue clearing technology in field of orthopedics
Gao Yang1, 2, Gao Yuan2, Ma Bingjiang1, 2, Yue Hui1, Shi Yongxin2, 3
- 1Mudanjiang Medical College, Mudanjiang 157011, Heilongjiang Province, China; 2Affiliated South China Hospital, Shenzhen University, Shenzhen 518111, Guangdong Province, China; 3Shenzhen Guangming District People’s Hospital, Shenzhen 518106, Guangdong Province, China
-
Received:2024-04-01Accepted:2024-05-14Online:2025-05-28Published:2024-11-05 -
Contact:Shi Yongxin, MD, Associate chief physician, Affiliated South China Hospital, Shenzhen University, Shenzhen 518111, Guangdong Province, China; Shenzhen Guangming District People’s Hospital, Shenzhen 518106, Guangdong Province, China -
About author:Gao Yang, Master candidate, Mudanjiang Medical College, Mudanjiang 157011, Heilongjiang Province, China; Affiliated South China Hospital, Shenzhen University, Shenzhen 518111, Guangdong Province, China -
Supported by:Shenzhen Guangming District Soft Science Research Project, No. 2021R01026 (to SYX); Doctoral Research Initiation Fund of Mudanjiang Medical College, No. 2021-MYBSKY-019 (to YH)
CLC Number:
Cite this article
Gao Yang, Gao Yuan, Ma Bingjiang, Yue Hui, Shi Yongxin. Applications and prospects of tissue clearing technology in field of orthopedics[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(15): 3227-3234.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

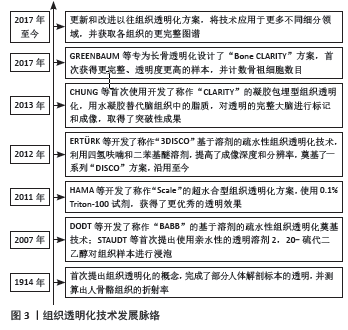
2.1 组织透明化技术概述及原理 对于生物组织结构和病理学变化的理解最初来自于解剖,显微镜问世后,才得以从细胞层面研究组织器官的形态学和病理学,与此同时切片技术应运而生。但对组织进行切片后,在显微镜下观察平面形态,会破坏原有的三维结构,例如神经或血管走行的立体结构、神经元之间的突触连接等,这些整体性更强的组织结构不能完整被看到,对人们理解生理、病理过程产生了阻碍,因此三维立体的成像技术成为目前以及未来的研究方向[6]。 目前三维的成像技术根据是否切片分为了两大类,即切片成像和非切片成像。切片三维成像技术也分为两类,第一类是借助计算机对所成的像进行重建,另一类是对组织表面进行成像再层层去除后成像,最后进行重建。由于其成像原理,此类技术最明显的不足就是对组织进行了切割,不能完整地保留组织。而非切片三维成像技术中,最为人们所熟知的是CT、MRI,还有临床精准医疗不可或缺的核医学技术等,这些成熟技术都能够快速地对大型组织器官进行成像,也不会对组织结构产生破坏。但其缺点在于难以达到高清单细胞分辨率水平,也难以追踪细胞携带的荧光信号,因而此类技术在细胞研究领域表现出了瓶颈[7]。 近年来,光学显微成像技术同时取得了突破,例如共聚焦显微镜、双光子显微镜、光片显微镜等的研发[8-9],为人们提供了更多成像组织、细胞的手段。然而传统组织切片技术的仍存在局限性,透明化技术应运而生。目前已有多种针对不同组织的透明化方案,根据透明溶剂的类型,分为了2个大类,分别是基于溶剂的疏水性组织透明化和基于水的亲水性组织透明化,基于水的亲水性方案又包括了3个类型,分别为单纯浸润型组织透明化、超水合型组织透明化、凝胶包埋型组织透明化[10-11]。每种技术都有其不同的优势和缺点,包括所需多少时间来清除组织、是否兼容免疫标记、是否能够保留荧光蛋白、是否对组织体积造成了改变、是否进行了电泳或凝胶嵌入,如何选择这些技术取决于具体的研究目的。 组织透明化技术最早被开发可追溯至1914年SPALTEHOLZ[12]首次将标本透明化处理,获得了清晰的三维解剖图像,但当时使用的强氧化性的溶剂使得组织标本的外层被破坏,同时受限于当时的成像技术,直到2000年前后才重新被重视,后续的研究也主要集中在大脑和神经科学领域[13-17];在2016年PAN等[18]改进并提出了uDISCO方案,并且用于长骨透明化后,也开拓了组织透明化技术在骨科学领域的更多研究[19-26]。组织透明化技术发展历程见图3。"

组织透明化的基本步骤主要包含:①灌注和固定:在透明化之前,通常需要先对组织进行固定,以保持其结构和细胞成分。灌注可以使用PBS做心脏灌注替代血液,固定通常使用甲醛、戊二醛或其他固定剂。②脱色:组织通常包含丰富的色素,例如血色素、黑色素、脂褐素等,使用强氧化剂过氧化氢能快速脱去这些色素,或者使用十二烷基硫酸钠进行脱色。③脱水:使用基于溶剂的疏水性组织透明化时需要给组织进行脱水,通常通过一系列浓度递增的乙醇或丙酮溶液来完成。④脂质去除:为了减少光的散射,需要去除组织中的脂质。通常使用有机溶剂(如二氯甲烷、苯甲醇等)或通过使用含有洗涤剂的水溶液来实现。⑤透明化:去除脂质后,组织被置于一种或多种透明化试剂中,这些试剂能够使组织变得透明,从而允许光穿透。透明化试剂的选择取决于所使用的透明化技术,可以是有机溶剂、高折射率的水溶液,或者是其他特定的化学混合物。⑥折射率匹配:将组织的折射率与周围介质(如显微镜的浸油或封盖液)匹配,这可能涉及到使用特定折射率的透明化试剂或调整透明化试剂的浓度。⑦免疫标记(可选):如果需要对特定的蛋白质或细胞类型进行标记,可以在透明化之前或之后进行免疫荧光标记。⑧成像:透明化处理后的组织可以使用各种显微镜技术进行成像,如共聚焦显微镜、双光子显微镜或光片荧光显微镜。⑨后续处理(可选):根据成像数据,可能需要进行一些后处理步骤,如图像堆叠、重建或分析。 骨组织的显著特性在于其含有高折射率的羟基磷灰石和血红蛋白,而脂质含量较少,羟基磷灰石因其光学特性,能够引起光的反射,而血红蛋白的存在则对组织的透光性产生显著影响[27]。即便在使用PBS进行全身灌注处理后,仍有许多血红蛋白残留影响透明效果。因此,在对骨组织进行透明化处理的过程中,必须特别关注脱色效果的优化,并考虑引入脱钙步骤。乙二胺四乙酸作为一种常用的脱钙剂,能够有效促进骨组织的脱钙过程,并且适用于全身灌注后的进一步处理。然而,乙二胺四乙酸的使用可能会引起组织结构的收缩,需要研究人员在处理不同样本的过程中充分考虑[27-28]。 具体的步骤可能会根据具体的透明化方案和研究目的有所不同。例如,一些基于水的透明化技术可能不需要使用有机溶剂进行脱水,而一些技术可能包括额外的步骤,比如电泳或凝胶嵌入,以进一步改善组织的透明化效果[16,21-22,29-33]。见表1。 "


2.2 组织透明化技术应用于骨结构研究 目前应用于骨结构分析的技术主要有X射线、CT、MRI、骨密度测量、骨组织切片染色等,这些技术都在骨结构分析中发挥着重要的作用。X射线片、骨组织切片能够从二维平面来分析骨结构,而CT、MRI的技术能够分析骨组织的立体结构。但传统的硬组织切片由于其厚度限制,通常只能进行表面的观察,立体的影像学技术难以达到单细胞分辨率的层面;新型硬组织切片技术对细胞结构损伤更小,成像分辨率也更高,在骨肿瘤、骨转移癌等标本上具有独特优势[45]。但是如果保留完整结构的同时高分辨率地成像,并且兼容各种免疫荧光、特殊染色,这些方法仍然存在各自的局限性。而对骨组织应用透明化技术,除了保留三维结构,深度成像以外,能够保留组织自体荧光的同时,更便于研究人员对完整样本进行免疫染色和多标记处理,将免疫染色技术结合使用,能够实现特对特定蛋白质或标记物的定位和分析。 2017年LI等[46]开发了Ce3D的透明化方案,实现了小鼠股骨骨膜血管的可视化;2019年CAI等[47]开发了vDISCO新型全身免疫标记方法,研究人员开发了一种高压心脏灌注技术,以实现纳米抗体在小鼠全身的均匀分布,并且显著增强了荧光蛋白的信号,进一步提高了成像质量,结果发现了颅骨骨髓和大脑硬膜之间的短血管连接,这些短血管连接在脑卒中后作为免疫细胞的通道,揭示了大脑和脊髓中新的免疫细胞流动路线,能够为研究人员提供一种强大的工具,具有实用的前景。2023年MOATTI等[48]优化了BoneClear方案,实现了猪内耳耳蜗和成年非洲绿猴耳蜗的透明化,利用共聚显微镜和光片显微镜对已经透明处理的耳蜗进行3D成像,通过开源软件对抗体标记的毛细胞进行计数。但其透明时间长达27-33 d, 仍需要继续改进方案以及透明条件来缩短试剂处理的时间。2024年THAI等改进了 iDISCO/iDISCO+透明化协议,实现对完整的小鼠股骨和下颌骨中高分辨率神经元结构的成像[34-35],使用针对蛋白基因产物9.5、降钙素基因相关肽和酪氨酸羟化酶的抗体进行免疫标记,追踪并揭示了这些神经纤维在骨骼内部的分布,探索了神经纤维与血管、骨髓腔和牙髓等骨组织的相互作用,为研究神经如何调节骨代谢和疼痛传递提供了新的视角,为未来可能的临床应用奠定了基础,例如在骨折愈合、骨重塑和牙科治疗中,通过了解神经分布和功能,可以设计更有效的治疗方案[49]。2024年YI等[50]开发了名为“透明包埋溶剂体系”的透明化方案,这项方法与传统相比,引入了一个“透明嵌入”的概念,它把组织在透明化的过程中,均匀地嵌入到一个固定的透明介质中,这种固定是利用紫外线照射特定的化学试剂BB-BED引发的聚合反应实现的,从而能获得一个坚固的有机凝胶,这种方法提高了样本的机械强度,传统方法可能会导致样本变脆弱和变形,而这样的透明嵌入可能提供了一种透明硬组织和骨组织的更优解。透明包埋溶剂体系结合共聚焦显微镜成像,实现了追踪从外周神经系统到中枢神经系统的单个神经轴突的投影映射,这在啮齿动物模型中还是首次实现。 可以对骨小梁结构、成骨细胞、破骨细胞、骨髓、血管等进行特定的免疫标记,并结合成像技术,能够直接观察相应细胞的分布、数量、形态和功能,以及各类细胞成分的互作关系[51]。在实际研究中,对模型进行不同的处理,并且通过骨组织透明化技术成像,能够直观地观察到骨结构、骨细胞、周围神经血管的改变,提供高质量的三维图像数据。这些数据再通过结合计算机数据分析和模型计算,可以对病理改变进行定量分析、参数的计算等,从而可能实现更全面地量化骨组织在不同疾病中的变化特征,辅助病理精准诊断。 2.3 组织透明化技术应用于骨代谢研究 骨组织中的骨形成和骨吸收两个过程的动态平衡调节被称为骨代谢,是维持骨骼结构和功能重要的过程,受多种因素调控,比如营养、激素调节、外力、细胞通路调控等[52]。骨髓中的细胞,如骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),参与骨代谢过程,影响骨的形成和吸收。骨髓移植对某些骨代谢疾病有治疗作用,如通过移植特定的干细胞来治疗骨质疏松症[53-54]。见表2。"

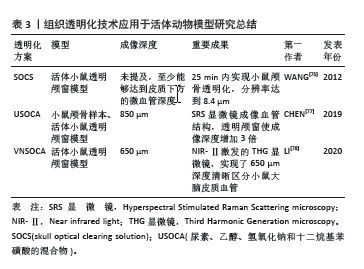
2016年PAN等[18]开发了uDISCO的透明化方案,突破了透明化大型样本的难题,能够实现完整大鼠、完整小鼠,各脏器的透明化。在透明化完整小鼠后,能够以单细胞分辨率检测整个小鼠体内注射移植的BMSCs,结果展示,大部分通过静脉注射的BMSCs被停截在肝、肺、脾脏中,以及在胃肠道和骨髓观察到少量散在的BMSCs,突破了以往很难对BMSCs全身定位的难题,可能有助于研究人员深入探索它们对于骨移植、造血和免疫的功能研究。因此uDISCO方案展示了在立体的单细胞分辨率层面,研究移植细胞在整个宿主体内的密度和分布的可行性。2017年GREENBAUM等[19]开发了名为BoneCLARITY骨组织透明化方案,使用Bone CLARITY和定制的光片荧光显微镜,研究人员在成年转基因小鼠的胫骨、股骨和脊椎中检测了成骨祖细胞的内源性荧光,并且通过半自动算法,实现了在完整骨髓中对成骨祖细胞的清晰成像和精确计数,提供了可视化稀有细胞分布的新平台,还可能促进转化研究,通过分析新骨调节药物对祖细胞群体的影响,提供对药物疗效和安全性的见解,但Bone CLARITY方法在当前仍有局限之处,它的处理时间较长,分析大数据较为复杂,但未来有望通过改进抗体染色、减少处理时间以及提高大数据获取和分析的技术来改进该方法。2023年BISWAS等[25] 利用新型骨组织透明化技术在高分辨率光片显微镜下成像,首次全面揭示了淋巴循环系统存在于正常人类和小鼠骨骼中。在基因毒性应激的情况下,发现骨组织中淋巴管大量增生,驱动其增生的信号通路是血管内皮生长因子C/血管内皮生长因子受体3和基因毒性应激诱导产生的白细胞介素6。同时,该研究成果还进一步发现,在淋巴管生成的过程中,增殖的淋巴内皮细胞分泌的CXCL12因子对骨髓造血功能和骨质再生至关重要。这些结果对骨疾病的新治疗方法的开发具有重要意义。2023年UTAGAWA等[26]在DISCO系列方案基础上进行改进,开发了新的有机溶剂透明法Osteo-DISCO,能够缩短透明化小鼠骨骼的孵育时间,保存荧光信号长达18个月;通过观察骨骼内神经血管网络的3D结构,辨认特定神经进入骨骼的入口,并进一步研究了由外科手术损伤导致的骨内感觉神经数量减少,感觉神经释放的降钙素基因相关肽能增强成骨并抑制手术损伤神经引起的骨丢失,表明骨内感觉神经可以调节骨稳态。 总之,骨组织透明化技术为研究骨代谢提供了一种非常有价值的工具,直观地揭示骨组织的结构、细胞活性和相互关系,对于深入理解骨的代谢机制具有重要意义。 2.4 组织透明化技术应用于骨肿瘤研究 骨组织中的良性或恶性肿瘤较多发于儿童和青少年,在临床中对其诊断常通过病史、影像学检查和组织病理学分析等手段,而组织病理学是骨肿瘤诊断的金标准。组织病理学诊断通常通过在显微镜下观察组织学特征、免疫组化检测标志物、分子遗传学分析来鉴别诊断肿瘤组织的类型[55-56]。 2019年PAN等[57]利用vDISCO透明化技术,利用纳米体增强了荧光信号,使完整小鼠包括骨组织透明化,并结合计算机深度学习技术,开发了一种算法称为DeepMACT,能够快速且准确地在细胞水平自动检测和分析癌细胞的转移,也能够探测全身靶向药物的功效,可用于进行癌症转移和治疗策略的广泛研究。 此外,也可以参考其他肿瘤的研究方案来应用于骨肿瘤的研究中。例如,2016年LLOYD-LEWIS等[58]对乳腺肿瘤进行了免疫荧光的标记,展示了几种不同透明化技术处理后,共聚焦成像的人内皮生长因子受体2的荧光信号,利用类似的研究方法,也可以研究骨肿瘤的靶标在肿瘤发生发展过程中的3D定位,这种完整的肿瘤可视化,有助于理解骨肿瘤以及肿瘤微环境之间的复杂相互作用关系。因此通过骨组织透明化技术可以做到标记特定靶标,甚至全程追踪量化其表达,进一步研究骨肿瘤的发生发展机制。 2.5 组织透明化技术应用于骨折研究 骨折是常见的骨损伤,通常由于外力作用或疾病导致。骨折愈合过程复杂,涉及多种细胞类型和生物分子的相互作用。因此,深入研究骨折的发生机制和病理变化对于预防和治疗具有重要意义[59-60]。通过骨组织透明化技术处理样本,骨骼内部微观结构得以显现,从而进一步研究病理性骨折的发生机制以及相关的病理改变。 2022年黄韬[61]的一项研究对比了两种透明化方法:BoneClear和PEGASOS,用于研究淫羊藿在骨折愈合中的疗效,用光片显微镜成像,全面直观地对股骨骨折区域的血管、神经分布进行研究。结果显示BoneClear的透明效果更好,同时该方法对抗体渗透性及荧光的保护能力较好,实验组术后2周显示更多密集分布的新生神经和成骨细胞,而血管分布相近;结合荧光标记显示术后4周实验组神经、血管及成骨细胞分布更广、荧光强度更高,尤其在骨折线两端及骨皮质走行处,提供了一种利用组织透明化研究骨折的案例与可能。 目前组织透明化技术应用于骨折的研究较少。但未来通过观察透明化处理后的骨骼样本,可以对已经病变的骨进行分析以建立更精准的预测病理性骨折模型,也可以用于追踪和分析骨折部位的骨细胞活动、脉管系统的改变以及骨骼重建的过程,有利于研究人员更深入地了解不同原因骨折的发生发展机制。 2.6 组织透明化应用于骨感染研究 骨感染通常与感染性骨缺损共同发生,周围软组织血运被破坏,细菌积聚在缺损部位,导致骨不连,影响临床预后[62-63]。 目前应用骨组织透明化技术在骨感染方面的研究暂未见报道,但可以参考和借鉴其他领域的研究。例如,2019年MATSUMOTO等[64]利用携带mCherry荧光蛋白基因的腺相关病毒(AAV-PHP.eB)对8周龄小鼠进行全脑感染,通过CUBIC组织透明化技术对小鼠大脑进行处理,并结合成像系统对感染后的细胞进行成像和计数;通过 CUBIC-Atlas工具的分析,揭示了大脑皮质和海马体等区域的细胞更易被AAV感染。2023年ZHAN等[65]通过结合组织透明化技术和逆行跨突触病毒示踪技术,评估了小鼠视神经损伤后视网膜神经节细胞的视网膜接受区域的变化,研究发现视神经损伤可选择性地改变来自视网膜神经节细胞的投射,证实了组织透明化技术与逆行跨突触病毒示踪技术结合使用,可以客观全面地评估小鼠视神经损伤后视网膜接受区域的变化。在骨科学的研究中,同样可以应用特定的免疫染色标记或是病毒基因编辑技术,在骨骼样本中观察和定位感染的病原体,帮助确定感染的范围、深度,以及对骨组织的侵袭程度;也可以检测骨感染相关的细胞情况,例如中性粒细胞、淋巴细胞、巨噬细胞等,观察炎性细胞的分布,量化评估炎症反应的强度和类型。组织透明化技术能直观地评价感染对骨组织的破坏程度,以及不同治疗措施对于骨修复的促进作用;结合荧光探针等技术,可以研究病原体与免疫细胞之间的相互作 用[66]。因此骨组织透明化技术应用于骨感染研究未来还有许多可探索的课题。 2.7 组织透明化技术应用于骨移植或骨植入物研究 骨移植是一种常见的骨科手术,通常用于替代或修复缺损的骨组织,用于替代的材料主要有3类,即自体骨、同种异体骨、合成材料,促进骨折愈合、骨缺损修复或改善骨结构的稳定性[67-69]。而组织透明化技术为骨移植相关的研究提供了一个强有力的平台。 2018年赵瑚团队开发的基于有机溶剂的PEGASOS透明化方案首次实现了几乎所有类型组织的透明,包括牙齿、长骨、脾脏、肝脏和心脏,使用聚乙二醇相关溶剂作为透明化试剂,提高了对内源性荧光的保存效果[20]。2019年赵瑚团队基于PEGASOS透明方案与转基因小鼠以及免疫标记技术相结合,首次实现了对植入物-组织界面的三维可视化,详细观察了钛和不锈钢植入物与骨组织界面的血管生成和成骨过程。结果表明,尽管两种植入物均能支持血管生成,但只有钛植入物能够促进成骨和骨整合。此外,通过使用钙黄绿素标记技术,研究还揭示了两种植入物表面不同的钙沉积活性,该研究展示了PEGASOS方法在骨植入物研究中的应用潜力[70]。 2.8 组织透明化技术应用于活体动物模型研究 活体动物疾病模型在骨科学研究中扮演着至关重要的角色,它们能够提供疾病发展过程中骨组织病理改变的直接证据,能够在一个接近自然生理状态的环境中观察和量化疾病或药物、组织工程修复支架等的影响,还有助于评估潜在治疗方法的安全性和有效性[71-72];另一个重要优势是它们能够模拟复杂的生物交互作用,这些交互作用在体外实验中很难复制。例如,它们可以揭示骨组织与免疫系统、神经系统以及其他器官系统的相互作用,这些相互作用在疾病的发生和进展中起着关键作用[73-74]。而骨组织透明化技术能够提供一种非侵入性的光学透明化方法,能够适用于活体动物模型。 SOCS(skull optical clearing solution)系列方案在2012年由WANG等[75]提出,利用SOCS溶剂直接涂抹于小鼠颅骨(SOCS由十二烷基硫酸钠、弱碱性物质、EDTA、二甲基亚砜、山梨醇、酒精和葡萄糖等生物相容性成分组成),实现了对小鼠颅骨的非侵入性透明化处理,在SOCS作用下,颅骨在25 min内变得透明,经过SOCS处理的颅骨能够清晰显示皮质微血管结构,最小分辨率直径接近于直接暴露的皮质微血管,但是没有对这种方案进行详尽的安全性和重复性测试。2018年ZHANG等[76]开发了称作USOCA(尿素、乙醇、氢氧化钠和十二烷基苯磺酸的混合物)的试剂,能够快速(15 min)在活体小鼠上实现透明颅窗,可用于2-8个月大的小鼠,无需进行开颅手术,并可重复建立,结合多种光学成像技术,如激光散斑对比成像、高光谱成像和双光子激光扫描显微镜,监测微胶质细胞动态和胶质纤维酸性蛋白的表达,以及测试USOCA的代谢毒性,证实了这种光学透明颅窗的安全性,突破了以往观察颅脑时,需要去除骨质可能导致病理生理变化的局限。2019年CHEN等[77]在USOCA试剂基础上利用受激拉曼散射显微镜检测了颅骨的主要成分,并检测颅骨中的成分在透明化过程中的变化,揭示了骨透明化技术的化学机制,同时也应用此技术通过透明颅骨窗对小鼠脉管系统进行了三光子激发成像,展现了皮质下的血管系统,其成像深 度> 850 μm,该光学透明颅骨窗技术提供了穿透骨组织活体成像的可能性。2020年LI等[78]开发了VNSOCA,其关键改进在于使用了重水(D2O,即氘氧化物)替代了普通水,这种替换使得VNSOCA在可见光至近红外第二窗口(NIR-Ⅱ)范围内具有更高的透明度。尽管这些文献并不是研究颅骨本身,但是要透过颅骨观察到颅内的血管系统,实现安全快速的颅骨透明是必要条件,未来研究人员也可以将这些方法用于其他疾病的不同动物模型上,例如卒中模型或其他颅脑疾病模型[79]。见表3。"
| [1] BUCK DW, DUMANIAN GA. Bone biology and physiology: Part I. The fundamentals. Plast Reconstr Surg. 2012;129(6):1314-1320. [2] FLORENCIO-SILVA R, SASSO GR DA S, SASSO-CERRI E, et al. Biology of Bone Tissue: Structure, Function, and Factors That Influence Bone Cells. Biomed Res Int. 2015;2015:421746. [3] CHAVASSIEUX P, CHAPURLAT R. Interest of Bone Histomorphometry in Bone Pathophysiology Investigation: Foundation, Present, and Future. Front Endocrinol (Lausanne). 2022;13:907914. [4] AY S, ME D, EA G, et al. Recent progress in tissue optical clearing for spectroscopic application. Spectrochim Acta A Mol Biomol Spectrosc. 2018; 197:216-229. [5] ZHANG D, CLEVELAND AH, KRIMITZA E, et al. Spatial analysis of tissue immunity and vascularity by light sheet fluorescence microscopy. Nat Protoc. 2024;19(4):1053-1082. [6] TAINAKA K, KUNO A, KUBOTA SI, et al. Chemical Principles in Tissue Clearing and Staining Protocols for Whole-Body Cell Profiling. Annu Rev Cell Dev Biol. 2016;32:713-741. [7] 李茜, 吴科锋. 疏水性组织透明化技术的研究进展[J]. 临床医学研究与实践,2022,7(14):191-195. [8] SMITH AC, WATAMANIUK L, ROGERS TL. Use of laser-scanning confocal microscopy in the detection of diagenesis in bone. J Forensic Sci. 2022; 67(1):92-101. [9] FENG F, MAO H, WANG A, et al. Two-Photon Fluorescence Imaging. Adv Exp Med Biol. 2021;3233:45-61. [10] RICHARDSON DS, LICHTMAN JW. Clarifying Tissue Clearing. Cell. 2015; 162(2):246-257. [11] 吴昊妍, 詹琰静, 张士文. 水性组织透明化技术的研究进展与应用[J]. 北京生物医学工程,2021,40(3):318-323+329. [12] SPALTEHOLZ W. Über das Durchsichtigmachen von menschlichen und tierischen Präparaten und seine theoretischen Bedingungen: nebst Anhang: Über Knochenfärbung. Verlag Von S Hirzel. 1914. [13] STAUDT T, LANG MC, MEDDA R, et al. 2,2’-thiodiethanol: a new water soluble mounting medium for high resolution optical microscopy. Microsc Res Tech. 2007;70(1):1-9. [14] DODT HU, LEISCHNER U, SCHIERLOH A, et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat Methods. 2007;4(4):331-336. [15] HAMA H, KUROKAWA H, KAWANO H, et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat Neurosci. 2011;14(11):1481-1488. [16] ERTÜRK A, BECKER K, JÄHRLING N, et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nat Protoc. 2012;7(11):1983-1995. [17] CHUNG K, WALLACE J, KIM SY, et al. Structural and molecular interrogation of intact biological systems. Nature. 2013;497(7449):332-337. [18] PAN C, CAI R, QUACQUARELLI FP, et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 2016;13(10):859-867. [19] GREENBAUM A, CHAN KY, DOBREVA T, et al. Bone CLARITY: Clearing, imaging, and computational analysis of osteoprogenitors within intact bone marrow. Sci Transl Med. 2017;9(387):eaah6518. [20] JING D, ZHANG S, LUO W, et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Res. 2018;28(8):803-818. [21] QI Y, YU T, XU J, et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 2019;5(1):eaau8355. [22] TREWEEK JB, BERES A, JOHNSON N, et al. Phenotyping Intact Mouse Bones Using Bone CLARITY. Exp Mol Med. 2021;2230:217-230. [23] XU C. Optical clearing of the mouse skull. Light Sci Appl. 2022;11(1):284. [24] KARTHIKEYAN S, ASAKURA Y, VERMA M, et al. Tissue Clearing and Confocal Microscopic Imaging for Skeletal Muscle. Methods Mol Biol. 2023;2640: 453-462. [25] BISWAS L, CHEN J, DE ANGELIS J, et al. Lymphatic vessels in bone support regeneration after injury. Cell. 2023;186(2):382-397.e24. [26] UTAGAWA K, SHIN T, YAMADA H, et al. Three-dimensional visualization of neural networks inside bone by Osteo-DISCO protocol and alteration of bone remodeling by surgical nerve ablation. Sci Rep. 2023;13(1):4674. [27] BRÉS EF, BARRY JC, HUTCHISON JL. High-resolution electron microscope and computed images of human tooth enamel crystals. J Ultrastruct Res. 1985;90(3):261-274. [28] JING D, YI Y, LUO W, et al. Tissue Clearing and Its Application to Bone and Dental Tissues. J Dent Res. 2019;98(6):621-631. [29] KE M-T, FUJIMOTO S, IMAI T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 2013;16(8):1154-1161. [30] WOO J, LEE M, SEO JM, et al. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Exp Mol Med. 2016;48(12):e274. [31] AFFATICATI P, SIMION M, DE JOB E, et al. zPACT: Tissue Clearing and Immunohistochemistry on Juvenile Zebrafish Brain. Bio Protoc. 2017;7(23):e2636. [32] MURAKAMI TC, MANO T, SAIKAWA S, et al. A three-dimensional single-cell-resolution whole-brain atlas using CUBIC-X expansion microscopy and tissue clearing. Nat Neurosci. 2018;21(4):625-637. [33] 李娜, 马静, 程妍. Passive-CLARITY法透明化小鼠脑及鼠脑组织的荧光检测[J]. 华西药学杂志,2021,36(6):625-627. [34] RENIER N, WU Z, SIMON DJ, et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 2014;159(4): 896-910. [35] PERIN P, VOIGT FF, BETHGE P, et al. iDISCO+ for the Study of Neuroimmune Architecture of the Rat Auditory Brainstem. Front Neuroanat. 2019;13:15. [36] ACAR M, KOCHERLAKOTA KS, MURPHY MM, et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 2015;526(7571):126-130. [37] JACOB L, BOISSERAND LSB, GERALDO LHM, et al. Anatomy and function of the vertebral column lymphatic network in mice. Nat Commun. 2019; 10(1):4594. [38] CAI R, KOLABAS ZI, PAN C, et al. Whole-mouse clearing and imaging at the cellular level with vDISCO. Nat Protoc. 2023;18(4):1197-1242. [39] TSAI PS, KAUFHOLD JP, BLINDER P, et al. Correlations of neuronal and microvascular densities in murine cortex revealed by direct counting and colocalization of nuclei and vessels. J Neurosci. 2009;29(46):14553-14570. [40] HOU B, ZHANG D, ZHAO S, et al. Scalable and DiI-compatible optical clearance of the mammalian brain. Front Neuroanat. 2015;9:19. [41] SUSAKI EA, TAINAKA K, PERRIN D, et al. Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis. Cell. 2014;157(3):726-739. [42] HAMA H, HIOKI H, NAMIKI K, et al. ScaleS: an optical clearing palette for biological imaging. Nat Neurosci. 2015;18(10):1518-1529. [43] CHUNG K, DEISSEROTH K. CLARITY for mapping the nervous system. Nat Methods. 2013;10(6):508-513. [44] TREWEEK JB, CHAN KY, FLYTZANIS NC, et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nat Protoc. 2015;10(11):1860-1896. [45] 殷俊辉, 周隽, 陈逸炜, 等. 新型硬组织切片技术在临床骨与骨髓病理诊断中的应用价值[J]. 中华医学杂志,2022,102(45):3617-3623. [46] LI W, GERMAIN RN, GERNER MY. Multiplex, quantitative cellular analysis in large tissue volumes with clearing-enhanced 3D microscopy (Ce3D). Proc Natl Acad Sci U S A. 2017;114(35):E7321-E7330. [47] CAI R, PAN C, GHASEMIGHARAGOZ A, et al. Panoptic imaging of transparent mice reveals whole-body neuronal projections and skull-meninges connections. Nat Neurosci. 2019;22(2):317-327. [48] MOATTI A, CAI Y, LI C, et al. Tissue clearing and three-dimensional imaging of the whole cochlea and vestibular system from multiple large-animal models. STAR Protoc. 2023;4(2):102220. [49] THAI J, FULLER-JACKSON J-P, IVANUSIC JJ. Using tissue clearing and light sheet fluorescence microscopy for the three-dimensional analysis of sensory and sympathetic nerve endings that innervate bone and dental tissue of mice. J Comp Neurol. 2024;532(1):e25582. [50] YI Y, LI Y, ZHANG S, et al. Mapping of individual sensory nerve axons from digits to spinal cord with the transparent embedding solvent system. Cell Res. 2024;34(2):124-139. [51] GORELASHVILI MG, HEINZE KG, STEGNER D. Optical Clearing of Murine Bones to Study Megakaryocytes in Intact Bone Marrow Using Light-Sheet Fluorescence Microscopy. Methods Mol Biol. 2018;1812:233-253. [52] 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊疗指南(2022)[J]. 中国全科医学,2023,26(14):1671-1691. [53] 陈光华, 黄贵芝, 林颢, 等. 骨髓间充质干细胞移植对去卵巢骨质疏松大鼠骨密度的影响[J]. 中国组织工程研究,2017,21(1):49-53. [54] 冯皓, 张斌, 王建平. 骨髓间充质干细胞移植可提高骨质疏松大鼠骨代谢水平[J]. 中国组织工程研究,2023,27(1):72-75. [55] CHOI JH, RO JY. The 2020 WHO Classification of Tumors of Bone: An Updated Review. Adv Anat Pathol. 2021;28(3):119-138. [56] FERGUSON JL, TURNER SP. Bone Cancer: Diagnosis and Treatment Principles. Am Fam Physician. 2018;98(4):205-213. [57] PAN C, SCHOPPE O, PARRA-DAMAS A, et al. Deep Learning Reveals Cancer Metastasis and Therapeutic Antibody Targeting in the Entire Body. Cell. 2019;179(7):1661-1676.e19. [58] LLOYD-LEWIS B, DAVIS FM, HARRIS OB, et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Res. 2016;18(1):127. [59] CAMAL RUGGIERI IN, CÍCERO AM, ISSA JPM, et al. Bone fracture healing: perspectives according to molecular basis. J Bone Miner Metab. 2021;39(3):311-331. [60] 来钰栋, 蒋振松. 骨质疏松性骨折的预防与临床治疗进展[J]. 山东第一医科大学(山东省医学科学院)学报,2023,44(1):67-73. [61] 黄韬. 淫羊藿苷在骨折愈合中的疗效及机制研究[D]. 汕头:汕头大学, 2022. [62] 王伟, 李文波, 张亚强, 等. 感染性骨缺损的诊断与临床治疗进展[J]. 中国骨与关节损伤杂志,2022,37(3):331-334. [63] MORIARTY TF, METSEMAKERS WJ, MORGENSTERN M, et al. Fracture-related infection. Nat Rev Dis Primers. 2022;8(1):67. [64] MATSUMOTO K, MITANI TT, HORIGUCHI SA, et al. Advanced CUBIC tissue clearing for whole-organ cell profiling. Nat Protoc. 2019;14(12):3506-3537. [65] ZHAN ZY, HUANG YR, ZHAO LW, et al. Use of a tissue clearing technique combined with retrograde trans-synaptic viral tracing to evaluate changes in mouse retinorecipient brain regions following optic nerve crush. Neural Regen Res. 2023;18(4):913-921. [66] HOFMANN J, KEPPLER SJ. Tissue clearing and 3D imaging - putting immune cells into context. J Cell Sci. 2021;134(15):jcs258494. [67] 宋会平, 王志强. 骨移植的过去、现在和未来[J]. 中国修复重建外科杂志,2009,23(5):513-516. [68] 袁冰, 韦卓. 骨缺损修复的研究进展[J]. 生物骨科材料与临床研究, 2014,11(3):38-41. [69] 宁钰, 赵红斌. 骨缺损修复方法的研究进展[J]. 世界最新医学信息文摘, 2019,19(50):115+117. [70] YI Y, MEN Y, JING D, et al. 3-dimensional visualization of implant-tissue interface with the polyethylene glycol associated solvent system tissue clearing method. Cell Prolif. 2019;52(3):e12578. [71] 赵延洁. 适用于活体皮层成像的光透明颅窗研究[D]. 武汉:华中科技大学, 2019. [72] 李东宇, 俞婷婷, 朱京谭, 等. 活体颅骨光透明方法及应用(特邀)[J]. 光子学报,2022,51(8):252-268. [73] 田彬, 刘长松, 程为. 骨质疏松兔颅骨骨缺损模型的建立[J]. 口腔颌面修复学杂志,2023,24(1):20-24, 37. [74] 张雅雯, 朱光旭, 李雅喆, 等. 一种改良大鼠颅骨缺损动物模型的构建及应用[J]. 实验动物与比较医学,2020,40(3):227-231. [75] WANG J, ZHANG Y, XU TH, et al. An innovative transparent cranial window based on skull optical clearing. Laser Phys Lett. 2012;9(6):469. [76] ZHANG C, FENG W, ZHAO Y, et al. A large, switchable optical clearing skull window for cerebrovascular imaging. Theranostics. 2018;8(10):2696-2708. [77] CHEN Y, LIU S, LIU H, et al. Coherent Raman Scattering Unravelling Mechanisms Underlying Skull Optical Clearing for Through-Skull Brain Imaging. Anal Chem. 2019;91(15):9371-9375. [78] LI DY, ZHENG Z, YU TT, et al. Visible-near infrared-II skull optical clearing window for in vivo cortical vasculature imaging and targeted manipulation. J Biophotonics. 2020;13(10):e202000142. [79] 宣昂. 组织光透明结合光学成像研究小鼠卒中后神经肌肉接头三维结构变化[D]. 武汉:华中科技大学,2022. [80] 田婷, 杨朝阳, 李晓光. 组织透明化技术的研究与应用[J]. 中国组织工程研究,2020,24(21):3363-3371. [81] 陈小玉, 罗连响, 潘韵琪, 等. 组织透明化技术在神经退行性疾病中的应用研究进展[J]. 解放军医学杂志,2022,47(3):305-313. [82] 陈影, 黄金智, 吴科锋, 等. 组织透明化三维成像技术在卵巢组织中的应用进展[J]. 国际妇产科学杂志,2022,49(5):492-496. |
| [1] | Li Shuai, Liu Hua, Shang Yonghui, Liu Yicong, Zhao Qihang, Liu Wen. Stress distribution on the maxilla when wearing the Twin-block appliance for Class II malocclusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 881-887. |
| [2] | Xiao Fang, Huang Lei, Wang Lin. Magnetic nanomaterials and magnetic field effects accelerate bone injury repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 827-838. |
| [3] | Zhang Yu, Xu Ruian, Fang Lei, Li Longfei, Liu Shuyan, Ding Lingxue, Wang Yuexi, Guo Ziyan, Tian Feng, Xue Jiajia. Gradient artificial bone repair scaffold regulates skeletal system tissue repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 846-855. |
| [4] | Li Mingzhe, Ye Xiangling, Wang Bing, Yu Xiang. Preparation and osteogenic properties of liquid crystal display light-cured polylactic acid scaffold loaded with nano-tantalum [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 670-677. |
| [5] | Wei Zhiheng, Guan Tianmin, Liu Qing, Gong Jue, Xiang Xianxiang. Application of 3D printing accurate osteotomy guide combined with the revision of anterior cruciate ligament with abnormally increased posterior slope of tibial plateau [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(33): 7130-7136. |
| [6] | Akliya·Anwar, Nafisa·Gupur, Baibugafu·Yelisi, Zilalai·Gulaiti, Guzalnur·Emrayim, Nijat·Tursun. Dynamic stress analysis of maxillary sinus lifting without bone grafting and with immediate loading after bone grafting [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6416-6425. |
| [7] | Deng Guanghui, Xiang Wei, Su Qifan, Chen Xiaoyu, Wang Liangwei, Wan Zhihong, Wu Jiaqi, Chen Xiaojun. Preparation of osteoporotic femoral condylar bone defect model in rabbits and its critical value [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6426-6433. |
| [8] | Fang Dandan, Ma Ruijie, Huang Yi, He Kelin, Wu Lei. Three-dimensional model of swallowing musculoskeletal system based on CT image data and biomechanical characteristics analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(29): 6167-6163. |
| [9] | Li Shuyuan, Yang Dawen, Zeng Zhanpeng, Cai Qunbin, Zhang Jingtao, Zhou Qishi. Application of induced membrane technique for repairing critical-sized bone defects: advantages and future development [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6083-6093. |
| [10] | Liu Yang, Yang Jilei, Wang Wenli, Cui Yingying, Sun Qihao, Li Yourui. Application characteristics of thermosensitive hydrogels in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6094-6100. |
| [11] | Li Zeming, Zhang Yuntao, Wang Maolin, Hou Yudong. Role and mechanism of hypoxia-inducible factor 1 alpha regulating bone homeostasis in oral and maxillofacial diseases [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(26): 5680-5687. |
| [12] | Yu Lei, Zhang Wei, Qin Yi, Ge Gaoran, Bai Jiaxiang, Geng Dechun. Repair of femoral condyle defects using mesoporous bioactive glass grafted with bone morphogenetic protein 2 osteogenic peptide inspired by mussel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4629-4638. |
| [13] | Zilalai · Julaiti, Mawulanjiang · Abudurenmu, Aikeliya · Ainiwaer, Reyila · Kuerban, Nijiati · Tuersun. Finite element analysis of ultrashort implants applied to the mandibular posterior tooth area under different bone conditions [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4679-4686. |
| [14] | Li Guangzhao, Pei Xibo, Wang Jian. Application of nanoparticles in gene modification therapy for bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4771-4783. |
| [15] | Wang Lingcheng, Chen Xi, Yang Shuoyao, Huang Zhoulu, Yang Shunjie, You Mingke, Zhou Kai, , Chen Gang, , Li Jian. Effect of periacetabular osteotomy on pelvic sagittal tilt in developmental dysplasia of hip [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(21): 4452-4457. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||