Chinese Journal of Tissue Engineering Research ›› 2020, Vol. 24 ›› Issue (25): 4046-4053.doi: 10.3969/j.issn.2095-4344.2092
Previous Articles Next Articles
Endothelial progenitor cells promote vasculogenesis and osteogenesis in the repair of bone defects
Feng Yuan1, 2, 3, 4, Han Zhiqi1, 2, 3, 4, Zhou Nuo1, 2, 3, 4
- 1College of Stomatology, Guangxi Medical University; 2Guangxi Key Laboratory of Oral and Maxillofacial Rehabilitation and Reconstruction; 3Guangxi Clinical Research Center for Craniofacial Deformity; 4Guangxi Key Laboratory of Oral and Maxillofacial Surgery
-
Received:2019-12-02Revised:2019-12-06Accepted:2020-01-22Online:2020-09-08Published:2020-08-26 -
Contact:Zhou Nuo, MD, Professor, Doctoral supervisor, College of Stomatology, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China -
About author:Feng Yuan, Master candidate, College of Stomatology, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China -
Supported by:the National Natural Science Foundation of China, No. 81870748; Technology Research and Development Program for Health Care in Guangxi Zhuang Autonomous Region, No. S201538; Key Scientific Research Program for Health Care in Guangxi Zhuang Autonomous Region, No. 200525
CLC Number:
Cite this article
Feng Yuan, Han Zhiqi, Zhou Nuo.
Endothelial progenitor cells promote vasculogenesis and osteogenesis in the repair of bone defects [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(25): 4046-4053.
share this article
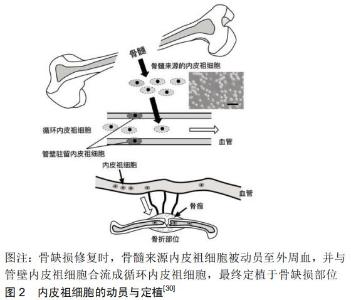
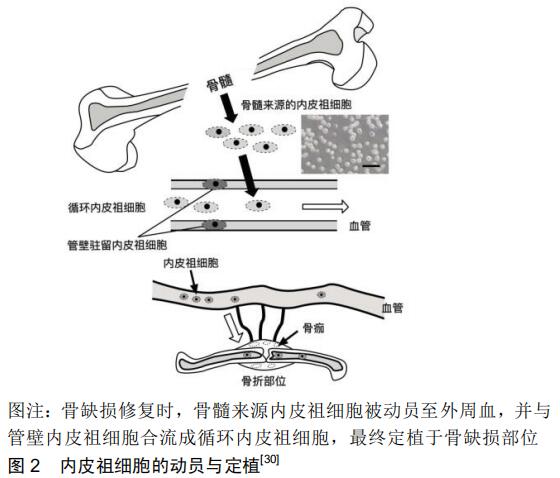
2 结果 Results 2.1 骨缺损的成因与临床转归 骨折是临床常见的骨科疾病,骨折后经血肿形成、血肿机化、纤维性和骨性骨痂形成以及骨痂改建的过程而完全愈合,使骨在结构与功能上恢复正常。虽然大多数骨折可以通过坚强内固定等手术治疗实现一期愈合,但仍有相当比例的骨折(5%-10%)愈合不良,严重影响患者的生活质量[7],其中无法愈合的大范围骨折将会造成骨质短缺,称为骨缺损,如创伤所造成的粉碎性骨折、开放性骨折导致大块骨组织缺损;此外,另有骨髓炎等炎症所致的骨坏死脱落分离,骨梗死或骨缺血性坏死所致大片骨坏死所造成的缺损,或因骨肉瘤等恶性肿瘤进行骨切除术导致的骨缺损等。骨缺损若处理不当可能导致肢体功能障碍,最终导致患者伤残,给患者造成极大的痛苦。 2.2 骨缺损的常规治疗 当骨缺损的长度达到骨干直径的1.5倍时,将超过自体修复的临界状态,常出现骨吸收或纤维愈合的情况[8-9]。目前骨缺损常通过骨粉充填或自体骨移植等方法进行手术治疗,此外还有同种异体骨移植、异种骨移植或利用修复体如颌面部的赝复体等方式进行骨缺损修复,但这些方法存在愈合不良、感染、免疫原反应、血源性疾病传播、组织相容性不佳等问题,导致手术失败。此外,即使使用上述方法积极治疗骨缺损,仍有一部分骨缺损最终仅能转归为骨不连,导致二次甚至多次手术,但手术效果不确切,部分患者反复手术也未必能够获得良好的治疗效果。 2.3 内皮祖细胞辅助治疗骨缺损的研究与探讨 骨再生是一个复杂的生物学过程,涉及许多细胞因子与多种干细胞之间良好的协调作用[10-12]。有研究认为骨损伤后骨形成缺损的主要原因之一是局部血液循环被破坏,导致相邻骨髓的缺氧和急性坏死[13-15]。骨损伤后的血管损伤及缺氧对成骨细胞也有很大的影响。另外目前学界认为动脉血管的存在是骨新生的必要条件,没有血管的生成,就不会有骨的新生。骨折后骨折部位周围首先形成血肿,才有后来的骨痂形成和改建。由此推断,骨损伤部位的血管生成可能对骨愈合起到至关重要的作用[16-18]。因此,基于内皮祖细胞促进组织血管发生的能力,其对骨再生和修复的辅助逐渐成为人们关注的焦点。 2.3.1 内皮祖细胞的起源及功能 内皮祖细胞是血管内皮细胞的前体细胞,在血管内皮再生中发挥着重要作用。1997年,日本学者ASAHARA等[1]首次使用免疫磁珠分选法从人外周血中分离出CD34+的内皮祖细胞,并将其定义为一组来源于成人外周血的纯化造血祖细胞,表达内皮相关标志物(CD34和Flk-1)且能够分化为内皮细胞。后来的研究发现CD133在内皮祖细胞中也有表达[19],CD133是一种干细胞特殊表面标记物,其在造血干细胞中高表达。目前人们普遍认为内皮祖细胞共同表达CD34、VEGFR2(又称KDR,Flk-1)以及CD133,但由于包括CD34、CD133在内的多种细胞表面抗原也在造血干细胞/祖细胞群中表达[20-21],如Flk-1、Tie-2、Sca-1和CD34[2],因此关于内皮祖细胞的表面标记物仍存在争议。 随后的研究发现内皮祖细胞不仅存在于外周血中,还存在于骨髓、骨骼肌、胚胎、脐血、心脏、脂肪等组织中,尤其大量存在于骨骼中。根据内皮祖细胞出现时间的差异、细胞表型及其生物学特性,可以将其分为早期内皮祖细胞和晚期内皮祖细胞[22]。DOYLE等[3]研究表明内皮祖细胞可以从骨髓转移到外周血,随后被远处器官或组织招募并定植,早期内皮祖细胞可以通过旁分泌对周围内皮细胞产生作用从而参与血管生成,晚期内皮祖细胞可以分化为内皮细胞并参与血管发生。 随着人们对细胞治疗的研究一步步向临床应用靠近,内皮祖细胞的定义应该更加精准而严谨[23]。内皮祖细胞应根据其谱系分为造血(髓)系和内皮系两大类。专家共识提出用“髓样血管生成细胞(myeloid angiogenic cells,MACs) ”来替代“早期内皮祖细胞”的说法,用“内皮集落形成细胞(endothelial colony forming cells,ECFCs)”来替代“晚期内皮祖细胞”以明确其谱系和功能。 2.3.2 内皮祖细胞的动员和趋化 人内皮祖细胞主要存在于骨髓中,外周血内皮祖细胞主要由骨髓动员而来,并趋化至缺血部位。GILL等[24]及SHINTANI等[25]的动物实验表明血管损伤和心肌梗死后骨髓来源内皮祖细胞的动员增加,还有一些研究表明内皮祖细胞参与新血管系统的建立[2,26-27]。 LEE等[28]利用小鼠胫骨骨折模型和大鼠胫骨牵张成骨模型评估了骨再生过程中内皮祖细胞在外周血和脾单核细胞中所占比例的变化,结果发现骨折后外周血和脾脏的内皮祖细胞比例增加,在骨折后第3天达到高峰,愈合期间恢复到基础水平。牵张成骨模型中内皮祖细胞比例增加的时间规律与骨折愈合模型相似,但在牵张期和固定期内皮祖细胞比例再次增加。MATSUMOTO等[29]利用活细胞荧光激活细胞分选术(FACS)对骨折小鼠进行分析,结果发现骨髓和外周血内皮祖细胞的比例在骨痂形成初期显著增加,且内皮祖细胞增强了骨折部位的血管生成。MATSUMOTO等[29]把内皮细胞特异性Tie2启动子调控下表达LacZ的转基因小鼠骨髓来源内皮祖细胞移植到骨折的野生型小鼠中,证实了促进骨折部位血管发生的内皮祖细胞来源于转基因小鼠骨髓。将绿色荧光蛋白阳性的外周血内皮祖细胞移植至骨折野生小鼠中并观察内皮祖细胞的迁移,结果进一步证实了外周血内皮祖细胞被招募动员到骨折部位促进骨折愈合。这些研究结果表明,骨折可诱导内皮祖细胞从骨髓向外周血的动员,并将动员的内皮祖细胞招募到骨折部位,从而促进血管发生,为骨折愈合提供良好的环境,在骨折愈合中发挥重要作用,见图2。 "
2.3.3 内皮祖细胞促进骨再生的机制 尽管内皮祖细胞在动物实验的骨折愈合中已显示出有效性,但内皮祖细胞促进骨折愈合的机制仍不清楚。MATSUMOTO 等[5,13]将人内皮祖细胞移植到大鼠骨折模型中,发现内皮祖细胞被招募到骨折部位,且在2周后发现骨折部位的内皮细胞和成骨细胞表达人特异性标志物,证明了内皮祖细胞通过向内皮细胞和成骨细胞分化参与骨再生。此外,FORD等[31]研究观察到内皮祖细胞在兔的胫骨截骨部位形成软骨腔。MIFUNE等[32]也在体外证实了粒细胞集落刺激因子动员的外周血内皮祖细胞有向成骨细胞分化的能力,直接促进了大鼠骨折的愈合。还有研究表明,内皮祖细胞和骨髓间充质干细胞之间通过旁分泌及直接细胞接触产生协同效应,对促进骨再生起到至关重要的作用[33-34]。 然而一些研究发现在缺血组织区域并未检测到大量的内皮祖细胞存在[35]。早在1992年,FOLKMAN等[36]研究证明移植的内皮祖细胞分泌多种促血管生成的细胞因子,促进已有内皮细胞的增殖和迁移,从而促进血管生成。MIFUNE等[32]通过大鼠骨折部位血管内皮生长因子和骨形成蛋白2表达量的增加证实了人类外周血内皮祖细胞具有旁分泌作用使大鼠骨折区毛细血管和成骨细胞密度增加。LI等[37-38]将内皮祖细胞局部移植于大鼠节段性骨缺损区,发现在修复早期血管内皮生长因子和骨形成蛋白2的表达量增加,证实内皮祖细胞可能通过高表达血管内皮生长因子和骨形成蛋白2促进血管发生,从而促进骨缺损的愈合。其他研究也证明内皮祖细胞中存在各种促血管生成因子,如血管内皮生长因子、肝生长因子、血管生成素1、基质衍生因子1α、胰岛素样生长因子1、内皮一氧化氮合酶/诱导型一氧化氮合酶和血小板衍生生长因子B等[27,37,39-42]。 综上所述,目前认为内皮祖细胞可以直接分化为内皮细胞或成骨细胞进而直接促进骨缺损的愈合,也可以通过旁分泌多种细胞因子间接地对骨再生做出贡献。 2.3.4 内皮祖细胞辅助治疗骨缺损的研究进展 为了增多骨缺损区域的内皮祖细胞,大量学者尝试了多种方法,见表1。MATSUMOTO等[13]将循环内皮祖细胞、循环单核细胞及等体积生理盐水通过尾静脉注射到裸鼠股骨骨缺损模型中,通过放射学、组织学和生物力学定量评估骨愈合,结果显示内皮祖细胞组的骨愈合明显优于单核细胞组和生理盐水组。为了减少静脉注射可能产生的不利影响并探索最适细胞量,ROZEN等[43]将自体内皮祖细胞单细胞悬液局部注射于绵羊胫骨骨缺损模型中,12周以后组织学检查显示对照组以纤维化瘢痕组织为主,而内皮祖细胞移植组形成了大量的编织骨。此外,也有人将生物支架与干细胞移植相结合,MIFUNE等[32]将去端肽胶原支架包被的内皮祖细胞局部移植于鼠骨缺损模型中,比较105,104,103 3种剂量和等量PBS对骨缺损愈合的影响,结果显示仅在105组和104组观察到了内皮祖细胞的成血管和成骨分化、骨缺损部位血供的增强以及骨缺损愈合的影像学和组织学证据。这些结果说明相比静脉注射较高数目内皮祖细胞,采用局部移植较低数目也可以起到相同的辅助作用。 "
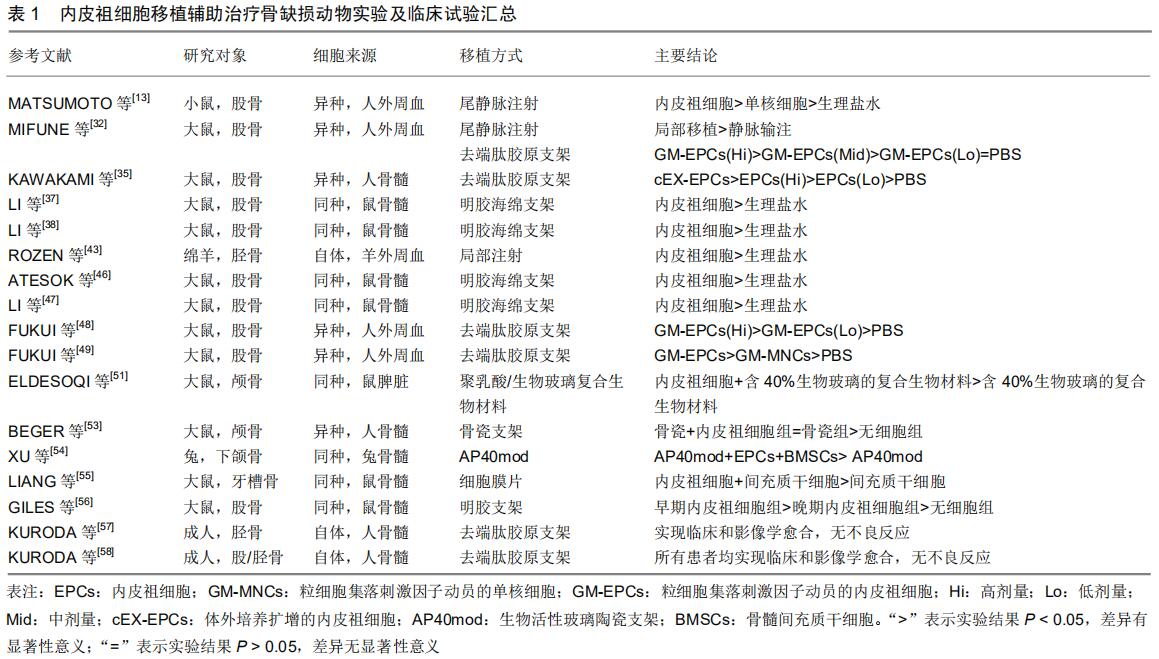
然而,自体内皮祖细胞数量的不足一直是困扰干细胞移植临床应用的原因。内皮祖细胞在骨髓细胞中占比不足1%,在外周血单核细胞中占比不足0.01%[44],且目前提取骨髓来源内皮祖细胞需要进行骨髓穿刺,给患者造成的伤害大,效率低,极其痛苦。为了能快速高效地获取内皮祖细胞,学者们不断优化其分离培养方法及培养体系以获得足够的细胞数量。目前研究中主要用单核细胞贴壁培养法、免疫磁珠分选法、差速贴壁培养法或差速消化分离法分离内皮祖细胞。该文章提到的研究大部分使用了单核细胞贴壁培养法,即根据细胞密度大小不同,采用不同密度的分离液(如Ficoll等)分离骨髓、外周血或脾脏中的单核细胞接种于纤维连接蛋白包被的培养皿中,用EGM-2-MV培养基培养2-7 d后通过换液去除未贴壁细胞,继续培养贴壁细胞即可得到内皮祖细胞。此方法操作简单,是目前应用最多、最成熟的分离方法。还有部分研究利用内皮祖细胞表面的特异性抗原与表面包被有相应抗体的免疫磁珠特异性结合,即免疫磁珠分选法来分选内皮祖细胞,或利用骨髓间充质干细胞与内皮祖细胞贴壁速度的不同,即差速贴壁培养法来分离内皮祖细胞。 就培养体系而言,目前通常使用含胎牛血清的培养基对分离出的内皮祖细胞进行培养扩增,并添加一些细胞因子以提高内皮祖细胞的增殖潜能。但由于胎牛血清中的营养成分会因为血清批次的不同而有所不同,且血清中含有抑制性成分(如转化生长因子β),这都会对细胞的培养产生影响,加之其中的安全隐患、经济成本及道德问题等因素,学者们开始研发胎牛血清替代物及不含血清的培养基。KAWAKAMI等[35]发现在无血清培养基中添加血管内皮生长因子、干细胞因子、白细胞介素6、Flt-3和血小板生成素等5种生长因子培养骨髓来源内皮祖细胞7 d,可使细胞数量增加20倍以上。将其运用于大鼠骨缺损模型中,结果显示此种方法获得的内皮祖细胞相比普通内皮祖细胞具有更好的成管能力且骨缺损区域的血液循环恢复更好,两种细胞都可以分化为成骨细胞,可见无血清培养基培养自体扩增的骨髓来源内皮祖细胞移植是一种高效简单且有前景的治疗骨缺损的方案。 2.3.5 组织工程学技术的辅助 大量研究表明全身或局部注射内皮祖细胞无法保证缺损区内皮祖细胞的数量及浓度,这可能是因为单细胞悬液无法长时间固定并保留在缺损区内。为了改进上述缺陷,越来越多的学者利用生物支架或细胞膜片等辅助内皮祖细胞的移植[45]。 例如上文中MIFUNE等[32]将内皮祖细胞附着于去端肽胶原支架。此外,ATESOK等[46]在大鼠股骨节段性缺损模型中用明胶海绵支架局部移植内皮祖细胞,结果显示支架组的骨再生明显增强,骨缺损被新生骨小梁和皮质骨完全充填。LI等[47]同样使用明胶海绵支架将内皮祖细胞接种于大鼠骨缺损处,通过X射线片、micro-CT扫描和生物力学评估,结果提示支架组能显著促进大鼠股骨节段缺损模型的愈合。FUKUI等[48-49]将粒细胞集落刺激因子注射于捐献者体内,4 d后从中提取外周血内皮祖细胞及单核细胞,并利用去端肽胶原支架将其分别局部移植于大鼠骨缺损模型中,结果表明内皮祖细胞组和单核细胞组均可增强骨缺损区域的血流恢复,但内皮祖细胞组在影像学、组织学和功能评估方面均优于单核细胞组,进一步的体内和体外实验证实粒细胞集落刺激因子动员的外周血单核细胞引起的过度炎症反应可能是导致这种差异的机制之一。 生物玻璃(BG)是一种硅酸钙(CaO-SiO2),与天然无机骨成分相似,具有促进生理溶液中磷酸钙形成和沉积的作用,可增强骨基质界面强度[50]。关于含有生物玻璃的复合材料对内皮祖细胞的影响,人们知之甚少。ELDESOQI等[51]研究了以聚乳酸为基础,探讨含20%或40%生物玻璃(即BG20和BG40)的复合生物材料对内皮祖细胞体外分化和存活的影响,结果表明含40%生物玻璃的复合生物材料可以显著提高体外内皮祖细胞的存活率,并推测原因是其可以释放大量Ca2+离子,然后以此复合材料联合内皮祖细胞移植于大鼠颅骨骨缺损模型,结果显示含40%生物玻璃的复合生物材料联合内皮祖细胞移植可显著促进大鼠颅骨骨缺损的早期血管发生。 骨瓷是市场上最好的同种异体骨替代物之一,例如Straumann? BoneCeramicTM由60%羟基磷灰石和40%β-磷酸三钙组成,可同时用作骨替代物及药物递送载体,具有良好的生物相容性,并且能够减缓和控制骨再生过程中的再吸收[52]。BEGER等[53]将大鼠颅骨骨缺损模型随机分为3组:骨瓷组,骨瓷+内皮祖细胞组以及空白对照组,结果证实了骨瓷与内皮祖细胞联合移植可以显著提升骨血管化和骨再生,见图3。 如上所述,与金属或高分子聚合物等其他材料相比,生物活性玻璃和陶瓷支架能与骨以化学键结合,故其具有出色的生物相容性、可吸收性及骨诱导性。羟基磷灰石和β-磷酸三钙是临床中最常用的支架材料,然而羟基磷灰石不易降解,β-磷酸三钙的机械强度较低,因此其应用范围受到一定限制,而生物玻璃的加入可明显提高β-磷酸三钙的抗压强度。XU等[54]研发了一种新型生物活性玻璃陶瓷,并将其命名为AP40mod。此材料提高了传统陶瓷的机械强度且降低了其过度降解率。他们应用包含内皮祖细胞与骨髓间充质干细胞的AP40mod支架成功修复了兔下颌骨骨缺损,并提出可以通过改变AP40mod的成分、生产方式及种子细胞来适应不同类型的骨缺损。 LIANG等[55]提取大鼠自体内皮祖细胞及间充质干细胞,制备间充质干细胞膜片及内皮祖细胞-间充质干细胞共培养细胞膜片,并将其移植到大鼠牙槽骨缺损中,结果显示内皮祖细胞-间充质干细胞膜片显示出更强的成骨活性,产生连续的新骨几乎覆盖整个缺损区域,这种共培养体系可能为骨缺损修复提供新的思路。 GILES等[56]从大鼠骨髓提取分离早期内皮祖细胞(E-EPCs)及晚期内皮祖细胞(L-EPCs),并使用明胶支架辅助内皮祖细胞移植于大鼠骨缺损区,结果显示早期内皮祖细胞治疗组有80%的大鼠完全愈合,20%的大鼠部分愈合,晚期内皮祖细胞组只有20%的大鼠完全愈合,而无细胞对照组均为骨不连,进一步体外实验表明,早期内皮祖细胞比晚期内皮祖细胞释放更多的血管内皮生长因子。此外,将内皮祖细胞与成骨细胞共培养可以刺激早期内皮祖细胞小管生成,抑制晚期内皮祖细胞小管生成。以上表明骨髓来源的早期内皮祖细胞相对晚期内皮祖细胞可以更有效地促进骨缺损的愈合。 2.3.6 临床试验 基于一系列动物实验的研究成果,KURODA等[57]报道了第1例胫骨骨缺损患者在切开复位内固定术后9个月接受自体粒细胞集落刺激因子动员的内皮祖细胞与自体骨移植,这是内皮祖细胞移植首次应用于骨缺损患者。细胞治疗和骨移植12周后,临床和影像学均实现了良好的愈合,未有疼痛、步态障碍等严重不良事件的发生。此个案为KURODA等[58]后来的Ⅰ/Ⅱa期临床试验奠定了基础,即将自体粒细胞集落刺激因子动员的内皮祖细胞使用去端肽胶原支架移植于股骨或胫骨骨缺损患者的骨缺损区域(n=7),其中有5例(71.4%)在第12周实现了影像学愈合,而所有患者均于植骨细胞移植术后16.4周获得了临床及影像学愈合,且在之后的1年随访中无严重不良事件发生。这些研究结果提示了内皮祖细胞有希望作为一种新的治疗方式应用于大范围骨缺损的修复治疗。然而内皮祖细胞移植的有效性及安全性仍需在随机临床对照试验中进一步阐明。 "
|
[1] ASAHARA T, MUROHARA T, SULLIVAN A, et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 1997;275(5302):964-967.
[2] ASAHARA T, MASUDA H, TAKAHASHI T, et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization. Circ Res. 1999;85(3):221-228.
[3] DOYLE B, METHAROM P, CAPLICE NM. Endothelial progenitor cells. Endothelium. 2006;13(6):403-410.
[4] LAING AJ, DILLON JP, CONDON ET, et al. Mobilization of endothelial precursor cells: systemic vascular response to musculoskeletal trauma. J Orthop Res. 2007;25(1):44-50.
[5] MATSUMOTO T, KURODA R, MIFUNE Y, et al. Circulating endothelial/skeletal progenitor cells for bone regeneration and healing. Bone. 2008;43(3):434-439.
[6] RISAU W, SARIOLA H, ZERWES HG, et al. Vasculogenesis and angiogenesis in embryonic-stem-cell-derived embryoid bodies. Development. 1988;102(3):471-478.
[7] MARSH D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. 1998;(355 Suppl):S22-30.
[8] SCHMITZ JP, HOLLINGER JO. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clin Orthop Relat Res. 1986;(205):299-308.
[9] JANG BJ, BYEON YE, LIM JH, et al. Implantation of canine umbilical cord blood-derived mesenchymal stem cells mixed with beta-tricalcium phosphate enhances osteogenesis in bone defect model dogs. J Vet Sci. 2008;9(4):387-393.
[10] ZIGDON-GILADI H, BICK T, LEWINSON D, et al. Mesenchymal stem cells and endothelial progenitor cells stimulate bone regeneration and mineral density. J Periodontol. 2014;85(7):984-990.
[11] LIU Y, TEOH SH, CHONG MS, et al. Contrasting effects of vasculogenic induction upon biaxial bioreactor stimulation of mesenchymal stem cells and endothelial progenitor cells cocultures in three-dimensional scaffolds under in vitro and in vivo paradigms for vascularized bone tissue engineering. Tissue Eng Part A. 2013;19(7-8):893-904.
[12] GEUZE RE, WEGMAN F, ONER FC, et al. Influence of endothelial progenitor cells and platelet gel on tissue-engineered bone ectopically in goats. Tissue Eng Part A. 2009;15(11):3669-3677.
[13] MATSUMOTO T, KAWAMOTO A, KURODA R, et al. Therapeutic potential of vasculogenesis and osteogenesis promoted by peripheral blood CD34-positive cells for functional bone healing. Am J Pathol. 2006;169(4): 1440-1457.
[14] LU C, MICLAU T, HU D, et al. Ischemia leads to delayed union during fracture healing: a mouse model. J Orthop Res. 2007;25(1):51-61.
[15] EINHORN TA. Enhancement of fracture-healing. J Bone Joint Surg Am. 1995;77(6):940-956.
[16] COLNOT CI, HELMS JA. A molecular analysis of matrix remodeling and angiogenesis during long bone development. Mech Dev. 2001;100(2):245-250.
[17] CARANO RA, FILVAROFF EH. Angiogenesis and bone repair. Drug Discov Today. 2003;8(21):980-989.
[18] GLOWACKI J. Angiogenesis in fracture repair. Clin Orthop Relat Res. 1998;(355 Suppl):S82-89.
[19] 汤文燕,栾佐.内皮祖细胞的生物学特性及其临床应用前景[J].中国生物工程杂志,2016,36(10):86-93.
[20] ASAHARA T, KAWAMOTO A, MASUDA H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 2011;29(11):1650-1655.
[21] LEE JH, HAH YS, CHO HY, et al. Human umbilical cord blood-derived CD34-positive endothelial progenitor cells stimulate osteoblastic differentiation of cultured human periosteal-derived osteoblasts. Tissue Eng Part A. 2014; 20(5-6):940-953.
[22] HUR J, YOON CH, KIM HS, et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 2004;24(2):288-293.
[23] MEDINA RJ, BARBER CL, SABATIER F, et al. Endothelial Progenitors: A Consensus Statement on Nomenclature. Stem Cells Transl Med. 2017;6(5):1316-1320.
[24] GILL M, DIAS S, HATTORI K, et al. Vascular trauma induces rapid but transient mobilization of VEGFR2(+)AC133(+) endothelial precursor cells. Circ Res. 2001;88(2):167-174.
[25] SHINTANI S, MUROHARA T, IKEDA H, et al. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction. Circulation. 2001;103(23):2776-2779.
[26] MASUDA H, KALKA C, TAKAHASHI T, et al. Estrogen-mediated endothelial progenitor cell biology and kinetics for physiological postnatal vasculogenesis. Circ Res. 2007;101(6):598-606.
[27] II M, NISHIMURA H, IWAKURA A, et al. Endothelial progenitor cells are rapidly recruited to myocardium and mediate protective effect of ischemic preconditioning via "imported" nitric oxide synthase activity. Circulation. 2005; 111(9):1114-1120.
[28] LEE DY, CHO TJ, KIM JA, et al. Mobilization of endothelial progenitor cells in fracture healing and distraction osteogenesis. Bone. 2008;42(5):932-941.
[29] MATSUMOTO T, MIFUNE Y, KAWAMOTO A, et al. Fracture induced mobilization and incorporation of bone marrow-derived endothelial progenitor cells for bone healing. J Cell Physiol. 2008;215(1):234-242.
[30] KAWAKAMI Y, MATSUMOTO T, MIFUNE Y, et al. Therapeutic Potential of Endothelial Progenitor Cells in the Field of Orthopaedics. Curr Stem Cell Res Ther. 2017;12(1):3-13.
[31] FORD JL, ROBINSON DE, SCAMMELL BE. Endochondral ossification in fracture callus during long bone repair: the localisation of 'cavity-lining cells' within the cartilage. J Orthop Res. 2004;22(2):368-375.
[32] MIFUNE Y, MATSUMOTO T, KAWAMOTO A, et al. Local delivery of granulocyte colony stimulating factor-mobilized CD34-positive progenitor cells using bioscaffold for modality of unhealing bone fracture. Stem Cells. 2008;26(6): 1395-1405.
[33] SEEBACH C, HENRICH D, KÄHLING C, et al. Endothelial progenitor cells and mesenchymal stem cells seeded onto beta-TCP granules enhance early vascularization and bone healing in a critical-sized bone defect in rats. Tissue Eng Part A. 2010;16(6):1961-1970.
[34] AGUIRRE A, PLANELL JA, ENGEL E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochem Biophys Res Commun. 2010;400(2): 284-291.
[35] KAWAKAMI Y, II M, ALEV C, et al. Local transplantation of ex vivo expanded bone marrow-derived CD34-positive cells accelerates fracture healing. Cell Transplant. 2012;21(12): 2689-2709.
[36] FOLKMAN J, SHING Y. Angiogenesis. J Biol Chem. 1992; 267(16):10931-10934.
[37] LI R, NAUTH A, LI C, et al. Expression of VEGF gene isoforms in a rat segmental bone defect model treated with EPCs. J Orthop Trauma. 2012;26(12):689-692.
[38] LI R, NAUTH A, GANDHI R, et al. BMP-2 mRNA expression after endothelial progenitor cell therapy for fracture healing. J Orthop Trauma. 2014;28 Suppl 1:S24-27.
[39] KAWAMOTO A, ASAHARA T, LOSORDO DW. Transplantation of endothelial progenitor cells for therapeutic neovascularization. Cardiovasc Radiat Med. 2002;3(3-4): 221-225.
[40] JUJO K, II M, LOSORDO DW. Endothelial progenitor cells in neovascularization of infarcted myocardium. J Mol Cell Cardiol. 2008;45(4):530-544.
[41] MIYAMOTO Y, SUYAMA T, YASHITA T, et al. Bone marrow subpopulations contain distinct types of endothelial progenitor cells and angiogenic cytokine-producing cells. J Mol Cell Cardiol. 2007;43(5):627-635.
[42] 周诺,廖妮,韦山良.一氧化氮合酶在犬下颌骨牵张成骨过程中的表达和意义[J].华西口腔医学杂志,2009,27(6):676-680.
[43] ROZEN N, BICK T, BAJAYO A, et al. Transplanted blood-derived endothelial progenitor cells (EPC) enhance bridging of sheep tibia critical size defects. Bone. 2009; 45(5):918-924.
[44] SMADJA DM, CORNET A, EMMERICH J, et al. Endothelial progenitor cells: characterization, in vitro expansion, and prospects for autologous cell therapy. Cell Biol Toxicol. 2007;23(4):223-239.
[45] 韩志琪,蒋伟东,周诺.干细胞组织工程技术辅助下颌牵张成骨的研究与进展[J].中国组织工程研究,2019,23(25):4037-4043.
[46] ATESOK K, LI R, STEWART DJ, et al. Endothelial progenitor cells promote fracture healing in a segmental bone defect model. J Orthop Res. 2010;28(8):1007-1014.
[47] LI R, ATESOK K, NAUTH A, et al. Endothelial progenitor cells for fracture healing: a microcomputed tomography and biomechanical analysis. J Orthop Trauma. 2011;25(8): 467-471.
[48] FUKUI T, MATSUMOTO T, MIFUNE Y, et al. Local transplantation of granulocyte colony-stimulating factor-mobilized human peripheral blood mononuclear cells for unhealing bone fractures. Cell Transplant. 2012;21(4): 707-721.
[49] FUKUI T, MIFUNE Y, MATSUMOTO T, et al. Superior Potential of CD34-Positive Cells Compared to Total Mononuclear Cells for Healing of Nonunion Following Bone Fracture. Cell Transplant. 2015;24(7):1379-1393.
[50] JELL G, STEVENS MM. Gene activation by bioactive glasses. J Mater Sci Mater Med. 2006;17(11):997-1002.
[51] ELDESOQI K, SEEBACH C, NGUYEN NGOC C, et al. High calcium bioglass enhances differentiation and survival of endothelial progenitor cells, inducing early vascularization in critical size bone defects. PLoS One. 2013;8(11):e79058.
[52] BOSE S, TARAFDER S. Calcium phosphate ceramic systems in growth factor and drug delivery for bone tissue engineering: a review. Acta Biomater. 2012;8(4):1401-1421.
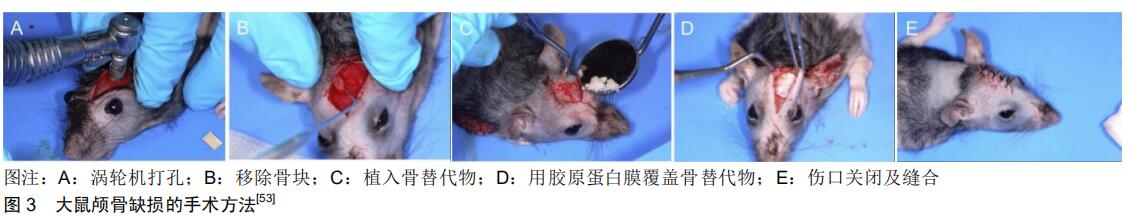
[53] BEGER B, BLATT S, PABST AM, et al. Biofunctionalization of synthetic bone substitutes with angiogenic stem cells: Influence on regeneration of critical-size bone defects in an in vivo murine model. J Craniomaxillofac Surg. 2018;46(9): 1601-1608.
[54] XU F, REN H, ZHENG M, et al. Development of biodegradable bioactive glass ceramics by DLP printed containing EPCs/BMSCs for bone tissue engineering of rabbit mandible defects. J Mech Behav Biomed Mater. 2019;103: 103532.
[55] LIANG Y, WEN L, SHANG F, et al. Endothelial progenitors enhanced the osteogenic capacities of mesenchymal stem cells in vitro and in a rat alveolar bone defect model. Arch Oral Biol. 2016;68:123-130.
[56] GILES EM, GODBOUT C, CHI W, et al. Subtypes of endothelial progenitor cells affect healing of segmental bone defects differently. Int Orthop. 2017;41(11):2337-2343.
[57] KURODA R, MATSUMOTO T, MIWA M, et al. Local transplantation of G-CSF-mobilized CD34(+) cells in a patient with tibial nonunion: a case report. Cell Transplant. 2011; 20(9):1491-1496.
[58] KURODA R, MATSUMOTO T, NIIKURA T, et al. Local transplantation of granulocyte colony stimulating factor-mobilized CD34+ cells for patients with femoral and tibial nonunion: pilot clinical trial. Stem Cells Transl Med. 2014; 3(1):128-134. |
| [1] | Zhou Pengfei, Lin Jing, Chen Yuying, Lin Minkui. Canine dental pulp stem cells-polyglycolic acid scaffold complex for canine periodontal tissue defect [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(34): 5526-5531. |
| [2] | Dong Wenjie, Zhang Shiyang, Zhao Lei, Wang Yukun. Icariin deproteinized inorganic bovine bone composite and deproteinized inorganic bovine bone material in repairing mandibular defects [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(34): 5467-5472. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||