Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (4): 964-974.doi: 10.12307/2026.531
Previous Articles Next Articles
Double lactate threshold exercise training: development context, basic connotation, application effect and mechanism of action
Wei Bo, Qiu Jiangang
- Chengdu Sport University, Chengdu 641418, Sichuan Province, China
-
Received:2024-12-16Accepted:2025-01-25Online:2026-02-08Published:2025-05-21 -
Contact:Qiu Jiangang, Master, Professor, Doctoral supervisor, Chengdu Sport University, Chengdu 641418, Sichuan Province, China -
About author:Wei Bo, PhD candidate, Chengdu Sport University, Chengdu 641418, Sichuan Province, China -
Supported by:the National Social Science Foundation of China (Western Program), No. 22XTY012 (to QJG); Thematic Project (Key Project) of the Sichuan Social Science Base of Sports and Arts, No. 24TYKP-A05 (to WB, ZYM)
CLC Number:
Cite this article
Wei Bo, Qiu Jiangang. Double lactate threshold exercise training: development context, basic connotation, application effect and mechanism of action[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 964-974.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
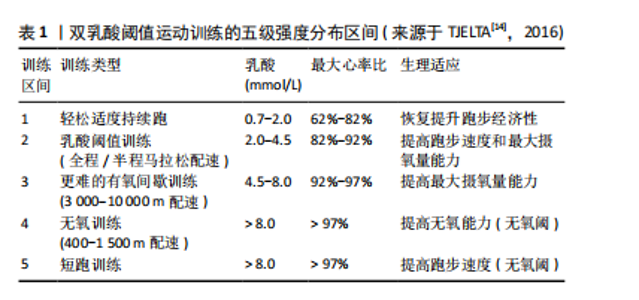
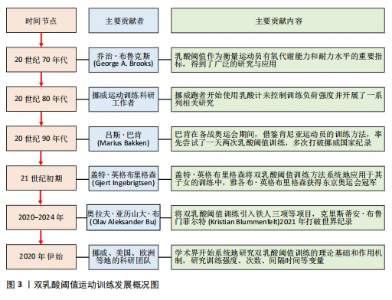
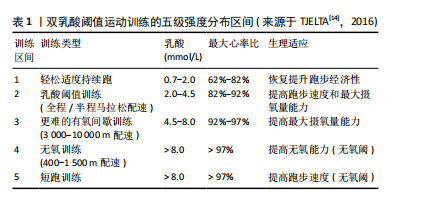
2.1 DLTT的发展脉络 20世纪70年代伊始,运动生理学家们深入探讨了乳酸在运动过程中产生和清除的机制,确立了乳酸阈值在训练中的重要地位,乳酸作为有氧代谢能力和耐力水平的重要指标,得到了广泛的研究与应用。20世纪80年代末,挪威跑者开始使用乳酸计来控制训练负荷强度并开展了一系列相关研究,此举为后来的DLTT研究提供了理论基础与实践经验。20世纪90年代末,挪威精英级田径中长跑运动者马吕斯·巴肯(Marius Bakken)开始通过“试错”的方法对DLTT进行开发与测试,并实际应用在自身的训练计划之中。同期,挪威田联与Olympiatoppen共同发起了通过乳酸计检测挪威顶级跑者的研究项目。21世纪初,马吕斯·巴肯开始系统研究并完善DLTT体系,并在2003-2004年赛季中实际应用,赛季表现出北欧5 000 m第二好成绩,该方法逐渐在挪威和其他国家运动者中应用和推广。21世纪初期盖特·英格布里格森(Gjert Ingebrigtsen)作为教练,将DLTT方法系统地应用于其子女的训练中,使得这一方法得到了验证和推广。2010年,挪威运动者亨里克·因格布里森(Henrik Ingebrigtsen)应用DLTT获得了室外欧洲1 500 m锦标赛冠军,于2024年获得巴黎奥运会5 000 m金牌并于2024年打破3 000 m世界记录。2020年代初,DLTT在其他项目推广,挪威铁人三项教练、运动科学家奥拉夫·亚历山大·布(Olav Aleksander Bu)将DLTT引入铁人三项等项目,同时运用先进的监测设备和数据分析,提高训练的精准性。自此,随着实践中的成功案例增多,学术界开始系统地研究DLTT的理论基础和作用机制,通过实验研究,验证双乳酸阈值训练对提高有氧能力、乳酸清除效率和耐力表现的效果。以上研究成果和实践案例表明,DLTT法是一种科学、系统的耐力训练方法,它通过精确控制训练强度和量,有效地提高了运动者的耐力和速度,已经被许多世界级运动者和教练所采用,DLTT时间发展概况见图3。最早发文于1990年,在2010年发文量有增长趋势,研究集中在生理机制、应用案例。国内对DLTT相关研究较少且关注度低。 2.2 DLTT的基本内涵 2.2.1 概念厘定 乳酸阈值是指在激烈运动过程中,肌肉在无氧代谢状态下产生乳酸速度与乳酸清除速度达到平衡的临界点,这个点标志着骨骼肌代谢方式由“有氧代谢”为主过渡为“无氧代谢”为主。其中,有两个关键的乳酸阈值:第一乳酸阈值(LT1),又称有氧乳酸阈值,血乳酸浓度通常在2 mmol/L左右水平,血乳酸值在第一乳酸阈值的训练过程中,训练主要目的是提高心肺功能和耐力,要求以较低的强度和较长的时间进行训练,训练手段为轻松跑、长距离慢跑等;第二乳酸阈值(LT2),又称无氧乳酸阈值,血乳酸浓度通常在4 mmol/L左右水平,血乳酸值在第二乳酸阈值的训练过程中,训练主要目的是提高无氧耐力和速度,要求以较高的强度和较短的时间进行训练,训练手段为高强度的短跑、间歇跑、山坡跑等。安静时血液乳酸浓度低于1 mmol/L,训练强度分级见表1。"

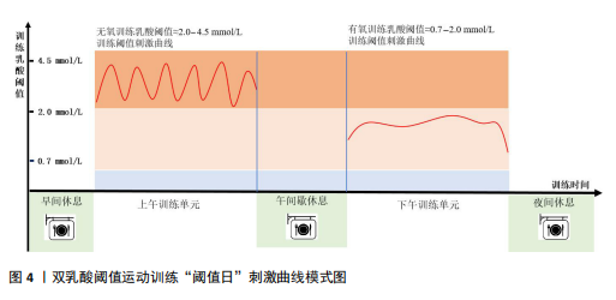
DLTT的训练方式:通常在一天训练课程中的两个(上午/下午)单元,安排有氧与无氧训练内容,训练负荷强度由血乳酸指标评判及监测,有氧训练负荷强度要求0.7-2.0 mmol/L、62%-82% HRmax,无氧训练负荷强度要求2.0-4.0 mmol/L、82%-92% HRmax或> 4 mmol/L、> 92%-97% HRmax,训练频次有1次/周、2次/周、3-5次/周,训练量分布在120-160 km不等。该研究综述过往研究文献成果,首次尝试将DLTT定义为:以提升有氧能力与速度能力为目的,在一天训练日内分别进行有氧阈值训练与无氧阈值训练(有氧训练负荷强度要求0.7-2.0 mmol/L、无氧训练负荷强度要求2.0-4.5 mmol/L)、训练频次≥2次/周,训练跑量在≈120-160 km/周,训练方法主要采取间歇训练法,训练手段主要采取短跑、中长跑、长跑、冲刺跑、法特莱特跑、越野跑,适用于体能周期性运动项目的一种运动策略。 2.2.2 本质特征 通过比较传统乳酸阈训练与双乳酸阈值训练的训练学差异,从而进一步提炼总结DLTT的本质特征。传统乳酸阈值训练主要是指在乳酸阈值附近进行训练,目标是提高运动者的乳酸阈值,从而延缓疲劳的出现。通过比较这两种训练方法的生理基础、训练效果、运动者体验和运动表现,可以更好地理解它们在提高耐力与速度方面的潜在优势和局限性。根据“Selye应激-适应”理论,二者在生理适应过程中存在明显差异,传统乳酸阈值训练通过提高乳酸阈值,运动者可以在更高的运动强度下维持更长时间的运动,然而,DLTT可能通过更频繁地刺激乳酸阈值,促进更快的生理适应。其中,DLTT的阈值训练日上午单元中进行无氧阈值训练,此时乳酸的产生速率远远大于清除速率,人体供能系统主要涉及磷酸原供能系统(ATP-PCr系统)、糖酵解供能系统(乳酸能系统),提高肌肉对高乳酸环境的耐受性;下午单元中进行有氧阈值训练,人体供能系统主要涉及糖酵解供能系统(乳酸能系统)、有氧氧化供能系统,提高血液中的氧气运输和利用效率。在一天训练日内容中包含以上两种阈值刺激,这种训练方式充分利用了人体在不同时间段的生理特点,科学地刺激了机体的能量供给系统,促进了有氧能力和无氧能力的全面提升。进一步细分,长时间有氧训练或高强度间歇训练的训练强度被分为5个训练区域,分别为3个有氧特定强度区域、2个无氧特定强度区域,分别为Z1-Z5区间,每个区间训练类型、乳酸(mmol/L)、最大心率比(HRmax%)、生理适应各不相同,传统乳酸阈值训练与DLTT训练区间分布存在差异,以此对运动者机能刺激类型、刺激强度、间歇时间存在显著差异,DLTT阈值训练日训练刺激曲线见图4。因适用运动者对象的不同,其训练量、训练强度、训练频次有着显著的不同,见表3。DLTT具备大训练量、低负荷强度、乳酸浓度指导训练、减缓疲劳的特征。 2.3 DLTT的应用效果 过往研究成果已经证实DLTT可能有效改善机体的肌肉适能、有氧与无氧能力、缓解中枢神经与外周疲劳的水平。该研究主要从DLTT对肌肉适能、有氧与无氧能力、中枢神经与外周疲劳影响3个方面介绍DLTT的应用效果。 2.3.1 DLTT对肌肉适能的影响 DLTT能有效提高肌肉对乳酸积累的耐受性,从而增强肌肉耐力、使运动者可以在更高强度的活动中保持更长时间的稳定表现,延缓疲劳的发生。肌肉适能也被称为肌肉适应性、肌肉可塑性(维度、弹性),是指肌肉在受到适度负荷和刺激后,能够经历一系列的生理和结构变化[22],从而提高肌肉功能和性能。 (1)肌肉适应性方面:已有研究表明传统乳酸阈值训练刺激过大(> 8 mmol/L)时,训练过程中机体乳酸不耐受并无法有效消除乳酸[23-24],从而导致训练负荷强度过大、训练疲劳和运动表现下降[25-26],更有甚者导致运动损伤[27-28]。DLTT每周的训练量与每天训练负荷标准(参考乳"

酸阈值)、间歇时间进行了明确厘定(有氧训练≈0.7-2.0 mmol/L;无氧训练≈2.0-4.5 mmol/L)并进监测[29],保证最大程度提高运动者的乳酸阈值的“门槛”,同时,阈值训练日(上/下午单元)的训练内容中明确间歇休息时间与周期[30],保证高能物质(腺苷三磷酸、磷酸肌酸)的有效恢复与及时补充,为机体持续运动供给能量。另外,DLTT通过间歇训练,使得肌肉在高强度运动中产生乳酸后的恢复期间,身体可以实现最大效率排除乳酸。 (2)肌肉可塑性(维度、弹性)方面:LTT训练通过多轮次间歇手段,能够有效刺激肌肉纤维的生长[30],此观点已被学界多方证实。DLTT同样作为分类阈值刺激训练,更加精确控制阈值刺激强度范围(HRmax、乳酸阈值、VO2max等)。该训练方式使肌肉在短时间内经历中等强度(60%-70% HRmax)的收缩和放松,从而促进肌肉蛋白质的合成[31],增加毛细血管的数量,改善肌肉的血液供应,实现增加肌肉维度[32]。另外,可以刺激肌肉中不同类型肌原纤维(0.7-2.5 mmol/L以刺激慢肌纤维TypeⅠ、2.0-4.5 mmol/L以刺激快肌纤维TypeⅡ)[33-34],优化肌肉结构,提高肌肉的力量和速度,从而影响肌肉的维度和弹性[35]。DLTT通过优化肌肉的特异性适应,包括清除乳酸而不是减少乳酸的产生,提高肌肉在高强度运动中的耐受性,从而提高肌肉的维度和弹性,特别是快速收缩纤维(TypeⅡ)[36]。 2.3.2 DLTT对有氧与无氧能力的影响 DLTT通过不同的训练强度来提高运动者的耐力和速度,在训练中依次提高有氧耐力和无氧能力,维持机体持续工作与保持速度的能力。有氧能力(Aerobic capacity),又称有氧耐力,是指人体在氧气供应充足的情况下,进行长时间、中低强度运动的能力;无氧能力(Anaerobic capacity),又称无氧耐力或力量耐力,是指人体在氧气供应不足的情况下,进行短时间、高强度运动的能力。 (1)有氧能力方面:DLTT提高乳酸阈值水平,挪威青年精英运动者在1周训练日中2 d进行双阈值刺激(如表4),使训练负荷保持在运动者承受范围内,通过持续有氧、无氧训练"


刺激,提高运动者机体耐受度从而提高机体乳酸阈值水平[37]。因DLTT要求对训练量与训练强度有明确要求,运动者可以在不同且固定工作区间内提高自己的表现,尤其是在乳酸阈值以下和以上的强度训练,DLTT有助于提高身体从血液中清除乳酸的能力,从而提高运动者的无氧能力。这与Wen等[38]提出的耐力项目高水平运动者长期进行“乳酸阈强度”或“混氧强度”的训练会导致交感神经疲劳,机体不能产生良性适应的观点一致。同时,随着乳酸阈的提高,运动者在高强度运动中会更加经济和高效,减少不必要的能量浪费。 (2)无氧能力方面:DLTT提升运动者在高强度、短时间运动中保持较高的速度耐力,维持运动者长时间运动中的水平速度。另外,DLTT通过提高身体对氧气的利用效率,延缓乳酸在肌肉中的积累速度[39],增加肌肉中所存贮糖原的数量,以及为中低速度训练提供热量能源,从而使得运动者减少对肌肉糖原的依赖,进而为高强度的练习提供充足的糖原,实现无氧能力的提升。同时,一天2次阈值训练可以提高运动期间糖原分解的速率,同时增加氧化利用丙酮酸和/或乳酸的能力,可以导致乳酸/速度曲线向右偏移,表明在相同的绝对速度下,运动者可以维持更高的血乳酸水平,从而提高运动效率[40]。最后,在DLTT实践应用过程中,增强心血管与呼吸系统功能从而实现提升将氧气输送到骨骼肌的能力[41],因DLTT“负荷强度”的明确规定与监测,可以降低“心率变异性”可能导致的伤病风险。 2.3.3 DLTT对中枢神经与外周疲劳的影响 DLTT通过“大量低强度”应激刺激可以改善神经传导效率,增强神经系统对肌肉的控制能力,减少疲劳感,使运动者能更长时间保持高强度输出。中枢神经疲劳(Central Nerve Fatigue)是指发生在从大脑皮质至脊髓运动神经元的疲劳,外周疲劳(Periphery fatigue)是指主要发生在神经-肌肉接点、肌细胞膜、细胞器和肌肉收缩蛋白等部位的疲劳。 (1)DLTT对中枢神经疲劳的影响:DLTT通过在一天中2次进行乳酸阈值训练,运动者可以在不积累过多疲劳的情况下,更频繁地刺激中枢神经系统,该训练模式有助于减少单次训练中枢神经系统的疲劳积累[42]。长期进行DLTT的运动者,其神经系统可能对乳酸的耐受性增强,能够更好地适应乳酸的存在,减少乳酸对中枢神经系统功能的抑制[43-44]。同时,促进神经元的生长和修复,增强神经系统的可塑性和恢复能力,有助于运动者在训练和比赛中更好地应对中枢疲劳[45]。另外,DLTT通过有节奏的疲劳练习,可以防止肌肉缺血,从而减缓疲劳的发展。 (2)DLTT对外周疲劳的影响:DLTT可以优化肌肉的能量代谢,提高肌肉对氧气的利用效率,从而在高强度运动中减少乳酸的积累,减少肌肉损伤和炎症,降低外周疲劳的发生。研究表明,适当的乳酸阈值训练(精英运动者周跑量140-160 km,2次/周阈值训练)可以提高肌肉对乳酸的清除能力,减少肌肉中的乳酸积累,从而减少肌肉损伤。另外,DLTT还能促进乳酸向葡萄糖的转化,为肌肉提供更多的能量来源,进一步减少外周疲劳的发生[46]。 最后,DLTT还能促进肌肉蛋白质的合成和肌肉纤维的增粗[47],从而增加肌肉力量和爆发力,减少外周疲劳的发生。 2.4 DLTT的作用机制 “机制”是诠释事物变化的理由依据,反映形成要素及要素之间的自然(变量)关系。已有研究对LTT的生物学机制进行研究,DLTT作为LTT的一种特殊形式,作用机制与其类似。运动者内在机制变化是“非线性-化学反应”而非“线性-累加效应”,呈现出内在功能要素“复杂互嵌”且“整合设计”的特点[48-51],目前对DLTT作用机制的研究结论并未完全统一,但是与LTT相比,DLTT在肌肉适能、无氧与有氧能力、中枢神经与外周疲劳的积极效应是相对较明显的,从而提升周期类体能项目运动者的竞技表现、对专项体能也存在潜在的积极作用,产生这些积极效应的作用机制可以归纳为有且不仅限于以下几方面。 2.4.1 激素分泌 有氧阈值训练过程中,分泌睾酮[52];同时,在有氧运动中,尤其是接近最大心率时,脑垂体会分泌生长激素,这被称为“青春之泉”。睾酮对肌肉蛋白质的合成、肌肉力量和肌肉体积的增长都有积极作用[53]。生长激素可以刺激细胞生长,增加肌肉质量,并促进脂肪代谢[54],已有研究证实,采取中等负荷强度60%-75% HRmax的有氧阈值训练可以有效刺激生长激素的分泌[55-56],同时不会过度疲劳。其他学者发现了相同的结论,如WIDEMAN等[55]研究发现采取间歇一两分钟、缓慢走动或慢跑、保持心率在60%-70%最大心率,同样可以促进生长激素的分泌。另外,60%-80% HRmax有氧阈值训练能够提升睾酮水平[57]。DLTT训练原则中要求阈值训练日上午单元进行有氧阈训练且训练负荷< 2 mmol/L,2 mmol/L对应62%-82%HRmax,DLTT可以促进睾酮、生长激素等激素的释放增多,这可能是肌肉适应性与可塑性的原因之一。 无氧阈值训练过程中,机体会分泌胰岛素样生长因子1,在胰岛素样生长因子1与生长激素协同作用机制下,促进肌肉细胞的分裂和生长,增加蛋白质合成[58-59]。同时,机体也会分泌肾上腺素(Epinephrine)和去甲肾上腺素(Norepinephrine)增加心输出量和血管扩张,为肌肉供应氧气和营养物质,从而提高心率和血压,增加血液流动,提高能量供应[60]。已有研究证实,无氧阈训练中40%-60% HRmax低到中等强度区间的训练[61-62],肾上腺素和去甲肾上腺素开始分泌,但胰岛素样生长因子1分泌较少;60%-80% HRmax乳酸阈值区间的训练,胰岛素样生长因子1开始显著分泌,肾上腺素和去甲肾上腺素分泌增加[63-65];80%-90% HRmax接近或超过乳酸阈值的高强度运动,胰岛素样生长因子1、肾上腺素和去甲肾上腺素的分泌显著增加[40,66]。DLTT训练原则中要求阈值训练日下午单元进行无氧阈训练且训练负荷2.0-4.5 mmol/L 82%-92% HRmax/92%-97% HRmax,在下午单元内胰岛素样生长因子1、肾上腺素、去甲肾上腺素显著分泌,促进肌肉的生长与修复,进而增强肌肉适能,这可能是DLTT的作用机制之一。 2.4.2 蛋白质合成与抑制调节 蛋白质在训练中扮演着至关重要的角色,运动训练能够促进蛋白质合成,不仅对肌肉的生长和修复至关重要,还在能量代谢、激素调节和免疫功能等方面发挥重要作用[67-68]。传统乳酸阈值训练过程促进蛋白质合成的观点得到了多项科学研究的支持。有氧阈值与无氧阈值训练促进蛋白质合成与抑制有着相同作用通路,也存在着差异。一方面,有氧阈值训练过程中,在60%-80% HRmax负荷范围条件下进行的有氧运动,已经被多项研究证实可以提高胰岛素敏感性[69-71],增强以胰岛素敏感性介导的氨基酸摄取和蛋白质合成[72-73],从而支持肌肉蛋白质合成和修复,帮助肌肉生长和恢复。另外,有氧训练(60%-75% HRmax)过程中可以保持稳定的能量供应从而抑制蛋白质降解,同时改善乳酸代谢,减少其对蛋白质的分解作用[74]。另一方面,无氧阈值训练过程中,如BAAR[75]综述了训练引起的骨骼肌变化,特别强调了乳酸阈值训练对mTOR通路的激活作用,从而促进蛋白质合成,增加肌肉质量和力量。PHILP等[76]介绍了耐力训练的特点,包括阈值训练对肌肉微损伤和修复的作用通路,从而促进蛋白质合成。另外,无氧训练抑制蛋白质降解有助于肌肉合成[77],增强肌肉力量和体积。 DLTT与上述生物学机制类似,有氧乳酸阈值(≈0.7-2.0 mmol/L)训练范围触发mTOR间接激活通路、减少氧应激、提高胰岛素敏感性、AMPK活化、内源性激素调节等可能是DLTT在有氧条件下提升肌肉适能、有氧与无氧能力的作用机制之一。DLTT在无氧乳酸阈值(≈2.0-4.5 mmol/L)训练区间触发mTOR通路、提升胰岛素敏感性、增加生长激素和睾酮、降低蛋白酶活性等,以上生物学机制通路可能是DLTT在无氧条件下提升肌肉适能、有氧与无氧能力的作用机制之一。 2.4.3 肌纤维募集与细胞肿胀 肌纤维募集机制是指在运动过程中通过神经系统激活更多的肌纤维来完成特定任务,可能是提高肌肉适能的作用机制之一[78]。已有研究证实,有氧阈值训练(60%-75% HRmax、持续30-60 min)主要激活Ⅰ型(慢肌)纤维[79-80],这些纤维具有较高的线粒体密度和氧化酶活性,适合长时间的有氧运动,从而提高有氧代谢能力;无氧阈值训练(85%-95% HRmax,持续时间1-5 min,间歇性训练)主要激活具有较高的爆发力和力量输出的Ⅱ型(快肌)纤维[81],提高Ⅱ型纤维的糖酵解能力和乳酸清除能力,从而减少疲劳感。传统乳酸阈值训练通常在一个训练日进行单乳酸阈值(有氧或无氧)训练刺激,主要改善机体一种肌纤维类型(Ⅰ型或Ⅱ型)。DLTT在阈值训练日内同时进行双阈值训练,从而对Ⅰ型、Ⅱ型肌纤维均有改善。因此,肌纤维募集机制可能是DLTT改善肌肉适应性、弹性、可塑性的作用机制之一。 细胞肿胀机制是指在双乳酸运动训练过程中,由于代谢物积累和渗透压变化,肌肉细胞吸收水分并膨胀的现象[82]。细胞肿胀导致肌纤维的横截面积增加、有助于清除代谢废物提高耐力,同时还可以改善局部血流,提高氧气和营养物质的输送[61]。细胞肿胀产生的机械信号有助于提高运动单位的同步化[83],使肌肉收缩更加高效。HOLLOSZY等[79]发现有氧训练条件下尤其接近有氧乳酸阈值(65%-85% HRmax、2 mmol/L)的长时间跑步/自行车训练过程中可能会导致细胞肿胀。HOFFMAN等[84]学者的研究进一步证实了这一观点。同时,采取间歇式训练手段(85%-95% HRmax、1 min间歇/不充分恢复)、持续跑训练法(65%-85% HRmax、30 min-数小时)会导致机体细胞肿胀[85-86]。DLTT在阈值训练日AM单元(上午)中要求62%-82% HRmax有氧长距离跑与上述证据训练条件区间相符,在PM单元(下午)开展的无氧阈训练多采取间歇训练手段(75%-80% HRmax/65%-82% HRmax;不充分间歇时间一两分钟)同样契合上述证据中训练要求。DLTT与LTT生物机制类似,因此,细胞肿胀同样可能是DLTT的作用机制之一。 2.4.4 线粒体生物合成与呼吸功能链改善 线粒体生物合成是指在接近乳酸阈值的强度下进行持续训练能够促进细胞内线粒体数量和质量的增加。线粒体数量增加,提高细胞的能量供应能力[87-88];线粒体质量改善,提升线粒体的结构和功能,使其更高效地进行能量代谢[89-90];长时间、持续运动提高线粒体的代谢能力和适应性。过往研究发现,在中等负荷强度(50%-70% HRmax、50%-70% VO?max)[91-92]、不完全疲劳的有氧跑步、自行车等训练条件下开始激活生理和生化信号通路并启动线粒体生物合成机制。GRANATA等[93]、GIBALA等[94]的研究成果进一步佐证这一观点。另外,也有研究成果发现短时间内进行达到或超过85%-95% VO?max、80%-90% HRmax、20-60 min、3-5次/周频率的高强度运动[71,95-96],如高强度间歇训练,可以有效促进线粒体生物合成,提高肌肉的氧化能力,激活肌肉细胞内的能量感应通路和线粒体生成的关键调控因子,对提高耐力有积极作用。DLTT阈值训练日的AM单元(上午)训练类型、负荷强度与线粒体生物合成机制的启动类似,PM单元(下午)的训练类型、负荷强度与加速线粒体生物合成类似,因此,线粒体生物合成机制可能是DLTT的作用机制之一。 呼吸功能链改善是指线粒体呼吸链功能的增强或优化,呼吸功能链的所有组件都位于线粒体内膜上,线粒体通过氧化磷酸化将糖类、脂肪和蛋白质分解产生的代谢物转化为三磷酸腺苷,为细胞提供能量[97]。因此,呼吸功能链改善与线粒体生物合成的关系相辅相成,改善呼吸功能链是增强线粒体功能的核心途径。呼吸功能链改善可以增强肌肉细胞的能量供应能力、提高耐力和力量表现、预防代谢性疾病、减少氧化应激损伤[98-101]。已有研究证实,有且不限于三类训练条件下,能够改善机体呼吸功能链:其一,有氧耐力训练(中等强度、长时间持续训练),在50%-75% VO?max、持续> 30 min、慢跑/游泳/自行车/划船等周期体能运动,能够增加线粒体数量(线粒体生物合成)进行呼吸功能链改善[66,102];其二,高强度间歇训练,短时间内达到或超过85%-95% VO?max、高强度运动与低强度恢复期交替进行、持续20-30 min[103],能够强烈刺激线粒体生物合成信号通路,增加线粒体呼吸链蛋白的表达[104],提高肌肉细胞的氧化能力和耐力;其三,接近或略高于无氧阈值的训练,强度要求75%-85% VO?max[105],持续时间20-60 min,能够增强肌肉代谢应激,激活AMPK等能量感应通路,提高线粒体呼吸链复合物的功能[106]。以上训练类型,DLTT训练计划与阈值训练日都涵盖其中,特别是有氧耐力训练、接近或略高于无氧阈值的训练,在训练条件下呼吸功能链改善,从而提高耐力和力量表现。因此,这可能是DLTT提高能量代谢的重要原因。 2.4.5 神经递质调节 神经递质调节是指神经递质在神经系统中通过调控其释放、作用和降解,来影响神经元之间的信息传递的过程。神经递质如乙酰胆碱在神经肌肉接头处传递信号,帮助肌肉收缩和放松[107],实现精确的动作控制;多巴胺和去甲肾上腺素影响动力和能量水平,帮助提升运动表现和耐力、缓解精神疲劳。已有研究证实,高强度间歇训练在接近或达到乳酸阈值[108]、每周两三次、完全恢复的条件下,利用神经递质的调节来提升机体运动的表现[109-110]。另外,20-30 min的高强度有氧运动会提高去甲肾上腺素和多巴胺水平[111-112]。以此,零散案例证据在一定程度上可以说明神经递质调节可能是DLTT的作用机制之一。但是,神经递质的调节涉及多种生物化学途径和相互作用,理解其在训练中的具体机制仍然复杂且不完全[113];同时,训练中的心理状态(如焦虑、压力)对神经递质的影响尚未完全理解,心理因素与生物学机制的交互作用仍需深入探讨。 2.5 DLTT的待解问题与应用要点 2.5.1 待解问题 DLTT作为运动训练提升运动者耐力素质、乳酸阈值承受与清除能力的一种新方法,受到了国内外运动训练科研人员与一线教练员的广泛关注,以独特的训练理念与显著的训练成果展示巨大的应用价值。正如大多数新兴训练方法都需要经历“经验案例”到“理论建构”的渐变阶段、“不成熟探究”到“成熟推广”的转化阶段,DLTT也不例外,仍然存在诸多待解之谜与阻碍“体系逻辑”闭环的问题,存在但不仅限于以下几方面内容。 (1)应用对象问题:DLTT是否适用于不同运动水平、全年龄阶段的运动者?现有研究中DLTT的研究对象多为奥运/世界/洲际冠军、高水平运动选手,鲜有对不同运动水平的运动者开展研究;另外,当前研究案例对象的年龄跨度在16-25岁,是否适用于其他年龄阶段的运动人群尚未有证据支撑,尤其是业余运动爱好者与其他年龄阶段的群体。因此,DLTT的适用人群与年龄阶段亟待进一步研究证实。应进一步研究DLTT应用对象范围,以此验证DLTT的普适性,以此满足不同水平、不同年龄、不同层次的运动者量身制定训练方案。 (2)训练方案问题:DLTT的训练计划、训练内容、训练负荷结构(负荷量/负荷强度)、训练密度、间歇时间缺乏统一的标准和指导原则。例如,在阈值训练日中,无氧阈训练与有氧阈训练的内容比例应如何平衡,以达到最佳的训练效果?这些关键问题的答案,对于DLTT的推广和实际应用至关重要。 (3)作用机制问题:当前DLTT生物机制尚未明确,此问题涉及多个复杂的生理和生化学科知识。尽管已有研究初步揭示了乳酸在能量代谢中的重要作用,对于DLTT如何具体影响线粒体功能、能量代谢和神经调节的生物学机制,尚需更多的基础研究支持。理解这些生物学机制将有助于优化训练方案,提高运动表现,并为运动者的长期发展提供支持。 (4)效果评估问题:DLTT的长期效果评估与持续性的适应性变化是当前研究的难点之一。具体而言,如何评估DLTT训练后的身体适应性?训练后运动者机体的适应能力与身体功能应激是否可以匹配?运动者专项运动成绩、专项耐力水平是否提升?其中线粒体功能、乳酸清除能力、能量代谢效率及肌肉力量等方面的变化将是效果评估的关键内容。此外,长期训练是否能带来持续的表现提升,或者在一定时间后是否会出现适应性停滞,也是亟待探讨的问题。 (5)安全应用问题:DLTT是否会对运动者产生负面影响。阈值训练日中频繁对机体进行阈值刺激,是否身体应激反应过大,精神疲劳与状态不佳,特别是对于初学者或生理条件较弱的运动者。不同水平的运动者负面影响的效应量是否相同等诸多安全性问题,因此,如何规避DLTT应用风险有待进一步研究。 2.5.2 应用要点 DLTT具有广阔的应用前景,能够针对性地提升运动者的有氧和无氧代谢能力,然而实际应用过程中要遵循个性化与科学化的原则,根据参赛目的与训练目标,合理设计DLTT训练内容并重视训练负荷的监控,以此充分发挥DLTT的训练功能与优势。因此,应用DLTT过程中应遵循但不仅限于以下几方面内容。 (1)个性化的训练方案:在DLTT训练内容设计过程中应充分考虑运动者的年龄、体能水平和训练背景,制定个性化的DLTT训练方案,以确保安全和效果。同时,持续监控运动者的反馈和适应情况,适时调整训练内容和强度,确保训练效果最大化,有效规避过度训练的风险/无效训练的比例。 (2)阈值训练日负荷强度的设计与监控:用心率监测仪、乳酸测试仪等设备,实时监控训练强度,确保阈值训练日上午单元有氧阈值训练负荷强度要求达到0.7-2.0 mmol/L、下午单元无氧阈值训练负荷强度要求达到2.0-4.5 mmol/L,每周阈值训练日安排2次且间隔1 d。持续记录训练数据,及时发现问题并进行调整。 (3)适用的运动项目:DLTT并非适用于所有运动项目,建议应用于体能主导周期性项目中。另外,在设计DLTT训练内容时,应充分考虑具体项目的专项需求,以确保与专项训练相协调。如田径中长跑、马拉松、长距离游泳、铁人三项、自行车等。技能主导类难美性项目运动项目应谨慎使用。 (4)训练安全与科学恢复原则:一方面,DLTT训练过程中教练员、科研工作者、运动训练工作人员要密切关注受训运动者的身体反应,如疲劳程度、心率变化、精神状态等,防止过度训练;另一方面,注重运动者的营养补充与疲劳消除,确保运动者摄入足够的蛋白质、维生素等营养物质,保证高质量、充足的睡眠,必要时进行心理辅导来缓解运动者的压力与心理疲劳。"

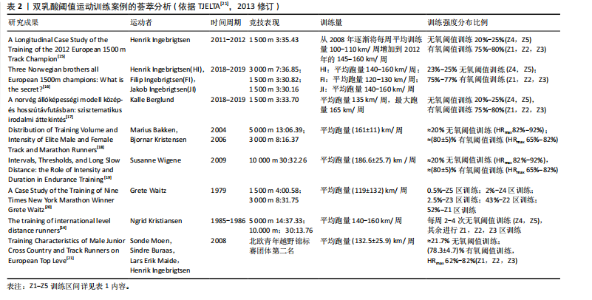
| [1] JOHANSEN JM, SUNDE A, HELGERUD J, et al. Relationships Between Maximal Aerobic Speed, Lactate Threshold, and Double Poling Velocity at Lactate Threshold in Cross-Country Skiers. Front Physiol. 2022;13: 829758. [2] FORTE LDM, MANCHADO-GOBATTO FB, RODRIGUES RCM, et al. Non-exhaustive double effort test is reliable and estimates the first ventilatory threshold intensity in running exercise. J Sport Health Sci. 2018;7(2):197-203. [3] SEILER S. What is best practice for training intensity and duration distribution in endurance athletes? Int J Sports Physiol Perform. 2010; 5(3):276-291. [4] 朱苗苗,孔凡明,赵倩.运动调控乳酸代谢 [J].中国组织工程研究, 2023,27(2):322-328. [5] KJØSEN TALSNES R, TORVIK PØ, SKOVERENG K, et al. Comparison of acute physiological responses between one long and two short sessions of moderate-intensity training in endurance athletes. Front Physiol. 2024;15:1428536. [6] SHEN T, WEN X. Heart-rate-based prediction of velocity at lactate threshold in ordinary adults. J Exerc Sci Fit. 2019;17(3):108-112. [7] NEUNHÄUSERER D, REICH B, MAYR B, et al. Impact of exercise training and supplemental oxygen on submaximal exercise performance in patients with COPD. Scand J Med Sci Sports. 2021;31(3):710-719. [8] MATSUMOTO K, KOBA T, HAMADA K, et al. Branched-chain amino acid supplementation increases the lactate threshold during an incremental exercise test in trained individuals. J Nutr Sci Vitaminol (Tokyo). 2009; 55(1):52-58. [9] LAROCHE DP, AMANN M, RUNDELL KW. Grade influences blood lactate kinetics during cross-country skiing. J Strength Cond Res. 2010; 24(1):120-127. [10] GURNEY T, BROUNER J, SPENDIFF O. Twenty-one days of spirulina supplementation lowers heart rate during submaximal cycling and augments power output during repeated sprints in trained cyclists. Appl Physiol Nutr Metab. 2021;47(1):18-26. [11] 黎涌明.动作与能量代谢视角下的体能[J].体育科研,2022,43(5): 1-6+35. [12] 黎涌明,张蓓,王雄,等.训练科学与训练实践的深度融合:现实•障碍•建议[J].体育科研,2020,41(6):1-9. [13] 黎涌明,殷明越,李博,等.运动与训练科学的五大“论战”[J].首都体育学院学报,2024,36(1):22-33. [14] TJELTA LI. The training of international level distance runners. Int J Sports Sci Coach. 2016;11(1):122-134. [15] TJELTA LI .A Longitudinal Case Study of the Training of the 2012 European 1500 m Track Champion. Int J Appl Sports Sci. 2013;25(1): 11-18. [16] TJELTA LI .Three Norwegian brothers all European 1500m champions: What is the secret. Int J Sports Sci Coach. 2019;14(5):694-700. [17] KELEMEN B, BENCZENLEITNER O, TÓTH L. The Norwegian Endurance Model in Middle and Long-Distance Running: A Systematic Review of the Literature. Hungarian Rev Sport Sci. 2022;23(4):19-25. [18] ENOKSEN E, TJELTA AR, TJELTA LI. Distribution of training volume and intensity of elite male and female track and marathon runners. Int J Sports Sci Coach. 2011;6(2):273-293. [19] SEILER S, TØNNESSEN E. Intervals, Thresholds, and Long Slow Distance: the Role of Intensity and Duration in Endurance Training.Training. 2006; 13:32-53. [20] TJELTA LI, TØNNESSEN E, ENOKSEN E. A case study of the training of nine times New York Marathon winner Grete Waitz. Int J Sports Sci Coach. 2014; 9(1):139-159. [21] TJELTA LI, ENOKSEN E. Training Characteristics of Male Junior Cross Country and Track Runners on European Top Level. Int J Sports Sci Coach. 2010;5(2):193-203. [22] 聂秋,李丹阳,陈建.肌力平衡:释义、内在机制及实践应用[J].中国体育科技,2023,59(3):28-36. [23] FLECKENSTEIN D, SEELHÖFER J, WALTER N, et al. From Incremental Test to Continuous Running at Fixed Lactate Thresholds: Individual Responses on %VO2max, %HRmax, Lactate Accumulation, and RPE. Sports (Basel). 2023;11(10):198. [24] KRISHNAN A, SIVARMAN A, ALWAR T, et al. Relevance of lactate threshold in endurance sports: A Review. Ejpmr. 2020;7(9):513-524. [25] FAUDE O, KINDERMANN W, MEYER T. Lactate threshold concepts: how valid are they? Sports Med. 2009;39(6):469-490. [26] BENEKE R. Maximal lactate steady state concentration (MLSS): experimental and modelling approaches. Eur J Appl Physiol. 2003; 88(4-5):361-369. [27] KREHER JB. Diagnosis and prevention of overtraining syndrome: an opinion on education strategies. Open Access J Sports Med. 2016;7: 115-122. [28] CASADO A, FOSTER C, BAKKEN M, et al. Does Lactate-Guided Threshold Interval Training within a High-Volume Low-Intensity Approach Represent the “Next Step” in the Evolution of Distance Running Training? Int J Environ Res Public Health. 2023;20(5):3782. [29] DEVLIN J, PATON B, POOLE L, et al. Blood lactate clearance after maximal exercise depends on active recovery intensity. J Sports Med Phys Fitness. 2014;54(3):271-278. [30] BISHOP D, EDGE J, THOMAS C, et al. High-intensity training enhances muscle responses. J Appl Physiol. 2008;105(3):857-864. [31] LEE MC, HSU YJ, CHEN MT, et al. Efficacy of Lactococcus lactis subsp. lactis LY-66 and Lactobacillus plantarum PL-02 in Enhancing Explosive Strength and Endurance: A Randomized, Double-Blinded Clinical Trial. Nutrients. 2024;16(12):1921. [32] GIBALA MJ, MCGEE SL. Metabolic adaptations to short-term high-intensity interval training: a little pain for a lot of gain? Exerc Sport Sci Rev. 2008;36(2):58-63. [33] BROOKS GA. Lactate: link between glycolytic and oxidative metabolism. Sports Med. 2007;37(4-5):341-343. [34] ZOLADZ JA, SZKUTNIK Z, MAJERCZAK J, et al. The effect of a 3-week cycling training on the activity of the enzyme phosphofructokinase (PFK) in human vastus lateralis muscle. Biochem Soc Trans. 2004; 32(Pt 2):333-335. [35] COYLE EF. Substrate utilization during exercise in active people. Am J Clin Nutr. 1995;61(4 Suppl):968S-979S. [36] ZHANG L, XIN C, WANG S, et al. Lactate transported by MCT1 plays an active role in promoting mitochondrial biogenesis and enhancing TCA flux in skeletal muscle. Sci Adv. 2024;10(26):eadn4508. [37] KELEMEN B, BENCZENLEITNER O, TÓTH L. The Norwegian double-threshold method in distance running: Systematic literature review. Sci J Sport Perform. 2024;3(1):38-46. [38] WEN D, UTESCH T, WU J, et al. Effects of different protocols of high intensity interval training for VO(2)max improvements in adults: A meta-analysis of randomised controlled trials. J Sci Med Sport. 2019; 22(8):941-947. [39] KILPATRICK MW, JUNG ME, LITTLE JP. High-intensity interval training: A review of physiological and psychological responses. Acsms Health Fit J. 2014;18(5):11-16. [40] LEVERITT M, ABERNETHY PJ, BARRY BK, et al. Concurrent Strength and Endurance Training. Sports Med. 1999;28(6):413-427. [41] YU H, CHEN X, ZHU W, et al. A quasi-experimental study of Chinese top-level speed skaters’ training load: threshold versus polarized model. Int J Sports Physiol Perform. 2012;7(2):103-112. [42] BURGOMASTER KA, HOWARTH KR, PHILLIPS SM, et al. Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans. J Physiol. 2008; 586(1):151-160. [43] HARRIS CP, ANDREWS NA, JOHNSON KE, et al. Physiological Responses To Intermittent Blood Flow Restriction During Cycling Exercise: 3256 Board# 77 May 29 2: 30 PM-4: 00 PM. Med Sci Sports Exerc. 2020; 52(7S):889. [44] 曾仁杰,周珂,姒刚彦,等.内感受对运动表现的影响:发生机制与潜在路径[J].中国体育科技,2024,60(2):21-27. [45] KELEMEN B, BENCZENLEITNER O, TÓTH L. The Norwegian Double- Threshold Method in Distance Running: Systematic Literature Review. Sci J Sport Perform. 2023;3(1):38-46. [46] DE FEO P, DI LORETO C, LUCIDI P, et al. Metabolic response to exercise. J Endocrinol Invest. 2003;26:851-854. [47] WEST DW, PHILLIPS SM. Anabolic processes in human skeletal muscle: restoring the identities of growth hormone and testosterone. Phys Sportsmed. 2010;38(3):97-104. [48] 魏博.整合分期训练模式的内涵与功能维度[J].中国体育教练员, 2024,32(3):20-26. [49] 魏博. 整合分期训练理论视域中“科技引领”要素的系统地位、结构功能与实践启迪[C]//中国体育科学学会. 第十三届全国体育科学大会论文摘要集:专题报告(运动训练学分会). 成都体育学院, 2023. [50] 魏博.整合分期理论视域下赛前竞技状态调控新路径的研究[C]//中国体育科学学会. 第八届中国体育博士高层论坛论文汇编(专题报告). 成都体育学院,2022. [51] 翟海亭,李成,夏吉祥,等.整合性神经肌肉训练预防下肢运动损伤的元分析 [J].中国组织工程研究,2022,26(15):2454-2460. [52] KRAEMER WJ, RATAMESS NA. Hormonal responses and adaptations to resistance exercise and training. Sports Med. 2005;35(4):339-361. [53] GRIGGS RC, KINGSTON W, JOZEFOWICZ RF, et al. Effect of testosterone on muscle mass and muscle protein synthesis. J Appl Physiol (1985). 1989;66(1):498-503. [54] SABAG A, CHANG D, JOHNSON NA. Growth Hormone as a Potential Mediator of Aerobic Exercise-Induced Reductions in Visceral Adipose Tissue. Front Physiol. 2021;12:623570. [55] WIDEMAN L, WELTMAN JY, HARTMAN ML, et al. Growth hormone release during acute and chronic aerobic and resistance exercise: recent findings. Sports Med. 2002;32(15):987-1004. [56] SABAG A, CHANG D, JOHNSON NA. Growth Hormone as a Potential Mediator of Aerobic Exercise-Induced Reductions in Visceral Adipose Tissue. Front Physiol. 2021;12:623570. [57] TREMBLAY A, SIMONEAU JA, BOUCHARD C. Impact of exercise intensity on body fatness and skeletal muscle metabolism. Metabolism. 1994; 43(7):814-818. [58] HÄKKINEN K, PAKARINEN A, ALÉN M, et al. Serum hormones during prolonged training of neuromuscular performance. Eur J Appl Physiol Occup Physiol. 1985;53(4):287-293. [59] BAKER JS, MCCORMICK MC, ROBERGS RA. Interaction among Skeletal Muscle Metabolic Energy Systems during Intense Exercise. J Nutr Metab. 2010;2010:905612. [60] GOLBIDI S, LAHER I. Exercise and the cardiovascular system. Cardiol Res Pract. 2012; 2012(1):210852. [61] ASTORINO TA, ROBERSON DW. Efficacy of low-volume high-intensity interval training: a meta-analysis. J Strength Cond Res. 2010;24(1): 244-257. [62] BERG HM, HARGREAVES M. Influence of exercise intensity on skeletal muscle hormone receptor regulation. J Appl Physiol. 2006;100(6): 2044-2048. [63] COFFEY VG, HAWLEY JA. The molecular bases of training adaptation. Sports Med. 2007;37(9):737-763. [64] KRAEMER WJ, RATAMESS NA, FRENCH DN, et al. Hormonal responses to resistance exercise in women. Sports Med. 2009;39(12):1033-1060. [65] HÄKKINEN K, PAKARINEN A, ALÉN M, et al. Serum hormones during prolonged training of neuromuscular performance. Eur J Appl Physiol Occup Physiol. 1988;58(2):113-120. [66] RENNIE MJ, WACKERHAGE H, SPANGENBURG EE, et al. Control of the size of the human muscle mass. Annu Rev Physiol. 2004;66:799-828. [67] BURD NA, WEST DW, MOORE DR, et al. Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. J Nutr. 2011;141(4):568-573. [68] RASMUSSEN BB, PHILLIPS SM. Contractile and nutritional regulation of human muscle growth. Exerc Sport Sci Rev. 2003;31(3):127-131. [69] HOLLOSZY JO, KOHRT WM. Exercise. Obesity. 1996;84(1):77-81. [70] RICHTER EA, HARGREAVES M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 2013;93(3):993-1017. [71] HEATH GW, GAVIN JR 3RD, HINDERLITER JM, et al. Effects of exercise and lack of exercise on glucose tolerance and insulin sensitivity. J Appl Physiol Respir Environ Exerc Physiol. 1983;55(2):512-517. [72] GUILLET C, BOIRIE Y. Insulin resistance: a contributing factor to age-related muscle mass loss? Diabetes Metab. 2005;31:5S20-5S26. [73] BIOLO G, MAGGI SP, WILLIAMS BD, et al. Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol. 1995;268(3 Pt 1):E514-E520. [74] BROOKS GA. Intra- and extra-cellular lactate shuttles. Med Sci Sports Exerc. 2000;32(4):790-799. [75] BAAR K. Training-induced changes in skeletal muscle. J Appl Physiol. 2006;101(1):3-11. [76] PHILP A, MACDONALD AL, BAAR K. Features of endurance training. Compr Physiol. 2011;1(2):923-959. [77] TIPTON KD, WOLFE RR. Exercise-induced changes in protein metabolism. Acta Physiol Scand. 2001;162(3):377-387. [78] CARROLL TJ, SELVANAYAGAM VS, RIEK S, et al. Neural adaptations to strength training: moving beyond transcranial magnetic stimulation and reflex studies. Acta Physiol (Oxf). 2011;202(2):119-140. [79] HOLLOSZY JO, COYLE EF. Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J Appl Physiol Respir Environ Exerc Physiol. 1984;56(4):831-838. [80] BERGMAN BC, BUTTERFIELD GE, WOLFEL EE, et al. Muscle triglyceride metabolism during prolonged exercise in men: effects of training. Am J Physiol Endocrinol Metab.1999;277(4):E667-E674. [81] GASTIN PB. Energy system interaction and relative contribution during maximal exercise. Sports Med. 2001;31(10):725-741. [82] VISSING K, CLAUSEN T. Cell swelling in human skeletal muscle fibers during exercise. J Physiol. 2000;528(3):637-644. [83] FARINA D, MERLETTI R, MINETTO MA. The control of motor units in human movements. J Neurophysiol. 2014;112(11):2821-2834. [84] HOFFMAN MD, MCCORMICK S. Physiological responses to prolonged exercise. Int J Sports Physiol Perform. 2016;11(1):5-12. [85] LAURSEN PB, JENKINS DG. The scientific basis for high-intensity interval training: optimising training programmes and maximising performance in highly trained endurance athletes. Sports Med. 2002;32(1):53-73. [86] VOLLAARD NB, SHEARMAN JP, COOPER CE. Exercise-induced oxidative stress:myths, realities and physiological relevance. Sports Med. 2005; 35(12):1045-1062. [87] 常芸,高晓嶙.线粒体DNA多态性与人类运动能力的研究进展[J].体育科学,2004,24(11):26-29,78. [88] HOLLOSZY JO. Biochemical adaptations in muscle. Effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. J Biol Chem. 1967;242(9):2278-2282. [89] HOOD DA. Mechanisms of exercise-induced mitochondrial biogenesis in skeletal muscle. Appl Physiol Nutr Metab. 2009;34(3):465-472. [90] LITTLE JP, SAFDAR A, WILKIN GP, et al. A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis in human skeletal muscle: potential mechanisms. J Physiol. 2010;588(Pt 6):1011-1022. [91] EGAN B, ZIERATH JR. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metab. 2013;17(2):162-184. [92] HOLLOSZY JO. Biochemical adaptations in muscle. Effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. J Biol Chem. 1967;242(9):2278-2282. [93] GRANATA C, OLIVEIRA RS, LITTLE JP, et al. Training intensity modulates changes in PGC-1α and p53 protein content and mitochondrial respiration, but not markers of mitochondrial content in human skeletal muscle. FASEB J. 2016;30(2):959-970. [94] GIBALA MJ, LITTLE JP, MACDONALD MJ, et al. Physiological adaptations to low-volume, high-intensity interval training in health and disease. J Physiol. 2012;590(5):1077-1084. [95] BURGOMASTER KA, HUGHES SC, HEIGENHAUSER GJ, et al. Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans. J Appl Physiol (1985). 2005;98(6): 1985-1990. [96] MACINNIS MJ, GIBALA MJ. Physiological adaptations to interval training and the role of exercise intensity. J Physiol. 2017;595(9):2915-2930. [97] SARASTE M. Oxidative phosphorylation at the fin de siècle. Science. 1999;283(5407):1488-1493. [98] YAN Z, LIRA VA, GREENE NP. Exercise training-induced regulation of mitochondrial quality. Exerc Sport Sci Rev. 2012;40(3):159-164. [99] SHORT KR, BIGELOW ML, KAHL J, et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proc Natl Acad Sci U S A. 2005;102(15):5618-5623. [100] 林建健,宋洁.运动调控线粒体动力学变化的研究进展 [J].中国组织工程研究,2024,28(11):1767-1771. [101] 郭辉,孔健达,田春兰.线粒体自噬相关受体蛋白和信号通路在运动防治肌少症中的作用[J].中国组织工程研究,2024,28(27):4397-4404. [102] SPINA RJ, CHI MM, HOPKINS MG, et al. Mitochondrial enzymes increase in muscle in response to 7-10 days of cycle exercise. J Appl Physiol (1985). 1996;80(6):2250-2254. [103] GIBALA MJ, LITTLE JP, VAN ESSEN M, et al. Short-term sprint interval versus traditional endurance training: similar initial adaptations in human skeletal muscle and exercise performance. J Physiol. 2006; 575(Pt 3):901-911. [104] BURGOMASTER KA, HOWARTH KR, PHILLIPS SM, et al. Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans. J Physiol. 2008;586(1):151-160. [105] DAUSSIN FN, ZOLL J, DUFOUR SP, et al. Effect of interval versus continuous training on cardiorespiratory and mitochondrial functions: relationship to aerobic performance improvements in sedentary subjects. Am J Physiol Regul Integr Comp Physiol. 2008; 295(1):R264-R272. [106] EDGE J, BISHOP D, GOODMAN C. The effects of training intensity on muscle buffer capacity in females. Eur J Appl Physiol. 2006;96(1): 97-105. [107] 田浩,陈丁丁,王登,等.神经肌肉训练:研究热点、前沿变迁与趋势展望[J].中国组织工程研究,2025,29(24):5148-5157. [108] BUCHHEIT M, LAURSEN PB. High-intensity interval training, solutions to the programming puzzle: Part I: cardiopulmonary emphasis. Sports Med. 2013;43(5):313-338. [109] MCAINCH AJ. The influence of high-intensity interval training on brain-derived neurotrophic factor levels and cognitive function. Physiol Rep. 2013;1(6):e00157. [110] KINNUNEN H. Effects of high-intensity interval training on the neural control of muscle metabolism in humans. J Physiol. 2014;592(15): 3207-3220. [111] DIETRICH A, MCDANIEL J. Endurance exercise and the brain: a review of the evidence for the role of exercise in improving cognitive function. J Cogn Neurosci. 2004;16(2):151-166. [112] CHEN SH. Effects of high-intensity interval training on plasma catecholamine levels in young men. J Exerc Nutrition Biochem. 2014; 18(4):383-387. [113] 黎涌明.动作与能量代谢视角下的体能[J].体育科研,2022,43(5): 1-6+35. |
| [1] | Li Qinlong, Zhou Yue, Wang Shuo. Changing step frequency influences energy expenditure, surface electromyography, and gait characteristics when running at anaerobic threshold [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(26): 4153-4159. |
| [2] | Jia Xiao, Xue Xiaojing, Kong Zhenxing, Yu Jingjing, Sun Tingting, Zhang Yimin. Anaerobic threshold intensity of adults aged 20 to 29: a speculation based on a 20-meter shuttle run test [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(14): 2231-2235. |
| [3] | Yan Pingping, Wang Kun, Luo Jiong. Regulation mechanism and effect of jump shock-induced nuclear factor kappaB on bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(34): 5550-5557. |
| [4] | Li Ying-ying, Peng Li, Bi Chen-chao. Effects of different test programs on the maximal fat oxidation in young females [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(32): 5145-5149. |
| [5] | Shao Lian-jie. Autonomic nervous system: its response and adaptation to exercises [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(46): 7509-7516. |
| [6] | Yang Ruo-yu, Wang Yu-bin, Shen Xun-zhang, Cai Guang . Association of elite athlete performance and gene polymorphisms [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(7): 1121-1128. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||