Chinese Journal of Tissue Engineering Research ›› 2019, Vol. 23 ›› Issue (34): 5550-5557.doi: 10.3969/j.issn.2095-4344.1441
Previous Articles Next Articles
Regulation mechanism and effect of jump shock-induced nuclear factor kappaB on bone metabolism
- 1Chongqing Medical University, Chongqing 400016, China; 2Research center for Exercise Detoxification, College of Physical Education, Southwest University, Chongqing 400715, China
-
Received:2019-04-15Online:2019-12-08Published:2019-12-08 -
About author:Yan Pingping, Master, Lecturer, Chongqing Medical University, Chongqing 400016, China -
Supported by:Chongqing Medical University School of Physical Education Program, No. TY2018 01 (to YPP)
CLC Number:
Cite this article
Yan Pingping, Wang Kun, Luo Jiong. Regulation mechanism and effect of jump shock-induced nuclear factor kappaB on bone metabolism[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(34): 5550-5557.
share this article
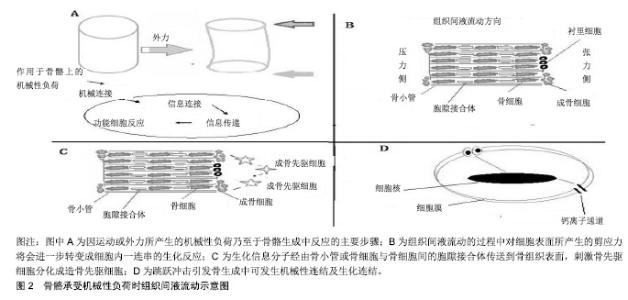
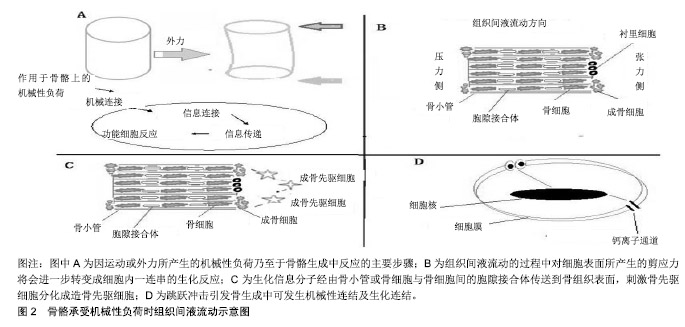
2.1 机械性负荷诱发骨骼的生成反应 骨代谢主要由成骨细胞与破骨细胞间的协调与配合来维持骨骼的结构与功能。成骨细胞可分为3种:活化的成骨细胞(存在于骨组织表面,约占所有成骨细胞数的5%)、衬里细胞(存在于骨组织表面之不活化的成骨细胞)及骨细胞(成熟的成骨细胞,包埋于骨基质中)。细胞与细胞间通过骨小管及胞隙接合体间形成网络联系,可供接收刺激与传送信息之用[15]。破骨细胞在骨代谢过程中所扮演与活化的成骨细胞相反的功能,即对骨骼进行破坏而产生骨吸收作用,从而驱使成骨细胞活化,这一过程称为骨重塑作用。 2.1.1 骨骼承受机械性负荷的反应机制 体外实验结果发现,成骨细胞及骨细胞皆与机械性传导所引致的骨生成有关,即此2种细胞都会对机械性负荷产生反 应[16-17],而骨细胞在机械性负荷影响局部骨再塑的过程中所扮演的角色比其他骨细胞更为重要[18-19]。通过培养皿中的骨细胞施予压力、牵引力或以液体流动对骨细胞产生剪应力,发现液体流动刺激产生的机械性负荷可能是活体中骨细胞生长的可靠力学模型[20]。从该液体流动模型看,组织间液流动可对骨细胞产生物理性刺激,当骨骼承受外力刺激时,骨骼产生变形,此变形会使得骨骼一侧产生压力,另一侧造成张力,组织间液体则会从压力端朝向张力侧流动,组织间液流动的过程中对细胞表面所产生的剪应力将会进一步转变成细胞内一连串的生化反应,见图2B。依据Gabriel等[21]推论指出,因运动或外力所产生的机械性负荷乃至于骨骼生成,其间的反应可分成4个步骤,分别是机械连结、生化连结、生化信息传递、功能细胞反应,见图2A。 跳跃动作对骨骼产生的物理性冲击,经由上述机制影响局部骨代谢,从而提升局部骨骼的骨质含量及骨质密度。Hinton等[22]研究发现,跳跃产生的机械性负荷的途径可能有2种:一种为肌肉的收缩,下肢骨骼必须承受起跳或落地时肌肉收缩造成的肌肉牵扯促使骨骼产生变形;另一种为外在刺激,落地时数倍体质量的地面反作用力的冲击,促使骨骼瞬间变形。故基于跳跃冲击引发骨生成可进行如下解释:①机械性连结:垂直冲击的外力转变成机械性信号经由骨细胞接收的过程;②生化连结:骨细胞膜上的机械性受器在感知机械性信号后,将此信息转换成胞内的化学变化,这些机械性受器目前较被广为研究证实,包含整合蛋白及牵张活化钙离子通道[23],见图2D,而上述2种机械性受器的机制再次分解两点描述:其一是整合蛋白:为一种横跨细胞膜的糖蛋白,可作为胞外基质的接受器,同时也与胞内细胞骨架及各种信息分子有交互作用。当胞外产生机械应力时,经由整合蛋白接收而将此机械信息传递到胞内的细胞核,并刺激细胞核产生与骨生成有关的基因表现[23];其二是牵张活化钙离子通道:在接受机械性负荷时,骨细胞膜上的钙离子通道会打开,进而使得胞外的钙离子流入细胞内,造成胞内钙离子浓度提高而活化胞内对钙离子反应性蛋白,进而引发骨生成作用;③生化信息传递:为生化信息分子经由感应细胞传至功能细胞的过程。在上述感应细胞因应机械性负荷之后,会分泌诸如促生长因子1、前列腺素E2、一氧化氮等促进骨生成的生化信息分子[24],这些细胞分泌的生化信息分子会经由骨小管或骨细胞与骨细胞间的胞隙接合体传送到骨组织表面,进而刺激骨先驱细胞分化成造骨先驱细胞,并且持续分化为成骨细胞,见图2C。 "
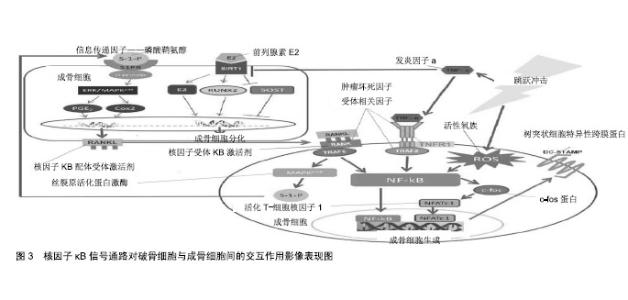
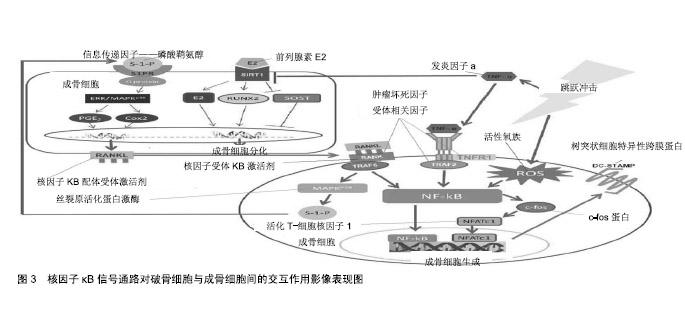
2.1.2 跳跃冲击诱发核因子κB信号通路在骨质代谢中扮演的角色 破骨细胞与成骨细胞间交互作用:骨质代谢的平衡主要由成骨细胞与破骨细胞两者共同作用,当骨骼组织老旧需更换,或因外力冲击使骨质损伤需重塑时,即可通过成骨细胞所分泌的核因子κB配体受体激活剂(receptor activator of nuclear factor-κB ligand, RANKL)与破骨前驱细胞表面核因子κB受体激活剂(receptor activator of nuclear factor-κB,RANK)结合,诱导破骨前驱细胞分化与融合成为成熟破骨细胞,以利骨吸收作用清除受损骨质面。RANK蛋白为肿瘤坏死因子受体家族成员之一,主要表现于星状细胞、巨噬细胞与单核球细胞,主导细胞的存活与黏附及细胞激素分泌等[12]。成熟且具有完整功能的破骨细胞的形成须受到许多细胞激素的调控,其中多经由RANKL蛋白的专一信号受体RANK蛋白活化后,启动一连串信息传递流程,促使多核成熟破骨细胞的生成与活化,而此过程可减少细胞凋亡的速度与概率。 RANKL蛋白为肿瘤坏死因子配体家族成员之一,是成骨细胞的膜蛋白。RANKL蛋白平时于骨骼中多停留于成骨细胞与基质细胞表面,经肿瘤坏死因子转换酶(如RANK,TNFR1及TRAF2蛋白等)刺激后,释放入血液成为可溶性RANKL,当成骨细胞膜上RANKL蛋白游离于体内与破骨细胞RANK蛋白结合,促使破骨细胞的分化与活化,也增强成熟破骨细胞的活性,使得蚀骨作用的产生,及增加破骨细胞存活时间,达到延缓成熟破骨细胞的凋 亡[22]。因RANKL蛋白同时具有调节免疫功能与骨质代谢的能力,该蛋白被认为是链接免疫功能与骨质代谢的重要枢纽;故免疫功能疾病时常导致骨质代谢的异常,如罹患风湿性关节炎患者,因局部炎症,造成T细胞大量分泌RANKL蛋白,被认为是导致炎症部位骨质流失的主要元凶[19]。RANKL-RANK蛋白信号通路对于骨质代谢影响主要着重于破骨细胞的生成,经由巨噬细胞集落刺激因子与其受体Ⅲ型酪氨酸激酶蛋白结合促使破骨前驱细胞进行增殖与分化,通过RANKL蛋白与白细胞介素1蛋白借由核因子κB信号通路的活化增加破骨细胞的存活[25];然而,细胞的聚集与融合过程需多次经由RANKL-RANK蛋白反复刺激,方能使单核破骨细胞融合为多核成熟的破骨细胞。整体信号通路表现通过RANKL蛋白刺激RANK蛋白活化,将启动细胞内信号蛋白肿瘤坏死因子受体相关因子(TRAF6)的活性,紧接着活化核因子κB信号通路,再往下游信号c-fos蛋白与转录蛋白活化T-细胞核因子1,最终诱导树突状细胞特异性跨膜蛋白(dendritic cell-specific transmembrane protein,DC-STAMP)的活化,促使功能完整的多核成熟破骨细胞的生成,见图3。 除此以外,RANKL-RANK-TRAF6蛋白信号通路并不只与破骨细胞分化有关,亦能诱发鞘氨醇激酶作用,产生信息传递因子磷酸鞘氨醇,调控由c-Fos蛋白与NFATs信号通路所诱发的融合蛋白DC-STAMP而影响破骨前驱细胞融合作用[13,26]。主要调节为磷酸鞘氨醇抑制p38蛋白的活化,导致c-fos蛋白与NFATc1蛋白的表现受到限制,进一步发现磷酸鞘氨醇能增加T细胞活化与造骨细胞的存活。磷酸鞘氨醇亦会影响造骨细胞内信息传递,通过与造骨细胞表面受体结合,经丝裂原活化蛋白激酶信号通路,再诱发前列腺素E2分泌,促使RANKL蛋白表现增加。磷酸鞘氨醇不仅调节着破骨细胞的分化,亦维持着造骨细胞的存活与迁移,以及促进造骨细胞与破骨细胞之间的连结。 核因子κB调节信号通路特征:核因子κB信号通路在人体常见的蛋白型态有P59,P52,P65,RelA与C-Rel等5种,调节先天免疫细胞活化、树突细胞成熟与淋巴细胞活化等阶段炎症因子。核因子κB信号通路不仅是发炎反应重要信号传递蛋白,亦是破骨细胞发展过程中扮演重要信号的传递角色[12]。故核因子κB信号通路被认为是汇聚炎症反应与骨质代谢之间的重要共通枢纽。 (1)破骨细胞生成主要信号通路为“核因子配体受体-核因子受体”蛋白反复活化转化过程,在核因子κB信号通路上[27],其亚群蛋白P50与P52在破骨前驱细胞发展成为多核成熟破骨细胞过程的必要传递蛋白,不过对于破骨细胞的存活则非主要蛋白[25]。核因子κB信号通路的活化将触发下游信号蛋白c-fos与“活化T细胞核因子”[28],NFATc1蛋白为诱发破骨细胞表面融合蛋白DC-STAMP的重要蛋白,促使单核破骨细胞融合形成多核的破骨细胞[26],如图2;此外,NFATc1蛋白也在多核成熟破骨细胞活化的最终阶段扮演重要的活化蛋白[29],是整体破骨细胞发展中调控细胞分化与融合的关键蛋白[28]。 (2)核因子κB信号通路在骨质疏松症中扮演抑制骨形成的关键角色。核因子κB信号通路具有抑制成骨细胞分化与功能的能力,为防止疏松骨质则须维持成骨细胞的功能,因此身体为维持骨骼平衡而发展出限制性代偿骨形成机制;故核因子κB信号通路对于成骨细胞不完全只具有抑制作用[27]。核因子κB信号通路通过调节破骨细胞与成骨细胞间的活化表现,经成骨细胞借由肿瘤坏死因子、白细胞介素1β及甲状旁腺素的刺激活化核因子κB信号通路,促使破骨细胞产生活性而表现出骨吸收功 能[13]。另一发现是肿瘤坏死因子α蛋白能诱发基质金属蛋白酶9而作用于成骨细胞,基质金属蛋白酶9是骨疾病的相当重要观察因子,能导致Ⅰ型与V型胶原降解与变性,进一步促进骨吸收及抑制骨形成,且在肿瘤坏死因子α活化信号通路中,核因子κB为其主要传递信号通路[14]。 (3)破骨细胞形成过程中,如何由单核细胞变成多核细胞的关键因子是融合蛋白DC-STAMP[30]。研究发现:在RANKL-RANK蛋白信号通路将活化信号的传递中,融合蛋白DC-STAMP的活化需通过转录蛋白NFATc1诱发,而NFATc1蛋白的活化又是通过由c-fos蛋白所诱发产生,级联活化的蛋白除了上游信号的刺激,其余皆是经由核因子κB信号通路将信息传递并活化下游蛋白[28]。可见,核因子κB信号通路、c-fos蛋白与NFATc1蛋白三者间信号传递关系的重要性。通过RANKL蛋白刺激破骨细胞形成需经由核因子κB信号通路将信息传递,诱发c-fos蛋白活化,紧接着活化转录蛋白NFATc1,最后诱导融合蛋白DC-STAMP表现于细胞表面,见图2,从而促使单核破骨细胞进行细胞融合成为成熟多核破骨细胞。 2.2 跳跃冲击对骨质代谢的影响作用 2.2.1 不同跳跃类型的地面反作用力的影响 在跳跃冲击性运动中,人体骨骼承受外力负荷常来自于物体或地面反作用力。研究表明,若以3 m/s跑步速度,下肢承受的地面反作用力约为受试者体质量的1.43倍[31];三级跳远选手在执行起跳时产生的地面反作用力高达体质量的17.3倍[32];篮球与排球场上起跳前的急停动作产生的地面反作用力高达人体质量的2.16倍[33];从61 cm高的箱子跃下,落地时会产生的地面反作用力约为体质量的8.8倍[34];若受试者本身进行最大自主垂直跳跃,起跳时会产生2.35倍体质量的地面反作用力,而落地时的地面反作用力则为体质量的4.76倍[22]。当然,落地产生的地面反作用力大小与落地技巧有关(如落地时是否有缓冲动作),单纯性跳跃中的落地所产生的地面反作用力显然比跑步及双脚急停产生的地面反作用力要大,这些冲击性动作所产生的地面反作用力将会对骨骼形成强烈的机械性负荷,从而促进骨的生成。 2.2.2 不同跳跃类型对骨质含量及骨密度的影响 跳跃冲击有助于提升骨合成指标与降低骨分解指标的表现,如执行高强度低冲击间歇运动后具有提升骨的周转 率[35]。如反复垂直跳急性运动、步行、球类运动及负重运动训练等不同强度冲击皆能在运动后增加骨合成指标,提升骨质表现[36-39]。但也有部分研究显示,跳跃冲击对于骨质含量及骨质密度没有增益效果[40-41],其原因可能是跳跃运动的强度(高度)不够,或是受试者的性成熟水平差异。相较于陆上跳跃冲击运动,水中运动项目的研究表明,这类低冲击不能明显增加骨合成指标,但显著影响骨分解指标[42],这些研究充分肯定了游泳项目是个体借对抗水阻前行,其骨骼处于缺乏地面反作用力冲击的现实状态,因而无法达到促进骨质密度增加的效果。 有氧运动:人体在氧气充分供应的情况下进行的身体锻炼。研究认为,适宜的有氧运动冲击时间、强度及频率能有效维持骨量、延缓骨量丢失[43]。要改善绝经后女性的骨密度,外加负荷冲击式有氧训练效果更加明 显[44]。动物实验研究同样表明,8周有氧运动+间歇负重训练对胰岛素抵抗大鼠股骨的微结构和骨生物力学特性的改善显著优于单纯有氧运动[45]。 抗阻性训练:通过肌肉克服外在阻力作拉长-缩短收缩,对骨骼产生应力,进而促进骨生成。研究认为,青少年时期进行抗阻训练可以增加骨密度、提高骨量、增强体质健康[46];20周下肢抗阻训练对青年和老年男女股骨近端区域骨密度增加皆有显效[47]。 冲击性训练:在运动过程中骨骼与关节承受短暂而重复负荷应力的一种训练形式,其可分为高冲击性和低冲击性运动。冲击性运动地面的支反力是人体质量的数倍,故骨承受的载荷相比其他运动冲击要大,对机体骨密度及骨强度的作用效果更明显,进而更有利于骨代谢的平衡。大量研究表明,高冲击性运动提高骨密度效果明显优于低冲击性运动效果,如排球、体操等运动冲击有助于青少年在青春期达到理想的峰值骨量,从而减缓骨流失[48-49]。 综上所述。跳跃冲击对人体生理所产生的变化不只局限于机械性负荷对骨骼的发展,它亦能改变人体内荷尔蒙的浓度,并进一步对骨质代谢产生影响。如成长激素和类胰岛素成长因子复合物能刺激骨转换率,并具有长期增加骨质的功效[50]。促生长因子1除可通过核因子κB信号通路调控身体的生理变化,如软骨增生与炎症反应外[14,26],也可通过诱导RANKL的合成,活化破骨细胞新生成作用。同样值得注意的是:跳跃冲击能刺激人体荷尔蒙产生变化,从而提升骨转换率,对骨代谢中的破骨细胞与造骨细胞发展产生有益影响;但荷尔蒙恒定的改变,也绝非全然有益,高强度冲击往往导致女性运动员因为雌激素降低而发生骨质流失的现象[51]。 2.2.3 跳跃冲击对核因子κB信号通路活化的影响 冲击产生振动及压力不仅影响骨骼的生理性变化,亦会因冲击强度对肌肉纤维造成轻微撕裂引起炎症反应。在炎症反应中,核因子κB信号通路是重要传递蛋白,其会受到常见的炎症因子肿瘤坏死因子α所刺激,且肿瘤坏死因子α会随着血液在身体内循环而造成到全身[52]。 (1)跳跃冲击产生的机械应力,通过骨骼将机械应力整合转化为细胞内信息传递信号通路的刺激[53],骨骼为适应外力的冲击,需不断的劣汰更新,形成骨重塑机制。较高的地面冲击能提供骨骼适当的机械应力负荷,对于骨骼的发展有较大的帮助[54],但冲击带来的机械应力除了对刺激骨骼重塑外,亦对身体结构产生许多微小的损伤而导致不同程度的炎症反应。此时血液中的炎症因子肿瘤坏死因子α蛋白与白细胞介素家族(白细胞介素3、白细胞介素6与白细胞介素8)水平增加[55-56];诸多炎症因子中,目前已知肿瘤坏死因子α蛋白的表现会影响造骨细胞与破骨细胞的表现[57]。因此,冲击诱发的炎症现象对于骨骼代谢、造骨细胞与破骨细胞间平衡影响不容小觑。 (2)冲击对细胞激素层次的调控表明:高强度低冲击间歇运动能诱导细胞因子RANKL表现增加[35],并通过RANKL蛋白的增加,促使下游破骨前趋细胞内核因子κB信号通路的活化表现提升而诱导产生破骨细胞。但也有研究发现急性冲击运动后,RANKL蛋白表现并未有明显增加,反而提升RANKL的拮抗蛋白骨保护素的表 现[36]。可见,机械应力在互相拮抗的细胞激素间,通过彼消此长调控成骨细胞的活性及破骨细胞的生成率,借此控制下游细胞内核因子κB活化信号通路反应,起到精确调控骨骼重塑[43]。除此,冲击载荷引发的局部炎症反应,通过炎症因子肿瘤坏死因子α蛋白调控细胞内核因子κB信号通路的作用[50],从而调节破骨细胞及造骨细胞的分化表现[56]。 (3)对于急性运动冲击,细胞内核因子κB信号通路活化能力会大幅受到诱发,但核因子κB信号通路活化程度受冲击强度及时间的影响,并随即影响到信号通路下游的次级蛋白P50与P60活化表现,核因子κB信号通路的活化似乎与冲击强度、时间及类型有着特殊的调控阈 值[58]。除此,剧烈运动冲击常造成体内产生大量活性氧化物质,并对身体产生氧化压力;活性氧作为细胞内第二信使,具有调节细胞内的信息传递与生理状态的功能,并对核因子κB信号通路产生活化,活性氧除了通过核因子κB信号通路活化诱导破骨细胞生成作用[59],亦会经由刺激成骨细胞的RANKL表现且增加核因子κB信号通路的活化表现,促进破骨细胞的分化。 (4)运动冲击后身体引发的炎症反应会导致延迟性肌肉酸痛。炎症反应的表现与核因子B信号通路活化程度高度相关[36]。研究表明跳跃冲击能抑制炎症因子肿瘤坏死因子α的蛋白表现,直接抑制核因子κB信号通路表现[60];而降低机械应力的刺激将会促使核因子κB信号通路表现增加,而导致骨质流失的增加[25]。冲击除对肌肉中细胞因子产生影响外,也影响运动后血液中总白血球数量,其效果主要因冲击时脂质过氧化反应过程受肿瘤坏死因子α蛋白与白细胞介素2受体蛋白的调控,进一步影响血液中淋巴细胞核因子κB信号通路的活化表现[52,59]。 "
| [1]Belavý DL, Armbrecht G, Blenk T, et al. Greater association of peak neuromuscular performance with cortical bone geometry, bone mass and bone strength than bone density: A study in 417 older women. Bone. 2016;83:119-126. [2]王晓阳,彭霞,董芬,等.云南省汉族人群骨骼健康状况及影响因素调查[J].中国公共卫生,2018,34(5):720-723.[3]夏维波,廖二元,章振林,等.补钙和维生素D对骨骼健康的必要性[J].中华骨质疏松和骨矿盐疾病杂志,2018,11(1):20-24.[4]吴志建,王竹影,宋彦,等.运动锻炼干预对我国中老年女性骨密度影响的meta分析[J].首都体育学院学报,2019,31(1):91-96.[5]赵常红,李世昌,孙朋,等.运动力学刺激对骨质量影响的研究进展[J].中国骨质疏松杂志,2018,24(6):820-824.[6]Mudd LM, Fornetti W, Pivarnik JM. Bone mineral density in collegiate female athletes: comparisons among sports. J Athl Train. 2007;42(3):403-408.[7]Marinho SM, Carraro Eduardo JC, Mafra D. Effect of a resistance exercise training program on bonemarkers in hemodialysis patients. Sci Sports. 2017;2(2):99-105.[8]Papageorgiou M, Martin D, Colgan H, et al. Bone metabolic responses to low energy availability achieved by diet or exercise in active eumenorrheic women. Bone. 2018;114:181-188.[9]Mullender MG, van der Meer DD, Huiskes R, et al. Osteocyte density changes in aging and osteoporosis. Bone. 1996;18(2):109-113.[10]Ginty F, Rennie KL, Mills L, et al. Positive, site-specific associations between bone mineral status, fitness, and time spent at high-impact activities in 16- to 18-year-old boys. Bone. 2005; 36(1):101-110. [11]赵常红,李世昌,孙朋,等.运动对骨骼和肌肉的共调作用研究[J].首都体育学院学报,2017,29(6):565-570,576.[12]Cao J, Chen T, Gong Y, et al. Molecular mechanisms of the secretion of cytokines and chemokines from human monocytes activated by pneumococcal surface protein A (PspA): Roles of mitogen-activated protein kinases and NF-kappaB. Microb Pathog. 2010;48(6):220-229.[13]Ning R, Zhang X, Guo X, et al. Staphylococcus aureus regulates secretion of interleukin-6 and monocyte chemoattractant protein-1 through activation of nuclear factor kappaB signaling pathway in human osteoblasts. Braz J Infect Dis. 2011;15(3):189-194.[14]Hippenstiel S, Schmeck B, Seybold J, et al. Reduction of tumor necrosis factor-alpha (TNF-alpha) related nuclear factor-kappaB (NF-kappaB) translocation but not inhibitor kappa-B (Ikappa-B)-degradation by Rho protein inhibition in human endothelial cells. Biochem Pharmacol. 2002;64(5-6):971-977.[15]Mancuso ME, Johnson JE, Ahmed SS, et al. Distal radius microstructure and finite element bone strain are related to site-specific mechanical loading and areal bone mineral density in premenopausal women. Bone Rep. 2018;8:187-194.[16]Genetos DC, Karin NJ, Geist DJ, et al. Purinergic signaling is required for fluid shear stress-induced NF-κB translocation in osteoblasts. Exp Cell Res. 2011;317(6):737-744. [17]Lin PS, Cheng RH, Chang MC, et al. TGF-β1 stimulates cyclooxygenase-2 expression and PGE2 production of human dental pulp cells: Role of ALK5/Smad2 and MEK/ERK signal transduction pathways. J Formos Med Assoc. 2017;116(10):748-754. [18]Main RP. Osteocytes and the bone lacunar-canalicular system: Insights into bone biology and skeletal function using bone tissue microstructure. Int J Paleopathol. 2017;18:44-46.[19]Cavo M, Scaglione S. Scaffold microstructure effects on functional and mechanical performance: Integration of theoretical and experimental approaches for bone tissue engineering applications. Mater Sci Eng C Mater Biol Appl. 2016;68:872-879. [20]Knothe Tate ML, Knothe U, Niederer P. Experimental elucidation of mechanical load-induced fluid flow and its potential role in bone metabolism and functional adaptation. Am J Med Sci. 1998;316(3): 189-195.[21]Galea GL, Lanyon LE, Price JS. Sclerostin's role in bone's adaptive response to mechanical loading. Bone. 2017;96:38-44. [22]Hinton PS, Nigh P, Thyfault J. Effectiveness of resistance training or jumping-exercise to increase bone mineral density in men with low bone mass: A 12-month randomized, clinical trial. Bone. 2015; 79:203-212. [23]Iqbal J, Zaidi M. Molecular regulation of mechanotransduction. Biochem Biophys Res Commun. 2005;328(3):751-755.[24]Spyropoulou A, Karamesinis K, Basdra EK. Mechanotransduction pathways in bone pathobiology. Biochim Biophys Acta. 2015;1852 (9):1700-1708. [25]Steinmetz M, Pelster B, Lucanus E, et al. Atorvastatin-induced increase in progenitor cell levels is rather caused by enhanced receptor activator of NF-kappaB ligand (RANKL) cell proliferation than by bone marrow mobilization. J Mol Cell Cardiol. 2013;57: 32-42.[26]Song I, Kim JH, Kim K, et al. Regulatory mechanism of NFATc1 in RANKL-induced osteoclast activation. FEBS Lett. 2009;583(14): 2435-2440. [27]Tonello S, Rizzi M, Migliario M, et al. Low concentrations of neutrophil extracellular traps induce proliferation in human keratinocytes via NF-kB activation. J Dermatol Sci. 2017;88(1): 110-116. [28]Yasunori K, Masaaki T, Tetsuyuki N, et al. Reduction of urinary levels of pyridinoline and deoxypyridinoline and serum levels of soluble receptor activator of NF-kappaB ligand by etanercept in patients with rheumatoid arthritis. Clin Rheumatol. 2008;27(9): 1093-1101.[29]Wang QS, Zhang XC, Li RX, et al. A comparative study of mechanical strain, icariin and combination stimulations on improving osteoinductive potential via NF-kappaB activation in osteoblast-like cells. Biomed Eng Online. 2015;14:46. [30]Sanecka A, Ansems M, Prosser AC, et al. DC-STAMP knock-down deregulates cytokineproduction and T-cell stimulatory capacity of LPS-matured dendritic cells. BMC Immunol. 2011,12:57.[31]邱宏达.赤足与穿鞋跑步之着地策略分析[J].大专体育学刊, 2000, 4(2):101-108.[32]Heinonen A, Sievänen H, Kyröläinen H, et al. Mineral mass, size, and estimated mechanical strength of triple jumpers' lower limb. Bone. 2001;29(3):279-285.[33]Yu B, Lin CF, Garrett WE. Lower extremity biomechanics during the landing of a stop-jump task. Clin Biomech (Bristol, Avon). 2006;21(3):297-305.[34]Johannsen N, Binkley T, Englert V, et al. Bone response to jumping is site-specific in children: a randomized trial. Bone. 2003;33(4):533-539.[35]Greenway K, Walkley JW, Rich PA. Impact exercise andbone density inpremenopausal women withbelow average bone density forage. Eur J Appl Physiol. 2015;115(11):2457-2469.[36]Multanen J, Rantalainen T, Kautiainen H, et al. Effect of progressive high-impact exercise on femoral neck structural strength in postmenopausal women with mild knee osteoarthritis: a 12-month RCT. Osteoporos Int. 2017;28(4):1323-1333.[37]Martyn-St James M, Carroll S. Meta-analysis of walking for preservation of bone mineral density in postmenopausal women. Bone. 2008;43(3):521-531.[38]Ishikawa S, Kim Y, Kang M, et al. Effects of weight-bearing exercise on bone health in girls: a meta-analysis. Sports Med. 2013;43(9):875-892.[39]Wang L, Khoo BCC, Cheng XG, et al. Differences in femoral neck structure between elderly Caucasian and Chinese populations: a cross-sectional study of Perth-Beijing cohorts. Arch Osteoporos. 2017;12(1):72.[40]Beck TJ, Fuerst T, Gaither KW, et al. The effects of bazedoxifene on bone structural strength evaluated by hip structure analysis. Bone. 2015;77:115-119.[41]Coventry E, O'Connor KM, Hart BA, et al. The effect of lower extremity fatigue on shock attenuation during single-leg landing. Clin Biomech (Bristol, Avon). 2006;21(10):1090-1097.[42]Morgan AL, Weiss J, Kelley ET. Bone turnover response to acute exercise with varying impact. Int J Exerc Sci. 2015;8(2):154-163.[43]任立峰,武斌,郝文博.过度有氧运动对不同性别成年骨代谢相关激素的影响[J].科学技术与工程,2017,17(13):136-140.[44]Roghani T, Torkaman G, Movasseghe S, et al. Effects of short-term aerobic exercise with and without external loading on bone metabolism and balance in postmenopausal women with osteoporosis. Rheumatol Int. 2013;33(2):291-298.[45]唐量,赵新娟,高小航,等.间歇负重跑台联合有氧运动对胰岛素抵抗大鼠股骨微结构及力学特性的影响[J].陕西师范大学学报(自然科学版),2016,44(6):110-115.[46]刘龙祥.抗阻训练对青少年骨密度的影响研究[J].当代体育科技, 2017,7(23):213-214.[47]陈金鳌,张霈,杨帆,陆阿明.青年和老年男女抗阻训练后的骨密度变化特征[J].成都体育学院学报,2013,39(2):83-88.[48]徐锋鹏,胡敏,黄俊豪,等.不同类型运动对骨密度影响的研究进展[J].上海体育学院学报,2017,41(1):55-60.[49]孙成涛,杨鸫祥.运动疗法防治原发性骨质疏松症的研究进展[J].中华中医药学刊,2016,34(9):2249-2252.[50]Tritos NA. Focus on growth hormone deficiency and bone in adults. Best Pract Res Clin Endocrinol Metab. 2017;31(1):49-57.[51]Petkus DL, Murray-Kolb LE, De Souza MJ. The Unexplored Crossroads of the Female Athlete Triad and Iron Deficiency: A Narrative Review. Sports Med. 2017;47(9):1721-1737.[52]Mitoma H, Horiuchi T, Tsukamoto H, et al. Molecular mechanisms of action of anti-TNF-α agents - Comparison among therapeutic TNF-α antagonists. Cytokine. 2018;101:56-63.[53]Scott D, Tan W, Lee JSH, et al. Vascular Cell Physiology Under Shear Flow: Role of Cell Mechanics and Mechanotransduction. In: Reinhart-King C, eds. Mechanical and Chemical Signaling in Angiogenesis. Studies in Mechanobiology, Tissue Engineering and Biomaterials, vol 12. Springer, Berlin, Heidelberg. 2013.[54]Nasri R, Hassen Zrour S, Rebai H, et al. Combat sports practice favors bone mineral density among adolescent male athletes. J Clin Densitom. 2015;18(1):54-59.[55]Atashak S, Azizbeigi K, Ali Azarbayjani M, et al. Changes of stress proteins and oxidative stress indices with progressive exercise training in elderly men. Sci Sports. 2017;32(3):152-159.[56]Santos RV, Bassit RA, Caperuto EC, et al. The effect of creatine supplementation upon inflammatory and muscle soreness markers after a 30km race. Life Sci. 2004;75(16):1917-1924.[57]Kohara H, Kitaura H, Fujimura Y, et al. IFN-γ directly inhibits TNF-α-induced osteoclastogenesis in vitro and in vivo and induces apoptosis mediated by Fas/Fas ligand interactions. Immunol Lett. 2011;137(1-2):53-61.[58]Barcelos RP, Bresciani G, Rodriguez-Miguelez P, et al. Diclofenac pretreatment effects on the toll-like receptor 4/nuclear factor kappa B-mediated inflammatory response to eccentric exercise in rat liver. Life Sci. 2016;148:247-253.[59]Lee SH, Jang HD. Scoparone attenuates RANKL-induced osteoclastic differentiation through controlling reactive oxygen species production and scavenging. Exp Cell Res. 2015;331(2): 267-277.[60]Rodrigues B, Jorge L, Mostarda CT, et al. Aerobic exercise training delays cardiac dysfunction and improves autonomic control of circulation in diabetic rats undergoing myocardial infarction. J Card Fail. 2012;18(9):734-744. |
| [1] | An Yang, Liao Yinan, Xie Chengxin, Li Qinglong, Huang Ge, Jin Xin, Yin Dong. Mechanism of Inulae flos in the treatment of osteoporosis: an analysis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-8. |
| [2] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [3] | Tang Hui, Yao Zhihao, Luo Daowen, Peng Shuanglin, Yang Shuanglin, Wang Lang, Xiao Jingang. High fat and high sugar diet combined with streptozotocin to establish a rat model of type 2 diabetic osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1207-1211. |
| [4] | Chen Jiming, Wu Xiaojing, Liu Tianfeng, Chen Haicong, Huang Chengshuo. Effects of silymarin on liver injury and bone metabolism induced by carbon tetrachloride in mice [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1224-1228. |
| [5] | Li Zhongfeng, Chen Minghai, Fan Yinuo, Wei Qiushi, He Wei, Chen Zhenqiu. Mechanism of Yougui Yin for steroid-induced femoral head necrosis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1256-1263. |
| [6] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [7] | Hou Guangyuan, Zhang Jixue, Zhang Zhijun, Meng Xianghui, Duan Wen, Gao Weilu. Bone cement pedicle screw fixation and fusion in the treatment of degenerative spinal disease with osteoporosis: one-year follow-up [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(6): 878-883. |
| [8] | Li Shibin, Lai Yu, Zhou Yi, Liao Jianzhao, Zhang Xiaoyun, Zhang Xuan. Pathogenesis of hormonal osteonecrosis of the femoral head and the target effect of related signaling pathways [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(6): 935-941. |
| [9] | Zheng Xiaolong, He Xiaoming, Gong Shuidi, Pang Fengxiang, Yang Fan, He Wei, Liu Shaojun, Wei Qiushi. Bone turnover characteristics in patients with alcohol-induced osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 657-661. |
| [10] | Xiao Fangjun, Chen Shudong, Luan Jiyao, Hou Yu, He Kun, Lin Dingkun. An insight into the mechanism of Salvia miltiorrhiza intervention on osteoporosis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 772-778. |
| [11] | Liu Bo, Chen Xianghe, Yang Kang, Yu Huilin, Lu Pengcheng. Mechanism of DNA methylation in exercise intervention for osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 791-797. |
| [12] | Xu Dongzi, Zhang Ting, Ouyang Zhaolian. The global competitive situation of cardiac tissue engineering based on patent analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 807-812. |
| [13] | Wu Zijian, Hu Zhaoduan, Xie Youqiong, Wang Feng, Li Jia, Li Bocun, Cai Guowei, Peng Rui. Three-dimensional printing technology and bone tissue engineering research: literature metrology and visual analysis of research hotspots [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 564-569. |
| [14] | Chang Wenliao, Zhao Jie, Sun Xiaoliang, Wang Kun, Wu Guofeng, Zhou Jian, Li Shuxiang, Sun Han. Material selection, theoretical design and biomimetic function of artificial periosteum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 600-606. |
| [15] | Liu Fei, Cui Yutao, Liu He. Advantages and problems of local antibiotic delivery system in the treatment of osteomyelitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 614-620. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||