Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (2): 480-488.doi: 10.12307/2026.518
Previous Articles Next Articles
Characteristic analysis of nanogel composite system and its application strategies in visualization of diagnostic imaging and therapy
Zhang Qian1, Wang Fuxia1, Wang Wen1, Zhang Kun1, 2, 3
- 1Department of Ultrasound, Cardiovascular and Cerebrovascular Disease Hospital, General Hospital of Ningxia Medical University, Yinchuan 750000, Ningxia Hui Autonomous Region, China; 2Central Laboratory, Sichuan Academy of Medical Sciences, Sichuan Provincial People’s Hospital, University of Electronic Science and Technology Medical School, Chengdu 610072, Sichuan Province, China; 3National Center for International Research of Bio-targeting Theranostics, Guangxi Key Laboratory of Bio-targeting Theranostics, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China
-
Received:2024-11-18Accepted:2025-01-06Online:2026-01-18Published:2025-07-02 -
Contact:Zhang Kun, Professor, Doctoral supervisor, Department of Ultrasound, Cardiovascular and Cerebrovascular Disease Hospital, General Hospital of Ningxia Medical University, Yinchuan 750000, Ningxia Hui Autonomous Region, China; Central Laboratory, Sichuan Academy of Medical Sciences, Sichuan Provincial People’s Hospital, University of Electronic Science and Technology Medical School, Chengdu 610072, Sichuan Province, China; National -
About author:Zhang Qian, MS, Attending physician, Department of Ultrasound, Cardiovascular and Cerebrovascular Disease Hospital, General Hospital of Ningxia Medical University, Yinchuan 750000, Ningxia Hui Autonomous Region, China -
Supported by:Natural Science Foundation of Ningxia Hui Autonomous Region, No. 2024AAC03656 (to ZQ)
CLC Number:
Cite this article
Zhang Qian, Wang Fuxia, Wang Wen, Zhang Kun. Characteristic analysis of nanogel composite system and its application strategies in visualization of diagnostic imaging and therapy[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 480-488.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.2.1 自身特性的影响 硬度:研究表明水凝胶能够发挥一定的支撑架构作用,这一特性要求水凝胶支撑体的刚度需符合特定细胞/组织类型的生理要求,故而在选用水凝胶时需依据实际用途审慎考量其硬度特性[29]。对于纳米水凝胶而言,硬度较高通常伴随着较低的形变能力,然而在通过抑制网状内皮系统时,上述特性能够提升细胞摄取效率并延长血液循环时间;相反,硬度较低的纳米水凝胶则展现出高效的肿瘤渗透与积聚特性。在药物递送各阶段采用不同硬度纳米水凝胶的综合策略,可有效增强药物的递送效率[30]。一项针对体外模拟血脑屏障的研究揭示,高硬度纳米水凝胶会增强脑内皮细胞的吸收,而低硬度纳米水凝胶则能促进血脑屏障中的穿胞转运过程,从而在体外血脑屏障模型中展现出比高硬度纳米水凝胶更高的转运效率。这一发现表明,纳米水凝胶的硬度特性与其在血脑屏障中的吸收及穿胞作用之间存在一种反向关联[31],这一发现可用于设计更多针对性的转运纳米水凝胶并用于改善疾病治疗。 3D多孔结构:水凝胶具有疏松的多孔结构网络,这些微观孔隙在三维空间内彼此相连通,孔隙的尺寸受到多种因素的调控。在水凝胶制备过程中,聚合物浓度会对其孔隙尺寸产生影响[32]。在聚合物链交联过程中,众多孔隙得以形成,可细分为纳米级孔(孔径< 0.1 nm)、微孔(0.1 nm < 孔径< 100 nm)以及大孔(孔径> 100 nm)。通过冷冻干燥或颗粒浸出的方法可以有效调整水凝胶孔径大小。值得注意的是,水凝胶孔径增大会相应地提升其膨胀程度与吸水性能[33]。多孔结构的非稳定性也在调节多种生理活动中扮演着关键角色,并直接影响着嵌入其中的细胞或药物在各类病理应用中的效果,因为这些多孔通道充当着营养物质、代谢废物及其他生物分子的传输路径。因此,全面且深入地探究水凝胶孔径对细胞生物学行为的影响,对于优化再生医学策略及癌症治疗方案至关重要[29,34]。 溶胀性和渗透性:水凝胶中的水分子被锁定在三维聚合物链的网络结构中[35-36],使得水凝胶展现出卓越的保水能力,水含量可超过90%。纳米水凝胶的一个重要特性是溶胀性,这与其吸水能力以及装载能力紧密相关。为了评估纳米水凝胶动的力学特性及溶胀平衡状态,最简单的方法是对比溶胀前后纳米水凝胶的质量。影响纳米水凝胶溶胀性能的因素包括单体类型及其含量、交联密度、pH值、温度以及离子强度等[37-38]。BOZO?LAN等[39]的研究表明,在酸性条件下,水凝胶的溶胀程度达到最大,相比之下,在蒸馏水环境中的溶胀程度则最小;此外,随着水凝胶基质中蒙脱石含量的提升,水凝胶样品的溶胀性能显著降低,这一发现证实,在水凝胶制备过程中添加剂的种类及占比会对溶胀性能产生显著影响。 黏弹性:多种水凝胶生物材料显示出黏弹性,表现为应力松弛或蠕变行为。影响水凝胶黏弹性的诸多因素包括前体物质的成分与浓度[40]、聚合物分子质量[41]、链段柔韧性以及交联密度或采取的交联方式(例如动态交联键的引入)[42-44]。调整藻酸盐的分子质量已被证实为一种用于调控水凝胶黏弹性的有效策略;此外,经过精细调节的黏弹性特性还可能对细胞行为产生显著影响[45-46]。应力松弛速率是衡量黏弹性的一个重要指标。颇为有趣的是,相较于高分子质量(280 kD)的藻酸盐,低分子质量(35 kD)的藻酸盐展现出更快的松弛速度[(3 300±800),(170±20) s],这种快速的松弛特性有利于细胞通过收缩力诱导基质进行机械重塑,并能增强RGD配体在水凝胶中的富集,从而进一步促进β1整合素在细胞中的表达、阿魏酸的形成以及YAP核的易位[47-49]。有研究团队观察到,在具有高塑性的海藻酸盐水凝胶基质环境中,MDA-MB231乳腺癌细胞能够扩展其内陷结构,通过机械作用开辟微小通道,以此促进细胞迁移,而非遵循传统蛋白酶介导的迁移路径[47]。因此,在水凝胶制备流程中黏弹性构成了至关重要的设计考量因素。 "

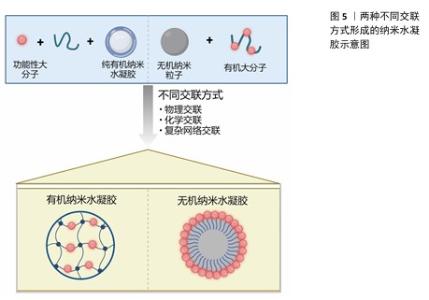
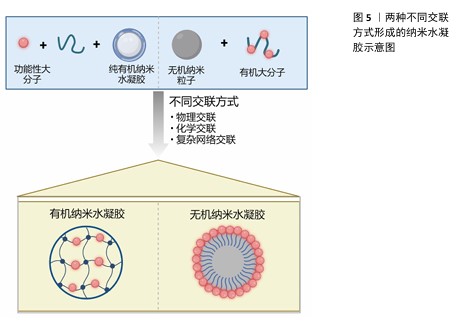
2.2.2 交联特性 交联方式:在常规交联机制(物理交联、化学交联和复杂网络交联)作用下,纳米水凝胶根据交联方式不同总体可分为两类[50](图5):①由纯有机纳米水凝胶交联功能性大分子构成,而功能性大分子是通过在大分子上改变官能团合成的,其交联剂可能具有双功能或多功能基团,可通过共价键[51]、超分子相互作用[52]、π-π 堆积和静电作用进行交联[53-54];一些交联剂含有二硫键等环境响应分子,可使纳米水凝胶具有响应性[55]。②通过将无机纳米粒子包裹在交联的有机外壳内部来构建。鉴于纯无机纳米粒子普遍存在着生物相容性不佳以及在生理环境下稳定性欠缺的问题,在其表层覆盖一层生物相容性良好的有机大分子成为提升其稳定性和生物相容性的有效策略;随后通过对外壳进行交联处理,可进一步增强纳米粒子的稳定性,从而得到无机纳米粒子为核心、交联有机外壳为结构的纳米水凝胶。相较于纯无机纳米粒子,此类纳米水凝胶不仅展现出了更高的稳定性,而且在体内的生物分布特性也得到了显著优化[50]。 交联剂:交联剂需满足的条件之一是拥有至少2种功能性基团,以便能够交联多种类型的聚合物;此外,所选取的交联反应需确保其高效产出。当前,点击化学反应,尤其是硫醇-烯反应,因高产率和温和的反应条件而广受青睐,其中含硫醇的化合物常被用作交联剂。二硫交换反应是制备对谷胱甘肽具有响应性纳米水凝胶的理想选择,因为它能在纳米凝胶结构中引入二硫键。采用聚合反应来实现大分子的交联,是制备交联纳米水凝胶的一种便捷途径[56],然而,这种方法很难开发出具有环境响应性的纳米水凝胶[57]。为了制备出高载药量的纳米水凝胶,一种有效的策略是将药物本身设计为交联剂,从而直接将药物嵌入到纳米水凝胶的骨架之中[50]。"

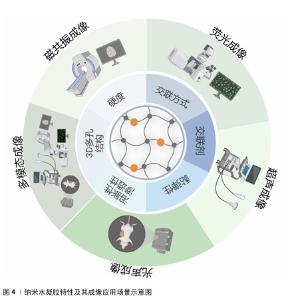
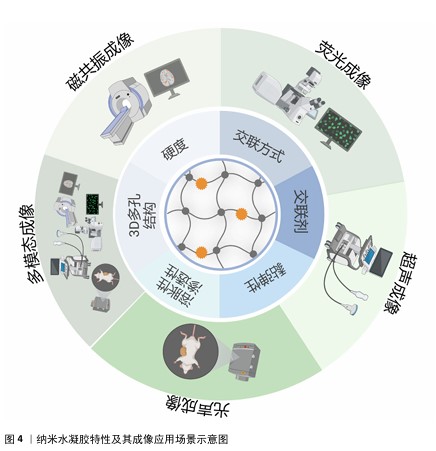
2.3 功能可视化纳米水凝胶影像诊疗一体化策略 近年来,纳米水凝胶的进步推动了多种治疗策略的不断涌现,为癌症及其相关疾病的治疗开辟了广阔的道路[58-59]。随着诊疗一体化理念的持续深化,研究者们通过对纳米水凝胶的合理改性使它能够作为多功能对比剂,实现响应性、疾病治疗及高分辨率成像等多重功能。就纳米水凝胶实现的影像学成像手段而言,可细化为磁共振成像、荧光成像、超声成像、光声成像与多模态成像。 2.3.1 磁共振成像 为实现高效、准确的癌症诊断,可选择性刺激肿瘤区域的可激活磁共振成像对比剂成为目前的迫切需求。CAO等[60]将柠檬酸修饰的极小氧化铁纳米粒子封装在二硫交联聚羧基甜菜碱甲基丙烯酸酯纳米水凝胶中,并进一步引入c(RGD)配体,从而获得含有肿瘤靶向的极小氧化铁纳米粒子封装聚羧基甜菜碱甲基丙烯酸酯纳米水凝胶(ICNs-RGD);在还原型谷胱甘肽诱导极小氧化铁纳米粒子由成簇转化为分散的基础上,ICNs-RGD可以完成从T2对比剂到T1对比剂的转化,实现选择性激活T1对比剂,由此改善了T2对比剂存在的低密度混淆等固有缺陷并放大T1信号;此外,ICNs-RGD还展现出了显著的靶向特异性和优良的生物相容性;在针对肿瘤小鼠的磁共振成像实验中,凭借对还原型谷胱甘肽的刺激响应性和靶向特异性,静脉注射ICNs-RGD后能够选择性地增强肿瘤组织的T1对比效果。因此,这种具备肿瘤靶向能力的ICNs-RGD,能够通过响应还原型谷胱甘肽来产生可切换的磁共振成像信号,是一种具有潜力的对比剂,有望在临床肿瘤的高效精确诊断中发挥重要作用。 随着肿瘤可视化治疗联合免疫疗法的策略逐渐兴起,LI等[61]设计了一种创新的纳米水凝胶系统(DTX/USIO@PEI NGs/siCD47),该系统结合了癌细胞伪装技术与超小型氧化铁纳米颗粒的负载能力,共同递送多西他赛与CD47小干扰RNA (siCD47)。此设计的目的是为了提升肿瘤靶向给药效率,从而突破现有化疗手段的局限,所构建的协同递送体系展现出了优异的稳定性、生物相容性,并能有效诱导巨噬细胞向M1型极化。在此基础上,该系统还通过模拟肿瘤微环境内还原型谷胱甘肽水平,在不同pH值条件下验证了超小型氧化铁纳米颗粒的释放及T1成像效果,实现了有效针对乳腺癌的磁共振成像功能,有力推动了这一生物仿生纳米水凝胶平台在乳腺癌诊断与治疗一体化领域的应用与发展。 癌症转移仍然是临床癌症治疗的主要障碍,也是导致癌症死亡的主要原因。设计具有更高的诊断灵敏度和抗肿瘤转移效率的多功能纳米平台是当前癌症治疗的一大趋势。PENG等[62]介绍了一种基于低分子质量聚乙烯亚胺与聚乙二醇构建的纳米水凝胶,该水凝胶系统能够负载转化生长因子β1的小干扰RNA以及超小型氧化铁纳米颗粒,旨在实现基因治疗的同时,在小鼠肉瘤模型中提供肿瘤及其转移的T1加权磁共振成像。该系统展现出了优异的细胞兼容性及增强的磁共振成像效能(具体表现为r1弛豫率值达1.034 6 mM-1), 远高于单独使用氧化铁纳米颗粒的弛豫水平(0.806 5 mM-1),改善了单独使用氧化铁纳米颗粒存在的分散度不佳等缺点。凭借静电相互作用,聚乙烯亚胺-聚乙二醇纳米水凝胶能够进一步装载转化生长因子β1 siRNA,并高效地将其递送至癌细胞及肿瘤模型内,实现转化生长因子β1基因的沉默。实验结果显示,该系统在体外显著抑制了癌细胞的增殖与侵袭能力,在体内则有效减缓了皮下肉瘤肿瘤的生长并阻断了肺转移,其潜在的应用价值不容忽视。 2.3.2 荧光成像 利用具有给药和成像的多功能纳米载体来提高癌症治疗效果,是目前纳米技术发展的热点[63]。HASHEMI等[64]开发了一种创新的混合纳米水凝胶系统——CCHNs,该系统融合了壳聚糖、碳点以及抗癌药物西利马林,并具备荧光显像功能,能够高效、低毒性地将西利马林递送到MCF-7乳腺癌细胞中,还可通过电荷相互作用使细胞内碳点释放增多,实现较低的淬灭效率;随着共孵育时间的延长,上述机制可显著提升共孵育细胞内的荧光成像水平。该系统通过联合生物荧光成像技术为提升乳腺癌的治疗效果开辟了新途径。SHIN等[65]报道了一项利用褐藻糖胶纳米水凝胶的策略,通过荧光诊疗系统实时监测结直肠癌的淋巴结转移,并结合光动力疗法来抑制肿瘤生长;通过对比5-氨基乙酰丙酸、二氢卟吩和褐藻糖胶纳米水凝胶在小鼠肿瘤模型及主要器官中的荧光成像结果,发现褐藻糖胶纳米水凝胶展现出对肿瘤良好的吸附性和较长的循环时间,可在肿瘤区域显示出高蓄积效率和强烈的荧光信号强度,并由此实现结肠癌转移淋巴结的实时成像。更重要的是,该策略借助光动力疗法显著减缓了癌细胞的生长,验证了该系统在精确诊疗结肠癌及其淋巴结转移方面的巨大潜力。尽管溶酶体的荧光成像已成为探究活细胞中溶酶体生理功能的重要工具,但值得注意的是,长时间的光照不可避免地会引起溶酶体损伤和光毒性问题。面对这一挑战,ZHANG等[66]设计了一种包含多功能纳米探针、铂纳米粒子以及喹啉共同装载的纳米水凝胶体系,该体系实现了对溶酶体的长期靶向追踪,同时最大程度地减少了光损伤。在构建这一复合纳米水凝胶的过程中,他们首先利用顺铂作为交联剂,确保了其治疗成分的有效保留;随后在乙醇的辅助下,顺铂原位还原生成铂纳米粒子,这些粒子能够清除光诱导产生的活性氧,从而确保了喹啉对溶酶体的长期荧光成像能力。体外成像结果显示,在24 h的跟踪期内,该纳米水凝胶体系即使在细胞分裂过程中也能实现稳定的动态成像,凸显了它在长期溶酶体追踪中的特异性和稳定性。这一基于纳米水凝胶的策略为改进溶酶体追踪过程提供了有力证明,同时也为基于纳米水凝胶荧光成像的优化提供了思路。 "


2.3.3 超声成像 集刺激响应成像和治疗功能于一体的多功能治疗纳米探针,在提高早期癌症诊断效果和治疗效率方面显示出巨大潜力[67]。WU等[68]将乳酸氧化酶和过氧化氢酶双酶封装到自组装纳米水凝胶中,制成了乳酸氧化酶/过氧化氢酶响应性纳米水凝胶探针(LCNGs),LCNGs能对富含乳酸和过氧化氢的肿瘤微环境做出反应,可使其迅速产生大量氧气并进一步积聚成微气泡,由于氧气的生成速度快于扩散速度,可加速肿瘤区域的微气泡快速积累并用以增强超声成像对比度,从而实现增强的超声成像;此外,LCNGs@阿霉素还通过将纳米探针与阿霉素结合,可完成可视化的抑制肿瘤细胞增殖,证实该基于酶的纳米水凝胶探针具有生物相容性和响应性,展现出作为一种极具潜力的治疗手段的广阔前景。尽管CT和数字减影血管造影等各种X射线成像技术被广泛应用于治疗肝细胞癌患者的经导管动脉栓塞疗法,但存在操作复杂和电离辐射暴露等缺点[69]。超声成像可通过改善上述问题在肝细胞癌的诊断中发挥重要作用。LI等[70]基于此合成了一种PNF纳米水凝胶(TGFPE),证实该水凝胶在经导管动脉栓塞疗法的动物模型中可用以实现血管栓塞和长期超声成像,该策略的优势在于可靶向肿瘤血管,并在37 ℃条件下由溶胶状态转变为凝胶状态,从而发挥其作为栓塞材料的作用;凝胶形成后,其内部的乳液液滴被包裹在凝胶网络中,可显著延长其在肿瘤血管中的停留时间,实现肿瘤的长效超声成像。这一系统的构建为实现经导管动脉栓塞疗法手术诊疗一体化策略开拓了新的思路。 2.3.4 光声成像 传统的光声纳米探针由于始终处于“开启”状态,因而或多或少会因背景信号干扰而影响成像效果[71-72],开发能对肿瘤内部微环境和外部刺激做出响应的纳米探针可能在肿瘤光声诊断方面具有巨大的应用潜力。SUN等[73]构建了一种低pH值触发的热响应体积相变纳米水凝胶(AuNR@PNIPAM-VAA),通过外部近红外光热开关可以动态调节AuNR@PNIPAM-VAA在肿瘤微环境中的吸收,从而使其在近红外-Ⅱ窗口产生可切换的光声信号,用于肿瘤特异性增强光声成像,体外实验结果表明,在pH 值为5.8时,AuNR@PNIPAM-VAA在近红外-Ⅱ波段的吸收和光声信号幅度经光热调制后明显增加,在pH值为7.4时其变化则相对微弱;定量计算结果表明,在模拟肿瘤微环境中,当温度从37.5 ℃升高到45 ℃时,AuNR@PNIPAM-VAA在1 064 nm波长处的光声信号幅度增强了约1.6倍;体内实验结果提示,AuNR@PNIPAM-VAA可通过动态响应热场实现增强的光声成像,因而可用于选择性肿瘤检测。该研究为利用近红外光调节热场、针对低pH值肿瘤微环境的特异性光声成像提供一种可行的策略,有望实现纳米水凝胶对肿瘤诊断和治疗的精确动态监测。 2.3.5 多模态成像 与近红外-Ⅰ(700-950 nm)窗口相比,近红外-Ⅱ窗口的光子散射更小、组织穿透力更强,因此,基于近红外-Ⅱ(1 000-1 700 nm)光的肿瘤疾病诊断和治疗受到广泛关注[74]。ZHANG等[75]据此提出一种钆和硫化铜集成的纳米水凝胶平台(Gd/CuS@PEI-FA-PS NGs),用于磁共振/光声成像引导的肿瘤靶向光热疗法,该纳米水凝胶的平均粒径为258 nm,具有良好的水分散性和抗蛋白质特性、极高的r1弛豫度(11.66 mM-1 s-1)、优异的近红外-Ⅱ吸收特性、高光热转换效率(26.7%)以及叶酸受体介导的癌细胞靶向特异性;由于该平台中聚乙烯亚胺内丰富的胺和纳米水凝胶的网络空间,不仅可以进行表面功能化,还可在内部与成像和治疗元件结合;凭借这些特性和良好的细胞相容性,所开发的 Gd/CuS@PEI-FA-PS NGs可在磁共振/光声双模式成像引导下对过表达叶酸受体的肿瘤进行靶向光热治疗。类似的,有研究者通过打造一种智能纳米水凝胶平台(P-TN-Dox@CM),在肿瘤区域的低pH值条件下可首先实现药物的猝发性释放,并在近红外诱导下激活细胞毒性并进一步加速药物释放;该纳米水凝胶平台良好的靶向聚集性和长效滞留性不仅可用于实现近红外辐照后的迅速升温,还能作为体内荧光和光热成像的对比剂,同时实现双模式成像,展现了其作为一种多功能精准协同治疗策略中的巨大潜力[76]。 开发具有放大增强渗透性和保留效应的纳米探针对精确诊断癌症的性能至关重要[77]。XU等[78]开发了一种功能性纳米水凝胶(DNGs),通过反向微乳液法,G3-NH2树枝状聚合物与N,N’-双(丙烯酰)胱胺发生迈克尔加成反应制备出DNGs,并与金纳米粒子夹杂形成 Au-DNGs,随后修饰并形成RGD-Gd@Au-DNGs-PS(R-G@ADP),该多功能纳米水凝胶具备较高X射线衰减系数及出色的r1弛豫度(9.13 mM-1 s-1),能够在体内对胰腺肿瘤模型进行靶向和增强的计算机断层扫描/磁共振双模式成像,R-G@ADP较大的尺寸显著延长了旋转相关时间,从而引发相应的r1值增加,其内部金纳米粒子的有效聚集提升了相应的X线衰减强度,证实其可作为一种出色的 T1加权对比剂和电子计算机断层对比剂用于肿瘤磁共振成像;此外,该复合纳米水凝胶具有的延长血液循环时间的特性可放大被动保留效应,因而可作为一种新兴的纳米探针用于胰腺癌的电子计算机断层扫描/磁共振成像及癌症的精准治疗。"

| [1] RAJPTU R, NARKHEDE J, NAIK J. Nanogels as nanocarriers for drug delivery: A review.ADMET DMPK. 2020;8(1):1-15. [2] HO TC, CHANG CC, CHAN HP, et al. Hydrogels: Properties and Applications in Biomedicine. Molecules. 2022;27(9):2902. [3] CHEN C, LI D, YANO H, et al. Bioinspired hydrogels: Quinone crosslinking reaction for chitin nanofibers with enhanced mechanical strength via surface deacetylation. Carbohydr Polym. 2019;207:411-417. [4] FOUDAZI R, ZOWADA R, MANAS-ZLOCZOWER I, et al. Porous Hydrogels: Present Challenges and Future Opportunities. Langmuir. 2023;39(6): 2092-2111. [5] FISHER DG, PRICE RJ. Recent Advances in the Use of Focused Ultrasound for Magnetic Resonance Image-Guided Therapeutic Nanoparticle Delivery to the Central Nervous System. Front Pharmacol. 2019;10:01348. [6] PINELLI F, PERALE G, ROSSI F. Coating and Functionalization Strategies for Nanogels and Nanoparticles for Selective Drug Delivery. Gels. 2020;6(1):6. [7] YIN Y, HU B, YUAN X, et al. Nanogel: A Versatile Nano-Delivery System for Biomedical Applications. Pharmaceutics. 2020;12(3):290. [8] 段秀红,马华,尚宏周,等.智能水凝胶在生物医药领域的应用进展[J].中国医院药学杂志,2024,16(44):1950-1959. [9] 宋昌隆,付翔,唐璐,等.抗溶胀水凝胶在生物医学领域的研究进展[J].生物医学工程学杂志,2024,4(41):848-853. [10] SHAH S, RANGARAJ N, LAXMIKESHAV K, et al. Nanogels as drug carriers - Introduction, chemical aspects, release mechanisms and potential applications. Int J Pharm. 2020;581:119268. [11] ZHOU W, YANG G, NI X, et al. Recent Advances in Crosslinked Nanogel for Multimodal Imaging and Cancer Therapy. Polymers. 2020;12(9):1902. [12] LIMA CSA, BALOGH TS, VARCA JPRO, et al. An Updated Review of Macro, Micro, and Nanostructured Hydrogels for Biomedical and Pharmaceutical Applications. Pharmaceutics. 2020;12(10):970. [13] 赵子沛,王旭,赵伟锋,等.金属有机框架基水凝胶复合材料修复软硬组织损伤的潜力和优势[J]. 中国组织工程研究, 2023,28(22):3583-3590. [14] 杨宁文,何星,唐寅.智能水凝胶在生物医学领域的研究进展[J].化学通报,2023, 86(10):1226-1233. [15] 田林灵,郭海瑞,杜晓明,等.纳米复合水凝胶在骨关节炎治疗中的优势与特征[J].中国组织工程研究,2024,28(15): 2410-2415. [16] 张攀,吕福杰,范治平,等.刺激响应性水凝胶在肿瘤治疗中的研究进展[J].高分子通报,2023,36(5):551-563. [17] AKIYOSHI K, KOBAYASHI S, SHICHIBE S, et al. Self-assembled hydrogel nanoparticle of cholesterol-bearing pullulan as a carrier of protein drugs: complexation and stabilization of insulin. J Control Release. 1998;54(3):313-320. [18] VINOGRADOV SV, BRONICH TK, KABANOV AV. Nanosized cationic hydrogels for drug delivery: preparation, properties and interactions with cells. Adv Drug Deliv Rev. 2002;54(1):135-147. [19] CHEN H, ZHANG J, QIAN Z, et al. In vivo non-invasive optical imaging of temperature-sensitive co-polymeric nanohydrogel. Nanotechnology. 2008;19(18):185707. [20] ZHANG J, CHEN H, XU L, et al. The targeted behavior of thermally responsive nanohydrogel evaluated by NIR system in mouse model. J Control Release. 2008; 131(1):34-40. [21] CHIANG WH, HO VT, CHEN HH, et al. Superparamagnetic Hollow Hybrid Nanogels as a Potential Guidable Vehicle System of Stimuli-Mediated MR Imaging and Multiple Cancer Therapeutics. Langmuir. 2013;29(21):6434-6443. [22] HUPPERTSBERG A, KAPS L, ZHONG Z, et al. Squaric Ester-Based, pH-Degradable Nanogels: Modular Nanocarriers for Safe, Systemic Administration of Toll-like Receptor 7/8 Agonistic Immune Modulators. J Am Chem Soc. 2021;143(26):9872-9883. [23] LIANG S, XIAO L, ChEN T, et al. Injectable Nanocomposite Hydrogels Improve Intraperitoneal Co-delivery of Chemotherapeutics and Immune Checkpoint Inhibitors for Enhanced Peritoneal Metastasis Therapy. ACS Nano. 2024;18(29):18963-18979. [24] LIU C, LEI F, LI P, et al. Borax crosslinked fenugreek galactomannan hydrogel as potential water-retaining agent in agriculture. Carbohydr Polym. 2020;236: 116100. [25] SHAHBAZI MA, HAMIDI M. The impact of preparation parameters on typical attributes of chitosan-heparin nanohydrogels: particle size, loading efficiency, and drug release. Drug Dev Ind Pharm. 2013;39(11): 1774-1782. [26] 杨海鹏,张幼维,赵炯心.P(MAA-co-AM)纳米水凝胶的制备与表征[J].功能高分子学报,2018,31(5):486-492. [27] 周忠旭,李雪婷,鲁希华.纳米水凝胶的制备及相变行为研究[J].应用化工,2023, 52(9):2524-2529. [28] 袁成,盛海亮,冯松,等.纳米金复合水凝胶的制备及其应用研究进展[J].中国科学:化学,2021,51(12):1563-1578. [29] CAO H, DUAN L, ZHANG Y, et al. Current hydrogel advances in physicochemical and biological response-driven biomedical application diversity. Signal Transduct Target Ther. 2021;6(1):426. [30] WANG J, BRUGNOLI B, FOGLIETTA F, et al. Tuning stiffness of hyaluronan-cholesterol nanogels by mussel-inspired dopamine-Fe3+ coordination: Preparation and properties evaluation. Int J Biol Macromol. 2024;280:135553. [31] RIBOVSKI L, DE JONG E, MERGEL O, et al. Low nanogel stiffness favors nanogel transcytosis across an in vitro blood–brain barrier. Nanomedicine. 2021;34:102377. [32] KIM U J, PARK J, LI C, et al. Structure and Properties of Silk Hydrogels. Biomacromolecules. 2004;5(3):786-792. [33] CHELLATHURAI MS, CHUNG LY, HILLES AR, et al. Pharmaceutical chitosan hydrogels: A review on its design and applications. Int J Biol Macromol. 2024;280:135775. [34] SCHULTE MF, BOCHENEK S, BRUGNONI M, et al. Stiffness Tomography of Ultra-Soft Nanogels by Atomic Force Microscopy. Angew Chem Int Ed Engl. 2021;60(5): 2280-2287. [35] WANG QS, GAO LN, ZHU XN, et al. Co-delivery of glycyrrhizin and doxorubicin by alginate nanogel particles attenuates the activation of macrophage and enhances the therapeutic efficacy for hepatocellular carcinoma. Theranostics. 2019;9(21): 6239-6255. [36] LIU C, LEI F, LI P, et al. Borax crosslinked fenugreek galactomannan hydrogel as potential water-retaining agent in agriculture. Carbohydr Polym. 2020;236: 116100. [37] KOPEČEK J. Polymer chemistry: swell gels. Nature. 2002;417(6887):389-391. [38] SONI KS, DESALE SS, BRONICH TK. Nanogels: An overview of properties, biomedical applications and obstacles to clinical translation. J Control Release. 2016;240:109-126. [39] BOZOĞLAN BK, DUMAN O, TUNÇ S. Preparation and characterization of thermosensitive chitosan/carboxymethylcellulose/scleroglucan nanocomposite hydrogels. Int J Biol Macromol. 2020;162:781-797. [40] RATAKONDA S, SRIDHAR UM, Rhinehart RR, et al. Assessing viscoelastic properties of chitosan scaffolds and validation with cyclical tests. Acta Biomater. 2012;8(4): 1566-1575. [41] CHARBONIER F, INDANA D, CHAUDHURI O. Tuning Viscoelasticity in Alginate Hydrogels for 3D Cell Culture Studies. Current Protocols. 2021;1(5):e124. [42] JANNATAMANI H, MOTAMEDZADEGAN A, FARSI M, et al. Rheological properties of wood/bacterial cellulose and chitin nano-hydrogels as a function of concentration and their nano-films properties. IET Nanobiotechnol. 2022;16(4):158-169. [43] WEI Z, SCHNELLMANN R, GERECHT S. Hydrogel Network Dynamics Regulate Vascular Morphogenesis. Cell Stem Cell. 2020;27(5):798-812. [44] VUNJAK-NOVAKOVIC G. Dynamic Hydrogels for Investigating Vascularization. Cell Stem Cell. 2020;27(5):697-698. [45] LEE H pyo, GU L, MOONEY DJ, et al. Mechanical confinement regulates cartilage matrix formation by chondrocytes. Nat Mater. 2017;16(12):1243-1251. [46] WISDOM K M, ADEBOWALE K, CHANG J, et al. Matrix mechanical plasticity regulates cancer cell migration through confining microenvironments. Nat Commun. 2018; 9(1):4144. [47] OVIJIT C, JUSTIN CW, PAUL AJ, et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 2020; 584(7822):535-546. [48] DUPONT S, MORSUT L, ARAGONA M, et al. Role of YAP/TAZ in mechanotransduction. Nature. 2011;474(7350):179-183. [49] FISCHER M, RIKEIT P, KNAUS P, et al. YAP-Mediated Mechanotransduction in Skeletal Muscle. Front Physiol. 2016;7:41. [50] ZHOU W, YANG G, NI X, et al. Recent Advances in Crosslinked Nanogel for Multimodal Imaging and Cancer Therapy. Polymers. 2020;12(9):1902. [51] SHIPWAY AN, WILLNER I. Nanoparticles as structural and functional units in surface-confined architectures. Chem Commun (Camb). 2001;(20):2035-2045. [52] QIAN Q, SHI L, GAO X, et al. A Paclitaxel‐Based Mucoadhesive Nanogel with Multivalent Interactions for Cervical Cancer Therapy. Small. 2019;15(47):e1903208. [53] ZHANG Q, WU J, WANG J, et al. A Neutrophil‐Inspired Supramolecular Nanogel for Magnetocaloric–Enzymatic Tandem Therapy. Angew Chem Int Ed Engl. 2020;59(9):3732-3738. [54] DING F, MOU Q, MA Y, et al. A Crosslinked Nucleic Acid Nanogel for Effective siRNA Delivery and Antitumor Therapy. Angew Chem Int Ed Engl. 2018;57(12):3064-3068. [55] QIAN H, WANG X, YUAN K, et al. Delivery of doxorubicin in vitro and in vivo using bio-reductive cellulose nanogels. Biomater. Sci. 2014;2(2):220-232. [56] TARIQ L, ARAFAH A, ALI S, et al. Nanogel-based Transdermal Drug Delivery System: A Therapeutic Strategy with Under Discussed Potential. Curr Top Med Chem. 2023;23(1): 44-61. [57] MOLINA M, ASADIAN-BIRJAND M, BALACH J, et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 2015; 44(17):6161-6186. [58] WANG H, PICCHIO ML, CALDERÓN M. One stone, many birds: Recent advances in functional nanogels for cancer nanotheranostics. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2022;14(4): e1791. [59] YIN Y, HU B, YUAN X, et al. Nanogel: A Versatile Nano-Delivery System for Biomedical Applications. Pharmaceutics. 2020;12(3):290. [60] CAO Y, MAO Z, HE Y, et al. Extremely Small Iron Oxide Nanoparticle-Encapsulated Nanogels as a Glutathione-Responsive T 1 Contrast Agent for Tumor-Targeted Magnetic Resonance Imaging. ACS Appl Mater Interfaces. 2020;12(24): 26973-26981. [61] LI L, GAO Y, ZHANG Y, et al. A Biomimetic Nanogel System Restores Macrophage Phagocytosis for Magnetic Resonance Imaging‐Guided Synergistic Chemoimmunotherapy of Breast Cancer. Adv Healthc Mater. 2023;12(26):e2300967. [62] PENG Y, GAO Y, YANG C, et al. Low-Molecular-Weight Poly(ethylenimine) Nanogels Loaded with Ultrasmall Iron Oxide Nanoparticles for T 1 -Weighted MR Imaging-Guided Gene Therapy of Sarcoma. ACS Appl Mater Interfaces. 2021; 13(24):27806-27813. [63] PREMAN NK, JAIN S, JOHNSON RP. “Smart” Polymer Nanogels as Pharmaceutical Carriers: A Versatile Platform for Programmed Delivery and Diagnostics. ACS Omega. 2021;6(8):5075-5090. [64] HASHEMI F, MOHAJERI N, RADNIA F, et al. Design of an efficient fluorescent nanoplatform carrier for hydrophobic drugs along with green carbon dot: Possible application in cancer image-guided drug therapy. Photodiagnosis Photodyn Ther. 2022;37:102738. [65] SHIN YK, PARK YR, LEE H, et al. Real-Time Monitoring of Colorectal Cancer Location and Lymph Node Metastasis and Photodynamic Therapy Using Fucoidan-Based Therapeutic Nanogel and Near-Infrared Fluorescence Diagnostic–Therapy System. Pharmaceutics. 2023;15(3):930. [66] ZHANG W, DU B, GAO M, et al. A Hybrid Nanogel to Preserve Lysosome Integrity for Fluorescence Imaging. ACS Nano. 2021;15(10):16442-16451. [67] MEKURIA SL, OUYANG Z, SONG C, et al. Dendrimer-Based Nanogels for Cancer Nanomedicine Applications. Bioconjug Chem. 2022;33(1):87-96. [68] WU Q, ZHANG Q, YU T, et al. Self-Assembled Hybrid Nanogel as a Multifunctional Theranostic Probe for Enzyme-Regulated Ultrasound Imaging and Tumor Therapy. ACS Appl Bio Mater. 2021;4(5):4244-4253. [69] KOSTELNIK T I, ORVIG C. Radioactive Main Group and Rare Earth Metals for Imaging and Therapy. Chem Rev. 2019;119(2): 902-956. [70] LI L, CAO Y, ZHANG H, et al. Temperature sensitive nanogel-stabilized pickering emulsion of fluoroalkane for ultrasound guiding vascular embolization therapy. J Nanobiotechnology. 2023;21(1):413. [71] ZENG Y, DOU T, MA L, et al. Biomedical Photoacoustic Imaging for Molecular Detection and Disease Diagnosis: “Always‐On” and “Turn‐On” Probes. Adv Sci (Weinh). 2022;9(25):e2202384. [72] LIN X, XU Z, LI J, et al. Visualization of photothermal therapy by semiconducting polymer dots mediated photoacoustic detection in NIR II. J Nanobiotechnology. 2023;21(1):468. [73] SUN X, LI Y, LIU X, et al. Tumor-specific enhanced NIR-II photoacoustic imaging via photothermal and low-pH coactivated AuNR@PNIPAM-VAA nanogel. J Nanobiotechnology. 2024;22(1): 326. [74] LIU Y, BHATTARAI P, DAI Z, et al. Photothermal therapy and photoacoustic imaging via nanotheranostics in fighting cancer. Chem Soc Rev. 2019;48(7): 2053-2108. [75] ZHANG C, SUN W, WANG Y, et al. Gd-/CuS-Loaded Functional Nanogels for MR/PA Imaging-Guided Tumor-Targeted Photothermal Therapy. ACS Appl Mater Interfaces. 2020;12(8):9107-9117. [76] ZHANG L, WANG Z, ZHANG R, et al. Multi-Stimuli-Responsive and Cell Membrane Camouflaged Aggregation-Induced Emission Nanogels for Precise Chemo-photothermal Synergistic Therapy of Tumors. ACS Nano. 2023;17(24): 25205-25221. [77] MIRHADI E, MASHREGHI M, FAAL MALEKI M, et al. Redox-sensitive nanoscale drug delivery systems for cancer treatment. Int J Pharm. 2020;589:119882. [78] XU X, XIAO T, ZHANG C, et al. Multifunctional Low-Generation Dendrimer Nanogels as an Emerging Probe for Tumor-Specific CT/MR Dual-Modal Imaging. Biomacromolecules. 2023;24(2):967-976. |
| [1] | Jiang Kan, Alimujiang·Abudourousuli, Shalayiding·Aierxiding, Aikebaierjiang·Aisaiti, Kutiluke·Shoukeer, Aikeremujiang·Muheremu. Biomaterials and bone regeneration: research hotspots and analysis of 500 influential papers [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 528-536. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||