Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (2): 451-458.doi: 10.12307/2025.977
Previous Articles Next Articles
Effect and mechanism of collagen combined with microneedles in treatment of skin photoaging
Tan Fengyi1, Xie Jiamin1, Pan Zhenfeng1, Zhang Xinxu1, Zheng Zetai2, Zeng Zhiying1, Zhou Yanfang2
- 1Second Clinical Medical College, Guangdong Medical University, Dongguan 523808, Guangdong Province, China; 2School of Basic Medicine, Guangdong Medical University, Dongguan 523808, Guangdong Province, China
-
Received:2024-10-09Accepted:2024-10-30Online:2026-01-18Published:2025-07-01 -
Contact:Zhou Yanfang, MD, Professor, School of Basic Medicine, Guangdong Medical University, Dongguan 523808, Guangdong Province, China -
About author:Tan Fengyi, Second Clinical Medical College, Guangdong Medical University, Dongguan 523808, Guangdong Province, China Xie Jiamin, Second Clinical Medical College, Guangdong Medical University, Dongguan 523808, Guangdong Province, China -
Supported by:Guangdong Provincial Department of Education Regular University Research Project, No. 2021KTSCX040 (to ZYF)
CLC Number:
Cite this article
Tan Fengyi, Xie Jiamin, Pan Zhenfeng, Zhang Xinxu, Zheng Zetai, Zeng Zhiying, Zhou Yanfang. Effect and mechanism of collagen combined with microneedles in treatment of skin photoaging[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 451-458.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
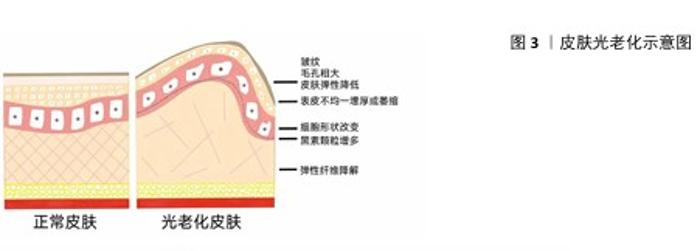
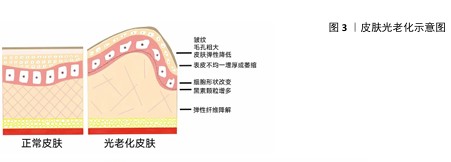
2.1 光老化的定义 光老化指皮肤因反复暴露于紫外线辐射而导致的结构和功能发生异常改变的现象,引发色素沉淀、毛孔粗大、皱纹、松弛下垂的问题,严重的更是会产生癌前病变和恶性肿瘤等[14]。紫外线根据波长可分为短波紫外线(200-280 nm)、中波紫外线(> 280-320 nm)和长波紫外线(> 320-400 nm)3种。其中,短波紫外线大部分被臭氧层吸收,因此对皮肤造成损害的主要是长波紫外线和中波紫外线。中波紫外线占紫外线总量的5%,仅能渗透表皮和浅真皮层。长波紫外线占紫外线总量的95%,能够穿透表皮层和真皮层,甚至影响皮下组织区域的细胞成分,因而长波紫外线辐射是导致光老化的主要原因[15]。重复紫外线辐射诱发皮肤免疫微环境时空变化和失衡机制,是近年来皮肤的研究热点。紫外线辐射可诱发皮肤组织微环境中的细胞表型及功能变化,通过直接和间接两种模式改变皮肤的免疫微环境。 2.2 光老化的组织学变化 在光老化过程中,每个皮肤层的结构、组成和功能都会发生特征性的变化,主要表现为表皮不均一增厚或萎缩、真皮-表皮交界处变平以及真皮和皮下组织厚度的降低[16]。轻度光老化皮肤的表皮厚度大于自然老化皮肤的表皮厚度。严重光老化的皮肤会发生表皮萎缩,细胞学方面表现为:角质形成细胞的有序分化受影响,排列失去极性,并有一定程度的细胞异型;黑素细胞和黑素颗粒增多,沿基底膜分布不规则,其大小、树突和色素变化差异变大;成纤维细胞增生,肥大异型的成纤维细胞增多[17]。光老化皮肤中表皮-真皮交界处的基底膜变平,甚至断裂,基底膜是紧密连接表皮和真皮的高度特化的细胞外基质,其结构受到损害会导致皮肤层之间的代谢中断,从而减少营养物质的供应和表皮细胞因子的传递,最终导致皮肤损伤。 紫外线辐射会导致基底膜中构成锚定纤维的 Ⅶ 型胶原蛋白水平降低、基质金属蛋白酶和纤溶酶的水平提高,从而破坏基底膜的完整性。光老化皮肤中真皮的变化最为明显,主要表现为细胞、结缔组织含量和结构的改变[16]:光老化皮肤真皮中成纤维细胞数目增加,其形状由梭形变为不规则的星形,超微结构显示这些星形细胞包含功能活跃的内质网结构,表明其生物合成活性增强;嗜酸性粒细胞、淋巴细胞、肥大细胞和单核细胞等炎症细胞数量增加,表明紫外光诱导皮肤产生炎症;真皮乳头及下方的血管扩张充血,血管内皮细胞肿胀;Ⅰ型胶原蛋白、Ⅲ 型胶原蛋白和新生的胶原蛋白减少,并可见大量的胶原嗜碱性变。弹性纤维变性是皮肤光老化最显著的特征性组织学改变,降解的弹性纤维无确定形态、破碎卷曲且纤维变粗,其弹性和生物功能基本消失[18]。紫外线辐射导致皮肤组织发生一系列损伤,见图3。 "
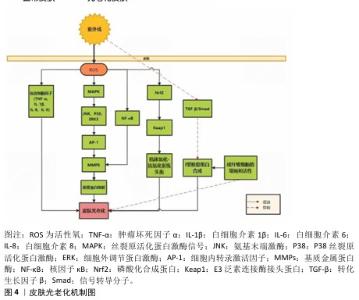
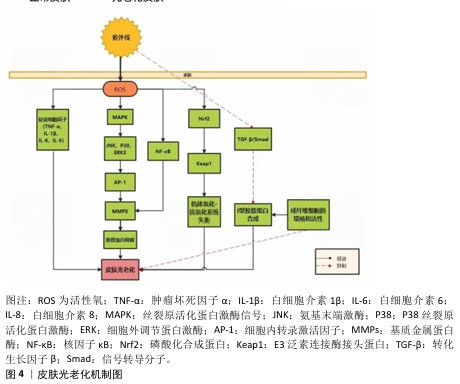
2.3 光老化的发生机制 紫外线辐射引起皮肤光老化的损伤机制主要包括氧化应激、基质金属蛋白酶的作用和细胞凋亡、炎症反应等,促进了胶原蛋白及纤维粘连蛋白等细胞外基质蛋白的降解和异常弹性纤维沉积,导致皮肤光老化的发生[19],见图4。 紫外线辐射会使细胞产生大量活性氧。正常情况下线粒体产生少量活性氧,维持细胞内动态平衡,当皮肤受到过量的紫外线照射时,细胞内活性氧出现堆积和重组现象,并激活磷酸化合成蛋白的特定激酶,使得磷酸化合成蛋白下调,从而影响其与细胞质中抑制磷酸化合成蛋白的蛋白(E3泛素连接酶接头蛋白)结合,最终导致E3泛素连接酶接头蛋白明显增高,机体氧化-抗氧化系统失衡[20]。同时活性氧的蓄积可诱导细胞因子白细胞介素1β、白细胞介素6、白细胞介素8、肿瘤坏死因子α的表达,进一步加重光老化[18]。 过量的活性氧可激活丝氨酸/苏氨酸激酶通路与核因子κB通路,导致基质金属蛋白酶表达上调[20]。基质金属蛋白酶是一类高度保守的内切蛋白水解酶,几乎能降解细胞外基质的所有成分,其表达的增加是导致皮肤光老化过程中的关键[21]。 紫外线辐射使表皮层内的角质形成细胞和真皮层内的成纤维细胞释放白细胞介素1β、白细胞介素6、肿瘤坏死因子α等炎性因子,激活丝裂原活化蛋白激酶信号,引起氨基末端激酶、P38丝裂原蛋白活化激酶、细胞外调节蛋白激酶3条信号通路活化,诱导C-Jun、C-Fos蛋白的表达水平依次升高,激活转录因子AP-1、AP-1和基质金属蛋白酶启动因子结合,上调基质金属蛋白酶的表达,促进细胞外基质降解[22]。正常情况下,核因子κB二聚体与核因子κB抑制蛋白形成三聚体,以未活化的状态存在于细胞质中,紫外线辐射使IκB激酶IKK被激活,活化的IKK诱导IKK磷酸化,使核因子κB转移到细胞核并与基质金属蛋白酶启动子的核因子κB位点结合,从而上调基质金属蛋白酶1、基质金属蛋白酶3表达,进一步降解胶原蛋白[23]。 另外,可通过抑制转化生长因子β/信号转导分子(Smad)信号通路减少Ⅰ型胶原蛋白合成,促进皱纹的形成。转化生长因子β能诱导细胞形成多种细胞外基质蛋白,包括胶原蛋白、层连蛋白等;同时它还可以抑制基质降解酶类的活性,在创面愈合、纤维化等过程发挥重要作用。转化生长因子β与其Ⅱ型受体结合,并磷酸化下游的信号转导分子2;激活的信号转导分子2和信号转导分子3再与信号转导分子4结合并进入细胞核内,调节目的基因的表达;转化生长因子β受体阻断剂能够通过抑制信号转导分子2和信号转导分子3的磷酸化,并抑制转化生长因子β与其受体形成复合物以及抑制该复合物进入细胞核,从而抑制Ⅰ型胶原蛋白或者其他基因的表达[24]。 也有研究显示紫外线辐射可以加速细胞端粒缩短。端粒位于真核生物染色体末端,是DNA的特定序列、相关蛋白结合形成的DNA蛋白复合物,端粒通过长度的改变影响细胞的增殖与分化能力,当端粒长度缩短到海弗利克(Hayflick)界限时,细胞进入老化阶段。皮肤光老化是细胞在紫外线辐射下细胞微环境发生改变,最终导致DAN损伤,加速端粒长度缩短,从而出现细胞提前老化[25]。 "
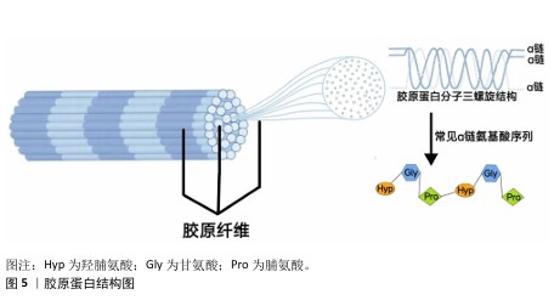
2.4 胶原蛋白联合微针技术的基本原理 2.4.1 胶原蛋白 胶原蛋白是一种结构蛋白,广泛存在于骨骼、肌腱、关节和皮肤等结缔组织中[26],尤其是在哺乳动物中,胶原蛋白含量非常丰富,约占体内总蛋白质质量的30%,是细胞外基质中最常见的成分。 胶原蛋白作为结缔组织基质的主要成分,在动物的真皮、肌腱、软骨中呈纤维状,集聚后构成胶原纤维,在电子显微镜的观察下呈现复杂的横纹结构。构成纤维的基本单位是相对分子质量约为3×105、长度280 μm、宽度1.5 μm的原胶原蛋白[27]。构成原胶原蛋白最主要的氨基酸为甘氨酸、脯氨酸和羟脯氨酸,由于分子间作用力,氨基酸链缠绕形成左手螺旋构型的α链,3条α链又以右手螺旋方式缠绕并形成三重螺旋结构,形成了胶原蛋白有别于其他基质蛋白的特征性结构[28-29],见图5。胶原蛋白具有独特的三股螺旋构象形态结构,生物相容性好,可生物降解,这些优良的特性使其在众多领域得到应用。 截至目前,已经被证实有28种不同类型的胶原蛋白(Ⅰ-ⅩⅩⅧ型)[30]。皮肤中胶原蛋白的主要类型为Ⅰ型、Ⅲ型和Ⅴ型,其次为Ⅻ型、ⅪⅤ型、ⅩⅥ型和Ⅵ型[31]。其中,Ⅰ型胶原在所有胶原中含量最高,起到结构支持的作用;Ⅲ型胶原在新生儿皮肤中含量较高;Ⅳ型胶原是基底膜网状结构的主要组成成分;Ⅶ型胶原起锚定功能,能够改善表皮与真皮层的连接;ⅩⅦ型胶原则是一种跨膜胶原,在改善皮肤衰老、促进毛发再生中具有潜在应用[32]。目前在皮肤中使用的胶原蛋白主要为Ⅰ、Ⅲ、ⅩⅦ型,未来更多亚型胶原蛋白的应用有望进一步丰富胶原蛋白在皮肤中的应用。 "
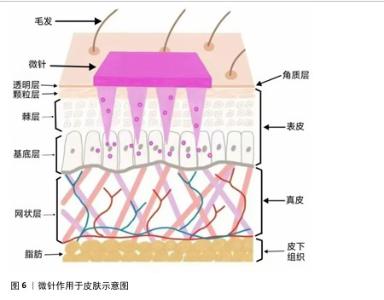
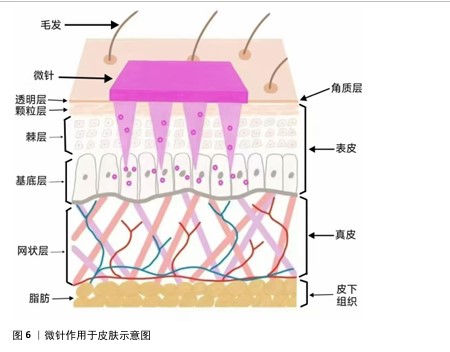
2.5 微针作用于皮肤的机制及其优缺点 微针是一种高效、安全、新型的经皮给药技术,主要通过将药物有效成分通过微针的形式高效输送至表皮下,具有无痛、微创、生物利用度高等优势。这一技术的作用机制主要包括2个方面:首先,微针在穿透皮肤表面时形成微小通道,突破角质层的屏障,提高了药物在皮肤内的渗透率[46];其次,微针的刺激可以激活皮肤的生理反应,增加局部血流量和淋巴循环,促使药物更加迅速有效地进入血液循环系统,从而实现局部以及整体的药物传递,为治疗提供一种高效而精准的途径[47],见图6。目前,微针被广泛应用于基因传递、诊断、疫苗接种以及美容护肤等方面[48]。 传统的经皮给药方式,如乳膏、凝胶等,往往因皮肤角质层的阻碍而难以达到理想的渗透效果,而与传统经皮给药方式相比,微针给药具有显著优势。微针的针体长度一般在25-2 000 μm(人体的角质层的厚度一般为10-20 μm)[49],可通过刺破皮肤角质层形成药物渗透的通道,显著提高药物的生物利用度,同时其微米级的长度在表皮下未触及神经末梢,使得患者只感受到轻微痛感,可增加患者依从性,是一种高效、便利的经皮给药方式[50]。与口服药物相比,微针给药可避免胃肠道中各种消化酶和化学因素所致的药物降解和肝脏首过效应,延长有效作用时间及稳定血药浓度等,是一种具有良好应用前景的新型给药系统[51]。 但同时微针也存在一些缺点:首先,微针治疗会在皮肤上制造微小创口,会出现如红斑、肿胀、疼痛等不良反应,给患者带来短暂不适感[52];此外,微针负载药量有限,合适的制备材料有限,导致药物的输送效率下降;不恰当的制备条件也可能导致不耐热药物的失活和降解[53]。不同患者的皮肤状况、恢复能力和对微针治疗的反应不同,治疗效果存在一定的个体差异,部分患者可能无法达到预期的改善效果[54]。 根据制备材料和工艺的不同,微针主要分为5种类型:水凝胶微针、中空微针、可溶性微针、固体微针和涂层微针。 2.5.1 水凝胶微针 水凝胶微针主要由可膨胀聚合物制成,当其进入人体后聚合物可迅速吸水膨胀,常被用于皮肤间质液的提取[55]。相比其他类型微针,水凝胶微针具备高载药量和持续性释放药物等优点,可为蛋白质、肽等各种大分子药物提供载体[56],但作用于皮肤后留下来的微孔过大、皮肤恢复时间较长、易感染等缺点限制了其广泛应用[57]。 2.5.2 中空微针 中空微针是一种内部设有空心孔道的微米级别针体,孔道内径和外径通常为60-300 μm,孔道中可负载液态和固态药物[58]。相对于其他类型微针,中空微针最大的特征在于针内部呈现空腔结构,可用于装载药物顺浓度梯度压力驱动进入体内,实现药物递送;也具有穿透角质层和灵活提供给药剂量的双重优势[59],但在使用过程中针孔存在被皮肤组织堵塞的风险[60]。 2.5.3 可溶性微针 可溶性微针由毒性低、生物相容性良好、可溶解聚合物或糖类经模具制作而成,如透明质酸[61]、聚乙烯醇、聚乙烯基吡咯烷酮等[62]。与其他微针类型相比,可溶性微针具有制备简单、交叉感染风险低、高效递送、无皮肤残留、使用便捷等优势[63],但依旧存在很多需解决的问题,如制备微针时部分针体存在机械强度不足,导致给药时发生针体弯曲、断裂等情况[59]。 2.5.4 固体微针 固体微针由金属、硅等无孔或无通道材料组成,通常不携带药物,通过物理穿透皮肤并形成暂时性微通道,促进药物溶液在敷料内的被动扩散[64]。固体微针的机械性能较强,常用材料中硅的成型性好、金属成本较低,但存在给药量低、针体易断裂滞留于皮肤中、金属成分会导致皮肤产生有害物质等问题,使其使用频率降低[65]。 2.5.5 涂层微针 涂层微针是一种具有外部药物涂层的固体微针,由尖锐的固体核心结构和其表面水溶性药物组成[64]。与固体微针相比,涂层微针消除了单独用药的需要,使用更方便,但因涂层较薄导致负载药物的能力有限,在部分疾病治疗中难以发挥作用[66]。 "
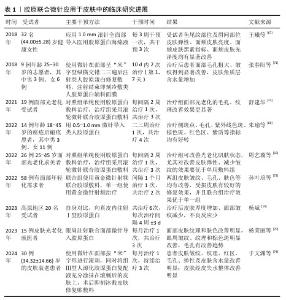
2.6 胶原蛋白联合微针治疗皮肤光老化的研究进展 胶原蛋白联合微针在治疗皮肤光老化方面展现出巨大的潜力,为了进一步验证胶原联合微针治疗光老化的可能性,有必要进行随机双盲的对照试验。目前国内已有多项临床试验证实,胶原经微针给药能达到明显的改善光老化的作用。 2.6.1 美白及改善色素沉着 王曦等[67]在对32例平均年龄(44.00±5.28)岁健康女性志愿者的临床研究中,应用1.0 mm滚针全面部导入医用胶原蛋白海绵液,并且在导入完成后用康复贴敷料(面膜)敷面,最后用医用胶原复配型凝胶敷料均匀喷涂于全面部,在为期9周的临床试验中所有受试者均能耐受治疗,无不良反应发生,受试者皮肤亮度、黑素含量及光泽度得到了显著改善。朱瑜等[68]在应用小剂量异维A酸联合微针导入类人胶原蛋白治疗寻常痤疮患者的临床试验当中,将患者随机分为实验组和对照组,实验组应用0.5-1.0 mm微针导入类人胶原蛋白,对照组仅保湿防晒护理,治疗后实验组紫外线色斑较对照组明显改善。 2.6.2 改善皮肤弹性减少皱纹 周艺璇等[69] 将26例受试者随机分为2组,对照组单纯使用胶原蛋白敷料治疗,治疗组采用滚轮微针联合胶原蛋白敷料,治疗3个疗程后的结果显示,治疗组皮肤弹性改善、皱纹减少方面优于对照组,并且安全性高。杨斌[10]对高原地区20名受试者进行自身对照研究,每位患者接受6次真皮内注射Ⅰ型胶原蛋白后皮肤厚度均增加,VISIA 红色区及皱纹特征计数均较治疗前减少,患者满意度高,不良反应少。杨荣丽等[70]在对15例30-50岁患者进行的9个月临床试验中,给予眼周注射联合面部微针导入胶原蛋白治疗,治疗后患者主观评价面部皮肤纹理和肤色明显改善,并且VISIA图像分析结果显示患者眼周皱纹、纹理和棕色斑明显改善,毛孔有改善趋势。 2.6.3 收缩毛孔及修复屏障 张春阳等[71]在观察微针联合类人胶原蛋白对面部毛孔粗大及皮肤屏障影响的研究中发现,治疗后患者面部毛孔、皱纹明显改善,患者满意度高。有研究对19名面部光老化受试者采用自面左右脸配对设计,根据随机原则对左右脸分组,对照组单纯使用胶原蛋白敷料治疗,治疗组采用滚轮微针联合胶原蛋白敷料,共治疗3次,每次间隔2周,两组治疗后的毛孔、纹理分值较治疗前均降低,并且治疗组皮肤改善优于对照组[72]。孙叶培等[73]将58例有面部年轻化需求者分为联合组(黄金微针射频联合胶原敷料)及单一组(黄金微针射频治疗),3个月治疗结束后两组皮肤皱纹、毛孔、肤色等均有改善,并且联合组的治疗效果优于单一组。 2.6.4 保湿补水 于文渊等[74]将进行面部治疗的30例患者随机分为实验组与对照组,实验组使用微针在面部进行滚刺,同时将重组Ⅲ组人源化胶原蛋白复配液充分涂抹在滚刺后的皮肤上,对照组使用重组Ⅲ组人源化胶原蛋白复配液直接用手全部涂抹在面部,治疗后的结果显示,治疗组患者的皮肤皱纹、纹理、红区、毛孔、弹性及皮肤含水量改善明显,说明微针导入重组Ⅲ组人源化胶原蛋白可以有效改善受试者皮肤水分含量的变化、增加角质层含水量、减少经皮水分流失值、增强皮肤锁水保湿能力。 表1汇集了国内近10年微针联合胶原蛋白应用于皮肤的相关临床试验,表明胶原蛋白联合微针给药具有更加显著持久的美白、改善色素沉着、减少皱纹、改善皮肤弹性、收缩毛孔和修复皮肤屏障等多种有益于皮肤健康的功效。 "

| [1] 韩丝银,吴永沛,王映彪,等.南珠粉预防小鼠皮肤光老化的作用及其机制研究[J].时珍国医国药 2021,32(2):308-312. [2] GUAN LL, LIM HW, MOHAMMAD TF. Sunscreens and Photoaging: A Review of Current Literature. Am J Clin Dermatol. 2021;22(6):819-828. [3] BOSCH R, PHILIPS N, SUÁREZ-PÉREZ JA, et al. Mechanisms of Photoaging and Cutaneous Photocarcinogenesis, and Photoprotective Strategies with Phytochemicals. Antioxidants (Basel). 2015;4(2):248-268. [4] 林荣锋.广藿香油对UV所致小鼠皮肤光老化模型保护作用的实验研究[D].广州:广州中医药大学,2015. [5] 葛格.蓝光对皮肤老化的影响及分子机制研究[D].沈阳:中国医科大学,2021. [6] FISHER GJ, DATTA S, WANG Z, et al. c-Jun-dependent inhibition of cutaneous procollagen transcription following ultraviolet irradiation is reversed by all-trans retinoic acid. J Clin Invest. 2000;106(5): 663-670. [7] 谷炎培,韩建欣,姜春鹏,等.植物提取物延缓皮肤光老化作用的研究进展[J].精细化工,2020,37(2):217-221,41. [8] 王国伟,侯丽,秦越,等.医用重组人源胶原蛋白功能敷料体外免疫原性评价[J].食品与药品,2024,26(2):153-157. [9] 尹翠元,刘璐,何琳琳.胶原蛋白肽修复光老化皮肤作用研究进展[J].生物学杂志,2023,40(1):14-20. [10] 杨斌.Ⅰ型胶原蛋白治疗高原地区面部皮肤光老化的临床研究[D].昆明:昆明医科大学,2023. [11] 闫星雨,但年华,陈一宁,等.胶原基复合止血材料的研究进展及展望[J].材料导报,2023,37(5):240-248. [12] 史双妮.迷你胶原蛋白的设计及其在光损伤皮肤修复中的应用[D].兰州:兰州大学,2023. [13] 何秋敏.微针联合脂肪干细胞来源胞外囊泡延缓小鼠皮肤光老化的作用及机制研究[D].扬州:扬州大学,2020. [14] SANDER M, SANDER M, BURBIDGE T, et al. The efficacy and safety of sunscreen use for the prevention of skin cancer. CMAJ. 2020;192(50):E1802-E1808. [15] GROMKOWSKA-KĘPKA KJ, PUŚCION- JAKUBIK A, MARKIEWICZ-ŻUKOWSKA R, et al. The impact of ultraviolet radiation on skin photoaging - review of in vitro studies. J Cosmet Dermatol. 2021;20(11):3427-3431. [16] KE Y, WANG XJ. TGFβ Signaling in Photoaging and UV-Induced Skin Cancer. J Invest Dermatol. 2021;141(4S):1104-1110. [17] BILAÇ C, ŞAHIN MT, ÖZTÜRKCAN S. Chronic actinic damage of facial skin. Clin Dermatol. 2014;32(6):752-762. [18] SHAO Y, QIN Z, ALEXANDER WILKS J, et al. Physical properties of the photodamaged human skin dermis: Rougher collagen surface and stiffer/harder mechanical properties. Exp Dermatol. 2019;28(8):914-921. [19] 姜文彬,陈雳风,孙家明.脂肪干细胞来源外泌体在皮肤创面修复中的作用机制[J].组织工程与重建外科,2021,17(4): 352-357. [20] 何琪钰,李雯琪,李雨橦,等.紫外线对人体皮肤的光毒性效应及机制[J].生态毒理学报,2024,19(2):66-74. [21] QUAN T, QIN Z, XIA W, et al. Matrix-degrading metalloproteinases in photoaging. J Investig Dermatol Symp Proc. 2009;14(1):20-24. [22] IVAN AL, CAMPANINI MZ, MARTINEZ RM, et al. Pyrrolidine dithiocarbamate inhibits UVB-induced skin inflammation and oxidative stress in hairless mice and exhibits antioxidant activity in vitro. J Photochem Photobiol B. 2014;138:124-133. [23] 赵婧琪,张小卿,吴景东.皮肤光老化发生发展的自噬机制[J].实用中医内科杂志,2023,37(12):78-80. [24] 叶希韵.紫外线致皮肤光老化研究进展[J].生物学教学,2015,40(11):2-5. [25] 谭玲,李大铁.端粒及端粒酶与皮肤光老化关系的研究进展[J].贵州医药,2018, 42(5):552-554. [26] ARAVINTHAN A, PARK JK, HOSSAIN MA, et al. Collagen-based sponge hastens wound healing via decrease of inflammatory cytokines. 3 Biotech. 2018;8(12):487. [27] 张小燕.胶原蛋白肽生物功能材料的研究与开发[D].西安:西北工业大学,2006. [28] HENNET T. Collagen glycosylation. Curr Opin Struct Biol. 2019;56:131-138. [29] HONG H, FAN H, CHALAMAIAH M, et al. Preparation of low-molecular-weight, collagen hydrolysates (peptides): Current progress, challenges, and future perspectives. Food Chem. 2019;301: 125222. [30] HUANG A, GUO G, YU Y, et al. The roles of collagen in chronic kidney disease and vascular calcification. J Mol Med (Berl). 2021;99(1):75-92. [31] MATHEW-STEINER SS, ROY S, SEN CK. Collagen in Wound Healing. Bioengineering (Basel). 2021;8(5):63. [32] 马晓瑜.胶原蛋白:迷思与真相[J].中国化妆品,2024(2):98-102. [33] VARANI J, SCHUGER L, DAME MK, et al. Reduced fibroblast interaction with intact collagen as a mechanism for depressed collagen synthesis in photodamaged skin. J Invest Dermatol. 2004;122(6):1471-1479. [34] XUE M, JACKSON CJ. Extracellular Matrix Reorganization During Wound Healing and Its Impact on Abnormal Scarring. Adv Wound Care (New Rochelle). 2015;4(3): 119-136. [35] 彭志兰.牡蛎蛋白源抗皮肤光老化活性肽的分离纯化、鉴定及其作用机理研究[D].湛江:广东海洋大学,2021. [36] NOH E, LEE G, LIM C, et al. Protective effects of Evodiae Fructus extract against ultraviolet-induced MMP-1 and MMP-3 expression in human dermal fibroblasts. J Herb Med. 2022;35:100586. [37] 盛周煌,贾盟盟,朱良.罗非鱼皮胶原蛋白多肽的体外抗氧化活性[J].食品科技, 2018,43(11):274-278. [38] CAO C, XIAO Z, TONG H, et al. Oral Intake of Chicken Bone Collagen Peptides Anti-Skin Aging in Mice by Regulating Collagen Degradation and Synthesis, Inhibiting Inflammation and Activating Lysosomes. Nutrients. 2022;14(8):1622. [39] 潘梦.密斑刺鲀鱼皮胶原蛋白对UVB诱导小鼠皮肤急性光损伤的保护作用[D].长春:吉林大学,2023. [40] LIU H, DONG J, DU R, et al. Collagen study advances for photoaging skin. Photodermatol Photoimmunol Photomed. 2024;40(1):e12931. [41] PYUN HB, KIM M, PARK J, et al. Effects of Collagen Tripeptide Supplement on Photoaging and Epidermal Skin Barrier in UVB-exposed Hairless Mice. Prev Nutr Food Sci. 2012;17(4):245-253. [42] ITO N, SEKI S, UEDA F. The Protective Role of Astaxanthin for UV-Induced Skin Deterioration in Healthy People-A Randomized, Double-Blind, Placebo-Controlled Trial. Nutrients. 2018;10(7):817. [43] KANG MK, KIM DY, OH H, et al. Dietary Collagen Hydrolysates Ameliorate Furrowed and Parched Skin Caused by Photoaging in Hairless Mice. Int J Mol Sci. 2021;22(11):6137. [44] 张宇涵,周靖萱,张南海,等.胶原蛋白肽与弹性蛋白肽对改善皮肤光老化的研究进展[J].食品研究与开发,2023, 44(11):208-216. [45] 王静凤,王奕,崔凤霞,等.鱿鱼皮胶原蛋白多肽对B16黑素瘤细胞黑素合成的影响[J].中国药理学通报,2007,23(9): 1181-1184. [46] 阿燕·哈山,刘妍,聂文佳,等.可溶性微针在皮肤美容中的研究与应用[J].皮肤科学通报,2023,40(4):424-429. [47] 张心悦,陶娟.中药组分-微针技术在皮肤病治疗中的研究进展[J].皮肤科学通报,2024,41(3):257-262. [48] BHATNAGAR S, DAVE K, VENUGANTI VVK. Microneedles in the clinic. J Control Release. 2017;260:164-182. [49] CHANG KT, SHEN YK, FAN FY, et al. Optimal design and fabrication of a microneedle arrays patch. J Manuf Process. 2020;54: 274-285. [50] BROGDEN NK, MILEWSKI M, GHOSH P, et al. Diclofenac delays micropore closure following microneedle treatment in human subjects. J Control Release. 2012; 163(2):220-229. [51] 朱学敏,马敏,任略,等.透皮吸收促进剂评价的新技术[J].中国药学杂志,2017, 52(15):1301-1307. [52] ALDAWOOD FK, ANDAR A, DESAI S. A Comprehensive Review of Microneedles: Types, Materials, Processes, Characterizations and Applications. Polymers (Basel). 2021;13(16):2815. [53] NGUYEN HX, NGUYEN CN. Microneedle-Mediated Transdermal Delivery of Biopharmaceuticals. Pharmaceutics. 2023; 15(1):277. [54] 刘宇萱,仲崇瑶,高娜,等.可溶性微针疫苗的研究进展[J].微生物与感染,2024, 19(1):52-57. [55] ZHU J, ZHOU X, KIM HJ, et al. Gelatin Methacryloyl Microneedle Patches for Minimally Invasive Extraction of Skin Interstitial Fluid. Small. 2020;16(16): e1905910. [56] 孔晓雯,王爽,曹洁.微针递送系统在口腔疾病治疗中的应用研究进展[J].青岛大学学报(医学版),2024,60(4):619-622. [57] 陈雅婷,吴玥,邓子贤,等.微针在促伤口愈合中应用的研究进展[J].中国药科大学学报,2024,55(4):557-564. [58] 平洋,王岩,王丽红,等.经皮载药微针的现代研究进展[J].中国新药杂志,2023, 32(19):1993-2000. [59] 赵翰卿,陈明龙,卢安琪,等.微针在经皮药物递送系统中的应用[J].药学进展 2024,48(4):244-253. [60] 任哲生,郑振龙,金哲虎.微针在病理性瘢痕治疗与预防中的应用[J].中国皮肤性病学杂志,2024,38(11):1181-1187. [61] 王周云,司玉玺,杨荣荣,等.可溶性透明质酸微针的制备及表征[J].中国海洋药物,2024,43(5):55-61. [62] 陈欢欢,宋信莉,汪云霞,等.雷公藤甲素双室可溶性微针的工艺研究及评价[J].中草药,2022,53(9):2668-2677. [63] ALI M, NAMJOSHI S, BENSON HAE, et al. Dissolvable polymer microneedles for drug delivery and diagnostics. J Control Release. 2022;347:561-589. [64] VORA LK, MOFFATT K, TEKKO IA, et al. Microneedle array systems for long-acting drug delivery. Eur J Pharm Biopharm. 2021; 159:44-76. [65] LUO X, YANG L, CUI Y. Microneedles: materials, fabrication, and biomedical applications. Biomed Microdevices. 2023; 25(3):20. [66] 王柏霖,丁晓航,于文渊,等.微针载药系统在局部器官组织疾病治疗中的研究进展[J].中国医药,2024,19(7):1087-1090. [67] 王曦,舒晓红,李朝霞,等.皮肤微针联合医用胶原蛋白海绵改善女性面部皮肤老化的疗效观察[J].中国美容医学, 2018,27(3):52-55. [68] 朱瑜,崔晓,曾维惠,等.小剂量异维A酸联合微针导入类人胶原蛋白治疗痤疮后瘢痕疗效观察[J]. 中国美容医学, 2022,31(10):47-50. [69] 周艺璇,舒建华,许婧. 滚轮微针联合胶原蛋白敷料改善面部光老化的自身半脸对照研究[J].中国医疗美容,2022,12(2): 29-33. [70] 杨荣丽,罗锦添,穆欣,等.眼周注射联合面部微针导入胶原蛋白改善皮肤光老化的疗效观察[J]. 中国美容医学,2023, 32(11):95-98. [71] 张春阳,宋静卉,李雪莉,等.微针联合类人胶原蛋白对面部毛孔粗大及皮肤屏障的影响[J].中国医疗美容,2018,8(12): 52-56. [72] 舒建华.滚轮微针联合胶原蛋白敷料改善面部光老化的疗效观察[D].成都:成都中医药大学,2021. [73] 孙叶培,唐春,李彦青,等.黄金微针射频联合胶原敷料在面部年轻化中的临床应用[J].中国医疗美容,2022,12(12):29-33. [74] 于文渊,耿栋芸,庄卉如,等.微针导入重组Ⅲ型人源化胶原蛋白在皮肤屏障功能修复中的应用效果[J].临床医学研究与实践,2024,9(7):102-105. |
| [1] | Huang Xinxu, Zhang Xin, Wang Jian. Living microecological hydrogels promote skin wound healing [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 489-498. |
| [2] | Chen Ling, Mao Qiuhua, Xu Pu, Zhang Wenbo. Effect of water-soluble matrix of nano-pearl powder on proliferation, migration and apoptosis of mouse fibroblasts#br# [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 338-344. |
| [3] | Liu Xiaohong, Zhao Tian, Mu Yunping, Feng Wenjin, Lyu Cunsheng, Zhang Zhiyong, Zhao Zijian, Li Fanghong. Acellular dermal matrix hydrogel promotes skin wound healing in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 395-403. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||