Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (11): 2385-2393.doi: 10.12307/2025.367
Previous Articles Next Articles
Application of deep learning in oral imaging analysis
Yang Yuxuan, Tan Jingyi, Zhou Lili, Bian Zirui, Chen Yifan, Wu Yanmin
- Department of Periodontology, the Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, Zhejiang Province, China
-
Received:2024-03-09Accepted:2024-05-25Online:2025-04-18Published:2024-08-12 -
Contact:Wu Yanmin, MD, Chief physician, Department of Periodontology, the Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, Zhejiang Province, China -
About author:Yang Yuxuan, Master candidate, Department of Periodontology, the Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, Zhejiang Province, China -
Supported by:Basic Public Welfare Research Program of Zhejiang Province, No. LY24H140003 (to TJY); Zhejiang Province Medical and Health Science and Technology Program, Nos. 2022498153 (to TJY) and 2021427110 (to ZLL)
CLC Number:
Cite this article
Yang Yuxuan, Tan Jingyi, Zhou Lili, Bian Zirui, Chen Yifan, Wu Yanmin. Application of deep learning in oral imaging analysis[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(11): 2385-2393.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
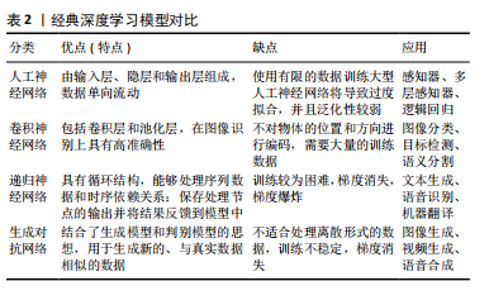
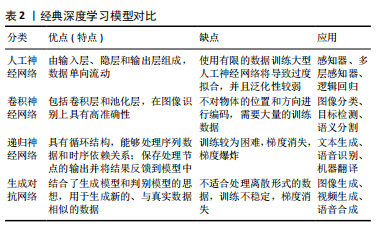
2.2 深度学习简介 深度学习是机器学习领域中一个新的研究方向,它通过模仿大脑神经元之间传递、处理信息的形式来解释例如文本、图像、声音等数据。深度学习通过建立神经元计算节点和多层次运算结构,选择合适的输入层和输出层,再经过神经网络的学习和调优,建立起从输入到输出的函数关系,从而实现输出结果与现实的高度相关。深度学习技术是数据驱动的,它们需要监督才能从数据中学习。深度学习模型的训练程度从完全监督学习到完全自监督学习不等。自监督学习是指数据由机器自主标记,不需要人工注释,而弱监督学习介于监督学习和自监督学习之间,需要有限数量的手动数据标记。深度学习的最终目标是建立一个完全自动化的无监督系统,并实现准确的预测[6]。 结合了计算机科学、统计学和决策理论的深度学习技术,在输入数据是非结构化数据(例如图像)时会显示出更高的解释效率,这也是它为越来越多医学领域学者所青睐的原因之一。其中在口腔医学领域,无论是疾病的诊断还是治疗方案的制定,都在很大程度上依赖医学影像资料的判读,深度学习技术在口腔医学领域有着非常巨大的应用前景。此外,近年来深度学习算法的发展呈指数级增长,彻底改变了传统机器学习的运算模式,例如:深度学习算法在图像分类和图像分割上的精进,即对于判别模型的优化,可以使其在辅助定位病变组织与正常组织方面具有更高的精准度;在合成和渲染方面的改进,即对于生成模型的优化,则可以使其在辅助可视化疾病诊断方面具有更优越的性能。 经典的深度学习模型包括人工神经网络、卷积神经网络、递归神经网络和生成对抗网络等,学者们以或竞争或联合的形式运用这些模型,以期实现更高效的对口腔医学影像的解释、更准确的疾病诊断及诊疗方案制定。人工神经网络最基本的形式是传统的神经网络(即多层感知器),它具有3个主要组件,即输入层、隐层和输出层。输入层接收初始数据源,输出层产生最终结果,各层连接在一起,每一层都包含一组人工神经元,执行编程所指定的任务,并且每一层的神经元数量由训练数据的大小和类型决定。隐藏层存在于输入层和输出层之间并被引入神经网络,以解决更复杂的计算任务。人工神经网络的网络大小和性能与参与训练的数据量呈正比,在大量数据上训练的超大型人工神经网络的性能明显优于基于较少数据的网络。但值得注意的是,使用有限的训练数据训练大型人工神经网络将导致过度拟合,并且泛化性较弱。事实上,目前的深度学习技术更多地由卷积神经网络驱动。卷积神经网络包含许多不同类型的层,包括卷积层和池化层。卷积神经网络使用卷积层作为特征提取器,并从其输入信号中识别重要特征;而池化层的作用是最小化网络规模,将系统稳定在计算阈值[7]。与传统的神经网络相比,卷积神经网络在空间特征提取方面表现出更优异的性能,更适合对大型图像进行分类。递归神经网络是另一种类型的人工神经网络,它主要通过接收标准输入来发挥作用,同时也接受过去感知到的输入。递归神经网络的工作原理是通过存储先前信息的循环反馈神经元隐藏层将存储的信息与当前传入的信息合并,利用旧的存储数据处理新的输入数据,从而做出更合理的决策。虽然卷积神经网络在图像分类方面性能优异,但递归神经网络在处理文本、音频或多组图像等序列时有其独特的优势。此外,生成对抗网络是深度学习算法蓬勃发展下的最新产物之一,它是一类特殊的卷积神经网络,利用博弈论原理训练,由生成器和鉴别器这2个主要组件组成[8]。生成器负责生成新的数据样本,将图像编码和解码到低维潜在空间中,鉴别器经过训练后用以辨别“真实”与“虚假”图像,这需要数以百万计的“真实”和“虚假”数据点来充分训练鉴别器,因此生成对抗网络严重依赖大数据。但不可否认的是,生成对抗网络的使用为许多计算机图形学和计算机视觉问题提供了高级解决方案,是视觉计算领域的最新成果。经典深度学习模型对比见表2。"

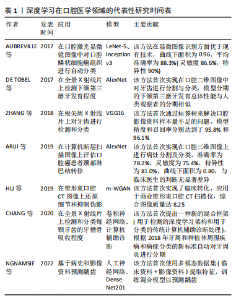
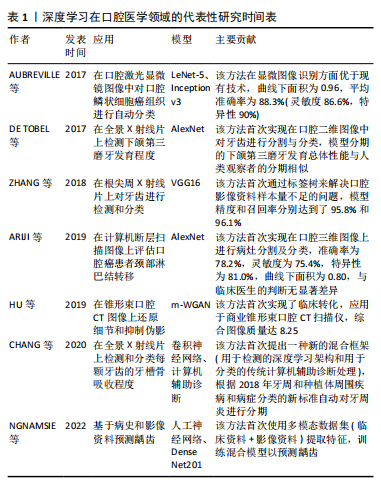
2.3 深度学习在口腔疾病诊断中的应用 2.3.1 深度学习技术检测龋齿 龋病是最常见的牙体疾病之一,临床诊断主要依靠视诊、探诊,辅以影像学检查,早期龋病表现为釉质的脱矿,临床上大多无明显症状,影像学检查也难以识别细微的病变,准确识别早期龋齿病变对临床医生来说是一个挑战,人工智能的使用,特别是深度学习,可以支持临床医生对不同类型的口腔影像进行龋齿病变检测和诊断,其中,深度学习技术检测龋齿在全景X射线片中的应用更为成熟,它支持对不同龋齿度(浅龋、中龋、深龋)图像的分割,能达到90%以上的准确度[9-11];在锥形束CT图像中,ESMAEILYFARD等[12]首次证实了卷积神经网络在对龋病累及范围和位置进行分类方面可以表现出平均高于92%的灵敏度、特异性和准确性;在咬合翼片及口内照片中,深度学习技术识别龋齿的准确性与灵敏度也能达到平均80%,可用于在人群中对龋齿进行低成本的初筛[13-16];而在近红外光透射图像上,深度学习技术显示的准确性和泛化性较低[17-18], 应批判性地评估使用体外图像开发深度学习模型的可推广性。有别于以上基于单一数据源的研究,NGNAMSIE等[19]创新性提出基于深度学习决策支持系统的多模态龋齿预测,使用多个数据源(病历数据和影像数据)及混合模型(由卷积神经网络和人工神经网络组成)来提取更多特征,表现出了良好的性能。综上,除近红外光透射图像外,针对不同来源的影像学数据,利用深度学习技术检测龋齿都具备较高可行性。 2.3.2 深度学习技术检测根尖周炎 根尖周炎在全球20-60岁年龄组中有33%-62%的患病率[20],影像学是该病重要的诊断依据之一,大多表现为根尖周阴影,病变范围易勾画,有利于深度学习技术在该领域的运用。深度学习技术检测根尖周炎大多使用根尖周X射线片作为数据源[21-22],纯模型检测的准确性大多优于人工检测。近年来,也有学者基于锥形束CT图像验证和开发了新型人工智能系统[23-24],总体敏感性和特异性均高于人工,特别是当排除非常小的病变时敏感性得到了进一步的提高。现有的研究提示深度学习技术检测根尖周炎的应用较为成熟,有望推广于临床以辅助医生提高诊断的准确性和一致性,而进一步增强算法的鲁棒性,可使其在检测非常小的病变以及处理临床中常见的伪影和异常值方面拥有更好的适应性。 2.3.3 深度学习技术检测牙根纵裂 在中国人群中,超过40%的牙根纵裂发生在未经根管治疗的牙齿中[25]。临床上,牙根纵裂的体征和症状通常不具有特异性,借助影像学的诊断效率也缺乏稳定性,人工阅片存在漏诊率较高的问题。而深度学习技术的发展使诊断牙根纵裂的准确率得到了一定提升,比如,一种利用根折线较清晰的全景X射线片训练和评估牙根纵裂的深度学习模型[26],其召回率可达到0.75,精度可达到0.93。而在锥形束CT图像上,研究者们发现与VGG19、DensenNet169等模型以及具有2年经验的放射科医生相比,基于ResNet50的深度学习模型诊断牙根纵裂的效率更高[27-28]。 2.3.4 深度学习技术检测牙周病 牙周病包括牙周炎和牙龈病2大类疾病。牙周炎作为成人缺牙的主要原因,其诊断标准之一是牙槽骨的吸收,检测和评估牙周骨质流失的常用附加方法是放射成像;而牙龈病的临床表现主要在于牙龈色、形、质的改变以及探诊出血。在临床上,通过口腔影像分析全口牙的牙周状况通常较为费时,深度学习技术的应用可提高阅片效率。研究者们对牙周炎的评估主要采用深度学习技术测量牙周骨吸收,大多以全景X射线片或根尖X射线片为数据源,构建不同的深度学习框架,例如:ALOTAIBI等[29]构建了基于VGG-16的深度学习模型;LEE等[30]通过整合3个分割网络(骨区域、牙齿、釉牙骨质界)建立深度学习模型;CHEN等[31]集成了YOLO-v5 模型和VGG-16及U-Net架构,他们在根尖X射线片中检测牙周骨吸收程度,结果均显示深度学习模型具有良好的特征捕获和诊断分级的能力。CHANG等[32]将传统计算机辅助设计与深度学习架构相结合;JIANG等[33]则提出一种基于UNet和YOLO-v4的两阶段深度学习架构,他们在全景X射线片上自动检测和分类每颗牙齿的牙周骨吸收,并且均根据2018年牙周病新分类进行牙周炎分期,表现出高精度和出色的可靠性。对于牙龈病的评估,研究者们大多以口内照片为数据源,例如:LI等[34]使用新型多任务学习卷积神经网络模型从口内照片中检测牙石软垢及牙龈炎,提出了一种经济高效的用于早期发现口腔疾病的方法;ANDRADE等[35]使用U-Net架构对牙齿的菌斑生物膜进行视觉分割,可达到91.8%的准确率;ALALHARITH等[36]则以ResNet-50 卷积神经网络作为特征提取器,在口内照片中检测牙龈炎,但该研究仅关注上切牙的牙龈状况,具有局限性。深度学习技术在牙周病的初步筛查和精确诊断方面都有重要意义,但深度学习技术在检测牙龈病方面的报道较少,这可能与牙龈病的诊断缺乏量化指标有关。 2.3.5 深度学习技术检测颌骨囊肿 颌骨囊肿和肿瘤早期大多无明显症状,早期诊断较为依赖影像学检查,深度学习技术的应用有望降低临床上早期颌骨囊肿的漏诊率。VER BERNE等[37]使用全局(病变一侧颌骨)和局部(仅病变)图像的双路径深度学习方法,在全景成像上可靠地区分根尖囊肿和根尖肉芽肿,有利于更有效地制定治疗方案。YANG等[38]提出一种基于卷积神经网络的YOLO架构,在全景X射线片中识别牙本质囊肿、牙源性角化囊肿和骨髓母细胞瘤,该模型的精度为0.707,召回率为0.680,略优于人工识别。另一种基于DetectNet神经网络的深度学习模型在识别根尖囊肿方面显示出了更高的敏感性,精度为0.898,召回率为0.771[39]。由此可见,深度学习技术可以识别大部分的颌骨囊肿病变,但需要进一步提高分类性能以提升诊断精确度。 2.3.6 深度学习技术检测颞下颌关节疾病 颞下颌关节疾病是口腔颌面部最常见的疾病之一,影像学检查包括X射线平片、关节造影、锥形束CT、磁共振等,正确识别影像中颞下颌关节区域的关键结构是诊断的基础。基于卷积神经网络的深度学习模型在分割下颌骨髁突、关节凹和颞下颌关节盘方面的表现与专家相似[40-42],这些模型的应用将帮助医生节省阅片时间并提高图像解释的准确性。基于准确的图像分割,深度学习技术可以进一步用于诊断筛查X射线平片中的颞下颌关节骨关节炎[43],检测磁共振成像中颞下颌关节盘位移[44-47],预测颞下颌关节盘穿孔等[48]。但运用深度学习技术识别关节囊及关节腔区域是否病变的研究鲜有报道,有待进一步研究。 2.3.7 深度学习技术检测口腔癌病理分型 口腔鳞状细胞癌是最常见的口腔癌类型,活检图像被认为是其病理诊断金标准。深度学习已被用于对细胞类型进行分类,现有研究多是基于活检图像中的形状、颜色和纹理特征对细胞进行二元分类(正常与恶性),使用决策树、支持向量机和线性回归等评估手段均可达到90%以上的准确率[49-50]。DAS等[51]首次提出基于口腔鳞状细胞癌活检图像对口腔癌细胞进行自动多类分级的深度学习架构,该架构明显优于现有的4种卷积神经网络类型(Alexnet、VGG-16、VGG-19和Resnet-50),提供了97.5%的最高准确率。 考虑到活检是一种侵入性且耗时的检测方式,也有许多学者基于光学成像数据结合深度学习检测口腔癌。AUBREVILLE等[52]提出并评估了一种使用深度学习在共聚焦激光内窥镜图像上诊断口腔鳞状细胞癌的方法;而YANG等[53]采用卷积神经网络结合光学相干断层扫描数据,分类准确率高达96.76%,优于机器学习(92.52%),并对扫描图像中的病变进行了可视化分析,评估了区分不同口腔黏膜组织模型的合理性和可解释性。综上,将深度学习与病变图像数据相结合的自动识别方法具有可行性,有望为口腔癌和癌前组织的有效筛查和诊断提供决策支持。 2.4 深度学习在口腔治疗方案决策中的应用 2.4.1 深度学习技术辅助第三磨牙拔除术前评估 第三磨牙拔除术是口腔颌面外科最常见的手术,而下牙槽神经损伤是第三磨牙拔除术较严重的并发症,会导致患者牙齿、黏膜、皮肤的疼痛、麻木及感觉异常,因此术前了解下牙槽神经管的位置和走向至关重要。虽然影像学被认为是下牙槽神经管可视化的重要辅助诊断工具,但也存在着一定的局限性:全景X射线片的分辨率较低,周围骨小梁密度较高可能会导致下牙槽神经管的可见性变差;锥形束CT通过三维重建更直观地展现了下牙槽神经管的相对位置,但也显著增加了医生的阅片时间。而基于影像学数据的深度学习模型的应用可以提高临床医生判断下牙槽神经管位置的准确性及效率,辅助临床医生选择合适的术式。以全景X射线片为数据源,VINAYAHALINGAM等[54]使用U-Net算法构建的深度学习模型对下颌第三磨牙及下牙槽神经管进行分割,利用平均Dice相似系数评估分割一致性,结果显示该模型对下颌第三磨牙的分割性能较好(平均Dice相似系数=0.947),但无法准确还原下牙槽神经管的位置(平均Dice相似系数=0.768),需进一步优化模型。而YOLO-v3模型用于自动评估全景X射线片上下颌第三磨牙与下牙槽神经管的关联,体现出了更高的准确率和精确度,平均可达0.892[55]。CARVALHO等[56]在识别下颌第三磨牙、下牙槽神经管及两者接触性的基础上提出了一个诊断表,用于提示是否需要锥形束CT进行额外成像。此外,基于锥形束CT数据集,一种支持主动学习的阶梯式3D nnU-Net方法被应用于下牙槽神经管分割[57],随着每一阶段的完成,平均Dice相似系数增加,分割时间逐渐减少,虽然该方法目前的准确性低于人工分割,但显示了主动学习框架在自动分割下牙槽神经管上的潜力。而ResNet50v2深度学习模型辅以优化器,在评估下颌第三磨牙与下牙槽神经管之间的接触性上表现出了优异的性能[58],准确度和曲线下面积大小分别达到了0.860和0.890。近年来,深度学习技术的黑盒性质被更广泛地讨论,人们普遍倾向于使用可解释的人工智能,以增加其在临床实践中的应用潜力。基于此,有学者引入新型分割模型SS-TransUnet和分类算法CD-IAN,量化了下颌第三磨牙和下牙槽神经管的接近程度,为诊断提供一定程度的可解释基础[59]。综上,深度学习技术可以在口腔影像上自动识别下牙槽神经管,但需要进一步优化算法提高其识别的准确性与一致性,这也是未来研究的重点。 2.4.2 深度学习技术辅助颈淋巴结清扫术前评估 对于口腔癌的患者而言,评估颈部淋巴结转移对于选择治疗方法和判断预后具有重要意义,这决定了颈淋巴结清扫的范围、术后新辅助放化疗的选择等。深度学习技术的发展将有助于医生在术前更准确地判断颈部淋巴结转移情况,以制定个性化治疗方案。ARIJI 等[60]和HUANG等[61]以淋巴结大小为特征对淋巴结进行分类,采用基于U-net的深度学习模型在对比增强计算机断层扫描图像中诊断转移性或非转移性淋巴结,以病理报告为金标准进行验证,模型识别短轴≥3 mm淋巴结的特异性较高,足以超过经验丰富的放射科医生。此外,有学者采用深度学习辅助对比剂[62-63]、深度学习结合影像组学的融合模型预测口腔癌患者颈部淋巴结转移[64],显示出远高于临床医生的敏感性。由此可见,深度学习模型的应用可以减少不必要的活检,降低良性淋巴结切除的概率。 2.4.3 深度学习技术辅助正畸术前评估 从经典到现代的口腔正畸学,分析牙齿、颌骨和颅骨空间关系是制定治疗方案的基础,这在很大程度上依赖于头影测量,临床实践中头影测量通常由训练有素的正畸医生进行,但存在人工标记耗时费力且异质性较大的问题。近年来越来越多的研究者利用深度学习模型建立自动化框架,在2D和3D头颅影像上检测头影测量标志,并采用不同方式优化其性能,比如在头颅标志点的估计位置周围实现置信区域(95%CI),可以使临床医生直观地衡量系统计算的标志点的准确性[65];采用两阶段的、从粗到细的深度学习方法,可以在更短的时间内实现更高精度的标注[66-67];开发多任务卷积网络深度学习模型[68],利用多个任务之间的协同作用提高每个任务的单独性能,可以显著降低数字化误差,提高模型的临床实用性。 2.4.4 深度学习技术辅助种植术前评估 锥形束CT是种植术前必不可少的影像资料,深度学习技术可用于评估锥形束CT中牙槽骨特征(骨质量、厚度和高度)和手术区域(如鼻窦、下颌管和颏孔)的解剖变化[69]。种植区域的骨密度与种植体初级稳定性和后期成功率密切相关,许多研究人员通过深度学习方法对锥形束CT图像上无牙颌区域的骨密度进行识别和分类。XIAO等[70]开发了基于Nested-Unet框架的自动颌骨密度分类模型,并提出了新的颌骨分类等级标准,以帮助临床医生调整种植手术方案。SAKAI等[71]则根据骨密度对1 200张锥形束CT图像进行分类,建立基于LeNet-5架构的模型以预测种植手术方案,准确率达93.8%。除了骨密度,骨高度也是判断种植体适应证和选择种植体类型的重要依据。KURT BAYRAKDAR等[72]利用基于3D U-Net架构的语义分割网络成功测量了前磨牙区和磨牙区的骨高度和骨厚度,并且测量结果在统计学上与临床医生测量的结果相似。 充足的软组织支撑对于实现种植体的良好预后也至关重要,然而关于软组织评估的研究相对较少。YANG等[73]首次提出基于深度学习测量牙龈沟深度的方法,将口腔扫描仪的STL文件和锥形束CT的DICOM文件叠加,采用U-Net算法得到颊侧和舌侧的探诊深度,结果与临床测量结果无统计学差异。这种方法不仅可以提高测量效率,还可以减少患者在检查过程中的不适感。目前软组织的研究仍处于起步阶段,尚无研究可以直接确定种植手术所需的牙龈状况。综上,深度学习技术可以通过识别种植区域软硬组织形态与密度评估个体行种植手术的相关风险,并辅助临床医生选择种植手术的方案,然而目前的评估仅限于对单个因素的判断,无法全面评估缺牙部位的整体情况。 2.4.5 深度学习技术辅助根管治疗 C形根管有着复杂的解剖结构,难以清洁、预备、充填完善,临床上通常需要借助锥形束CT评估根管形态以利于根管治疗。然而,即使是对于经验丰富的牙体科医生而言,在锥形束CT上识别分类C形根管也会耗费大量时间,并有一定的漏诊率。基于此,深度学习技术凭借其优越的图像分割识别能力以及高效的学习能力被研究者们运用于影像学C形根管的分类。SHERWOOD等[74]开发了一种深度学习模型在锥形束CT图像上对下颌第二磨牙C型根管解剖进行检测和分类,并比较了3种不同深度学习架构(U-Net,残余U-Net和Xception U-Net)的平均Dice相似系数和灵敏度性能,其中Xception U-Net在C形解剖结构自动标记的体素匹配准确性上表现更为优异(平均Dice相似系数=0.768±0.034 9;灵敏度值=0.720±0.049 5)。随着深度学习算法的不断优化,其临床应用价值也会不断提高。 2.4.6 深度学习技术辅助牙体缺损修复 评价修复治疗成功与否的关键因素是确保所设计的牙冠修复体具有正确的咬合接触关系和足够的天然牙齿解剖形态特征。传统牙冠修复体的制作需要利用印模材料转移口内邻牙与对牙合牙列的形态以及咬合关系,咬合表面的还原往往依靠技工的个人经验,精确度较低。近年来数字化口腔医学快速发展,三维口腔扫描仪的应用越来越广泛,给深度学习技术在重建牙冠表面方面的发展奠定了基础。目前研究咬合面重建的模型主要有Pix2pix、Pix2pixHD、感知对抗网络等。YUAN等[75]开发的基于Pix2pix的模型,通过结合感知对抗性损失来生成咬合面。但是上述方法没有考虑牙齿生物形态(咬合面窝沟点隙)对咬合面重建的影响,因此这些方法生成的咬合面不具有天然牙齿的解剖形态。鉴于此,TIAN等[76]设计了一种使用两阶段深度卷积生成对抗网络,从数据驱动的视角重建牙冠表面,该模型计算出的形成的咬合表面与目标牙冠之间的标准差和均方根均小于0.161 mm,在具有足够解剖学形态的实际口腔数据库中显示出卓越的性能,具有更高的临床适用性。但该研究主要针对下颌第一磨牙,后续研究可推广至其他牙齿类别。 2.5 深度学习技术在口腔影像分析中的优势与局限性 2017年全球疾病负担研究显示,全世界近 35 亿人患有口腔疾病[77],而与此同时,大多数国家存在口腔医疗资源分布不均的现象,随着医疗服务体系和模式改革,个体化的精准医疗和普适性的初级口腔卫生服务都将成为口腔疾病防治的重点。 口腔影像是口腔疾病诊治的重要辅助工具,利用深度学习技术进行口腔影像分析突破了传统医疗方式的局限性:①深度学习技术分析口腔影像可减少人眼视觉误差导致的误诊或漏诊,同时克服了人工诊断的异质性;②完成训练与优化的深度学习模型可实现对口腔影像的实时诊断分析,提高了临床决策效率;③基于大数据的深度学习模型可同时储存、处理包括口腔影像在内的多维度数据,挖掘疾病相关因素,提高口腔疾病的早期预防、早期诊断和早期治疗的敏感性和特异性;④深度学习技术赋能远程医疗可助力基层得到标准化和高质量的诊疗服务,弥补医生可能存在的跨专业知识空缺或经验不足的问题。 尽管深度学习技术在口腔影像分析领域有着广阔的应用前景和社会经济价值,但也带来了一系列挑战。在模型技术方面:①人工标注精度的不足以及不同标注人员的异质性导致数据质量不佳,从而影响深度学习模型的精确度;②缺乏对深度学习算法运行的充分理解,导致深度学习模型的可解释性和泛化性较弱,出现错误无法精准修正;③由于放射成像设备异质性带来的图像差异,基于单中心的数据源训练的模型可推广性不强,已有学者报道深度学习模型在其他机构的图像上测试时性能变差[78-79]。在安全伦理方面:①医疗影像数据涉及患者隐私,深度学习技术的应用不当有隐私数据泄露的风险;②对抗攻击的干扰,即通过向正常数据添加精细设计的微小改变,就可能导致模型错误决策[80],引发严重的医疗事故;③在模型研发设计阶段,由于训练数据偏倚等原因而将种族、性别、阶层偏见等伦理问题带入模型中,导致其在医疗应用中出现歧视性问题。在法律监管方面:①深度学习技术引入医疗领域提高了医疗责任主体认定的复杂度,不利于患者权益的保障;②目前尚无完善的深度学习技术医疗应用相关法律法规,组织监管力度不足。 2.6 深度学习技术在口腔影像分析中的未来展望 深度学习应用于口腔影像分析领域是一种新兴技术,它克服了主观个体检查的可变性,提高了临床诊断的效率,还能降低诊断和治疗的成本,有助于解决医疗资源分配不均的问题。尽管现有的研究显示深度学习技术具有非劣于人工的口腔影像诊断分析能力,但深度学习技术仍处于临床试验阶段,未来研究应侧重于证明深度学习的可推广性、稳健性和临床实用性,寻找将深度学习自动化决策支持系统应用于常规临床工作流程中的最佳方式。 在实践过程中,首先需要对来自医疗机构、社区、家庭可穿戴设备的数据进行筛选处理,并对数据使用保持透明,允许数据的可追溯性和可访问性,建立去隐私化、标准化、高质量的数据库,同时结合多中心的数据库,减轻数据偏倚导致的伦理偏见问题;其次,深度学习在口腔医学领域的发展有赖于计算机科学本身的进步,通过改进算法使模型具有更好的普适性、精确性以及可解释性至关重要,事实上,近年来可解释人工智能已取得了巨大进展,有望增加医学人工智能的可信度;最后,医学人工智能研究需要制定严格的开展标准,如样本量估计、性能测试指标、风险管理等,同时需要提供一种与循证医学和口腔医学中已接受和建立的评估监管机制相媲美的机制,用于医学人工智能领域,并且设立人工智能医学伦理审查小组严格责权相关问题。 "

| [1] WAINBERG M, MERICO D, DELONG A, et al. Deep learning in biomedicine. Nat Biotechnol. 2018;36(9):829-838. [2] ZHANG K, LIU X, LIU F, et al. An interpretable and expandable deep learning diagnostic system for multiple ocular diseases: qualitative study. J Med Internet Res. 2018;20(11):e11144. [3] BING D, YING J, MIAO J, et al. Predicting the hearing outcome in sudden sensorineural hearing loss via machine learning models. Clin Otolaryngol. 2018;43(3):868-874. [4] JIANG Y, ZHANG Z, WANG W, et al. Biology-guided deep learning predicts prognosis and cancer immunotherapy response. Nat Commun. 2023;14(1):5135. [5] MATHEWS SM, KAMBHAMETTU C, BARNER KE. A novel application of deep learning for single-lead ECG classification. Comput Biol Med. 2018;99:53-62. [6] SULTAN AS, ELGHARIB MA, TAVARES T, et al. The use of artificial intelligence, machine learning and deep learning in oncologic histopathology. J Oral Pathol Med. 2020;49(9):849-856. [7] RAWAT W, WANG Z. Deep convolutional neural networks for image classification: a comprehensive review. Neural Comput. 2017;29(9): 2352-2449. [8] PU W. Shuffle GAN With Autoencoder: A Deep Learning Approach to Separate Moving and Stationary Targets in SAR Imagery. IEEE Trans Neural Netw Learn Syst. 2022;33(9):4770-4784. [9] ZHU H, CAO Z, LIAN L, et al. CariesNet: a deep learning approach for segmentation of multi-stage caries lesion from oral panoramic X-ray image. Neural Comput Appl. 2022:1-9. doi: 10.1007/s00521-021-06684-2. [10] OZTEKIN F, KATAR O, SADAK F, et al. An Explainable Deep Learning Model to Prediction Dental Caries Using Panoramic Radiograph Images. Diagnostics (Basel). 2023;13(2):226. [11] DAYı B, ÜZEN H, ÇIÇEK İB, et al. A Novel Deep Learning-Based Approach for Segmentation of Different Type Caries Lesions on Panoramic Radiographs. Diagnostics (Basel). 2023;13(2):202. [12] ESMAEILYFARD R, BONYADIFARD H, PAKNAHAD M. Dental Caries Detection and Classification in CBCT Images Using Deep Learning. Int Dent J. 2024;74(2):328-334. [13] ESTAI M, TENNANT M, GEBAUER D, et al. Evaluation of a deep learning system for automatic detection of proximal surface dental caries on bitewing radiographs. Oral Surg Oral Med Oral Pathol Oral Radiol. 2022;134(2):262-270. [14] CHEN X, GUO J, YE J, et al. Detection of Proximal Caries Lesions on Bitewing Radiographs Using Deep Learning Method. Caries Res. 2022; 56(5-6):455-463.
[15] ZHANG X, LIANG Y, LI W, et al. Development and evaluation of deep learning for screening dental caries from oral photographs. Oral Dis. 2022;28(1):173-181. [16] KÜHNISCH J, MEYER O, HESENIUS M, et al. Caries Detection on Intraoral Images Using Artificial Intelligence. J Dent Res. 2022;101(2):158-165. [17] HOLTKAMP A, ELHENNAWY K, CEJUDO GRANO DE ORO JE, et al. Generalizability of Deep Learning Models for Caries Detection in Near-Infrared Light Transillumination Images. J Clin Med. 2021;10(5):961. [18] SCHWENDICKE F, ELHENNAWY K, PARIS S, et al. Deep learning for caries lesion detection in near-infrared light transillumination images: A pilot study. J Dent. 2020;92:103260. [19] NGNAMSIE NJIMBOUOM S, LEE K, KIM JD. MMDCP: Multi-Modal Dental Caries Prediction for Decision Support System Using Deep Learning. Int J Environ Res Public Health. 2022;19(17):10928. [20] TIBÚRCIO-MACHADO CS, MICHELON C, ZANATTA FB, et al. The global prevalence of apical periodontitis: a systematic review and meta-analysis. Int Endod J. 2021;54(5):712-735. [21] CHEN H, LI H, ZHAO Y, et al. Dental disease detection on periapical radiographs based on deep convolutional neural networks. Int J Comput Assist Radiol Surg. 2021;16(4):649-661. [22] LI S, LIU J, ZHOU Z, et al. Artificial intelligence for caries and periapical periodontitis detection. J Dent. 2022;122:104107. [23] EZHOV M, GUSAREV M, GOLITSYNA M, et al. Clinically applicable artificial intelligence system for dental diagnosis with CBCT. Sci Rep. 2021;11(1):15006. [24] HADZIC A, URSCHLER M, PRESS JA, et al. Evaluating a Periapical Lesion Detection CNN on a Clinically Representative CBCT Dataset-A Validation Study. J Clin Med. 2023;13(1):197. [25] LIAO WC, CHEN CH, PAN YH, et al. Vertical root fracture in non-endodontically and endodontically treated teeth: current understanding and future challenge. J Pers Med. 2021;11(12):1375. [26] FUKUDA M, INAMOTO K, SHIBATA N, et al. Evaluation of an artificial intelligence system for detecting vertical root fracture on panoramic radiography. Oral Radiol. 2020;36(4):337-343. [27] HU Z, CAO D, HU Y, et al. Diagnosis of in vivo vertical root fracture using deep learning on cone-beam CT images. BMC Oral Health. 2022;22(1):382. [28] YANG P, GUO X, MU C, et al. Detection of vertical root fractures by cone-beam computed tomography based on deep learning. Dentomaxillofac Radiol. 2023;52(3):20220345. [29] ALOTAIBI G, AWAWDEH M, FAROOK FF, et al. Artificial intelligence (AI) diagnostic tools: utilizing a convolutional neural network (CNN) to assess periodontal bone level radiographically-a retrospective study. BMC Oral Health. 2022;22(1):399. [30] LEE CT, KABIR T, NELSON J, et al. Use of the deep learning approach to measure alveolar bone level. J Clin Periodontol. 2022;49(3):260-269. [31] CHEN CC, WU YF, AUNG LM, et al. Automatic recognition of teeth and periodontal bone loss measurement in digital radiographs using deep-learning artificial intelligence. J Dent Sci. 2023;18(3):1301-1309. [32] CHANG HJ, LEE SJ, YONG TH, et al. Deep Learning Hybrid Method to Automatically Diagnose Periodontal Bone Loss and Stage Periodontitis. Sci Rep. 2020;10(1):7531. [33] JIANG L, CHEN D, CAO Z, et al. A two-stage deep learning architecture for radiographic staging of periodontal bone loss. BMC Oral Health. 2022;22(1):106. [34] LI W, LIANG Y, ZHANG X, et al. A deep learning approach to automatic gingivitis screening based on classification and localization in RGB photos. Sci Rep. 2021;11(1):16831. [35] ANDRADE KM, SILVA BPM, DE OLIVEIRA LR, et al. Automatic dental biofilm detection based on deep learning. J Clin Periodontol. 2023; 50(5):571-581. [36] ALALHARITH DM, ALHARTHI HM, ALGHAMDI WM, et al. A Deep Learning-Based Approach for the Detection of Early Signs of Gingivitis in Orthodontic Patients Using Faster Region-Based Convolutional Neural Networks. Int J Environ Res Public Health. 2020;17(22):8447. [37] VER BERNE J, SAADI SB, POLITIS C, et al. A deep learning approach for radiological detection and classification of radicular cysts and periapical granulomas. J Dent. 2023;135:104581. [38] YANG H, JO E, KIM HJ, et al. Deep Learning for Automated Detection of Cyst and Tumors of the Jaw in Panoramic Radiographs. J Clin Med. 2020;9(6):1839. [39] WATANABE H, ARIJI Y, FUKUDA M, et al. Deep learning object detection of maxillary cyst-like lesions on panoramic radiographs: preliminary study. Oral Radiol. 2021;37(3):487-493. [40] LI M, PUNITHAKUMAR K, MAJOR PW, et al. Temporomandibular joint segmentation in MRI images using deep learning. J Dent. 2022; 127:104345. [41] NOZAWA M, ITO H, ARIJI Y, et al. Automatic segmentation of the temporomandibular joint disc on magnetic resonance images using a deep learning technique. Dentomaxillofac Radiol. 2022;51(1): 20210185. [42] VINAYAHALINGAM S, BERENDS B, BAAN F, et al. Deep learning for automated segmentation of the temporomandibular joint. J Dent. 2023;132:104475. [43] JUNG W, LEE KE, SUH BJ, et al. Deep learning for osteoarthritis classification in temporomandibular joint. Oral Dis. 2023;29(3): 1050-1059. [44] LEE YH, WON JH, KIM S, et al. Advantages of deep learning with convolutional neural network in detecting disc displacement of the temporomandibular joint in magnetic resonance imaging. Sci Rep. 2022;12(1):11352. [45] RAHMAN TY, MAHANTA LB, DAS AK, et al. Automated oral squamous cell carcinoma identification using shape, texture and color features of whole image strips. Tissue Cell. 2020;63:101322. [46] YOON K, KIM JY, KIM SJ, et al. Explainable deep learning-based clinical decision support engine for MRI-based automated diagnosis of temporomandibular joint anterior disk displacement. Comput Methods Programs Biomed. 2023;233:107465. [47] KAO ZK, CHIU NT, WU HH, et al. Classifying Temporomandibular Disorder with Artificial Intelligent Architecture Using Magnetic Resonance Imaging. Ann Biomed Eng. 2023;51(3):517-526. [48] KIM JY, KIM D, JEON KJ, et al. Using deep learning to predict temporomandibular joint disc perforation based on magnetic resonance imaging. Sci Rep. 2021;11(1):6680. [49] LIN B, CHENG M, WANG S, et al. Automatic detection of anteriorly displaced temporomandibular joint discs on magnetic resonance images using a deep learning algorithm. Dentomaxillofac Radiol. 2022;51(3):20210341. [50] YANG SY, LI SH, LIU JL, et al. Histopathology-Based Diagnosis of Oral Squamous Cell Carcinoma Using Deep Learning. J Dent Res. 2022; 101(11):1321-1327.
51] DAS N, HUSSAIN E, MAHANTA LB. Automated classification of cells into multiple classes in epithelial tissue of oral squamous cell carcinoma using transfer learning and convolutional neural network. Neural Netw. 2020;128:47-60.
[52] AUBREVILLE M, KNIPFER C, OETTER N, et al. Automatic Classification of Cancerous Tissue in Laserendomicroscopy Images of the Oral Cavity using Deep Learning. Sci Rep. 2017;7(1):11979. [53] YANG Z, PAN H, SHANG J, et al. Deep-Learning-Based Automated Identification and Visualization of Oral Cancer in Optical Coherence Tomography Images. Biomedicines. 2023;11(3):802. [54] VINAYAHALINGAM S, XI T, BERGÉ S, et al. Automated detection of third molars and mandibular nerve by deep learning. Sci Rep. 2019;9(1):9007. [55] TAKEBE K, IMAI T, KUBOTA S, et al. Deep learning model for the automated evaluation of contact between the lower third molar and inferior alveolar nerve on panoramic radiography. J Dent Sci. 2023; 18(3):991-996. [56] CARVALHO JS, LOTZ M, RUBI L, et al. Preinterventional Third-Molar Assessment Using Robust Machine Learning. J Dent Res. 2023;102(13): 1452-1459. [57] LIM HK, JUNG SK, KIM SH, et al. Deep semi-supervised learning for automatic segmentation of inferior alveolar nerve using a convolutional neural network. BMC Oral Health. 2021;21(1):630. [58] SUKEGAWA S, TANAKA F, HARA T, et al. Deep learning model for analyzing the relationship between mandibular third molar and inferior alveolar nerve in panoramic radiography. Sci Rep. 2022;12(1):16925. [59] GONG Z, FENG W, SU X, et al. System for automatically assessing the likelihood of inferior alveolar nerve injury. Comput Biol Med. 2024;169:107923. [60] ARIJI Y, KISE Y, FUKUDA M, et al. Segmentation of metastatic cervical lymph nodes from CT images of oral cancers using deep-learning technology. Dentomaxillofac Radiol. 2022;51(4):20210515. [61] HUANG SY, HSU WL, LIU DW, et al. Identifying Lymph Nodes and Their Statuses from Pretreatment Computer Tomography Images of Patients with Head and Neck Cancer Using a Clinical-Data-Driven Deep Learning Algorithm. Cancers (Basel). 2023;15(24):5890. [62] XU X, XI L, WEI L, et al. Deep learning assisted contrast-enhanced CT-based diagnosis of cervical lymph node metastasis of oral cancer: a retrospective study of 1466 cases. Eur Radiol. 2023;33(6):4303-4312. [63] STRUCKMEIER AK, YEKTA E, AGAIMY A, et al. Diagnostic accuracy of contrast-enhanced computed tomography in assessing cervical lymph node status in patients with oral squamous cell carcinoma. J Cancer Res Clin Oncol. 2023;149(19):17437-17450. [64] CHEN Z, YU Y, LIU S, et al. A deep learning and radiomics fusion model based on contrast-enhanced computer tomography improves preoperative identification of cervical lymph node metastasis of oral squamous cell carcinoma. Clin Oral Investig. 2023;28(1):39. [65] LEE JH, YU HJ, KIM MJ, et al. Automated cephalometric landmark detection with confidence regions using Bayesian convolutional neural networks. BMC Oral Health. 2020;20(1):270. [66] DOT G, SCHOUMAN T, CHANG S, et al. Automatic 3-Dimensional Cephalometric Landmarking via Deep Learning. J Dent Res. 2022; 101(11):1380-1387. [67] CHEN X, LIAN C, DENG HH, et al. Fast and Accurate Craniomaxillofacial Landmark Detection via 3D Faster R-CNN. IEEE Trans Med Imaging. 2021;40(12):3867-3878. [68] ZHANG J, LIU M, WANG L, et al. Context-guided fully convolutional networks for joint craniomaxillofacial bone segmentation and landmark digitization. Med Image Anal. 2020;60:101621. [69] AYIDH ALQAHTANI K, JACOBS R, SMOLDERS A, et al. Deep convolutional neural network-based automated segmentation and classification of teeth with orthodontic brackets on cone-beam computed-tomographic images: a validation study. Eur J Orthod. 2023;45(2):169-174. [70] XIAO Y, LIANG Q, ZHOU L, et al. Construction of a new automatic grading system for jaw bone mineral density level based on deep learning using cone beam computed tomography. Sci Rep. 2022; 12(1):12841. [71] SAKAI T, LI H, SHIMADA T, et al. Development of artificial intelligence model for supporting implant drilling protocol decision making. J Prosthodont Res. 2022;67:360-365. [72] KURT BAYRAKDAR S, ORHAN K, BAYRAKDAR IS, et al. A deep learning approach for dental implant planning in cone-beam computed tomography images. BMC Med Imaging. 2021;21(1): 86. [73] YANG M, LI C, YANG W, et al. Accurate gingival segmentation from 3D images with artificial intelligence: an animal pilot study. Prog Orthod. 2023;24(1): 14. [74] SHERWOOD AA, Sherwood AI, Setzer FC, et al. A Deep Learning Approach to Segment and Classify C-Shaped Canal Morphologies in Mandibular Second Molars Using Cone-beam Computed Tomography. J Endod. 2021;47(12):1907-1916. [75] YUAN F, DAI N, TIAN S, et al. Personalized design technique for the dental occlusal surface based on conditional generative adversarial networks. Int J Numer Method Biomed Eng. 2020;36(5):e3321. [76] TIAN S, WANG M, DAI N, et al. DCPR-GAN: Dental Crown Prosthesis Restoration Using Two-Stage Generative Adversarial Networks. IEEE J Biomed Health Inform. 2022;26(1):151-160. [77] BERNABE E, MARCENES W, HERNANDEZ CR, et al. Global, regional, and national levels and trends in burden of oral conditions from 1990 to 2017: a systematic analysis for the global burden of disease 2017 study. J Dent Res. 2020;99(4): 362-373. [78] NISHIYAMA M, ISHIBASHI K, ARIJI Y, et al. Performance of deep learning models constructed using panoramic radiographs from two hospitals to diagnose fractures of the mandibular condyle. Dentomaxillofac Radiol. 2021;50(7): 20200611. [79] KROIS J, GARCIA CANTU A, CHAURASIA A, et al. Generalizability of deep learning models for dental image analysis. Sci Rep. 2021;11(1): 6102. [80] FINLAYSON SG, BOWERS JD, ITO J, et al. Adversarial attacks on medical machine learning. Science. 2019;363(6433): 1287-1289. |
| [1] | Wu Ziwei, Luo Yicai, Wei Yinge, Liao Hongbing. Application of poly(lactic-co-glycolic acid) copolymer in stomatology [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7393-7404. |
| [2] | Song Yufei, Cheng Huanzhi, Fan Haixia, Hou Meng. Role and advantages of 3D printing technology in stomatology and maxillofacial surgery restoration and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4823-4831. |
| [3] | Bian Yuqing, Ma Yidan, Dai Dongyue, Su Ping, Jia Mengqi, Zhan Desong, Fu Jiale. Biological characteristics of tannic acid and its application value in medicine and stomatology [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(2): 284-290. |
| [4] | Zhu Li-sha, Chen Yu-ming, Li He-fei, Kang Hong. Photosensitive resin used for 3D printing and its application in dentistry [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(6): 979-984. |
| [5] |
Lin Yu-heng, Wang Xu-dong, Shen Guo-fang.
3D bioprinting of tissues and organs and its application in oral medicine
[J]. Chinese Journal of Tissue Engineering Research, 2017, 21(22): 3589-3594.
|
| [6] | Cui Yan, Wei Li-li, Li Lin, Wang Xiang-hua, Wang Jing-yuan. Individualized intervention and collective intervention effects on quality of life in maintenance hemodialysis patients [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(44): 7815-7820. |
| [7] | Shi Xu-xu, Zhou Wen, Yang Wen-xiang. Influence on the bacteria and fungi taken from the impressions after the use of two kinds of mouthwashes [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(38): 6853-6860. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||