Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (14): 3020-3026.doi: 10.12307/2025.616
Previous Articles Next Articles
Relationship between ferroptosis and peripheral nerve injury
Lyu Lijie1, Yuan Yiming1, Wang Yan1, 2, Pei Fei1, 2
- 1Graduate School, Heilongjiang University of Chinses Medicine, Harbin 150006, Heilongjiang Province, China; 2Department of Rehabilitation Medicine, the Second Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin 150001, Heilongjiang Province, China
-
Received:2024-05-20Accepted:2024-07-15Online:2025-05-18Published:2024-09-29 -
Contact:Wang Yan, Professor, Graduate School, Heilongjiang University of Chinses Medicine, Harbin 150006, Heilongjiang Province, China; Department of Rehabilitation Medicine, the Second Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin 150001, Heilongjiang Province, China -
About author:Lyu Lijie, Master candidate, Graduate School, Heilongjiang University of Chinses Medicine, Harbin 150006, Heilongjiang Province, China -
Supported by:the National Natural Science Foundation of China, No. 82274623 (to WY); Heilongjiang University of Chinese Medicine Graduate Student Innovative Scientific Research Project, No. 2023yjscx005 (to WY)
CLC Number:
Cite this article
Lyu Lijie, Yuan Yiming, Wang Yan, , Pei Fei, . Relationship between ferroptosis and peripheral nerve injury[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(14): 3020-3026.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
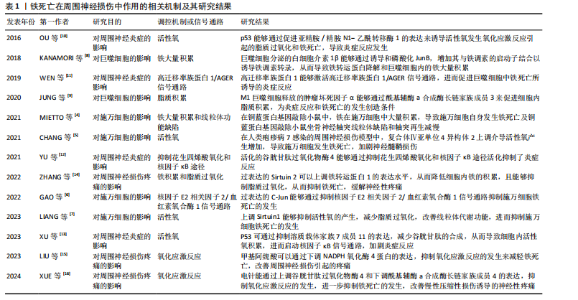
2.1 铁死亡在周围神经损伤中作用的相关机制及研究结果[4-16] 见表1。 2.2 铁死亡的概述 铁死亡是一种新定义的程序性细胞死亡形式[17]。在形态学上,铁死亡会导致线粒体变小、线粒体膜密度增加和线粒体嵴减少或消失[18],这可能是由于脂质过氧化产物导致电压依赖性阴离子通道功能障碍和线粒体膜流动性改变所致[19]。随着对铁死亡的进一步研究发现,线粒体通过铁代谢、能量代谢、脂质代谢等调控过程在铁死亡中起着重要作用[20],因此,铁、半胱氨酸和脂质代谢之间的复杂相互作用已成为铁死亡的重要调节因子。有研究表明,铁死亡的异常调控可能与神经退行性疾病、脑卒中、神经胶质瘤等多种神经系统疾病的发病机制密切相关[21]。因此,探究铁死亡在神经系统疾病过程中的作用可为进一步的临床治疗提供新的干预方法。 2.3 铁死亡相关的抗氧化防御系统 2.3.1 铁代谢异常 铁作为一种氧化活性金属参与自由基的形成和脂质过氧化的产生,因此,铁水平升高可以"

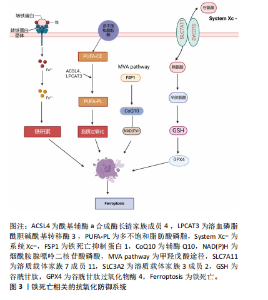
增加对铁死亡的敏感性[22]。铁代谢主要由肝脏调节,肝脏通过产生和分泌铁稳态调节因子来维持全身铁平衡。一些蛋白质,如转铁蛋白、铁蛋白、铁调素和铁转运蛋白在维持全身铁稳态中发挥重要作用[23]。研究表明,铁调节蛋白和缺氧诱导因子1可通过增强转铁蛋白受体的表达来增加细胞对铁的摄取,从而促进细胞铁死亡的发生[24-25]。因此,铁代谢调节蛋白能够诱导铁死亡的发生,并且铁代谢异常对于铁死亡的发生发展具有重要意义。 2.3.2 脂质过氧化 多不饱和脂肪酸对脂质过氧化很敏感,是使细胞对铁死亡敏感的关键因素[26]。铁死亡的激活需要酰基辅酶a合成酶长链家族成员4和溶血磷脂酰胆碱酰基转移酶3的参与。在铁死亡过程中,酰基辅酶a合成酶长链家族成员4将辅酶A连接到长链多不饱和脂肪酸上,然后溶血磷脂酰胆碱酰基转移酶3可以利用长链多不饱和脂肪酸来酯化溶血磷脂,一旦这些被植入细胞膜,它们就会发生过氧化并引发铁死亡[27]。研究指出,在慢性压迫性损伤诱导的铁死亡过程中,谷胱甘肽过氧化物酶4表达受到抑制,细胞膜出现一系列脂质过氧化反应,而酰基辅酶a合成酶长链家族成员4 表达上调[16],表明脂质氧化过程可能依赖于酰基辅酶a合成酶长链家族成员4的激活。另外,酶促脂质过氧化是由脂氧合酶的活性介导的,脂氧合酶通过介导细胞膜上的脂质过氧化增加了铁死亡的敏感性[28];此外,脂质过氧化对细胞膜的破坏可引起形态学改变,如线粒体收缩和损伤。研究表明,在铁死亡过程中,脂质过氧化物分解为活性衍生物,包括4-羟基壬烯醛和丙二醛,它们与核酸和蛋白质发生反应从而破坏膜的完整性,导致细胞破裂[29],表明脂质过氧化的过度积累是铁死亡发生的决定性因素。 2.3.3 抗氧化防御系统 周围神经损伤伴有氧化应激,在周围神经损伤后神经功能恢复中起负向作用[30]。研究表明,抑制周围神经损伤后的氧化应激可以加速神经损伤后的修复过程,改善神经损伤后的功能恢复[31]。另外,靶向系统 Xc-/谷胱甘肽/谷胱甘肽过氧化物酶4、铁死亡抑制蛋白1-辅酶Q10信号通路来调节抗氧化系统,对预防细胞铁死亡发挥了重要作用。铁死亡相关的抗氧化防御系统见图3。"
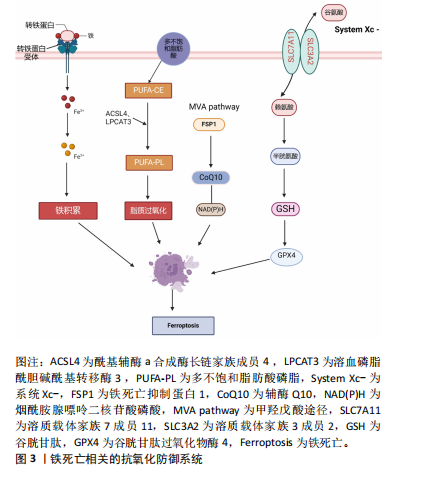

(1)系统 Xc-/谷胱甘肽-谷胱甘肽过氧化物酶4信号通路:该信号通路作为抵抗氧化应激反应的主要防御系统(如脂质过氧化),在铁死亡介导周围神经损伤的过程中起主要作用[32]。系统Xc-是一种由溶质载体家族7成员11 和溶质载体家族3成员2 组成的反转运体,它可以同时将谷氨酸转移出细胞并将胱氨酸转移到细胞[33],胱氨酸还原成半胱氨酸参与谷胱甘肽的合成[34]。谷胱甘肽作为一种重要的抗氧化剂,其表达水平的降低不仅促进了高毒性的羟基自由基生成,还影响到谷胱甘肽过氧化物酶4的活性,导致脂质过氧化物大量累积,诱导细胞发生铁死亡[35]。谷胱甘肽过氧化物酶4作为谷胱甘肽过氧化物酶的一员,主要通过限制脂质过氧化物积累来保护细胞免受损伤[36]。研究表明,激活转录因子3通过与溶质载体家族7成员11 启动子结合抑制溶质载体家族7成员11转录,减少谷胱甘肽的合成,从而促进Erastin(小分子药物)诱导铁死亡的发生[33]。FAN等[37]研究指出,核因子E2相关因子2作为调控脂质过氧化最重要的转录因子之一,通过与溶质载体家族7成员11 启动子的抗氧化反应元件结合促进了谷胱甘肽的合成。有研究表明,铁死亡抑制剂去铁胺可以通过上调系统Xc-/谷胱甘肽过氧化物酶4信号通路抑制脂质活性氧的产生,抑制铁死亡,从而促进脊髓损伤后的修复[38]。有研究指出,缺氧干预显著促进坐骨神经断裂大鼠的神经再生。最近研究表明,在坐骨神经损伤模型中,上调缺氧诱导因子1α可以通过提高溶质载体家族7成员11和谷胱甘肽过氧化物酶4的表达增加半胱氨酸和谷胱甘肽的含量,抑制活性氧的积累,促进神经损伤后的功能恢复[39]。XUE等[16]研究指出,在慢性压缩性损伤诱导的神经性疼痛模型中,电针能够明显上调谷胱甘肽过氧化物酶4的表达和下调酰基辅酶a合成酶长链家族成员4的表达来逆转氧化应激介导的脊髓神经元铁死亡发生。 (2)铁死亡抑制蛋白1-辅酶Q10信号通路:除了上述的抗氧化通路外,铁死亡抑制蛋白1-辅酶Q10信号通路也在抑制脂质过氧化方面发挥了重要作用。研究表明,铁死亡抑制蛋白1的表达可以独立于谷胱甘肽过氧化物酶4捕获脂质自由基,抑制脂质过氧化[40]。辅酶Q10作为一种亲脂性自由基捕获抗氧化剂,可以阻止脂质过氧化物的增多[41]。GUO等[42]通过观察发现,人参皂苷Rg1能够通过激活铁死亡抑制蛋白1-辅酶Q10-烟酰胺腺嘌呤二核苷酸磷酸通路,进而抑制脂多糖诱导的HK-2细胞脂质过氧化,从而阻断肾小管上皮细胞铁死亡的发生。另有研究表明,铁死亡抑制蛋白1-辅酶Q10-烟酰胺腺嘌呤二核苷酸磷酸通路可独立于系统Xc-/谷胱甘肽/谷胱甘肽过氧化物酶4通路来抑制脂质过氧化[43]。综上所述,靶向调节抗氧化防御系统能够有效抑制铁死亡的发生,从而加速神经修复进程。 2.4 铁死亡对施万细胞和巨噬细胞的效应 2.4.1 铁死亡与施万细胞 施万细胞在周围神经损伤后分化为修复表型,通过清除多余的髓鞘碎片,募集巨噬细胞,分泌各种细胞生长因子,引导轴突的生长[44]。过量的铁对施万细胞来说是具有毒性的,因为铁过载引起芬顿反应的发生,进一步促进脂质过氧化及活性氧的产生,导致施万细胞发生铁死亡[45]。活性氧的产生反过来又可以引起DNA损伤,促进脂质过氧化,导致神经元或施万细胞高度变性[45]。GAO等[6]研究发现,周围神经损伤后施万细胞中谷胱甘肽过氧化物酶4蛋白表达水平下调,同时细胞发生铁死亡的经典通路核因子E2相关因子2/血红素氧合酶1被激活,表明施万细胞发生了铁死亡。C-Jun作为施万细胞对周围神经损伤反应的关键调节因子,在神经损伤后迅速上调[46]。研究显示,C-Jun过表达能够通过抑制核因子E2相关因子2/血红素氧合酶1信号通路抑制施万细胞铁死亡的发生,促进神经损伤后修复[6]。由此可知,神经损伤后施万细胞铁死亡的发生严重阻碍了轴突再生。由于施万细胞靠近轴突,那么周围神经系统中轴突线粒体中的铁可能来源于施万细胞。研究发现,从施万细胞释放的铁需要通过铁输出蛋白和铁氧化酶铜蓝蛋白分子机制排出,并且铁摄取所需的转铁蛋白受体和铁转运蛋白定位于轴突线粒体Ranvier和Schmidt-Lanterman切口节点附近区域的轴突中表达,因此施万细胞释放的铁可能被轴突线粒体吸收用于轴突生长和再生[4]。研究人员发现,在铜蓝蛋白基因敲除小鼠中,铁在施万细胞中大量积累且输出减少,导致其自身发生铁死亡[4];铜蓝蛋白基因敲除的小鼠中坐骨神经轴突线粒体缺陷和轴突再生减慢[4]。上述研究结果表明,铜蓝蛋白基因敲除小鼠施万细胞中的铁输出被破坏不仅导致其自身发生了铁死亡,还不利于轴突再生。 研究发现,在埃坡霉素B诱导的周围神经功能障碍过程中,埃坡霉素B通过下调Sirtuin1的表达增加了施万细胞中细胞色素C的表达,抑制了施万细胞线粒体中ATP的产生,诱发线粒体中大量活性氧的产生,使线粒体功能障碍,Sirtuin1激活剂SRT1720可显著改善埃坡霉素B导致的线粒体功能受损,从而抑制施万细胞发生铁死亡[7],表明可以通过上调Sirtuin1来减少脂质过氧化、改善线粒体代谢功能、抑制施万细胞铁死亡的发生。另外在人类疱疹病7感染的周围神经损伤模型中,复合体Ⅳ亚单位4异构体2上调介导活性氧产生增加,导致施万细胞发生铁死亡,加剧了神经髓鞘损伤[5]。上述研究结果表明,可以将清除活性氧为干预靶点来抑制施万细胞铁死亡的发生。 2.4.2 铁死亡与巨噬细胞 巨噬细胞是一种广泛存在的吞噬性免疫细胞,具有吞噬、分泌细胞因子和产生活性氧等多种功能。由于损伤后巨噬细胞对红细胞吞噬作用加强,红细胞被快速分解代谢,并且在血红素氧合酶1的作用下将铁从血红素中释放出来[47]。铁在巨噬细胞内大量积累诱导了巨噬细胞铁死亡的发生。研究表明,细胞内铁的大量积累将会引起炎症因子表达水平的提高、糖酵解增加、活性氧的产生增多和p53乙酰化,进而诱导巨噬细胞向M1表型极化[48],然后释放一系列的炎性因子,提供了不利于周围神经再生的促炎微环境。在铁死亡的发生过程中,高迁移率族蛋白1的释放激活了炎症反应,导致了大量巨噬细胞在损伤处聚集[11]。除高迁移率族蛋白1之外,CC趋化因子配体2和CC趋化因子配体7等各种炎症相关基因在铁死亡过程中被诱导,也促进了巨噬细胞的聚集和趋化[48]。研究表明,神经损伤后对铁死亡细胞的清除也是由巨噬细胞来完成的。LUO等[49]研究指出,巨噬细胞上的Toll样受体2能够识别铁死亡细胞表面的氧化磷脂、1-硬脂酰-2-15-HpETE-sn-甘油基-3-磷脂酰乙醇胺并对其吞噬,起到清除作用,说明铁死亡细胞与巨噬细胞之间存在相互作用的关系,可以通过调控铁死亡降低炎症反应,并促进巨噬细胞对铁死亡细胞的清除,从而改善微环境。 巨噬细胞产生的活性氧主要通过消耗脂质过氧化物或氨基酸代谢中谷胱甘肽/谷胱甘肽过氧化物酶4等抗氧化剂诱导其自身发生铁死亡[48]。另外,M1巨噬细胞释放的炎症因子(肿瘤坏死因子α、白细胞介素1β)也促进了铁死亡的发生[48]。研究表明,肿瘤坏死因子α能够上调酰基辅酶a合成酶长链家族成员3来促进细胞内脂质积累,为炎症反应和铁死亡的发生创造条件[9]。巨噬细胞分泌的白细胞介素1β能够通过诱导和磷酸化JunB增加其与铁调素的启动子结合,以诱导铁调素转录,从而导致铁转运蛋白降解和巨噬细胞内的铁大量积累[8]。因此,巨噬细胞分泌的炎症因子在诱导其自身发生铁死亡方面发挥了重要作用。 2.5 铁死亡与周围神经炎症 神经炎症是神经系统因创伤、神经变性或自身免疫反应而发生的局部炎症,是神经系统胶质细胞与周围免疫细胞相互作用的复杂过程[50]。周围神经损伤后,各种危险相关分子模式会从破裂的铁死亡细胞中释放出来[51],这些释放物被模式识别受体可以作为Toll受体激动剂的类似物激活TLR/核因子κB信号通路[52],促进炎性小体及炎症因子的表达,最终导致周围神经损伤的进一步加重。高迁移率族蛋白1是铁死亡过程中释放出来的一种危险相关分子模式,高迁移率族蛋白1的释放能够激活高迁移率族蛋白1-AGER信号通路,进而促进巨噬细胞中铁死亡所诱导的炎症反应[11]。由此表明,危险相关分子模式是介导细胞铁死亡过程中炎症反应的关键因子。 除此之外,转录因子p53在铁死亡中也发挥着重要的作用。尽管p53在介导细胞周期的抑制、衰老和凋亡等方面发挥了重要作用,但随着对铁死亡的深入研究,发现p53可以作为一个抑制细胞铁死亡发生的潜在靶点[53]。研究表明,p53可通过抑制溶质载体家族7成员11的表达减少谷胱甘肽的合成,进而导致活性氧在细胞内大量积累[13],并且大量的活性氧能够通过启动核因子κB信号通路加剧炎症反应[54],对周围神经造成进行进一步的破坏。p53能够通过促进亚精胺/精胺N1-乙酰转移酶1的表达来诱导活性氧发生氧化应激反应,引起脂质过氧化和铁死亡[10],从而导致神经发生炎症反应。值得注意的是,亚精胺/精胺N1-乙酰转移酶1能够上调花生四烯酸15-脂氧合酶的表达,并且花生四烯酸15-脂氧合酶抑制剂可以完全挽救亚精胺/精胺N1-乙酰转移酶1诱导的铁死亡[10],说明亚精胺/精胺N1-乙酰转移酶1能够通过花生四烯酸15-脂氧合酶来诱导细胞铁死亡的发生。上述研究结果表明,p53能够通过多条信号通路相互串扰引起细胞发生铁死亡,诱导炎症反应,从而阻碍神经损伤后修复,因此靶向p53可能对周围神经损伤后的炎症反应和修复有着积极作用。 另外,脂质过氧化在周围神经损伤后的炎症反应中也发挥了重要作用。研究证实,谷胱甘肽过氧化物酶4通过抑制细胞内脂质氢过氧化物的水平对细胞起保护作用,而脂质氢过氧化物是诱导炎症反应的原因之一[55]。研究指出,活化的谷胱甘肽过氧化物酶 4能够通过抑制花生四烯酸氧化和激活核因子κB途径来抑制炎症反应的发生[12]。另外,细胞应激期间的花生四烯酸在磷脂酶A2或磷脂酶C的作用下从磷脂中释放出来,其作为生物活性促炎递质的前体,主要是通过环氧合酶夸克斯和脂氧合酶代谢途径生成炎性递质前列腺素和白三烯,进而介导炎症反应的发生[22]。研究表明,在细胞铁死亡过程中前列腺素内过氧化物合酶2基因的表达上调[56],前列腺素内过氧化物合酶2基因能够通过环氧化酶2促进花生四烯酸代谢[57],进而促进炎症信号分子的分泌。综上所述,谷胱甘肽过氧化物酶4作为抑制铁死亡过程中脂质过氧化的重要调节因子,在介导炎症反应中是至关重要的。 2.6 铁死亡与周围神经损伤疼痛 神经性疼痛是周围神经损伤和适应不良的神经系统功能常见后遗症,通常会表现为自发性疼痛、痛觉过敏和异常性疼痛[58]。有研究表明,神经性疼痛中存在着铁死亡的发生,并且这种新型的细胞死亡方式主要是通过调节细胞内铁离子水平、脂质过氧化及氧化应激反应的发生来介导神经性疼痛,其中线粒体损伤诱导的氧化应激反应是神经性疼痛的重要发生机制[26]。 神经损伤后,铁死亡发生期间线粒体形态特征发生了改变[20],细胞内氧化应激反应失衡引起脂质过氧化,从而导致胶质细胞的激活、疼痛相关离子通道活性的增强[59]。在神经病理性疼痛小鼠中,由于脊髓胶质细胞中转铁蛋白和铁转运蛋白的表达失衡,细胞中铁大量积累,导致细胞中谷胱甘肽过氧化物酶下调及活性氧表达水平升高,表明铁积累引起的脂质过氧化和氧化应激均参与了慢性压迫性损伤引起的神经性疼痛的发生和发展[60]。因此,在神经性疼痛中铁死亡起到的作用是不可忽视的。 最新研究指出,Sirtuin2能够通过抑制铁死亡来减轻周围神经损伤引起的神经性疼痛。研究显示,过表达Sirtuin2能够上调铁转运蛋白1的表达水平,从而降低细胞内铁的积累,起到缓解神经性疼痛的作用;过表达Sirtuin2能够抑制神经损伤模型诱导的脂质过氧化,逆转酰基辅酶a合成酶长链家族成员4和谷胱甘肽过氧化物酶4水平的变化,从而抑制铁死亡[14],表明Sirtuin2在神经保护通路中发挥重要作用。研究发现,甲基阿魏酸可以通过下调NADPH氧化酶4蛋白的表达抑制氧化应激反应的发生,进而减轻铁死亡,从而改善周围神经损伤引起的疼痛[15]。电针能通过上调谷胱甘肽过氧化物酶4和下调酰基辅酶a合成酶长链家族成员4的表达抑制氧化应激反应的发生,进一步抑制铁死亡的发生,从而有效改善慢性压缩性损伤诱导的神经性疼痛[16]。再次提示了铁死亡可以作为神经损伤后疼痛治疗的关键靶点。"

| [1] DE LA ROSA MB, KOZIK EM, SAKAGUCHI DS. Adult Stem Cell-Based Strategies for Peripheral Nerve Regeneration. Adv Exp Med Biol. 2018; 1119:41-71. [2] WANG ML, RIVLIN M, GRAHAM JG, et al. Peripheral nerve injury, scarring, and recovery. Connect Tissue Res. 2019;60(1):3-9. [3] 赵孝淳,包映晖.铁死亡与神经系统疾病[J].中华神经医学杂志, 2017,16(1):104-107. [4] MIETTO BS, JHELUM P, SCHULZ K, et al. Schwann cells provide iron to axonal mitochondria and its role in nerve regeneration. J Neurosci. 2021;41(34):7300-7313. [5] CHANG B, GUAN H, WANG X, et al. Cox4i2 Triggers an Increase in Reactive Oxygen Species, Leading to Ferroptosis and Apoptosis in HHV7 Infected Schwann Cells. Front Mol Biosci. 2021;8:660072. [6] GAO D, HUANG Y, SUN X, et al. Overexpression of c‐Jun inhibits erastin‐induced ferroptosis in Schwann cells and promotes repair of facial nerve function. J Cell Mol Med. 2022;26(8):2191-2204. [7] LIANG Z, ZHANG N, WANG X, et al. Epothilone B inactivation of Sirtuin1 promotes mitochondrial reactive oxygen species to induce dysfunction and ferroptosis of Schwann cells. Eur J Pharm Sci. 2023;181:106350. [8] KANAMORI Y, MURAKAMI M, MATSUI T, et al. JNK facilitates IL-1β-induced hepcidin transcription via JunB activation. Cytokine. 2018;111: 295-302. [9] JUNG HS, SHIMIZU-ALBERGINE M, SHEN X, et al. TNF-α induces acyl-CoA synthetase 3 to promote lipid droplet formation in human endothelial cells. J Lipid Res. 2020;61(1):33-44. [10] OU Y, WANG SJ, LI D, et al. Activation of SAT1 engages polyamine metabolism with p53-mediated ferroptotic responses. Proc Natl Acad Sci U S A. 2016;113(44):E6806-E6812. [11] WEN Q, LIU J, KANG R, et al. The release and activity of HMGB1 in ferroptosis. Biochem Biophys Res Commun. 2019;510(2):278-283. [12] YU Y, YAN Y, NIU F, et al. Ferroptosis: a cell death connecting oxidative stress, inflammation and cardiovascular diseases. Cell Death Discov. 2021;7(1):193. [13] XU S, LI X, WANG Y. Regulation of the p53 mediated ferroptosis signaling pathway in cerebral ischemia stroke. Exp Ther Med. 2023; 25(3):113. [14] ZHANG X, SONG T, ZHAO M, et al. Sirtuin 2 Alleviates Chronic Neuropathic Pain by Suppressing Ferroptosis in Rats. Front Pharmacol. 2022;13:827016. [15] LIU T, WANG R, QI W, et al. Methyl Ferulic Acid Alleviates Neuropathic Pain by Inhibiting Nox4-induced Ferroptosis in Dorsal Root Ganglia Neurons in Rats. Mol Neurobiol. 2023;60(6):3175-3189. [16] XUE C, KUI W, HUANG A, et al. Electroacupuncture suppresses neuronal ferroptosis to relieve chronic neuropathic pain. J Cell Mol Med. 2024; 28(7):e18240.
[17] DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: An Iron-Dependent Form of Nonapoptotic Cell Death. Cell. 2012;149(5):1060-1072. [18] XIE Y, HOU W, SONG X, et al. Ferroptosis: process and function. Cell Death Differ. 2016;23(3):369-379. [19] LIU Y, FANG Y, ZHANG Z, et al. Ferroptosis: an emerging therapeutic target in stroke. J Neurochem. 2021;160(1):64-73. [20] WANG H, LIU C, ZHAO Y, et al. Mitochondria regulation in ferroptosis. Eur J Cell Biol.2019;99(1):151058. [21] ZHOU Y, LIN W, RAO T, et al. Ferroptosis and its potential role in the nervous system diseases. J Inflamm Res. 2022;15:1555-1574. [22] SUN Y, CHEN P, ZHAI B, et al. The emerging role of ferroptosis in inflammation. Biomedicine. 2020;127:110108. [23] ROCHETTE L, DOGON G, RIGAL E, et al. Lipid Peroxidation and Iron Metabolism: Two Corner Stones in the Homeostasis Control of Ferroptosis. Int J Mol Sci. 2022;24(1):449. [24] BAI T, LEI P, ZHOU H, et al. Sigma-1 receptor protects against ferroptosis in hepatocellular carcinoma cells. J Cell Mol Med. 2019;23(11):7349-7359. [25] LI Y, JIN C, SHEN M, et al. Iron regulatory protein 2 is required for artemether -mediated anti-hepatic fibrosis through ferroptosis pathway. Free Radic Biol Med. 2020;160:845-859. [26] YUAN H, PRATTE J, GIARDINA C. Ferroptosis and its potential as a therapeutic target. Biochem Pharmacol. 2021;186:114486. [27] CONRAD M, PRATT DA. The chemical basis of ferroptosis. Nat Chem Biol. 2019;15(12):1137-1147. [28] SHINTOKU R, TAKIGAWA Y, YAMADA K, et al. Lipoxygenase-mediated generation of lipid peroxides enhances ferroptosis induced by erastin and RSL3. Cancer Sci. 2017;108(11):2187-2194. [29] GASCHLER MM, STOCKWELL BR. Lipid peroxidation in cell death. Biochem Biophys Res Commun. 2017;482(3):419-425. [30] QIU J, YANG X, WANG L, et al. Isoquercitrin promotes peripheral nerve regeneration through inhibiting oxidative stress following sciatic crush injury in mice. Ann Transl Med. 2019;7(22):680. [31] ZHANG L, JOHNSON D, JOHNSON JA. Deletion of Nrf2 impairs functional recovery, reduces clearance of myelin debris and decreases axonal remyelination after peripheral nerve injury. Neurobiol Dis. 2013;54:329-338. [32] LI FJ, LONG HZ, ZHOU ZW, et al. System Xc−/GSH/GPX4 axis: An important antioxidant system for the ferroptosis in drug-resistant solid tumor therapy. Front Pharmacol. 2022;13:910292. [33] LIU M, KONG XY, YAO Y, et al. The critical role and molecular mechanisms of ferroptosis in antioxidant systems: a narrative review. Ann Transl Med. 2022;10(6):368. [34] BAYıR H, ANTHONYMUTHU TS, TYURINA YY, et al. Achieving Life through Death: Redox Biology of Lipid Peroxidation in Ferroptosis. Cell Chem Biol. 2020;27(4):387-408. [35] 常熙雯,赵安鹏,姚菀腾,等.铁死亡在缺氧相关脑损伤中的研究进展[J].生理学报,2023,75(2):255-268. [36] URSINI F, MAIORINO M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4. Free Radic Biol Med. 2020;152(2020):175-185. [37] FAN Z, WIRTH AK, CHEN D, et al. Nrf2-Keap1 pathway promotes cell proliferation and diminishes ferroptosis. Oncogenesis. 2017;6(8):e371. [38] YAO X, ZHANG Y, HAO J, et al. Deferoxamine promotes recovery of traumatic spinal cord injury by inhibiting ferroptosis. Neural Regen Res. 2019;14(3):532-541. [39] AN S, SHI J, HUANG J, et al. HIF-1α Induced by Hypoxia Promotes Peripheral Nerve Injury Recovery Through Regulating Ferroptosis in DRG Neuron. Mol Neurobiol. 2024. doi: 10.1007/s12035-024-03964-5 [40] DOLL S, FREITAS FP, SHAH R, et al. FSP1 is a glutathione-independent ferroptosis suppressor. Nature. 2019;575(7784):693-698. [41] 朱婷,范洋.自噬在细胞铁死亡发生中作用机制的研究进展[J].现代肿瘤医学,2021,29(11):1994-1999. [42] GUO J, CHEN L, MA M. Ginsenoside Rg1 Suppresses Ferroptosis of Renal Tubular Epithelial Cells in Sepsis-induced Acute Kidney Injury via the FSP1-CoQ10-NAD(P)H Pathway. Curr Med Chem. 2024;31(15): 2119-2132. [43] BERSUKER K, HENDRICKS JM, LI Z, et al. The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis. Nature. 2019;575(7784): 688-692. [44] JESSEN KR, ARTHUR-FARRAJ P. Repair Schwann cell update: Adaptive reprogramming, EMT, and stemness in regenerating nerves. Glia. 2019;67(3):421-437. [45] HUANG L, BIAN M, ZHANG J, et al. Iron Metabolism and Ferroptosis in Peripheral Nerve Injury. Oxid Med Cell Longev. 2022;2022:5918218. [46] FONTANA X, HRISTOVA M, DA COSTA C, et al. c-Jun in Schwann cells promotes axonal regeneration and motoneuron survival via paracrine signaling. J Cell Biol. 2012;198(1):127-141. [47] SOE-LIN S, SHEFTEL AD, WASYLUK B, et al. Nramp1 equips macrophages for efficient iron recycling. Exp Hematol. 2008;36(8):929-937. [48] YANG Y, WANG Y, GUO L, et al. Interaction between macrophages and ferroptosis. Cell Death Dis. 2022;13(4):355. [49] LUO X, GONG HB, GAO HY, et al. Oxygenated phosphatidylethanolamine navigates phagocytosis of ferroptotic cells by interacting with TLR2. Cell Death Differ. 2021;28(6):1971-1989. [50] JI RR, CHAMESSIAN A, ZHANG YQ. Pain regulation by non-neuronal cells and inflammation. Science. 2016;354(6312):572-577. [51] PRONETH B, CONRAD M. Ferroptosis and necroinflammation, a yet poorly explored link. Cell Death Differ. 2019;26(1):14-24. [52] AKIRA S. Toll-like receptor signaling. J Biol Chem. 2003;278(40):38105-38108. [53] KANG R, KROEMER G, TANG D. The tumor suppressor protein p53 and the ferroptosis network. Free Radic Biol Med. 2019;133:162-168. [54] CHENG Y, SONG Y, CHEN H, et al. Ferroptosis Mediated by Lipid Reactive Oxygen Species: A Possible Causal Link of Neuroinflammation to Neurological Disorders. Oxid Med Cell Longev. 2021;2021:5005136. [55] LI C, DENG X, XIE X, et al. Activation of Glutathione Peroxidase 4 as a Novel Anti-inflammatory Strategy. Front Pharmacol. 2018;9:1120. [56] YANG WS, SRIRAMARATNAM R, WELSCH ME, et al. Regulation of Ferroptotic Cancer Cell Death by GPX4. Cell. 2014;156(1-2):317-331. [57] 李福兴,谢可心,张玉琳,等.铁死亡在炎症性疾病中的研究进展[J].医学研究生学报,2020,33(12):1315-1319. [58] BOUHASSIRA D. Neuropathic pain: Definition, assessment and epidemiology. Rev Neurol (Paris). 2019;175(1-2):16-25. [59] CZERSKA M, MIKOŁAJEWSKA K, ZIELIŃSKI M, et al. Today’s oxidative stress markers. Med Pr. 2015;66(3):393-405. [60] GUO Y, DU J, XIAO C, et al. Inhibition of ferroptosis‐like cell death attenuates neuropathic pain reactions induced by peripheral nerve injury in rats. Eur J Pain. 2021;25(6):1227-1240. |
| [1] | Wang Wentao, Hou Zhenyang, Wang Yijun, Xu Yaozeng. Apelin-13 alleviates systemic inflammatory bone loss by inhibiting macrophage M1 polarization [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1548-1555. |
| [2] | Huang Ting, Zheng Xiaohan, Zhong Yuanji, Wei Yanzhao, Wei Xufang, Cao Xudong, Feng Xiaoli, Zhao Zhenqiang. Effects of macrophage migration inhibitory factor on survival, proliferation, and differentiation of human embryonic stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1380-1387. |
| [3] | Chang Jinxia, Liu Yufei, Niu Shaohui, Wang Chang, Cao Jianchun. Visualization analysis of macrophage polarization in tissue repair process [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1486-1496. |
| [4] | Yu Ting, Lyu Dongmei, Deng Hao, Sun Tao, Cheng Qian. Icariin pretreatment enhances effect of human periodontal stem cells on M1-type macrophages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1328-1335. |
| [5] | Zhao Xiaoxuan, Liu Shuaiyi, Li Qi, Xing Zheng, Li Qingwen, Chu Xiaolei. Different exercise modalities promote functional recovery after peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1248-1256. |
| [6] | Liu Lingyun, He Guixin, Qin Weibin, Song Hui, Zhang Liwen, Tang Weizhi, Yang Feifei, Zhu Ziyi, Ou Yangbin . Improvement of myocardial injury by traditional Chinese medicine: mitochondrial calcium homeostasis mediates macrophage autophagy and pyroptosis pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1276-1284. |
| [7] | Liu Zan, An Ran, Li Baocheng. Effect of pravastatin on functional recovery from sciatic nerve crush injury in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 942-950. |
| [8] | Wang Sifan, He Huiyu, Yang Quan, Han Xiangzhen. miRNA-378a overexpression of macrophage cell line composite collagen sponge: anti-inflammation and tissue repair promotion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 789-799. |
| [9] | Zhao Jianwei, Li Xunsheng, Lyu Jinpeng, Zhou Jue, Jiang Yidi, Yue Zhigang, Sun Hongmei. Deer antler stem cell exosome composite hydrogel promotes the repair of burned skin [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7344-7352. |
| [10] | Deng Ran, Wei Yi, Ji Xiaowei. Induction of M1/M2 polarization of macrophages by lipopolysaccharides and titanium particles in peri-implant tissues [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7415-7422. |
| [11] | Yan Laijun, Ge Haiya, Wang Zhengming, Yang Zongrui, Niu Lifeng, Zhan Hongsheng. Mechanism by which Tongdu Huoxue Decoction inhibits macrophage inflammation to delay intervertebral disc degeneration in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6851-6857. |
| [12] | Wang Qifei, Du Xingbin, Kong Jianda. Neural physiological basis and exercise-induced mechanism of central fatigue [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6979-6988. |
| [13] | Yao Lanxuan, Wang Xuefei, Liu Yang, Yang Yujia, Zhao Yi, Qi Fangfang, Li Yinghui . Mesenchymal stem cells and their derived extracellular vesicles target macrophages to intervene in autoimmune diseases [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(31): 6772-6781. |
| [14] | Zhao Xiaoxuan, Liu Shuaiyi, Xing Zheng, Li Qingwen, Chu Xiaolei, Li Qi. Research hotspots and trends in application of tissue engineering in peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6591-6600. |
| [15] | Xu Zhenhua, Li Yanjie, Qin Hewei, Liu Haoyuan, Zhu Bochao, Wang Yupu. Traditional Chinese medicine monomer in treatment of neuroinflammation after spinal cord injury: effects of nuclear transcription factor kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 590-598. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||