Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (12): 2569-2574.doi: 10.12307/2025.370
Previous Articles Next Articles
The molecular mechanism of necroptosis and its correlation with periodontitis
Sun Huanhuan, Zhao Fei, Tao Ran, Liu Bing
- Hebei Medical University School and Hospital of Stomatology, Hebei Provincial Key Laboratory of Stomatology, Hebei Provincial Clinical Medical Research Center for Oral Diseases, Shijiazhuang 050017, Hebei Province, China
-
Received:2024-04-07Accepted:2024-06-01Online:2025-04-28Published:2024-09-11 -
Contact:Liu Bing, Master, Chief physician, Associate professor, Hebei Medical University School and Hospital of Stomatology, Hebei Provincial Key Laboratory of Stomatology, Hebei Provincial Clinical Medical Research Center for Oral Diseases, Shijiazhuang 050017, Hebei Province, China -
About author:Sun Huanhuan, Master candidate, Hebei Medical University School and Hospital of Stomatology, Hebei Provincial Key Laboratory of Stomatology, Hebei Provincial Clinical Medical Research Center for Oral Diseases, Shijiazhuang 050017, Hebei Province, China -
Supported by:Hebei Province Medical Science Research Project, Nos. 20240512 (to LB), 20221454 (to ZF), and 20241077 (to TR)
CLC Number:
Cite this article
Sun Huanhuan, Zhao Fei, Tao Ran, Liu Bing. The molecular mechanism of necroptosis and its correlation with periodontitis[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(12): 2569-2574.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
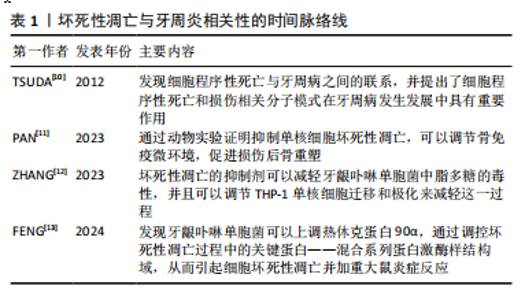
2.1 坏死性凋亡的概述及分级 2000年HOLLER等[8]提出RIP1和RIP3是调节TNF诱导细胞坏死性死亡的重要激酶;2005年DEGTEREV等[9]通过合成了一种可以抑制细胞坏死小分子物质necrostatin-1,才第一次提出了术语“坏死性凋亡”,这一发现使人们意识到完全可以通过调节其发生过程来控制细胞生命,因此越来越多的人关注细胞坏死性凋亡的研究。2012年,TSUDA 等 [10]带领团队讨论了细胞程序性死亡与牙周病之间的联系,并提出了细胞程序性死亡和从坏死细胞的胞质中释放出来的损伤相关分子模式(damage-associated? molecular? pattern,DAMPs)在牙周病发展中具有重要作用,自此坏死性凋亡与牙周炎相关性的研究拉开了序幕[11-13]。两者相关性的时间脉络线见表1。"
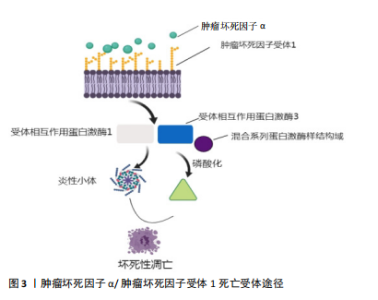
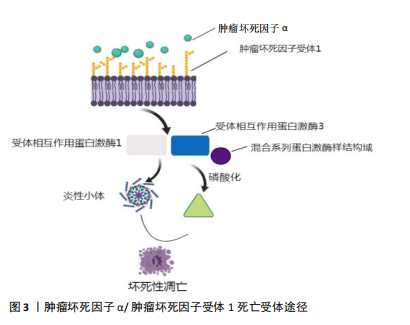
坏死性凋亡的发生是一个十分复杂的过程,其发生与RIP1、RIP3以及其混合系列蛋白激酶样结构域(mixed lineage kinase domain-like,MLKL)等多种蛋白及信号分子有关。可将其发生过程大致分为4个层次:1级为触发器(开关),主要包括如紫外线、Toll样受体、脂多糖等各种不同的生理病理性刺激;2级为激活启动机制(导火索),主要包括坏死小体、炎性小体、线粒体通透性转变、NADPH氧化酶等;3级为传播信号的介质(引线);4级为导致细胞死亡的生化机制(刽子手)。 2.2 坏死性凋亡的分子机制 坏死性凋亡的发生与多种蛋白及信号分子有关,其中半胱氨酸蛋白酶8(caspase-8)是坏死性凋亡的启动子,RIP1、RIP3是调节细胞坏死性凋亡的关键蛋白,而MLKL是介导细胞发生坏死性凋亡的最终刽子手。介导细胞坏死性凋亡的途径主要包括外源性途径和内源性途径2种[14],目前研究最广泛的分子模型就是由肿瘤坏死因子α(tumor necrosis factor,TNF-α)介导的细胞死亡受体途径:在炎性状态下,TNF-α与肿瘤坏死因子受体1(tumor necrosis factor receptor-1,TNFR-1)相结合,与此同时使RIP1和RIP3相互作用,形成坏死性凋亡所必需的功能性丝状淀粉样复合物,即坏死小体;自磷酸化和寡聚化的RIP3激活MLKL磷酸化;随后磷酸化的MLKL转移到细胞质膜上,通过钙离子内流依赖性方式介导细胞发生坏死性凋亡,造成质膜破裂并释放促炎性物质,最终导致细胞死亡[15]。在细胞坏死性凋亡后所释放的炎性物质的刺激下,机体微生态平衡逐渐发生改变,引起大量免疫炎症反应。TNF-α/TNFR1死亡受体途径见图3。"

2.3 坏死性凋亡对牙周炎影响可能的生物学作用及发病机制 2.3.1 细菌性微生物 坏死性凋亡最初被发现可以通过调控多种信号通路及蛋白,调节机体免疫炎症反应、氧化应激等,从而在多种疾病,尤其是感染性疾病中发挥重要作用。鉴于其促炎和免疫调节性质,坏死性凋亡在细菌性疾病发病机制中的作用近年来受到越来越多的关注[16]。牙周炎作为一种高度流行的细菌口腔感染性疾病,目前大多数学者认为其发病机制主要是微生物感染导致机体免疫机制不平衡的结果,由于定植于牙菌斑生物膜内的牙周致病菌刺激机体,导致牙周微环境发生改变,打破原有免疫平衡并释放各种炎症因子,病原微生物和免疫反应之间的相互作用导致细胞死亡的激活,细胞死亡后的无节制炎症可能导致组织损伤、牙周组织破坏以及加剧牙周炎的严重程度。而牙周炎的严重程度与某些介导炎症反应并导致牙周组织破坏的细菌存在有关。其中,牙龈卟啉单胞菌是一种重要的牙周致病菌,被描述为一种关键病原体,它可以侵入牙周组织并且可以逃避维持牙周健康至关重要的正常监测系统。其部分细胞成分被认为是毒力因子,尤其是牙龈卟啉单胞菌外膜囊泡,如脂多糖、蛋白质、遗传物质等,对牙周炎的发生发展起到重要作用[17]。人们通过动物实验证明通过调节牙龈卟啉单胞菌的毒性产物(如硫化氢、脂多糖等)可以操纵TLR-RIP1/3-MLKL通路介导的坏死性凋亡,从而在牙周组织中产生强大但有害的炎症反应[18];随后又有学者研究发现牙龈卟啉单胞菌可以刺激细胞发生坏死性凋亡,且阻断细胞坏死性凋亡可以影响细菌的生物活性及能力,减少其负荷早期的炎症反应以及提高体内清除率,从而减弱牙周组织炎症反应[19];粪肠球菌可以通过RIP3/MLKL信号通路诱导巨噬细胞坏死性凋亡促进难治性根尖牙周炎,且敲除RIP3可以减轻小鼠模型中的炎症性骨质流失[20]。这些研究提示坏死性凋亡可能会通过参与牙周致病菌感染牙周组织的进展,从而影响牙周组织炎症,操纵细胞坏死性凋亡是预防致病菌诱导的牙周炎的潜在治疗方法。 因多项研究显示坏死性凋亡在牙周炎疾病的发生发展中可能起重要作用,HE等[21]通过生物信息分析和机器学习算法共鉴定出10个与坏死性凋亡相关的长链非编码RNA,包括EPB41L4A-AS1、FAM30A、LINC01004、MALAT1、MIAT、OSER1-DT、PCOLCE-AS1、RNF144A-AS1、CARMN和LINC00582,并通过体外研究验证了长链非编码RNA与牙周炎的相关性。上述诸多研究表明坏死性凋亡与牙周炎之间存在密不可分的关系,坏死性凋亡参与了牙周炎的病理生理过程,然而其具体的机制仍未完全明确,进一步深入探讨牙周炎与坏死性凋亡之间的关系,将有利于牙周炎的临床防治。 2.3.2 慢性免疫炎症以及DAMPs的释放 炎症是机体组织受到损伤时所发生的一系列保护应答反应,是机体自我防御的一种。当细菌等病原体侵入牙周组织时,牙周组织会通过多种方式调控局部牙周组织和免疫系统共同应对细菌等病原体,从而维持体内微生物平衡。首先是由吞噬细胞聚集到病原体所在部位并吞噬病原体,随后引起大量免疫炎症反应以及与炎症不相关的细胞凋亡等,进一步杀死病原体,阻止病原体的传播[22-23]。然而,侵入牙周组织的病原体过度生长、牙周微环境各种致病因子、炎症递质的产生以及局部组织产生不受控制的、过度的免疫炎症反应均会对牙周宿主细胞的生存造成了极大的威胁。虽然最初认为细胞死亡是炎症的结果,但最近认为某些类型的细胞死亡也可能加重炎症反应[24]。例如细胞焦亡作为一种炎症性细胞死亡方式之一,可以通过释放促炎物质使部分机体发生感染后产生并加重炎症反应[25-26]。近年来,坏死性凋亡、细胞焦亡、铁死亡等多种细胞死亡模式在炎症性疾病的致病性中起着至关重要的作用,而牙周炎作为一种破坏牙周软硬支持组织的慢性炎症性疾病,其与坏死性凋亡之间具有不可分割的关系,且坏死性凋亡在牙周炎免疫方面的调控机制已被证明。有研究发现,RIP3/caspase-8介导的坏死性凋亡可以通过增强体内免疫炎症反应来促进牙周炎性微环境,且使用抑制剂抑制RIP3/caspase-8介导的坏死性凋亡后可以明显促进牙周组织再生、延缓病变的进展并修复受损的牙周组织,该实验为坏死性凋亡参与了牙周炎免疫方面的调控机制提供了有力证明[27];动物实验研究表明,阻断压力侧牙周组织坏死性凋亡的发生,可以有效影响牙周组织改建[28]。牙周细胞发生坏死性凋亡后,释放各种炎症因子及促炎性介质,如TNF-α、白细胞介素6、白细胞介素1β、DAMPs等,激活机体免疫防御功能,引起大量慢性炎症反应。 值得注意的是,细胞发生坏死性凋亡过程中所释放的DAMPs在牙周炎的发生发展在起到重要作用[29]。DAMPs是指细胞受到刺激或损伤后所释放的内源性分子,即内源性危险信号,它可以激活非免疫细胞,如上皮细胞等,也可以激活先天免疫细胞,如中性粒细胞、巨噬细胞等。这些细胞的激活会导致各种细胞因子和趋化因子的产生,可以通过多种途径诱导免疫炎症反应,是坏死炎症中的主要驱动力[30]。DAMPs主要来源于细胞膜、细胞质、细胞核、内质网以及线粒体等诸多结构,对免疫系统具有调控作用[31]。正常情况下,DAMPs被限制在细胞内,只有当细胞受到创伤等其他刺激时,才会从细胞中释放出来。目前,已经有多种疾病被证明与DAMPs介导的免疫炎症有关,如急性肝衰竭[32]、获得性免疫缺陷综合征[33]、心肌病等[34]。坏死性凋亡作为一种高度促炎性细胞死亡方式,表现为大量炎症细胞浸润,主要是由释放了大量DAMPs所致。其中高迁移率族蛋白1是DAMPs最典型的蛋白分子之一,人们发现在牙周炎患者的龈沟液以及炎症牙龈中可以检测到较高水平的高迁移率族蛋白1[35];并有报道称高迁移率族蛋白1以及活性氧的产生在细胞坏死性凋亡的过程中也可能发挥重要作用[36]。高迁移率族蛋白1在多种炎症性疾病中高表达,被认为是参与炎症进展的重要调节因子[37-38]。流行病学调查研究发现,慢性牙周炎患者中牙龈卟啉单胞的感染浓度与血清中高迁移率族蛋白1蛋白等其他炎症因子水平及牙周临床指标均呈正相关,且抑制血清中高迁移率族蛋白1的水平,可以减轻牙周组织炎症反应[39]。何龙等[40]的研究发现高迁移率族蛋白1参与慢性牙周炎的发生、发展过程;YOSHIHARA-HIRATA等[41]通过动物实验观察到高迁移率族蛋白1是响应牙周感染引起的炎症刺激而分泌的,且抑制高迁移率族蛋白1可以减轻小鼠牙周组织炎症和牙槽骨吸收。以上研究均表明,DAMPs作为重要的炎症因子可能参与牙周炎的进程。因此,可以推测当牙周组织受到刺激,细胞损伤、质膜破裂后释放了大量DAMPs从而诱导炎症和免疫反应可能是导致牙周组织破坏、牙周炎形成的又一重要原因。然而DAMPs是通过何种方式或通路引起炎症的具体机制尚不明确,仍有待进一步研究。随着牙周组织炎症的不断进展,牙周组织细胞又进一步坏死裂解从而释放更多的炎症介质,而持续的系统性低度炎症作用以及各种炎症因子的释放又可能会反过来激活某些信号通路,从而诱导坏死性凋亡的发生,进一步导致牙周细胞坏死、牙周组织破坏。由此坏死性凋亡与炎症形成正反馈回路。鉴于慢性免疫炎症在多种人类疾病中的基础作用,了解驱动这种反应的关键介质和途径具有十分重要的意义。 2.3.3 RIP3的促炎作用 RIP3是RIP家族中与RIP1具有相同N端和C端的“孪生姐妹”,是启动坏死性凋亡的特异性蛋白因子,由于RIP3和RIP1的C端都拥有一个同源结构域,因此使得二者可以相互作用协同调节细胞死亡[42]。 RIP3的主要促炎因子——白细胞介素1β激活受体并活化核因子κB信号通路,上调炎症因子的基因表达,随后通过持续诱导趋化因子和细胞因子的表达加重牙周组织炎症。近年来,RIP家族作为重要的传感器,在介导细胞死亡和免疫炎症反应的信号转导方面,受到广泛关注,RIP3作为RIP家族中的一员,具有较强的促炎作用[43-44]。RIP3的促炎作用一方面表现在可以通过诱导坏死性凋亡介导炎症反应,另一方面表现在RIP3可以直接产生炎性因子而引起炎症反应[45]。动物实验研究表明,RIP1可以通过调节炎症因子的表达从而减轻实验性牙周炎小鼠的牙槽骨吸收[46];柯晓菁[47]通过对小鼠皮下小室模型进行研究发现,阻断RIP3/MLKL介导的坏死性凋亡通路,可以显著降低牙周组织炎症渗出水平;OROZCO等[48]发现RIP3被激活后会导致细胞因子及趋化因子的产生,这种持续的细胞因子产生依赖于mRNA的翻译,并且需要内质网的完整性。RIP3的促炎作用使牙周组织微生态平衡遭到破坏,在持续性低度炎症微环境状态以及大量促炎性细胞因子的刺激下,逐渐诱导牙周组织发生免疫炎症反应,加速牙周组织中的免疫细胞和组织细胞死亡,最终可能对牙周炎的发生发展产生影响。然而,就目前而言缺乏更多的研究证实与坏死性凋亡密切相关的RIP3在牙周炎中的具体机制及作用,仍需结合更多实验进一步阐明。 2.4 坏死性凋亡在牙周炎中的应用 2.4.1 坏死性凋亡在牙周炎预防及诊断中的的应用 牙周炎作为一种口腔常见的慢性进行性炎症性疾病,多由牙龈炎症不断进展而来,其初期症状不明显,易受到人们的忽视,往往待疾病进展到晚期,出现出血溢脓、牙齿明显松动、牙槽骨吸收等严重后果时才被重视,而牙周炎的治疗是一个十分具有挑战性的问题,因此,牙周炎的早期诊断及预防是非常重要的。依上文所述,坏死性凋亡的发生与RIP3/MLKL信号通路密切相关,MLKL是介导细胞坏死性凋亡的最终执行者,此信号通路的核心步骤就是RIP3被上游信号激活,随后磷酸化MLKL,接着pMLKL转移到质膜上造成生物膜的破坏,使细胞内容物释放到细胞外基质中。已有学者发现,在慢性阻塞性肺疾病、炎症性肠病的细胞中pMLKL表达升高,且pMLKL的表达量与炎症程度有关[49-50],这提示高表达的pMLKL可能作为牙周炎的诊断指标,若未来可以证明pMLKL作为牙周炎的诊断指标,将有利于牙周炎的预防、早期诊断以及治疗。 2.4.2 坏死性凋亡在牙周炎治疗中的应用 牙周炎治疗的最终目标是实现炎症环境下牙周组织的再生和修复,恢复牙周组织的功能和结构。近年来,随着再生医学的不断发展,人们开始着重于干细胞应用于牙周组织再生与修复的研究,并且在多种疾病的治疗中已展现出巨大潜力。体外培养干细胞,同时采取各种方式阻断干细胞坏死性凋亡的发生以利于牙周组织再生与修复的研究也迅速成为了医学研究中备受关注的热点。2000年GRONTHOS等[51]首次从人的第三磨牙牙髓中分离并鉴定出具有多向分化和自我更新能力的成体干细胞,并命名为牙髓干细胞;KAWAGUCHI等[52]证明骨髓中存在间充质干细胞并能通过自体移植使受损的牙周组织实现再生与修复,自此标志着以干细胞研究为基础的口腔再生医学正式开创。 牙周组织稳态主要是通过牙周微环境中常驻细胞的细胞死亡、分化和增殖之间的动态平衡来维持的。而常驻牙周膜成纤维细胞的受损死亡一直是牙周治疗中的一大挑战。有学者已证明牙周膜成纤维细胞中发生了坏死性凋亡[53]。此外,抑制细胞周期蛋白依赖性激酶9有助于通过调控坏死性凋亡,减少牙周微环境中牙龈卟啉单胞菌诱导的牙槽骨丧失和炎症反应[54]。YAN等[55-56]证实了通过特异性抑制剂Nec-1可以有效阻断牙周膜干细胞和牙周韧带干细胞中坏死性凋亡的发生,同时可以缓解牙周膜干细胞成骨分化能力的下降以及保护其多电位分化和免疫调节的生物特性,从而下调牙周炎症反应,有效促进牙周组织修复与再生。推而广之,通过阻断细胞发生坏死性凋亡可能在组织修复研究中具有重大价值,对其进一步探究有望成为牙周组织修复与再生的治疗靶点。"

| [1] TRINDADE D, CARVALHO R, MACHADO V, et al. Prevalence of periodontitis in dentate people between 2011 and 2020: A systematic review and meta-analysis of epidemiological studies. J Clin Periodontol. 2023;50(5):604-626. [2] 张晗,秦亦瑄,韦帝远,等.牙周炎患者种植修复维护治疗依从性的影响因素[J].北京大学学报(医学版),2024,56(1):39-44. [3] 袁思娆,张亮,刘佳,等.慢性牙周炎与全身系统性疾病关系的研究进展[J].实用临床医学,2023,24(3):122-128+138. [4] 李兴蕊.糠尿病促进牙龈卟啉单胞菌远端转移的实验研究[D].济南:山东大学,2023. [5] 姜雨然.多组学联合分析尼古丁对牙周膜干细胞再生功能的作用及机制研究[D].西安:中国人民解放军空军军医大学,2023. [6] TSAI CY, TANG CY, TAN TS, et al. Subgingival microbiota in individuals with severe chronic periodontitis. J Microbiol Immunol Infect. 2018;51(2):226-234. [7] GU C, HOU C, ZHANG S. miR-425-5p improves inflammation and septic liver damage through negatively regulating the RIP1-mediated necroptosis. Inflamm Res. 2020;69(3):299-308. [8] HOLLER N, ZARU R, MICHEAU O, et al. Fas triggers an alternative, caspase-8-independent cell death pathway using the kinase RIP as effector molecule. Nat Immunol. 2000;1(6):489-95. [9] DEGTEREV A, HUANG Z, BOYCE M, et al. Chemical inhibitor of nonapoptoticcell death with therapeutic potential for ischemic brain injury. Nat Chem Biol. 2005;1(2):112-119. [10] TSUDA H, NING Z, YAMAGUCHI Y, et al. Programmed cell death and its possible relationship with periodontal disease. J Oral Sci. 2012;54(2):137-149. [11] PAN W, GU J, XU S, et al. Dietary nitrate improves jaw bone remodelling in zoledronate-treated mice. Cell Prolif. 2023;56(7):e13395. [12] ZHANG K, CHEN X, ZHOU R, et al. Inhibition of gingival fibroblast necroptosis mediated by RIPK3/MLKL attenuates periodontitis. J Clin Periodontol. 2023; 50(9):1264-1279. [13] FENG N, HAN X, PENG D, et al. P. gingivalis alters lung microbiota and aggravates disease severity of COPD rats by up-regulating Hsp90α/MLKL. J Oral Microbiol. 2024;16(1):2334588. [14] 赵英淇. Fas和TNF-α通路在皮质酮和CRH诱导小鼠输卵管上皮细胞凋亡过程中的作用研究[D]. 泰安:山东农业大学,2020. [15] 宋瑞婧,张欣欣,高飞,等. 加味升降散通过介导RIP1/RIP3/MLKL通路抑制坏死性凋亡减轻糖尿病肾病大鼠肾脏纤维化[J]. 中国实验方剂学杂志,2022,28(17):33-42. [16] PLACE DE, LEE S, KANNEGANTI TD. PANoptosis in microbial infection. Curr Opin Microbiol. 2021;59:42-49. [17] 邓愉,曹牛奔,刘笑梦,等.牙龈卟啉单胞菌外膜囊泡对牙周炎影响的研究进展 [J].现代口腔医学杂志,2023,37(5):339-344. [18] ZHANG JH, DONG Z, CHU L. Hydrogen sulfide induces apoptosis in human periodontium cells. J Periodontal Res. 2010;45(1):71-78. [19] KE X, LEI L, LI H, et al. Manipulation of necroptosis by Porphyromonas gingivalis in periodontitis development. Mol Immunol. 2016;77:8-13. [20] DAI X, MA R, JIANG W, et al. Enterococcus faecalis-Induced Macrophage Necroptosis Promotes Refractory Apical Periodontitis. Microbiol Spectr. 2022;10(4):e0104522. [21] HE J, ZHENG Z, LI S, et al. Identification and assessment of differentially expressed necroptosis long non-coding RNAs associated with periodontitis in human. BMC Oral Health. 2023;23(1):632. [22] 刘瑞卿,许宏敏,赵岩,等.程序性细胞死亡与感染性疾病的研究进展[J].中国热带医学,2023,23(11):1213-1221. [23] 徐力,聂柳燕,汪胡燕,等.自身免疫性疾病中程序性细胞死亡因子1及其配体的研究进展[J].中华全科医学,2022,20(5):832-835+843. [24] BERTHELOOT D, LATZ E, FRANKLIN BS. Necroptosis, pyroptosis and apoptosis: an intricate game of cell death. Cell Mol Immunol. 2021;18(5): 1106-1121. [25] 王旭东,梁强,周景寰,等.焦亡机制及其在胶质瘤中的作用研究进展[J/OL].国际神经病学神经外科学杂志,1-9[2024-05-09].http://kns.cnki.net/kcms/detail/43.1456.R.20240419.1113.002.html. [26] BURDETTE BE, ESPARZA AN, ZHU H, et al. Gasdermin D in pyroptosis. Acta Pharm Sin B. 2021;11(9):2768-2782. [27] LOPEZ R, HUJOEL P, BELIBASAKIS GN. On putative periodontal pathogens: anepidemiological perspective. Virulence. 2015;6(3):249-57. [28] 张严匀,李易,王贺,等.大鼠牙齿移动过程中Piezo1对压力侧牙周组织中RIP3及MLKL的影响[J].口腔医学,2022,42(10):883-888. [29] KAY JG, KRAMER JM, VISSER MB. Danger signals in oral cavity-related diseases. J Leukoc Biol. 2019;106(1):193-200. [30] GONG T, LIU L, JIANG W, et al. DAMP-sensing receptors in sterile inflammation and inflammatory diseases. Nat Rev Immunol. 2020;20(2):95-112. [31] 胡月,乔春燕,辛颖,等.损伤相关分子模式在牙周炎中的作用[J].免疫学杂志,2016,32(1):85-88. [32] 陈小梅,于淼,徐向红.损伤相关分子模式在慢加急肝衰竭中的研究进展[J].国际检验医学杂志,2023,44(16):2029-2034. [33] 潘万旗,张淼,许前磊,等.损伤相关分子模式在艾滋病炎症反应中的作用[J].中国艾滋病性病,2023,29(10):1152-1155. [34] 李军,姜春云,解紫从,等.基于Toll样受体通路与损伤相关分子模式分子炎症机制探讨扩张型心肌病中医药干预作用[J].河北中医,2023, 45(10):1725-1727+1731. [35] ANDERSSON U, YANG H, HARRIS H. Extracellular HMGB1 as a therapeutic target in inflammatory diseases. Expert Opin Ther Targets. 2018;22(3):263-277. [36] ROH JS, SOHN DH. Damage-Associated Molecular Patterns in Inflammatory Diseases. Immune Netw. 2018;18(4):e27. [37] CREWS FT, FISHER RP, QIN L, et al. HMGB1 neuroimmune signaling and REST-G9a gene repression contribute to ethanol-induced reversible suppression of the cholinergic neuron phenotype. Mol Psychiatry. 2023:10.1038/s41380-023-02160-6. [38] WANG Z, HE S, XIN L, et al. HMGB1-mediated transcriptional activation of circadian gene TIMELESS contributes to endometrial cancer progression through Wnt-β-catenin pathway. Cell Signal. 2024;116:111045. [39] 肖帅,禹洁,何杨,等.慢性牙周炎患者牙龈卟啉单胞菌感染与血清HMGB1, IL-1β, IL-6以及牙周临床指标的相关性研究[J].现代生物医学进展,2022,22(5):985-989. [40] 何龙,云蔓,吴薇薇,等.血清PGE2, HMGB1和CGRP在慢性牙周炎患者中的表达及预测效能[J].分子诊断与治疗杂志,2022,14(7):1242-1245. [41] YOSHIHARA-HIRATA C, YAMASHIRO K, YAMAMOTO T, et al. Anti-HMGB1 Neutralizing Antibody Attenuates Periodontal Inflammation and Bone Resorption in a Murine Periodontitis Model. Infect Immun. 2018;86(5): e00111-18. [42] 张端午.RIP3作为细胞凋亡与细胞坏死相互转换的分子开关的发现及机理研究[D].厦门:厦门大学,2009. [43] PEIXOTO MS, DE OLIVEIRA GALVÃO MF, BATISTUZZO DE MEDEIROS SR. Cell death pathways of particulate matter toxicity. Chemosphere. 2017;188:32-48. [44] MORIWAKI K, CHAN FK. Necroptosis-independent signaling by the RIP kinases in inflammation. Cell Mol Life Sci. 2016;73(11-12):2325-2334. [45] 于泽奇,衣泰龙,程世翔,等.受体相互作用蛋白3在炎症中的作用[J].医学综述,2016,22(16):3121-3124. [46] 夏思颖,杨亚楠,闫香珍,等.受体相互作用蛋白激酶1在小鼠实验性牙周炎模型中的作用[J].实用口腔医学杂志,2021,37(5):596-600. [47] 柯晓菁.RIP3介导的坏死性凋亡在牙周炎发病过程中的作用[D].南京:南京大学,2017. [48] OROZCO SL, DANIELS BP, YATIM N, et al. RIPK3 Activation Leads to Cytokine Synthesis that Continues after Loss of Cell Membrane Integrity. Cell Rep.2019;28(9):2275-2287.e5. [49] 刘佳丽,赵卉. 坏死性凋亡在慢性阻塞性肺疾病中的研究进展[J]. 临床肺科杂志,2023,28(1):117-120. [50] 龙秀艳,朱宁馨,邱佳宁,等. 炎症性肠病中的坏死性凋亡:一个潜在的治疗靶点[J]. 中南大学学报(医学版),2022,47(9):1289-1298. [51] GRONTHOS S, MANKANI M, BRAHIM J, et al. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci U S A. 2000;97(25): 13625-13630. [52] KAWAGUCHI H, HIRACHI A, HASEGAWA N, et al. Enhancement of periodontal tissue regeneration by transplantation of bone marrow mesenchymal stem cells. J Periodontol. 2004;75(9):1281-1287. [53] SHI J, LI J, SU W, et al. Loss of periodontal ligament fibroblasts by RIPK3-MLKL-mediated necroptosis in the progress of chronic periodontitis. Sci Rep. 2019;9(1):2902. [54] LI J, SHI J, PAN Y, et al. Transcription modulation by CDK9 regulates inflammatory genes and RIPK3-MLKL-mediated necroptosis in periodontitis progression. Sci Rep. 2019;9(1):17369. [55] YAN B, WEI K, HOU L, et al. Receptor-Interacting Protein 3/Caspase-8 May Regulate Inflammatory Response and Promote Tissue Regeneration in the Periodontal Microenvironment. Med Sci Monit. 2018;24:5247-5257. [56] YAN B, ZHANG H, DAI T, et al. Necrostatin-1 promotes ectopic periodontal tissue like structure regeneration in LPS-treated PDLSCs. PLoS One. 2018; 13(11):e0207760. |
| [1] | Yu Shuai, Liu Jiawei, Zhu Bin, Pan Tan, Li Xinglong, Sun Guangfeng, Yu Haiyang, Ding Ya, Wang Hongliang. Hot issues and application prospects of small molecule drugs in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1913-1922. |
| [2] | Li Kaiying, Wei Xiaoge, Song Fei, Yang Nan, Zhao Zhenning, Wang Yan, Mu Jing, Ma Huisheng. Mechanism of Lijin manipulation regulating scar formation in skeletal muscle injury repair in rabbits [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1600-1608. |
| [3] | Wang Yuru, Li Siyuan, Xu Ye, Zhang Yumeng, Liu Yang, Hao Huiqin. Effects of wogonin on joint inflammation in collagen-induced arthritis rats via the endoplasmic reticulum stress pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1026-1035. |
| [4] | Bai Jing, Zhang Xue, Ren Yan, Li Yuehui, Tian Xiaoyu. Effect of lncRNA-TNFRSF13C on hypoxia-inducible factor 1alpha in periodontal cells by modulation of #br# miR-1246 #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 928-935. |
| [5] | Zhi Fang, Zhu Manhua, Xiong Wei, Lin Xingzhen. Analgesic effect of acupuncture in a rat model of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 936-941. |
| [6] | Zhao Zengbo, Li Chenxi, Dou Chenlei, Ma Na, Zhou Guanjun. Anti-inflammatory and osteogenic effects of chitosan/sodium glycerophosphate/sodium alginate/leonurine hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 678-685. |
| [7] | Zheng Yitong, Wang Yongxin, Liu Wen, Amujite, Qin Hu. Action mechanism of intrathecal transplantation of human umbilical cord mesenchymal stem cell-derived exosomes for repair of spinal cord injury under neuroendoscopy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7743-7751. |
| [8] | Yu Hui, Yang Yang, Wei Ting, Li Wenli, Luo Wenqian, Liu Bin. Gadd45b alleviates white matter damage in chronic ischemic rats by modulating astrocyte phenotype [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7797-7803. |
| [9] |
Li Zhipeng, Xing Rongxin, Hu Lianghong.
Roles of SOX5 in bone metabolism and prevention of bone diseases and the relationship with exercise#br#
#br#
[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7589-7600.
|
| [10] | Zhang Yixuan, Li Dongna, Liu Chunyan. Pathological processes, inflammatory responses, and related biomarkers of periodontitis: a multi-omics analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7601-7610. |
| [11] | Pan Chun, Fan Zhencheng, Hong Runyang, Shi Yujie, Chen Hao. Effect and mechanism of polystyrene microplastics on prostate in male mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7353-7361. |
| [12] | Su Yongkun, Sun Hong, Liu Miao, Yang Hua, Li Qingsong. Development of novel antioxidants and antioxidant combination carried by nano-hydrogel systems in treatment of intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7376-7384. |
| [13] | Yan Laijun, Ge Haiya, Wang Zhengming, Yang Zongrui, Niu Lifeng, Zhan Hongsheng. Mechanism by which Tongdu Huoxue Decoction inhibits macrophage inflammation to delay intervertebral disc degeneration in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6851-6857. |
| [14] | Zhao Xuemei, Wang Rui, Ao · Wuliji, Bao Shuyin, Jiang Xiaohua. Effects of Agiophyllum Oligo Saccharides on inflammation and apoptosis of mouse synovial cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6939-6946. |
| [15] | Wang Qifei, Du Xingbin, Kong Jianda. Neural physiological basis and exercise-induced mechanism of central fatigue [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6979-6988. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||