Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (2): 507-515.doi: 10.12307/2025.897
Previous Articles Next Articles
3D printed poly-L-lactic acid bone scaffolds in repair of bone defects
Yang Fengli1, 2, Zhou Chao2, Xiong Wei3, Zhou Yuxiang2, Li Dengshun2, Wang Xin4, Li Zhanzhen1, 2
- 1Jiangxi University of Chinese Medicine, Nanchang 330004, Jiangxi Province, China; 2Zhoushan Dinghai Guanghua Hospital, Zhoushan 316000, Zhejiang Province, China; 3Zhejiang Chinese Medical University, Hangzhou 310000, Zhejiang Province, China; 4Chinese PLA General Hospital, Beijing 100028, China
-
Received:2024-09-30Accepted:2024-11-25Online:2026-01-18Published:2025-07-03 -
Contact:Li Zhanzhen, Doctoral supervisor, Jiangxi University of Chinese Medicine, Nanchang 330004, Jiangxi Province, China; Zhoushan Dinghai Guanghua Hospital, Zhoushan 316000, Zhejiang Province, China Wang Xin, MD, Master’s supervisor, Chinese PLA General Hospital, Beijing 100028, China -
About author:Yang Fengli, Master candidate, Jiangxi University of Chinese Medicine, Nanchang 330004, Jiangxi Province, China; Zhoushan Dinghai Guanghua Hospital, Zhoushan 316000, Zhejiang Province, China -
Supported by:Zhoushan City Public Welfare Project, No. 2022C31034 (to ZC); Graduate Innovation Special Fund of Jiangxi University of Chinese Medicine, No. JZYC23S24 (to XW)
CLC Number:
Cite this article
Yang Fengli, Zhou Chao, Xiong Wei, Zhou Yuxiang, Li Dengshun, Wang Xin, Li Zhanzhen. 3D printed poly-L-lactic acid bone scaffolds in repair of bone defects[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 507-515.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
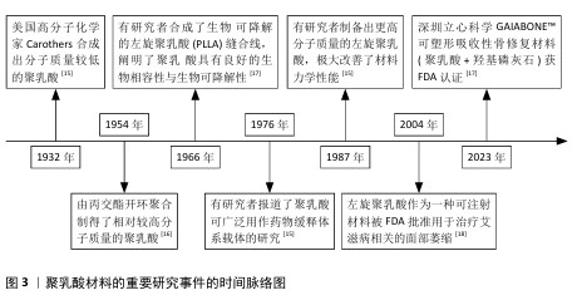
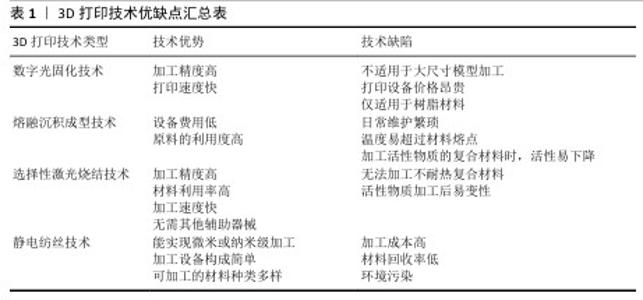
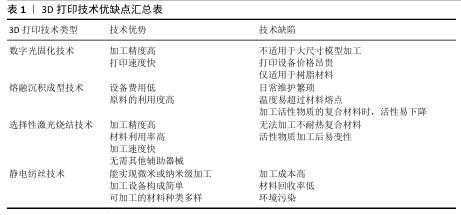
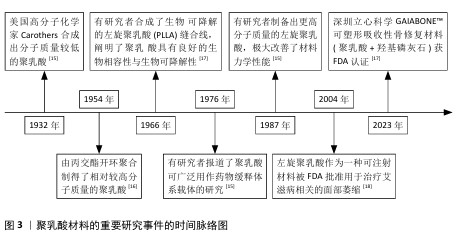
2.1 3D打印技术应用于聚乳酸骨支架的制备 聚乳酸(polylactic acid,PLA),又称聚丙交酯,是一种脂肪族聚酯类聚合物,主要由小分子乳酸发生聚合反应形成。根据旋光性不同,合成的聚乳酸可细分为左旋聚乳酸(L-polylactic acid,PLLA)、右旋聚乳酸(D-polylactic acid,PDLA)、外消旋聚乳酸(PDLLA)及内消旋聚乳酸(meso-PLA)4类,其中PLLA常作为制备人工骨支架的候选材料[15-18],见图3。 PLLA作为骨组织工程研究的重要原材料之一,通过必要的控制加工手段,生产出仿生人工骨支架等产品。该产品能与组织活体细胞结合,并可植入生物体内,为细胞提供获取营养、气体交换、排泄废物和生长发育的场所,并支持细胞逐渐增殖分化,最终形成新的具有形态和功能的组织器官。但骨骼作为人体支撑系统的重要成员,不仅具有优良的机械强度,并且其内部的立体多孔结构对骨内血管生成和血管周围神经纤维的生长,及骨细胞的黏附、渗透、分化、扩散和骨向内生长均有积极作用[19-20]。因此选用一种能生成出复杂外形且加工精度高,同时安全可靠的加工技术对聚乳酸人工骨支架的发展至关重要。 3D打印技术,也称增材制造技术,是一种革命性的生物材料制造工艺。相比于传统制造技术,3D打印技术通过逐层添加材料的方式来根据预先设置的3D模型数据构建物体,通常包括3个步骤:一是利用计算机建模软件设计三维模型,二是将三维模型切成切片,最后逐层打印模型[21]。因此,在理论上,任何复杂的三维模型都可以通过3D打印技术来制作,这满足了在人工骨支架制备过程中模拟骨骼中多层次和致密多孔结构的设计需求,该技术的应用给人工骨修复材料的发展带来了新的契机。 既往3D打印的服务对象多在涡轮叶片制造、珠宝设计、模具制造、建筑等领域[22-23],自20世纪80年代到21世纪初,众多设计人员基于不同的工作原理开发出许多3D打印技术,目前常用于人工骨支架研究的3D打印技术有数字投影技术、熔融沉积技术、选择性激光烧结技术和静电纺丝技术等[24-27]。不同3D打印技术由于工作机制和加工技术的天差地别,导致各技术对加工原料的要求和制备出人工骨支架的性能差异巨大,故选择3D打印技术制备聚乳酸骨支架时需结合自身的设计需求出发,见表1。 "

2.1.1 数字光固化技术 数字光固化技术(digital light processing,DLP)是利用数字光源对液态光敏树脂进行固化,将材料层层打印成型的技术[28]。在打印过程中,使用数字反射镜装置来控制激光束的移动。通过使用数字反射镜装置,可以一次性固化整层,这使得DLP打印速度比传统光固化成型技术更快[29]。KORDI等[30]通过DLP技术以氧化石墨烯(GO)纳米粒子为增强材料,开发出一种具有优异机械性能的GO/PLLA支架,结果表明随着支架中GO百分比的增加,GO/PLLA支架的机械性能、亲水性均有明显增加,通过对支架进行热处理,可有效降低支架的降解速率,以便更好地匹配新骨的再生速度。 高精度和打印速度快是DLP打印的最大优势。但为了保证高精度,模型的尺寸是有限的,因此,DLP打印不适合打印大尺寸物体。另一方面,DLP技术主要由美国德州仪器公司主导研发,故DLP打印机价格昂贵。此外,DLP打印仅适用于树脂材料,不能应用于金属和复合粉末的加工打印,故限制了该技术的规模应用。 2.1.2 熔融沉积成型技术 熔融沉积成型打印(fused deposition modeling,FDM),是利用热塑性材料的热熔性、黏结性,将材料加热融化成型的3D打印技术[31]。其工作机制是将材料通过加热器的喷头熔化成液体,喷头在控制系统指令下沿着零件截面轮廓和内部轨迹运动,同时将半流动状态的热熔材料挤出,黏稠状的成型材料和支撑材料被选择性地涂覆在工作台上,迅速固化后形成截面轮廓。当前层成型后,喷头上升一定的高度后再进行下一层的打印,最终完成整个三维立体支架的打印。 ZHANG等[32]采用FDM技术来制备具有定制几何形状的PLLA/羟基磷灰石(hydroxyapatite,HA)复合支架,该支架不仅具有良好的机械性能与生物活性,且加工精度也满足个性化骨修复应用的要求。并且作者还研究了不同HA含量对支架力学性能的影响,同时HA含量的增加有助于缓解PLLA降解产物的酸度,改变降解速率,提高生物活性;在体内动物实验中,高负载HA的PLLA支架也展现出更出色的骨再生能力。与其他复杂、尖端的3D打印技术相比,该研究借助FDM技术总结出一种快速、稳定、低成本的方法来实现人工骨支架的个性化打印。 尽管FDM技术能制备出性能优异的人工骨支架,还能实现支架外形的定制,且设备费用低、原料的利用度高,但是FDM打印机的喷头处易发生堵塞,日常维护繁琐。同时,FDM长时间打印会出现温度过高的情况,最高温度甚至超过聚合物的熔点;此外,FDM在打印含活性物质的聚合物材料时,由于温度限制易引起物质的活性下降[33]。 2.1.3 选择性激光烧结技术 选择性激光烧结技术(selective laser sintering,SLS)是一种先进的3D打印技术,它通过把激光作为热源,对粉末材料进行选择性加热和熔化,从而逐层构建出三维物体[34]。该技术由DECHARD于20世纪80年代研发,目前已广泛应用于金属、生物陶瓷以及高分子聚合物等材料的加工成型[35]。其工作系统主要是由二氧化碳激光发射器、计算机控制系统、可升降的材料成型平台所组成。这种加工方式的加工精度和材料利用率高、加工速度快、且无需其他辅助器械,并能制备各类复杂结构的支架,满足了不同骨支架的外形设计需要。 SHUAI等[36]将聚乙交酯(PGA)混合到PLLA/HA粉末中,借助SLS技术成功制备了一种多孔骨支架(PLLA/HA/PGA),该支架通过PGA的掺杂,显著提高了骨支架的亲水性,并且通过PGA的快速降解,增加了支架中HAP与体液的接触,从而加速了Ca,P离子进入细胞的速度,促进了骨样磷灰石沉积;此外,多孔支架的孔径控制在500 μm,该设计能增强细胞与支架间相互作用,为成骨细胞的生长和增殖提供了合适的表面接触环境。XIONG等[37]利用SLS技术设计并制备了多孔中药复合支架,首先借助介孔生物微球成功负载了中药活性单体柚皮苷,然后掺杂进PLLA粉末后在SLS加工平台上制备复合支架,所得到的中药复合支架(NG-MBG/PLLA)不仅具有优异的细胞相容性与成骨活性,且在细胞共培养实验中证实,中药复合支架组具有调控巨噬细胞极化的能力,通过调节适宜的骨免疫微环境以加速骨组织的再生。 2.1.4 静电纺丝技术 静电纺丝技术一种高效的纳米纤维制备技术,其加工原理与传统加工办法差异巨大,是利用高压电场对聚合物溶液表面施加静电排斥力,当排斥力能克服溶液表面张力时,开始静电纺丝,能制备出微米或纳米级的纤维,常用于生产具有仿生细胞外基质结构的组织工程材料[38]。 MENG等[39]设计出一种具有高表面积、高孔隙率和有利于细胞黏附表面结构的纤维支架,其通过将PLLA与聚己内酯(PCL)溶液混合,再经过静电纺丝技术打印出纤维支架,随后用丙酮对纤维支架进行处理从而生成高密度多孔的结构。与原始样品相比,多孔的PLLA/PCL支架的细胞增殖率明显增加,同时还具有高表面积(平均表面积36.302 m2/g)和良好的力学性能(平均杨氏模量1.65 GPa和平均拉伸强度5.1 MPa)等特质。细胞外基质是一种由细胞分泌的围绕在组织周围的复杂结构,其在维持组织结构、提供支持和保护细胞方面发挥着重要作用。研究表明,细胞外基质能促进细胞对基质的贴附,细胞之间的黏着,细胞内微丝及应力纤维的构建,高度参与调节组织周围的细胞活动。为了模仿天然细胞外基质形态,MENG等[40]开发出一种海绵状PLLA/PCL纤维支架,该海绵纤维支架表现出高度多孔的结构(总孔隙率=85.9%),且具备相互连接的规则大孔结构,很好地模仿了天然细胞外基质。与此同时,生物活性玻璃(BG)颗粒的添加进一步提高了海绵支架的亲水性(水接触角=79.7°)和生物相容性,并促进了成骨细胞生长与增殖,因此,这种带有生物活性玻璃的PLLA/PCL海绵支架在骨缺损修复方面具有广阔的应用前景[40]。 静电纺丝技术的未来蕴含着无限可能,其不仅加工装置构成简单,且可加工的材料种类多样,目前可用于溶液静电纺丝的聚合物材料就有数十种。但是其不足之处也十分明显,如原材料需先溶于有机溶剂中,该过程不仅增加了加工成本而且易造成原材料浪费,且有机溶剂易造成环境污染,同时生物安全性有待考量[41-42]。 2.2 3D打印的聚乳酸支架在不同骨病环境修复骨缺损 由骨髓炎、骨肿瘤、骨坏死及骨质疏松等病理性疾病引起的骨缺损是骨科常见疾病,相较于创伤导致的骨缺损,骨病引起的病理性骨缺损的骨微环境更为复杂,骨组织再生能力因受原发骨病影响较正常骨组织有所下降。因此使用骨组织工程支架修复此类骨缺损时,除关注支架的促成骨性能之外,支架对原发骨病的治疗能力亦需格外重视,恢复正常的成骨微环境对骨组织再生意义巨大。聚乳酸骨组织工程支架具备可加工性强、功能多样等优点,借助3D打印技术并采取不同策略制备出的聚乳酸复合支架有望满足在不同骨病环境修复骨缺损的治疗需求。 2.2.1 聚乳酸支架修复骨髓炎相关骨缺损 骨髓炎是一种因开放性骨折等原因导致细菌侵袭进入骨组织的严重骨科疾病,由于治疗过程长、病情复杂、易复发,一直是骨科医生临床治疗所面对的一个巨大挑战。传统治疗骨髓炎一般采用外科清创联合长期抗生素治疗,但长期高剂量使用抗菌药物不仅会存在肝和肾损伤等风险,还可能导致耐药菌株的出现[43]。此外骨髓炎清创术后常存在大段的骨缺损,若不进行有效的植骨干预措施,该骨缺损很难愈合。因此,骨髓炎清创术后感染骨缺损的重建和抑制局部感染复发是临床治疗的两大难点。为解决感染性骨缺损难修复这一临床问题,人们已经设计和开发了许多同时具有抗菌和成骨功能的3D打印聚乳酸复合支架的治疗策略,将抗生素、金属离子、生物活性成分等具有抗菌特性的物质与聚乳酸支架结合,已被证实具备修复感染性骨缺损的潜能[44-45]。 QIAO等[46]利用3D-Bioplotter打印机开发出一种利福平/莫西沙星-PLGA的抗菌微球(RM-P),RM-P微球与PLLA粉末混合制备出多孔RM-P/PLLA支架。在细胞实验中RM-P/PLLA支架可以促进人骨髓间充质干细胞的黏附、增殖和成骨分化,并且应用于兔桡骨感染性骨缺损模型时,RM-P/PLLA支架不仅为骨缺损部位提供了结构支撑,还通过支架释放出的利福平/莫西沙星发挥抗感染作用。尽管将抗生素引入骨组织工程支架可取得较为理想的结果,但抗生素对载药平台的要求较高,制作也较为复杂,因此许多学者将注意力转向具有抗菌属性的生物材料,希望将其作为抗生素替代物发挥作用,同时减少细菌耐药性的发生。 目前研究已证实,纳米银具有广谱抗菌性能和较小的细菌耐药性,将纳米银引入骨组织工程支架是抑制骨感染的有效途径。GUO等[47]利用天然铝硅纳米管埃洛石纳米管(HNTs)作为纳米容器,通过真空负压抽吸和注射等方式将纳米银(Ag)负载于管腔中(Ag-HNTs),然后,将Ag-HNTs与PLLA混合通过SLS技术打印出骨支架。在体外离子释放实验中,由于HNTs管壁起着的“屏蔽”作用可以延迟生成的Ag向外扩散,在超过28 d的时间内支架均能持续释放Ag,并且通过细胞实验证实,支架的持久抗菌性能不会损害细胞相容性。因此引入天然抗菌剂的支架设计策略可适用于骨髓炎的治疗,相较于单纯使用抗生素,该策略可以减轻人体对抗生素的依赖,避免细菌耐药问题的出现。 2.2.2 聚乳酸支架修复骨肿瘤相关骨缺损 目前,临床治疗恶性骨肿瘤和转移性骨肿瘤患者多采取联合策略,如骨肿瘤切除术与化疗、放疗手段结合。尽管如此,切除术后的肿瘤复发、放化疗带来的不良反应、肿瘤对药物的低敏感性等因素的限制,致使联合方案的效果难以满足患者的治疗需求,并且骨肿瘤切除所导致的骨缺损亦严重影响着患者的生活质量[48]。 聚乳酸骨组织工程支架由于其功能设计的灵活性,在治疗恶性骨肿瘤切除术所导致的骨缺损时具备诸多优势:第一,将聚乳酸支架植入因骨肿瘤导致的缺损部位,不仅可替代原有骨骼的支撑作用,还能为骨细胞迁移与分化提供创造条件,并可避免软组织侵袭缺损部位,保留骨组织再生的空间;第二,聚乳酸支架可负载免疫调节剂,通过局部释放免疫调节剂激活机体的免疫系统,增强免疫细胞对肿瘤细胞的杀伤作用;第三,聚乳酸支架骨缺损部位缓释抗肿瘤药物,对周围组织中残存的肿瘤细胞达到持续杀伤的效果,从而减轻口服药物导致的胃肠反应,减少或避免骨肿瘤复发,延长患者生命。 因此,无论是从短期疗效和远期预后来看,聚乳酸支架修复骨肿瘤相关骨缺损都有较大优势。目前具体支架设计策略主要包括借助支架局部缓释抗肿瘤药物、或将支架与其他有抗肿瘤功效的材料(如光热/磁热/光动力/化学动力等材料)等联合使用,共同制备符合预期功效的多功能支架[49]。有研究将唑来膦酸盐(ZOL)负载到胺化功能化介孔硅(SBA15NH2)中,然后掺入左旋聚乳酸(PLLA)粉末中通过SLS技术的制备出(PLLA\SBA15NH2-ZOL)支架[50]。一方面,通过静电吸附与介孔结构的SBA15NH2起到屏障作用,持续释放唑来膦酸可以通过竞争性结合破骨细胞前体中的核转化因子kB受体激活剂来抑制破骨细胞的分化;另一方面,局部释放的唑来膦酸能诱导细胞凋亡来抑制骨肉瘤细胞的增殖。上述结果表明该设计策略在抑制骨肿瘤引起的骨吸收、减缓骨肿瘤进行和修复相关骨缺损等方面具有应用价值。 基于芬顿反应的化学动力疗法作为传统肿瘤治疗(如手术、放疗及化疗)的前瞻性替代方案,由于其高选择性和不良反应小,近年来引起了的广泛关注[51]。QIAN等[52]发现在肿瘤微环境中由于过氧化氢 (H2O2)不足制约了化学动力学疗法的抗肿瘤疗效,他们借助过氧化钙(CaO2)能释放H2O2的能力,并在过氧化钙原位生长沸石咪唑骨架-67(ZIF-67)保护其过早分解,将CaO2@ZIF-67颗粒掺入聚乳酸粉末中通过SLS技术制备出复合支架(CaO2@ZIF-67/PLLA)[52]。实验结果表明由于ZIF-67的疏水性,ZIF-67可以作为保护层防止CaO2过早分解释放双氧水,然后在肿瘤酸性微环境下ZIF-67发生pH响应性开始降解,CaO2暴露并与水反应释放H2O2,结果表明,CaO2@ZIF-67/PLLA支架对肿瘤细胞的杀死率达到84.64%,具有治疗肿瘤性骨缺损的潜力。 2.2.3 聚乳酸支架修复骨坏死相关骨缺损 缺血性骨坏死是骨科领域的一种重大疾病,通常由创伤、长期使用糖皮质激素、减压病症或血脂异常等风险因素诱发[53]。这种疾病的主要问题是骨头部分因血液供应不足导致细胞活性下降,影响了骨骼的自然恢复过程,最终造成严重的骨质损伤。在治疗策略上,初期可能采取核心减压或血管移植手术来缓解症状,但这些手段在多数情况下只能对部分患者有所裨益,并不能阻止病情的恶化;对于疾病晚期的患者,多以关节置换手术为主。近年来,骨组织工程技术的发展为治疗骨坏死提供了创新的治疗方案[54]。将具有促进成骨和促血管生成功能的人工骨支架填充至骨坏死缺损处,以此激活骨细胞的增殖和分化,同时促进血管网络的重建,进而实现受损骨组织的修复和功能的恢复,这种方法为传统治疗手段提供了一个替代或补充的选择,给骨坏死患者带来了新的希望。 针对因骨坏死所导致的缺损修复,骨组织工程治疗策略多聚焦于恢复骨组织正常血供,以保证新骨顺利再生[55]。YANG等[56]利用低温快速成型技术将PLLA 和二氧化锰 (MnO2) 纳米颗粒组成的微环境响应性骨支架,旨在通过清除内源性活性氧和原位调节免疫微环境来增强缺血性骨坏死的再生速率。在骨缺损区域产生的 MnO2 和内源性过氧化氢 (H2O2) 之间的过氧化氢样催化反应,通常变为酸性且富含活性氧,触发氧气和 Mn2+ 的按需释放,通过促进巨噬细胞的 M2 型极化、重编程有利于血管生成和成骨的骨免疫微环境来显著改善炎症反应。此外,通过转录组测序分析探索了基本机制,揭示了 PLLA/MnO2骨支架可通过上调人骨髓间充质干细胞 (hBMSC) 中的转化生长因子β/Smad 信号通路促进成骨分化,实现坏死骨缺损的修复[56]。 将中药与骨组织工程技术结合被认为是极具研究意义的探索方向,FENG等[57]利用静电纺丝技术设计了一种顺序释放的聚乳酸支架,即内层装载总黄酮,外层装载三七皂苷,以分别促进成骨和血管生成。他们将其与单层支架(总黄酮和三七皂苷同时嵌入聚乳酸溶液)相比较,发现随着内外侧药物的逐渐释放,总黄酮和三七皂苷对内皮细胞和骨髓间充质干细胞的增殖和成骨/成血管分化具有积极作用,进而表现出优异的促血管生成和促成骨效果;进一步研究发现,血管内皮生长因子、血小板内皮细胞黏附分子1、骨钙素、骨桥蛋白及碱性磷酸酶等在双层支架中的表达均明显高于单层支架[57],他们认为其机制可能是血管生成蛋白和成骨蛋白表达上 调。这种双层顺序释放支架的设计理念为骨缺损修复提供了新方向,未来该支架也可以应用于其他病理环境的骨缺损治疗中。 2.2.4 聚乳酸支架修复骨质疏松相关骨缺损 治疗骨质疏松症患者的骨缺损目前仍然是一个重大临床挑战,由于骨质疏松症患者的骨代谢紊乱进而导致骨愈合能力受损,治疗此类患者不仅需对受损骨组织进行修复,还需纠正紊乱的骨代谢和恢复骨组织再生能力,目前大多数患者多接受抗骨质疏松药物和手术的联合治疗方案[58]。然而骨质疏松症患者松质骨的高孔隙率和低强度,不仅增加了术中螺钉或固定板对缺损骨的固定难度,且术后患者发生二次骨折和植入物脱落的概率较正常患者明显增高[59]。既往方案多在术前对患者给予增强成骨/抑制破骨的生物制剂以恢复正常骨代谢,达到降低植入物脱落等并发症发生率的目的。进入21世纪,天然/合成来源的生物材料被广泛用于修复骨质疏松性骨缺损的相关研究中。 聚乳酸支架等人工骨移植治疗策略的不断发展有望帮助一线医生为骨质疏松性骨缺损患者提供更好的临床诊疗。ORYAN等[60]用3D打印(ZMorph打印机)将唑来膦酸负载于PLLA/PCL/HA支架中,制备载药复合支架以期修复骨质疏松性骨缺损,在大鼠桡骨骨缺损模型中,该载药复合支架通过释放唑来膦酸能够纠正失衡的成骨微环境,骨诱导性和促血管生成的能力,还加速了大鼠损伤桡骨的结构重构和功能恢复。 传统治疗骨质疏松症的药物主要为减少骨吸收类(如雌激素、选择性雌激素受体调节剂、双膦酸盐、地诺单抗和降钙素)或增加骨形成类(如甲状旁腺激素、甲状旁腺激素相关肽和雷奈酸锶)[61],但这些药物在长期使用中也存在不同的不良反应(如胃肠道反应、肌肉抽搐、循环系统毒性、诱发骨肉瘤等),且副反应很大程度上是因为药物在骨微环境中缺乏骨靶向能力,因此骨靶向递送抗骨质疏松物质的聚乳酸支架在骨质疏松性骨缺损的治疗优势巨大。YAN等[62]开发了一种用 EPLQLKM 和 SVVYGLR 肽修饰的 3D 打印聚己内酯(PCL-SE)支架,EPLQLKM肽吸引骨髓间充质干细胞(BMSCs),而SVVYGLR肽增强内皮祖细胞血管分化,从而通过内皮祖细胞的旁分泌作用调节骨代谢并促进骨再生。进一步的机制研究表明,PCL-SE促进内皮祖细胞的血管化,激活骨髓间充质干细胞中的Notch信号通路,导致成骨相关基因的上调和破骨细胞相关基因的下调,从而恢复骨代谢平衡。此外,PCL-SE 促进内皮祖细胞分化为“H”型血管,并招募骨髓间充质干细胞来协同增强成骨作用,从而加速骨质疏松 SD 大鼠股骨髁骨缺损的正常微血管和骨组织再生,该研究为骨质疏松性骨缺损提供了一种新的组织工程修复策略[62]。 "

| [1] ZAN J, QIAN G, DENG F, et al. Dilemma and breakthrough of biodegradable poly-l-lactic acid in bone tissue repair. J Mater Res Technol. 2022;17:2369-2387. [2] NORRIS BL, VANDERKARR M, SPARKS C, et al. Treatments, cost and healthcare utilization of patients with segmental bone defects. Injury. 2021;52(10):2935-2940. [3] BALL AN, DONAHUE SW, WOJDA SJ, et al. The challenges of promoting osteogenesis in segmental bone defects and osteoporosis. J Orthop Res. 2018;36(6):1559-1572 [4] SADOWSKA JM, POWER RN, GENOUD KJ, et al. A multifunctional scaffold for bone infection treatment by delivery of microRNA therapeutics combined with antimicrobial nanoparticles. Adv Mater. 2024;36(6):2307639. [5] MAUFFREY C, BARLOW BT, SMITH W. Management of segmental bone defects. J Am Acad Orthop Surg. 2015;23(3):143-153. [6] VALTANEN RS, YANG YP, GURTNER GC, et al. Synthetic and bone tissue engineering graft substitutes: what is the future? Injury. 2021;52 Suppl 2:S72-S77. [7] SCHMIDT AH. Autologous bone graft: is it still the gold standard? Injury. 2021;52 Suppl 2:S18-S22. [8] 张治博,王兆林,王志刚,等.Ilizarov骨搬移联合抗生素骨水泥促进胫骨大段骨缺损的对接点愈合[J].中国组织工程研究,2025,29(10):2038-2043. [9] DAHL MT, MORRISON S. Segmental bone defects and the history of bone transport. J Orthop Trauma. 2021;35(Suppl 4):S1-S7. [10] 赵越,许燕,周建平,等.骨组织工程中传统与仿生支架结构设计的差异[J].中国组织工程研究,2025,29(16):3458-3468. [11] 朱昱衡,肖砚斌,李凌,等.3D打印聚醚醚酮假体重建锁骨恶性肿瘤切除后缺损[J].中国矫形外科杂志,2024,32(15): 1410-1414. [12] 刘姿辰,禹宝庆.生物可降解聚乳酸用于骨修复的发展前景和研究价值[J].中国组织工程研究,2021,25(34):5552-5560. [13] XIA D, WANG Y, WU R, et al. The effect of pore size on cell behavior in mesoporous bioglass scaffolds for bone regeneration. Appl Mater Today. 2022;29:101607. [14] 董博,李效宇,李碧榕,等.3D打印支架修复感染性骨缺损[J].中国组织工程研究,2024,28(29):4685-4690. [15] 崔靖园,陈璨,杨洋,等.医用级聚乳酸合成及改性研究进展[J].化工新型材料, 2020,48(10): 268-272. [16] 许明奕,逄宇帆,刑涛,等.聚乳酸合成方法的研究进展及市场分析[J].应用化工,2022,51(12):3614-3618,3624. [17] 龚亚辉,王舒.新型生物医用材料聚乳酸产业及植入应用现状研究[J].当代化工研究,2024(6):24-26. [18] 董诚挚,朱辉.注射用聚左旋乳酸在体表软组织充填中的应用现状[J].中国美容医学,2022,31(2):182-185. [19] DAI W, LI S, JIA H, et al. Indirect 3D printing CDHA scaffolds with hierarchical porous structure to promote osteoinductivity and bone regeneration. J Mater Sci Technol. 2025;207:295-307. [20] WANG C, WANG H, CHEN Q, et al. Polylactic acid scaffold with directional porous structure for large-segment bone repair. Int J Biol Macromol. 2022;216:810-819. [21] 章乐民.3D打印左旋聚乳酸复合骨植入物的成骨和抗菌性能研究[D].南昌:江西理工大学,2023. [22] ZHENG Y, DENG F, WANG B, et al. Melt extrusion deposition (MED™) 3D printing technology-a paradigm shift in design and development of modified release drug products. Int J Pharm. 2021;1(60):120-135. [23] 董谢平,裴国献.3D打印技术在骨科临床的应用与展望[J].陆军军医大学学报, 2022,44(15):1501-1507. [24] WANG Z, WANG Y, YAN J, et al. Pharmaceutical electrospinning and 3D printing scaffold design for bone regeneration. Adv Drug Deliv Rev. 2021; 174:504-534. [25] XIONG S, ZHANG Y, ZENG J, et al. DLP fabrication of HA scaffold with customized porous structures to regulate immune microenvironment and macrophage polarization for enhancing bone regeneration. Mater Today Bio. 2024;24:100929. [26] WANG W, LIU P, ZHANG B, et al. Fused deposition modeling printed PLA/Nano β-TCP composite bone tissue engineering scaffolds for promoting osteogenic induction function. Int J Nanomed. 2023; 18:5815-5830. [27] DI W, SHUAI C, WANG Y, et al. A Chemotherapy-photothermal synergistic system in bifunctional bone scaffold: tumor therapy and bone repair. Mater Des. 2024. DOI: 10.1016/j.matdes.2024. 113269. [28] 张雪琴,章宇轩,侯丹,等.光固化生物3D打印研究进展及其在生物医药领域的应用[J].中国科学:化学,2023,53(6): 958-973. [29] 董栋,苏海军,李翔,等.光固化3D打印磷酸钙基生物陶瓷支架的研究进展[J].材料导报, 2023,37(18):66-74. [30] KORDI O, BEHRAVESH AH, HASANNIA S, et al. Additive manufacture of PLLA scaffolds reinforced with graphene oxide nano-particles via digital light processing (DLP). J Biomater Appl. 2023;38(4):484-499. [31] GARZON-HERNANDEZ S, GARCIA-GONZALEZ D, JERUSALEM A, et al. Design of FDM 3D printed polymers: an experimental-modelling methodology for the prediction of mechanical properties. Mater Des. 2020;188:108414. [32] ZHANG B, WANG L, SONG P, et al. 3D printed bone tissue regenerative PLA/HA scaffolds with comprehensive performance optimizations. Mater Des. 2021;201:109490. [33] KOLLAMARAM G, CROKER DM, WALKER GM, et al. Low temperature fused deposition modeling (FDM) 3D printing of thermolabile drugs. Int J Pharm. 2018; 545(1-2):144-152. [34] TABRIZ AG, KUOFIE H, SCOBLE J, et al. Selective Laser Sintering for printing pharmaceutical dosage forms. J Drug Deliv Sci Tec. 2023;86:104699. [35] FENG P, SHEN S, SHUAI Y, et al. PLLA grafting draws GO from PGA phase to the interface in PLLA/PGA bone scaffold owing enhanced interfacial interaction. SM&T. 2023;35:e00566. [36] SHUAI C, YANG W, FENG P, et al. Accelerated degradation of HAP/PLLA bone scaffold by PGA blending facilitates bioactivity and osteoconductivity. Bioact Mater. 2021;6(2): 490-502. [37] XIONG W, YUAN L, HUANG J, et al. Direct osteogenesis and immunomodulation dual function via sustained release of naringin from the polymer scaffold. J Mater Chem B. 2023;11(45):10896-10907. [38] RAHMATI M, MILLS DK, URBANSKA AM, et al. Electrospinning for tissue engineering applications. Prog Mater Sci. 2021;117:100721. [39] MENG C, TANG D, LIU X, et al. Heterogeneous porous PLLA/PCL fibrous scaffold for bone tissue regeneration. Int Bio Macromol. 2023;235:123781. [40] MENG C, LIU X, LI R, et al. 3D Poly (L-lactic acid) fibrous sponge with interconnected porous structure for bone tissue scaffold. Int Bio Macromol. 2024;268:131688. [41] STELLA SMM, RAMA M, SRIDHAR TM, et al. Optimization of biologically inspired electrospun scaffold for effective use in bone regenerative applications. Polymers. 2024;16(14):2023. [42] MIRJALILI M, ZOHOORI S. Review for application of electrospinning and electrospun nanofibers technology in textile industry. J Nanostruct Chem. 2016;6: 207-213. [43] LI Y, LI J, ZHONG Y, et al. pH-Responsive and nanoenzyme-loaded artificial nanocells relieved osteomyelitis efficiently by synergistic chemodynamic and cuproptosis therapy. Biomaterials. 2025;313:122762. [44] SHUAI C, SHI X, WANG K, et al. Ag-doped CNT/HAP nanohybrids in a PLLA bone scaffold show significant antibacterial activity. Bio-Des Manuf. 2024;7(2): 105-120. [45] LI B, YANG H, SONG H, et al. Composite PLLA/Ag@ SiO2 microspheres for bone regeneration in infected bone defects. Ceram Int. 2023;49(18):30424-30435. [46] QIAO Z, ZHANG W, JIANG H, et al. 3D-printed composite scaffold with anti-infection and osteogenesis potential against infected bone defects. RSC Adv. 2022;12(18): 11008-11020. [47] GUO W, LIU W, XU L, et al. Halloysite nanotubes loaded with nano silver for the sustained-release of antibacterial polymer nanocomposite scaffolds. J Mater Sci Technol. 2020;46:237-247. [48] LIU X, LIU Y, QIANG L, et al. Multifunctional 3D-printed bioceramic scaffolds: recent strategies for osteosarcoma treatment. J Tissue Eng. 2023;14:20417314231170371. [49] REN Y, CHEN C, ZHANG M, et al. Application of nanostructure-loaded hydrogels for cancer treatment and tissue regeneration. Appl Mater Today. 2024;37:102086. [50] DI W, SHUAI Y, BO W, et al. A bifunctional zoledronate sustained-release system in scaffold: Tumor therapy and bone repair. Colloids Surf B. 2023;222:113064. [51] SZYMANSKI W. Beyond photodynamic therapy: light-activated cancer chemotherapy. Curr Med Chem. 2017; 24(42):4905-4950. [52] QIAN G, WANG J, YANG L, et al. A pH-responsive CaO2@ ZIF-67 system endows a scaffold with chemodynamic therapy properties. J Mater Sci. 2023;58(3):1214-1228. [53] LEE HJ, JEON JH, KIM CH, et al. Photosynthetic microporous bioactive glass ceramic beads for treating avascular osteonecrosis. J Ind Eng Chem. 2023;122:551-561. [54] MA C, ANDRE G, EDWARDS D, et al. A rat model of ischemic osteonecrosis for investigating local therapeutics using biomaterials. Acta Biomater. 2021;132:260-271. [55] YANG F, XU C, ZHANG W, et al. Biodegradable magnesium incorporated microspheres enable immunomodulation and spatiotemporal drug release for the treatment of osteonecrosis of the femoral head. Compos Part B-Eng. 2023; 250:110430. [56] YANG Y, YAO Z, SUN Y, et al. 3D-printed manganese dioxide incorporated scaffold promotes osteogenic-angiogenic coupling for refractory bone defect by remodeling osteo-regenerative microenvironment. Bioact Mater. 2025;44:354-370. [57] FENG G, ZHANG P, HUANG J, et al. Sequential release of Panax notoginseng saponins and osteopractic total flavone from poly (L-lactic acid) scaffold for treating glucocorticoid-associated osteonecrosis of femoral head. J Funct Biomater. 2023;14(1):31. [58] HWANG SH, CHO PG, KIM K, et al. What are the risk factors for a second osteoporotic vertebral compression fracture? Spine J. 2023;23(11):1586-1592. [59] KATTHAGEN JC, SCHWARZE M, WARNHOFF M, et al. Influence of plate material and screw design on stiffness and ultimate load of locked plating in osteoporotic proximal humeral fractures. Injury. 2016;47(3): 617-624. [60] ORYAN A, HASSANAJILI S, SAHVIEH S. Zoledronate loaded polylactic acid/polycaprolactone/hydroxyapatite scaffold accelerates regeneration and led to enhance structural performance and functional ability of the radial bone defect in rat. Iran J Vet Res. 2023;24(2):122. [61] DRAKE MT, CLARKE BL, LEWIECKI EM. The pathophysiology and treatment of osteoporosis. Clin Ther. 2015;37(8): 1837-1850. [62] YAN C, ZHANG P, QIN Q, et al. 3D-printed bone regeneration scaffolds modulate bone metabolic homeostasis through vascularization for osteoporotic bone defects. Biomaterlals. 2024;311:122699. |
| No related articles found! |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||