Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (27): 5914-5923.doi: 10.12307/2025.842
Previous Articles Next Articles
Non-surgical influencing factors of rotator cuff retear after arthroscopic rotator cuff repair
Huang Zishuai, Wang Jian
- Department of Orthopedics, Shandong Provincial Hospital Affiliated to Shandong First Medical University, Jinan 250000, Shandong Province, China
-
Received:2024-06-04Accepted:2024-08-12Online:2025-09-28Published:2025-03-07 -
Contact:Wang Jian, MD, Chief physician, Department of Orthopedics, Shandong Provincial Hospital Affiliated to Shandong First Medical University, Jinan 250000, Shandong Province, China -
About author:Huang Zishuai, Master candidate, Physician, Department of Orthopedics, Shandong Provincial Hospital Affiliated to Shandong First Medical University, Jinan 250000, Shandong Province, China
CLC Number:
Cite this article
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
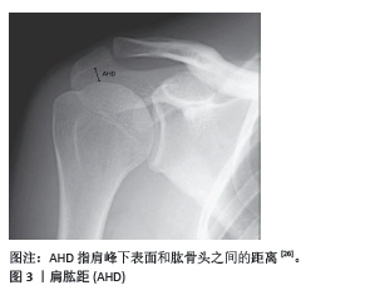
2.1 社会人口危险因素 2.1.1 年龄 研究发现随着年龄的增长,肩袖肌腱会发生退行性变,如肌腱退化、脂肪浸润和肌肉萎缩[3-5],这些变化减少了肌腱的弹性和强度;此外,随着年龄的增长,患者肩关节的活动范围和日常使用频率可能减少,这可能影响肩袖的机械负载和应力分布,这使得其能够承受的负荷以及抗拉伸强度下降[6-7],ARCR术后再撕裂率也会随之上升。KHAZZAM等[8]发现年龄每增加1岁,再撕裂率就会增加5%,50岁时再撕裂的风险为15%,70岁时则会增加到30%以上。DIEBOLD 等[9]认为老年患者的生理恢复能力和组织再生能力通常较低,这可能导致手术后的愈合过程缓慢和不完全,同时年纪较大的患者可能会因为微血管疾病或血流减少而导致肩袖区域的血液供应不足,影响手术区域的愈合和组织修复,从而增加再撕裂的风险。综上,对于年纪较大的患者,在进行肩袖修补手术时,骨科医生应更加仔细地评估患者的整体健康状况、肩袖的质量和患者的康复潜力,术后康复计划也可能需要更加个性化,以适应老年患者较低的生理恢复能力和其他并存疾病的管理。 2.1.2 脂质代谢异常 PARK等[10]发现,脂质代谢异常可能导致血管病变,如动脉硬化,影响肩部区域的血液供应,血液供应不足会减慢愈合过程,影响手术部位的恢复质量。脂肪细胞可通过机械和生物化学途径影响周围组织,脂肪细胞产生的炎症因子和酶可能破坏胶原蛋白的质量,降低肌腱的结构完整性和力学性能[11]。LEE等[12]发现高血脂症会导致肩袖肌肉中脂肪组织的积累增多,即脂肪浸润,这种浸润会减少肌肉组织的力量和耐力,影响肌肉的功能和肌腱的负荷承受能力,增加手术后肌腱再撕裂的风险。该研究表明,低密度脂蛋白在肩袖肌腱中的浸润、高脂血症引起的慢性低级别微血管炎症与肌腱强度和质量的恶化以及肌腱愈合不良有关。因此,对于有脂质代谢异常的患者,在进行肩袖修补术前后,医生需要评估和管理患者的代谢状况,通过饮食和药物干预来优化患者的代谢参数,以降低再撕裂的风险并提高手术效果。 2.1.3 糖尿病 糖尿病是肩袖撕裂的一个重要发病因素。但术后血糖控制不佳是否是术后再撕裂的危险因素仍存在争议。PARK等[10]发现糖尿病患者如果血糖控制不良,高血糖状态可以通过减弱组织的愈合能力来增加术后并发症的风险。高血糖可能导致肩袖区域的微血管病变,影响血液供应,从而影响肌腱和肌肉的修复过程。KIM等[13]报道糖尿病患者的组织修复能力通常较差。糖化终产品的积累可能会导致胶原蛋白交联异常,降低肌腱的机械强度,使得修复后的肩袖更容易再次撕裂。KIM等[14]在一项研究中进一步发现糖尿病患者术后糖化血红蛋白水平越高,术后再撕裂率就越高。此外糖尿病患者的肌肉和肌腱可能存在退行性改变,包括脂肪浸润和肌肉萎缩,这些改变可能会降低肩袖的整体质量和修复后的稳定性。为降低再撕裂率,控制患者术后血糖水平至关重要。因此,对于糖尿病患者来说,在进行肩袖修补术前后需要严格控制血糖水平,并通过合理的术后康复计划,加强对患者的监测和支持,以降低再撕裂的风险。医生通常会更加细致地评估这些患者的风险,并可能调整治疗策略以适应糖尿病患者的特殊需求 2.1.4 骨质疏松 肱骨肩袖肌腱附着处骨密度越低,ARCR术后肩袖越容易发生再撕裂。CHUNG等[15]研究发现骨密度T值< - 2.5的患者术后再撕裂率为41.7%,T值> - 2.5的患者再撕裂率为13.2%。PIETSCHMANN等[16]分别在健康和骨质疏松的尸体标本上进行评估,发现骨质疏松可能改变了肩部结构的生物力学属性,使肩袖肌腱在活动中受到更大的应力,这种增加的负荷可能对已经修复的肌腱构成额外的压力,增加再撕裂的可能性。TINGART 等[17]发现骨质疏松会导致肩部骨骼(特别是肩峰和肱骨大结节)密度降低,使得在手术中使用的锚钉难以稳固地固定在骨头中。如果锚钉固定不牢,手术后肌腱与骨头之间的结合可能会变得不够稳定,增加肌腱再撕裂的风险就会增加。肩袖修补手术中需要在骨头上进行钻孔以放置锚钉,在骨质疏松的情况下,手术过程中的钻孔可能导致额外的骨质损伤,影响手术区域的整体稳定性和愈合质量[18]。研究发现骨质疏松患者可以通过使用唑来膦酸钠来降低ARCR术后的再撕裂率[19-20]。SHAH等[21]在一项动物实验研究中发现应用硬化蛋白抗体可以促进小鼠肩袖肌腱和骨更好地愈合,该研究表明,硬化蛋白抗体通过提高肌腱附着部位的骨密度来促进腱-骨愈合,从而降低再撕裂风险。对于骨质疏松患者,在进行肩袖修补手术前,医生可能需要考虑采用特殊的手术技术或增强骨质的方法(如使用骨水泥、压缩骨填充骨囊肿,选择更多的锚钉或改善缝合方法)来提高手术的成功率和耐久性;同时,术后的康复计划也可能需要调整,以避免过早或过度使用肩部,确保充分的恢复。此外,对骨质疏松的治疗也是术前和术后管理的重要组成部分。 2.1.5 吸烟饮酒 一项研究指出,吸烟、嗜酒是肩袖再撕裂或不良临床结局(术后肩关节活动度差、患者疼痛加重等)的独立危险因素[22]。吸烟会导致血管收缩,减少血液流向肩袖区域,影响组织的氧气和营养供应,延缓愈合过程。此外,烟草中的有害物质(如尼古丁和一氧化碳)会干扰胶原蛋白的合成,降低组织修复的质量和速度。吸烟会增加体内的炎症反应,导致术后炎症持续时间延长,影响伤口愈合。吸烟会削弱免疫系统功能,使得机体对感染和炎症的抵抗力下降,增加术后并发症发生的风险,如术后感染、伤口愈合不良、血栓形成等并发症,这些并发症都会影响肩袖修复效果。因此,建议患者在手术前至少6周戒烟,以减少吸烟对血液供应和组织愈合的不良影响。长期饮酒会损害肝脏功能,影响蛋白质和营养物质的合成和代谢,进而影响组织修复。过量饮酒会导致营养吸收不良和营养缺乏,影响伤口愈合和组织修复。饮酒会削弱免疫系统,使得机体对感染和炎症的抵抗力下降,增加术后并发症的风险。酒精会引起全身性炎症反应,延长术后炎症期,影响伤口愈合。长期饮酒会导致骨质疏松和肌肉萎缩,影响肩袖的结构和功能,增加再撕裂的风险。对于吸烟和长期饮酒的患者,应于手术前后戒烟酒或限制饮酒,以减少酒精对肝功能、营养吸收和免疫系统的不良影响。同时,提供适当的营养支持,确保患者获得足够的蛋白质、维生素和矿物质,以促进伤口愈合和组织修复,术后应密切监测伤口愈合情况,及时处理任何并发症,确保最佳的康复效果。 2.1.6 体质量指数 有研究指出, 体质量指数是中小型撕裂肩袖修复术后愈合失败的独立预测因素,在 63 岁以下且体质量指数低于28.1 kg/m2的患者中更有可能成功修复[7]。 较高的体质量指数可能会导致血液循环不良,特别是微循环受损,这会影响肩袖组织的血液供应,进而影响愈合能力。较高的体质量指数患者术后感染、伤口愈合不良等并发症的发生率较高,同时体质量较大的患者常伴有慢性炎症和代谢综合征(如糖尿病、高血压等),这些因素均会影响组织的愈合和修复能力。体质量指数超标可能会限制患者进行术后康复锻炼的能力和效果,影响康复进程和最终的治疗结果。 2.1.7 性别 性别对肩袖再撕裂的影响是一个复杂的问题,涉及生理、解剖、激素水平和生活方式等多方面的因素。以下是一些关键点: (1) 解剖和生理差异 肌肉力量和质量:男性通常具有较大的肌肉质量和力量,这可能有助于肩袖的稳定性和功能。然而,女性在肩袖手术后的康复过程中可能需要更多的时间和努力来恢复肌肉力量。 肩关节解剖结构:女性的肩关节可能更容易出现不稳定性和过度活动,这可能增加肩袖撕裂和再撕裂的风险。 (2)激素水平:雌激素对肌腱和韧带的代谢和修复有一定的影响。研究表明,雌激素水平的变化可能影响女性肩袖的愈合能力,尤其是在绝经期期间。 (3) 骨质密度:女性,特别是绝经后的女性,更容易患骨质疏松,这可能影响肩袖的附着点和整体稳定性,增加再撕裂的风险。 (4)生活方式和活动水平:男性和女性在生活方式和运动类型上可能存在差异,这也会影响肩袖的健康。例如,男性可能更倾向于从事高强度的体力活动,而女性可能更多地参与柔韧性训练。 (5)疾病和健康状况:某些疾病如糖尿病、甲状腺疾病等在性别上的分布可能有所不同,这些疾病也会影响肩袖的健康和愈合能力。一些研究表明,女性在肩袖修复手术后的再撕裂率可能略高于男性,但这并不是绝对的,具体情况还需要考虑个体差异和其他风险因素[22]。因此,女性患者可能需要更多的骨质密度监测和激素水平管理。 2.1.8 优势手 优势手(即主导手)对肩袖再撕裂的影响是一个重要的研究课题,因为肩袖撕裂的发生和再撕裂与肩关节使用频率、负荷和运动模式密切相关。优势手通常使用频率更高,承担的负荷也更大。这种高频使用和高负荷可能导致肩袖更容易受到磨损和损伤,优势手在日常生活和工作中可能需要进行大量的重复性动作,这些动作可能导致肩袖肌腱的疲劳和微小损伤,增加再撕裂的可能性。 在肩袖修复手术后,优势手的康复可能更具挑战性,因为患者可能对优势手有较强的心理依赖,可能急于恢复其正常功能,以便继续日常活动和工作。这可能导致过早或过度使用,影响愈合过程。由于优势手的重要性,患者和康复团队可能会更加关注其功能恢复,这有助于更好的康复结果。然而,如果康复计划不够谨慎,这也可能导致在康复过程中更高的再撕裂风险。某些运动和活动可能对优势手施加更多的压力和负荷,如网球、棒球等,这些运动需要特别注意预防和康复。术后应制定针对优势手的个性化康复计划,确保在恢复过程中逐步增加负荷,避免过早或过度使用。对患者进行教育,强调在康复期间保护优势手的重要性,避免过度使用和负荷。在康复过程中进行定期随访和功能评估,及时调整康复计划,以确保最佳的恢复效果和减少再撕裂的风险。 2.1.9 继发性冻结肩 继发性冻结肩(又称粘连性肩关节囊炎)是一种肩关节活动范围显著受限的疾病,通常伴有疼痛和僵硬。有研究表明,肩袖修复手术后出现继发性冻结肩的患者,其再撕裂率高于未出现冻结肩的患者[23],这可能与冻结肩对肩关节功能恢复的负面影响有关。冻结肩不仅导致肩关节囊和周围组织的僵硬,限制肩袖肌腱的正常移动和功能恢复,还会导致肩关节周围组织的血液供应减少,从而影响愈合。冻结肩通常伴有显著的疼痛且显著限制肩关节的活动范围,患者可能无法进行全面的康复训练,增加康复训练的难度,这可能导致康复过程延长,增加再撕裂的风险。在康复过程中,通过物理治疗和药物治疗可以减轻疼痛和改善活动范围,骨科医生、物理治疗师和疼痛管理专家的合作,可以提供全面的治疗和康复支持,帮助患者更好地恢复肩袖功能。还应提供心理支持和教育,帮助患者应对疼痛和功能受限,增强其康复的积极性和配合度。 2.1.10 教育程度 LEE等[24]研究发现,患者受教育程度以及经济条件显著影响肩袖再撕裂率,文化程度较高的人通常拥有更好的健康知识和意识,他们可能更了解肩袖撕裂的严重性和治疗的重要性,这可以促使他们更早地寻求医疗帮助,并严格遵循医生的建议和康复计划,从而降低再撕裂的风险。文化程度较低的人可能缺乏相关的健康知识和意识,可能会忽视早期症状,延误治疗,或者在康复过程中不严格遵循医生的建议,从而增加再撕裂的风险。此外,文化程度较高的人通常从事体力劳动较少的职业,生活方式相对健康,减少了肩部再次受伤的风险。文化程度较低的人可能从事体力劳动较多的职业,肩部活动频繁且强度大,增加了肩袖再撕裂的风险。 2.2 解剖因素 2.2.1 肩肱距 肩肱距是指肩峰与肱骨头之间的距离(图3),这个距离对肩袖的健康和功能至关重要。肩肱距的大小会直接影响肩袖肌腱的空间和压力状态,进而影响肩袖修补术后再撕裂的风险。大部分文献都选择了站立位肩关节正位X射线片来测量该指标。SANGUANJIT等[25]同时也测量了仰卧位的肩关节正位X射线片以及肩部的MRI,发现通过仰卧位肩关节正位X射线片测量肩肱距预测再撕裂的价值与MRI相同。CAFFARD等[26]发现术前肩肱距小于0.74 cm的患者有较高的概率发生ARCR术后的再撕裂,也有研究发现肩肱距< 0.4 cm是术后肩袖再撕裂的独立危险因素[23]。"
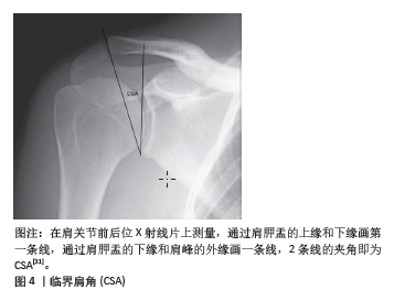
空间限制:肩肱距较小意味着肩袖肌腱和肩峰之间的空间减少,这会增加肩袖肌腱在肩部活动过程中与肩峰的摩擦和冲突。这种持续的摩擦可能导致手术后肩袖的修复组织更容易发生磨损和再撕裂。 肌腱压迫:较小的肩肱距可能导致肌腱被压迫,特别是在肩部进行上举等活动时。持续的压迫不仅增加肌腱磨损的机会,也可能影响肌腱的血液供应,从而影响其愈合能力。 生物力学改变:肩肱距的减小通常与肩部的生物力学功能失调相关,如肌肉不平衡或结构异常,这些问题可能会加剧手术区的应力,使得修复组织更易于撕裂。 较小的肩肱距取决于两个方面,一是肩峰下表面骨质增生(如Ⅱ型、Ⅲ型肩峰),二是由于肩袖巨大撕裂或肩袖质量差导致的肱骨头上移。因此,在手术前进行详细的影像学评估以测量肩肱距是非常重要的,这可以帮助预测术后的结果和潜在的再撕裂风险,同时医生应在手术中采取措施来尽可能恢复或增加肩肱距,例如通过肩袖修补下压肱骨头和适当的肩峰成形术去除肩峰下表面的骨质增生来减少肌腱和肩峰的摩擦。此外,术后康复计划中也应包含专门的练习,以增强周围肌肉群,改善肩部的生物力学状态,从而帮助维持或增加肩肱距。 2.2.2 临界肩角 临界肩角是通过测量肩胛骨的外侧延伸角度与肩峰下角度的综合来计算的(图4),它反映了肩峰和肩关节腔的相对位置关系,由MOOR等[27-28]提出,临界肩角是结合了肩峰关节盂倾角和肩关节横向延伸的放射学参数。"
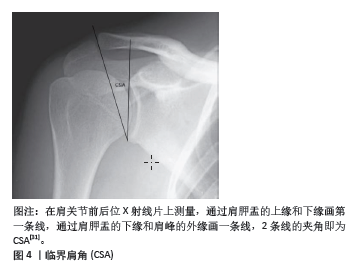
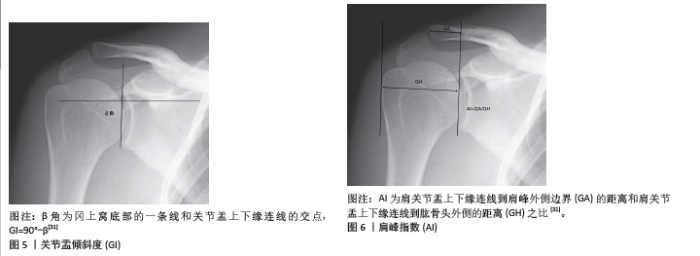
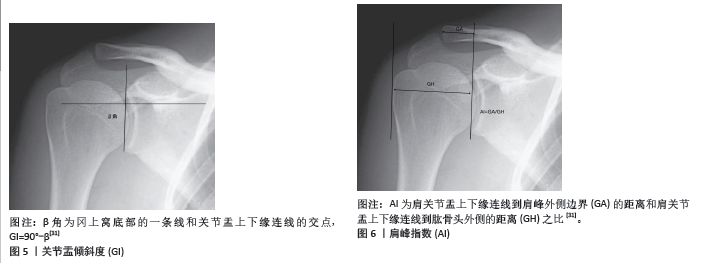
临界肩角对肩袖修复手术后撕裂率的影响是一个有争议的话题,研究显示了不同的结果。一些研究表明,较大的临界肩角会增加手术后复发的风险。例如,LIU等[29]在一项研究中发现再撕裂组平均临界肩角大于愈合组。OPSOMER等[30]研究发现,临界肩角> 35°的患者,ARCR术后发生肩袖再撕裂的风险是临界肩角正常患者的5倍。同样的,SCHEIDERER 等[31]指出,临界肩角较高的患者术后6个月再撕裂的风险增加了4倍。研究表明临界肩角> 38°的患者术后发生再撕裂的风险比临界肩角< 38°的患者高15倍[32-34]。此外,一项关注肩峰成形术对临界肩角影响的研究发现,与前外侧肩峰成形术相比,外侧肩峰成形术可显著降低临界肩角,提示手术技术调整可以降低与临界肩角升高相关的一些风险[35]。较大的临界肩角通常意味着肩峰更向外侧或更垂直,这可能导致肩袖(特别是肩旋转肌群)在肩部活动时承受更大的力量和剪切力,这种力量的增加可能导致手术后修复的肩袖组织更容易撕裂[36]。有研究指出,临界肩角的大小直接影响肩袖肌腱,特别是冈上肌肌腱在肩部活动中的负载[37]。一个较大的临界肩角会增加冈上肌在举臂时的张力,从而增加肌腱的负担和撕裂的风险。更大的临界肩角还可能反映了肩峰的解剖学变异[35],如肩峰类型或是肩峰下骨质增生等,这些变异可能导致对肩袖的机械磨损,尤其是在反复的或高强度的肩部活动中。但也有研究提出不同的观点,CAFFARD等[26]的研究表明临界肩角并不会影响冈上肌修补后的再撕裂率,临界肩角不是术后发生再撕裂的预测因素。在一项回顾性研究中,COMO等[33]共回顾了164例肩袖撕裂患者,术后再撕裂的患者与术后肩袖完整的患者相比临界肩角没有显著差异。对于上述研究中存在的争议性结果,可能与术后影像评估方式、随访时间长短不一、年龄、术前撕裂大小和手术技术等其他因素的限制等因素有关[37]。上述研究中,部分研究于术后采用了超声评估肩袖肌腱的完整性,也有研究基于Sugaya分类方法在MRI上评估肩袖肌腱完整性,随访时间从6个月到8年不等。总体而言,虽然在一些研究中,较高的临界肩角与肩袖撕裂和再撕裂的风险增加有关,但临界肩角对术后再撕裂率的综合影响受多种因素的影响,包括手术技术和个体患者特征。手术计划必须考虑这些方面,以优化患者的治疗结果。 2.2.3 关节盂倾斜度 关节盂倾斜度是描述肩关节盂与肩胛骨的相对角度,这个角度影响肩关节的稳定性及肱骨头的位置(图5)。有研究发现术后再撕裂的患者关节盂倾斜度变化程度显著大于未再撕裂组[38]。2项研究表明,关节盂倾斜度 > 14°的患者术后再撕裂率增加了5-15倍,即高关节盂倾斜度显著增加了ARCR术后再撕裂风 险[32,39]。关节盂倾斜度对肩袖修补术后再撕裂率的影响也是通过影响肩部的生物力学环境来实现的。 关节盂倾斜与肩袖压力:较大的关节盂倾斜度可能导致肱骨头在肩袖内的位置更为上移,这种位置的变化可能增加肩袖特别是冈上肌肌腱的压力,从而在手术后增加肌腱撕裂的风险[40]。 肩关节稳定性:关节盂的角度还会影响肩关节的整体稳定性[41-42]。不正常的倾斜可能导致关节不稳,增加肩袖修复后的机械应力,这些应力可能导致修复的肌腱更容易撕裂。 生物力学调整:有研究建议,通过手术或非手术方法调整关节盂倾斜度,可能有助于减少肩袖修复后再撕裂的风险。例如,使用特定的术式或肩部支撑设备来调整肩关节的生物力学环境,从而减轻肩袖的负担。 总之,关节盂倾斜度是一个重要的解剖学参数,它通过影响肩部的力学环境间接影响肩袖修复后的再撕裂风险。在进行肩袖修复手术时,考虑这一参数的评估和可能的调整对于优化手术结果和减少再撕裂风险具有重要意义。 2.2.4 肩峰指数 肩峰指数是关节盂上下缘到肩峰最外侧缘的距离与关节盂上下缘到肱骨头最外侧的距离之比,代表肩关节的侧向延伸,是评估肩峰相对于肱骨头大小的一个影像学指标(图6)。OPSOMER等[30]研究发现,肩峰指数≥0.75的患者ARCR术后再撕裂风险会增加6倍。SCHEIDERER等[31]在一项研究中发现,术后肩袖完整的患者平均肩峰指数为0.69,发生再撕裂的患者平均肩峰指数为0.73,再撕裂组肩峰指数显著高于完整组。LI等[43]的研究发现,肩峰指数> 0.7的67例患者中有9例术后发生再撕裂,而对照组23例中无再撕裂发生。研究发现临界肩角、肩峰指数对中小型撕裂单排缝合术后发生再撕裂的预测具有很高的预测价值[44]。肩峰指数较高表明肩峰较为突出,这可能增加了下方肩袖组织的挤压和磨损,从而导致肩袖的退变或撕裂。在手术后,这种解剖特征可能导致肩袖修复区的压力增加,从而增加了再撕裂的风险。肩峰指数较高的患者在肩袖修补术后可能需要更长时间的恢复和更为谨慎的康复计划,以减少肩部的负担和避免过早的活动导致修复组织损伤。"

2.3 肩袖质量 2.3.1 脂肪浸润 纤维成脂祖细胞是存在于肌肉纤维间隙的干细胞群,在肩袖肌肉发生撕裂尤其是慢性肩袖撕裂时纤维成脂祖细胞的细胞标记物如CCAAT增强子结合蛋白α和过氧化物酶体增殖物激活受体γ表达水平增加,纤维成脂祖细胞很容易转化为脂肪细胞,发生脂肪浸润,脂肪浸润通常从这些肌肉的肌腱附着点开始,逐渐向肌肉纤维本身扩展[45]。FEELEY等[46]研究发现,肩袖脂肪浸润和纤维成脂祖细胞数量随撕裂大小和厚度的增加而增加脂肪浸润导致的肌肉质量下降,意味着修复组织的整体质量也较差,这种退化改变了肌肉的结构和力学特性,减少了肌肉的弹性和收缩能力。在手术过程中,需要施加较大的拉力将撕裂的肌腱带到肱骨足印区,修复后肌肉的弹性和收缩能力差很可能导致肩袖肌肉和肌腱之间产生缝隙而发生再撕裂,故脂肪浸润很大程度上影响术后的再撕裂率[47-48]。另外有研究表明ARCR术后再撕裂的患者术前冈上肌、冈下肌及小圆肌的脂肪浸润程度均高于术后未再撕裂的患者[49]。CAFFARD等[26]研究发现肩肱距较小以及肩峰斜率较大者的脂肪浸润程度更为严重。所以术者均应在术前和术后进行MRI检查,对脂肪浸润程度常规进行Goutallie分期评估,高度的脂肪浸润可能会影响手术方法的选择,例如在有显著脂肪浸润的情况下,医生可能会考虑更保守的治疗策略或修改手术技术以适应组织的质量,这对患者的预后以及康复均有指导意义。 2.3.2 肌肉萎缩 NAKAMURA等[49]认为ARCR术后再撕裂患者的冈上肌、冈下肌及小圆肌在初次修补术前的萎缩程度明显高于术后无再撕裂的患者。GLADSTONE等[50]发现,肌肉萎缩和脂肪浸润的增加是肩关节功能评分变差的预测因素,ARCR术后脂肪浸润和肌肉萎缩没有发生逆转,并且中度或重度脂肪浸润和肌肉萎缩的再撕裂率为67%-70%,而无或轻度脂肪浸润和肌肉萎缩的再撕裂率为22%-29%。 肌肉萎缩通常意味着肌肉力量和耐力的降低。肩袖肌群的萎缩减少了肌肉支持肩关节的能力,增加了手术修复的肌腱在日常活动中承受过度负荷的风险。肌肉萎缩可能导致与肌腱连接的肌肉纤维减少,这影响了手术后肌腱的愈合质量和强度。萎缩的肌肉可能不足以支持手术修复的肌腱,从而增加了撕裂的可能性。同时,肌肉萎缩影响术后康复过程,由于肌肉强度的减少,患者可能需要更长时间的康复训练来重建肌肉力量和功能,同时康复的难度也相应增加。 肌肉萎缩严重的患者在手术后可能面临功能恢复不全的问题,这不仅限于肌肉力量的恢复,还包括关节的活动范围和日常活动的能力。 2.3.3 撕裂面积 较大的撕裂和复杂形状的撕裂(例如“L形”“U形”或“反L形”)通常与更高的再撕裂率相关联。这是因为越大的撕裂原始肌腱与骨头之间的应力越大,这增加了修复后肌腱骨长入失败的风险,并且愈合过程中的应力分布不均。大面积的撕裂也可能涉及到更多的肌腱组织,使得彻底的修复更加困难。撕裂面积较大的情况下,血液供应可能不足,影响愈合过程。大面积撕裂可能伴随着组织质量的下降,如肌腱退化或变性,这会进一步影响愈合能力。 GUO等[51]在一项研究中发现,撕裂面积大于4 cm2的患者在术后6周的再撕裂率明显升高,撕裂面积> 6 cm2术后再撕裂率较撕裂面积≤1 cm2的患者显著增加。TOKUNAGA等[5]发现较大的撕裂在愈合过程中对肌腱和锚固点施加了更大的力,这种增加的力可能导致修复不稳定,增加再撕裂的风险。GUO等[52]研究发现Patte Ⅲ度回缩是术后再撕裂的独立危险因素。 大面积撕裂的患者术后康复相对复杂,患者需要更为严格和个性化的康复计划,包括逐步增加的运动强度和范围。如果康复计划不当或患者不遵循康复方案,可能导致再撕裂。大面积撕裂后,肩袖肌肉的力量和柔韧性可能受到更大影响,需要更多的时间和训练来恢复。如果这些因素未能恢复到足够水平,会导致再撕裂的风险增加。 2.3.4 撕裂厚度 有研究证实了肩袖肌腱撕裂厚度与再撕裂呈正相关,浅表撕裂(涉及肌腱表面)和深部撕裂(接近肌腱底部)通常比全厚度撕裂更容易愈合,因为未完全断裂的肌腱仍然有一定的结构完整性和血液供应,部分撕裂康复时间相对较短,功能恢复较快,再撕裂的风险相对较低。 部分厚度撕裂可以通过保守治疗(如物理治疗、药物治疗)或微创手术修复,治疗效果通常较好,而全厚度撕裂的康复时间较长,功能恢复较慢,通常需要手术修复,如缝合、移植等,术后需要严格的康复计划,再撕裂的风险相对较高。 2.3.5 回缩程度 肩袖撕裂的回缩程度(retraction)是指肌腱撕裂后,受伤肌腱从原来的附着点回缩的距离,这种回缩可以影响肩袖修补术后的再撕裂率。研究发现,L型撕裂患者平均撕裂回缩长度显著高于反L型撕裂,36例L型撕裂患者中术后9例出现再撕裂,而反L型患者没有出现再撕裂[53]。肌腱回缩越严重,术中将其拉回到正常位置并固定的难度就越大,肌腱在被拉伸到原始长度时可能会产生较高的张力,这种张力可以增加术后肌腱撕裂的风险[54]。肌腱的回缩通常伴随着肌腱内的脂肪浸润增加和肌肉纤维变性,这些改变可能降低肌腱的生物力学特性,使得修补后的肌腱更易于再次撕裂。此外,良好的血液供应是组织修复和愈合的关键因素之一,长时间的肌腱回缩可能影响肌腱的血液供应,进而影响肌腱的愈合能力。回缩程度较高的肌腱在手术修复后,即使愈合也可能因为肌腱长度和张力的变化而导致肩关节的活动范围和功能受限[55],同时由于肌腱张力发生变化,其下压肱骨头的力量也会减弱,导致肩肱距减小,从而影响整体的手术效果。在进行肩袖修补术前,对肌腱回缩的程度进行评估是非常重要的。手术策略的选择和术后康复计划的制定都应该考虑到回缩程度的影响,以降低再撕裂的风险并优化手术结果。 2.4 术后康复 术后部分患者会因术后肩关节支具固定出现肩关节僵硬[56]。目前流行的肩袖手术后早期的康复方法主要有两种:第一种是加速康复,即允许早期运动,努力减少术后僵硬;第二种是传统康复方案,建议术后进行6-8周的固定治疗,以保护肌腱的完整性。NIKOLAIDOU等[57]研究发现上述两种康复方法术后再撕裂无统计学差异。HOTTA等[58]研究发现患者连续进行8周的肩胛周围肌肉加强训练与进行肩胛稳定化训练的患者相比,加强训练的患者并没有获得更佳的肩部肌肉力量和活动度。GUO 等[51] 在一项研究中发现术后6周肩关节僵硬患者与非肩关节僵硬患者相比,再撕裂率更低。同样的,MCNAMARA等[59]报道,术后早期肩关节活动度差与肩袖腱-骨愈合的改善有关,更不易发生再撕裂,这可能与术后活动度下降减少了对修复的肌腱的牵拉,从而加速了腱骨愈合有关。有些研究表明肩袖修补后的早期运动可改善活动度,康复过程中适度的活动还可以促进血液循环,增加修复区域的血液供应,有助于肌腱和周围软组织的愈合,但过早或过度的康复方式会增加肩袖再撕裂的风险[51,59-60]。因此,术后康复计划还应包括适当的休息和逐步恢复活动的策略,避免过早或过度使用手术肩部,这些都是导致再撕裂的常见原因。 2.5 肩袖撕裂类型 2.5.1 撕裂病因分类 肩袖撕裂按照病因可分为创伤性撕裂和退行性撕裂,50岁之前很少发生全层撕裂[61-62],因此中年患者创伤可能会加剧已经存在的退行性撕裂,从而发生症状明显的退行性撕裂。 MALL等[63]研究发现创伤性撕裂多发生于54岁左右的男性,原因可能是从事重体力劳动的男性比女性多,更易受到创伤,受伤机制大都为手臂伸展位摔倒[64]。退行性撕裂大部分都发生在具有Ⅱ、Ⅲ型肩峰的患者中,由于长期反复撞击肩峰发生的撕裂。HAVIV等[65]研究发现,创伤性撕裂术前出现大面积冈上肌肌腱撕裂的比例是退行性撕裂的2倍,退行性撕裂的患者术后平均恢复时间比创伤性撕裂的患者短,再撕裂的概率比创伤性撕裂的患者低。 2.5.2 撕裂类型分类 文献指出,全层撕裂的再撕裂风险较部分撕裂高,特别是如果撕裂面积较大或修复质量不佳。 折叠肩袖撕裂,又被称为“肩袖折叠”,是肩袖撕裂部分撕裂的一种。在这种撕裂中,肩袖的肌腱部分被撕裂并向后折叠,这种情况常常导致肩袖组织重叠或卷曲,由于撕裂部分可能向内或向外折叠,导致肌腱的正常解剖结构被破坏以及肌腱张力异常。JEONG等[66]研究发现,折叠肩袖撕裂患者肩袖肌腱的质量较差且术后再撕裂率较普通部分撕裂更高。 2.6 手术时机 研究表明,肩袖撕裂ARCR术后的再撕裂率受到手术时机影响,选择适当的手术时机可以显著影响术后恢复的结果和再撕裂的风险[67]。REES[68]研究发现对保守治疗3-6个月无效的患者,应尽早行手术治疗,如果撕裂较长时间未治疗,未修复的肌腱可能会发生回缩和脂肪浸润,肌腱组织质量下降,导致修复更加困难,愈合质量下降,从而增加再撕裂的风险。有研究表明创伤性肩袖撕裂在伤后6个月内手术比在伤后6个月之后手术的患者有更低的再撕裂率[65]。FINGER等[69]研究发现,症状出现1年内行ARCR与1年之后接受手术的非创伤性撕裂患者的再撕裂率无显著差异,延迟手术治疗1年或更长时间似乎不会显著影响术后结果;然而,在1年内进行修复的患者术后冈上肌力量增加的可能性更大。张清等[70]发现Ⅲ型肩峰、临界肩角≥35°、脂肪浸润分级高、高龄等是保守治疗无效的危险因素,对于此类患者应考虑早期手术治疗。此外肩袖肌腱在撕裂后可能会出现退化和变性,包括胶原纤维的排列紊乱、纤维化和钙化,这些变化会降低肌腱的强度和弹性,如果长时间不给予治疗,其更容易再次撕裂。 对于活跃的年轻患者或那些对肩部功能有较高要求的人来说肌腱质量和愈合能力通常比老年患者好,因此对于此类患者而言,即使稍后进行手术,恢复的结果也比较乐观。手术时机的选择应考虑患者的特定情况和撕裂的具体特点,以期达到最佳的手术结果和最小的再撕裂风险。在多数情况下,及早进行手术会有助于保持肌腱的质量和功能,从而减少未来复发的风险。"

| [1] ZHAO J LUO M, PAN J, et al. Risk factors affecting rotator cuff retear after arthroscopic repair: a meta-analysis and systematic review. J Shoulder Elbow Surg. 2021;30(11):2660-2670. [2] IANNOTTI JP, DEUTSCH A, GREEN A, et al. Time to failure after rotator cuff repair: a prospective imaging study. J Bone Joint Surg Am. 2013; 95(11):965-971. [3] LONG Z, NAKAGAWA K, WANG Z, et al. Age-related cellular and microstructural changes in the rotator cuff enthesis. J Orthop Res. 2022;40(8):1883-1895. [4] JO CH, SHIN WH, PARK JW, et al. Degree of tendon degeneration and stage of rotator cuff disease. Knee Surg Sports Traumatol Arthrosc. 2017;25(7):2100-2108. [5] TOKUNAGA T, KARASUGI T, TANIMURA S, et al. Association of Severe Histological Degeneration of the Torn Supraspinatus Tendon and Retear After Arthroscopic Repair of Full-Thickness Rotator Cuff Tears Using the Suture Bridge Technique. Am J Sports Med. 2023;51(9):2411-2421. [6] 庄鳌,黄长明,董辉详,等.影响肩袖术后再撕裂相关因素及研究进展[J]. 中国矫形外科杂志,2023,31(2):140-144. [7] ERSEN A, SAHIN K, ALBAYRAK MO. Older age and higher body mass index are independent risk factors for tendon healing in small- to medium-sized rotator cuff tears. Knee Surg Sports Traumatol Arthrosc. 2023;31(2):681-690. [8] KHAZZAM M, SAGER B, BOX HN, et al. The effect of age on risk of retear after rotator cuff repair: a systematic review and meta-analysis. JSES Int. 2020;4(3):625-631. [9] DIEBOLD G, LAM P, WALTON J, et al. Relationship Between Age and Rotator Cuff Retear: A Study of 1,600 Consecutive Rotator Cuff Repairs. J Bone Joint Surg Am. 2017;99(14):1198-1205. [10] PARK HB, GWARK JY, KWACK BH, et al. Hypo-High-Density Lipoproteinemia Is Associated With Preoperative Tear Size and With Postoperative Retear in Large to Massive Rotator Cuff Tears. Arthroscopy. 2020;36(8):2071-2079. [11] SCIORATI C, CLEMENTI E, MANFREDI AA, et al. Fat deposition and accumulation in the damaged and inflamed skeletal muscle: cellular and molecular players. Cell Mol Life Sci. 2015;72(11):2135-2156. [12] LEE S, LEE N, SHIN SJ, et al. Relationship of Missed Statin Therapy and 10-Year Atherosclerotic Cardiovascular Disease Risk Score to Retear Rate After Arthroscopic Rotator Cuff Repair. Am J Sports Med. 2023; 51(8):1988-1996. [13] KIM YK, JUNG KH, KIM JW. Factors affecting rotator cuff integrity after arthroscopic repair for medium-sized or larger cuff tears: a retrospective cohort study. J Shoulder Elbow Surg. 2018;27(6):1012-1020. [14] KIM MS, RHEE SM, CHO NS. Increased HbA1c Levels in Diabetics During the Postoperative 3-6 Months After Rotator Cuff Repair Correlated With Increased Retear Rates. Arthroscopy. 2023;39(2):176-182. [15] CHUNG SW, OH JH, GONG HS, et al. Factors affecting rotator cuff healing after arthroscopic repair: osteoporosis as one of the independent risk factors. Am J Sports Med. 2011;39(10):2099-2107. [16] PIETSCHMANN MF, FROHLICH V, FICKLSCHERER A, et al. Suture anchor fixation strength in osteopenic versus non-osteopenic bone for rotator cuff repair. Arch Orthop Trauma Surg. 2009;129(3):373-379. [17] TINGART MJ, APRELEVA M, LEHTINEN J, et al. Anchor design and bone mineral density affect the pull-out strength of suture anchors in rotator cuff repair: which anchors are best to use in patients with low bone quality? Am J Sports Med. 2004;32(6):1466-1473. [18] DENARD PJ, BURKHART SS. Techniques for managing poor quality tissue and bone during arthroscopic rotator cuff repair. Arthroscopy. 2011; 27(10):1409-1421. [19] LEE JH, YOON JY, LEE YB. The Use of Intravenous Zoledronate May Reduce Retear Rate after Rotator Cuff Repair in Older Female Patients with Osteoporosis: A First In-Human Prospective Study. J Clin Med. 2022;11(3):836. [20] LEI M, ZHU Z, HU X, et al. Postoperative Antiosteoporotic Treatment with Zoledronic Acid Improves Rotator Cuff Healing but Does Not Improve Outcomes in Female Patients with Postmenopausal Osteoporosis: A Prospective, Single-Blinded, Randomized Study. Arthroscopy. 2024;40(3):714-722. [21] SHAH SA, KORMPAKIS I, HAVLIOGLU N, et al. Sclerostin Antibody Treatment Enhances Rotator Cuff Tendon-to-Bone Healing in an Animal Model. J Bone Joint Surg Am. 2017;99(10):855-864. [22] KIM DM, JEON IH, YANG HS, et al. Poor Prognostic Factors in Patients With Rotator Cuff Retear. Orthop J Sports Med. 2021;9(4): 2325967121992154. [23] CORBAN J, SHAH S, RAMAPPA AJ. Current Evidence Based Recommendations on Rehabilitation following Arthroscopic Shoulder Surgery: Rotator Cuff, Instability, Superior Labral Pathology, and Adhesive Capsulitis. Curr Rev Musculoskelet Med. 2024;17(7):247-257. [24] LEE JS, SUH KT, SHIN WC, et al. Socioeconomic and Other Risk Factors for Retear after Arthroscopic Surgery for Nontraumatic Rotator Cuff Tear. Medicina (Kaunas). 2024;60(4):640. [25] SANGUANJIT P, APIVATGAROON A, BOONSUN P, et al. The differences of the acromiohumeral interval between supine and upright radiographs of the shoulder. Sci Rep. 2022;12(1):9404. [26] CAFFARD T, KRALEWSKI D, LUDWIG M, et al. High Acromial Slope and Low Acromiohumeral Distance Increase the Risk of Retear of the Supraspinatus Tendon After Repair. Clin Orthop Relat Res. 2023;481(6): 1158-1170. [27] MOOR BK, BOUAICHA S, ROTHENFLUH DA, et al. Is there an association between the individual anatomy of the scapula and the development of rotator cuff tears or osteoarthritis of the glenohumeral joint?: A radiological study of the critical shoulder angle. Bone Joint J. 2013; 95-B(7): 935-941. [28] DIETRICH TJ, MOOR BK, PUSKAS GJ, et al. Is the lateral extension of the acromion related to the outcome of shoulder injections? European Radiology. 2015;25(1):267-273. [29] LIU T, ZHANG M, YANG Z, et al. Does the critical shoulder angle influence retear and functional outcome after arthroscopic rotator cuff repair? A systematic review and meta-analysis. Arch Orthop Trauma Surg. 2023;143(5):2653-2663. [30] OPSOMER GJ, VERSTUYFT L, MUERMANS S. Long-term follow-up of patients with a high critical shoulder angle and acromion index: is there an increased retear risk after arthroscopic supraspinatus tendon repair? JSES Int. 2020;4(4):882-887. [31] SCHEIDERER B, IMHOFF FB, JOHNSON JD, et al. Higher Critical Shoulder Angle and Acromion Index Are Associated With Increased Retear Risk After Isolated Supraspinatus Tendon Repair at Short-Term Follow Up. Arthroscopy. 2018;34(10):2748-2754. [32] GARCIA G., LIU JN, DEGEN RM, et al. Higher critical shoulder angle increases the risk of retear after rotator cuff repair. J Shoulder Elbow Surg. 2017;26(2):241-245. [33] COMO CJ, HUGHES JD, LESNIAK BP, et al. Critical shoulder angle does not influence retear rate after arthroscopic rotator cuff repair. Knee Surg Sports Traumatol Arthrosc. 2021;29(12):3951-3955. [34] 陈俊,楼珏翔,申屠国建,等.肩关节峰盂角对肩袖撕裂修补术后再撕裂的影响[J]. 中国运动医学杂志,2022,41(6):423-429. [35] KAISER D, BACHMANN E, GERBER C, et al. Influence of the site of acromioplasty on reduction of the critical shoulder angle (CSA) - an anatomical study. BMC Musculoskelet Disord. 2018;19(1):371. [36] HAECKER AM, CONTRERAS J, VALENZUELA A, et al. Critical shoulder angle and failure of conservative treatment in patients with atraumatic full thickness rotator cuff tears. BMC Musculoskelet Disord. 2022; 23(1):561. [37] LONGO UG, CARNEVALE A, PIERGENTILI I, et al. Retear rates after rotator cuff surgery: a systematic review and meta-analysis. BMC Musculoskelet Disord. 2021;22(1):749. [38] KIM JH, MIN YK, KIM DY, et al. Evaluation of Scapula and Humerus Bone Change after Repair of Small- to Medium-Sized Rotator Cuff Tears: Comparison between Healing and Retear Groups Using Three-Dimensional Computed Tomography. Clin Orthop Surg. 2022;14(4):564-575. [39] SHI X, XU Y, DAI B, et al. Effect of different geometrical structure of scapula on functional recovery after shoulder arthroscopy operation. J Orthop Surg Res. 2019;14(1):312. [40] FLIEG NG, GATTI CJ, DORO LC, et al. A stochastic analysis of glenoid inclination angle and superior migration of the humeral head. Clin Biomech (Bristol, Avon). 2008;23(5):554-561. [41] ITOI E, MOTZKIN NE, MORREY BF, et al. Scapular inclination and inferior stability of the shoulder. J Shoulder Elbow Surg. 1992;1(3):131-139. [42] BOUAICHA S, KUSTER RP, SCHMID B, et al. Biomechanical analysis of the humeral head coverage, glenoid inclination and acromio-glenoidal height as isolated components of the critical shoulder angle in a dynamic cadaveric shoulder model. Clin Biomech. 2020;72:115-121. [43] LI H, CHEN Y, CHEN J, et al. Large Critical Shoulder Angle Has Higher Risk of Tendon Retear After Arthroscopic Rotator Cuff Repair. Am J Sports Med. 2018;46(8):1892-1900. [44] 苑博,田明, 张绍龙,等. 解剖因素对中小型肩袖修补术后再撕裂率的预测价值[J] 中华骨科杂志,2023,43(18):1193-1200. [45] AGHA O, DIAZ A, DAVIES M, et al. Rotator cuff tear degeneration and the role of fibro-adipogenic progenitors. Ann N Y Acad Sci. 2021; 1490(1):13-28. [46] FEELEY BT, LIU M, MA CB, et al. Human Rotator Cuff Tears Have an Endogenous, Inducible Stem Cell Source Capable of Improving Muscle Quality and Function After Rotator Cuff Repair. The Am J Sports Med. 2020;48(11):2660-2668. [47] GIAMBINI H, HATTA T, REZAEI A, et al. Extensibility of the supraspinatus muscle can be predicted by combining shear wave elastography and magnetic resonance imaging-measured quantitative metrics of stiffness and volumetric fat infiltration: A cadaveric study. Clin Biomech (Bristol, Avon). 2018;57:144-149. [48] 丁明,张春礼. 肩袖撕裂后脂肪浸润对肩袖再撕裂的影响[J]. 中国微创外科杂志,2019,19(1):68-71. [49] NAKAMURA H, GOTOH M, MITSUI Y, et al. Factors Affecting Clinical Outcome in Patients With Structural Failure After Arthroscopic Rotator Cuff Repair. Arthroscopy. 2016;32(5):732-739. [50] GLADSTONE JN, BISHOP JY, LO IK, et al. Fatty infiltration and atrophy of the rotator cuff do not improve after rotator cuff repair and correlate with poor functional outcome. Am J Sports Med. 2007;35(5):719-728. [51] GUO AA, STITZ DJ, LAM P, et al. Tear Size and Stiffness Are Important Predictors of Retear: An Assessment of Factors Associated with Repair Integrity at 6 Months in 1,526 Rotator Cuff Repairs. JB JS Open Access. 2022;7(3):e22.00006. [52] GUO S, ZHU Y, SONG G, et al. Assessment of Tendon Retraction in Large to Massive Rotator Cuff Tears: A Modified Patte Classification Based on 2 Coronal Sections on Preoperative Magnetic Resonance Imaging With Higher Specificity on Predicting Reparability. Arthroscopy. 2020;36(11):2822-2830. [53] LEE KJ, KIM YT, CHOI M, et al. Characteristics and outcomes of L-shaped and reverse L-shaped rotator cuff tears. Bone Joint J. 2022;104-B(3): 394-400. [54] NOVI M, KUMAR A, PALADINI P, et al. Irreparable rotator cuff tears: challenges and solutions. Orthop Res Rev. 2018;10:93-103. [55] ESCAMILLA RF, YAMASHIRO K, PAULOS L, et al. Shoulder muscle activity and function in common shoulder rehabilitation exercises. Sports Med. 2009;39(8):663-685. [56] 关晨炜. 肩袖撕裂后继发关节僵硬的影响因素初步分析[D].承德:承德医学院,2022:39. [57] NIKOLAIDOU O, MIGKOU S, KARAMPALIS C. Rehabilitation after Rotator Cuff Repair. Open Orthop J. 2017;11:154-162. [58] HOTTA GH, COUTO AGDA, COOLS AM, et al. Effects of adding scapular stabilization exercises to a periscapular strengthening exercise program in patients with subacromial pain syndrome: A randomized controlled trial. Musculoskelet Sci Pract. 2020;49:102171. [59] MCNAMARA WJ, LAM PH, MURRELL GA. The Relationship Between Shoulder Stiffness and Rotator Cuff Healing: A Study of 1,533 Consecutive Arthroscopic Rotator Cuff Repairs. J Bone Joint Surg Am. 2016;98(22):1879-1889. [60] HOUCK DA, KRAEUTLER MJ, SCHUETTE HB, et al. Early Versus Delayed Motion After Rotator Cuff Repair: A Systematic Review of Overlapping Meta-analyses. Am J Sports Med. 2017;45(12):2911-2915. [61] YAMAGUCHI K, DITSIOS K, MIDDLETON WD, et al. The demographic and morphological features of rotator cuff disease. A comparison of asymptomatic and symptomatic shoulders. J Bone Joint Surg Am. 2006; 88(8):1699-1704. [62] YAMAMOTO A, TAKAGISHI K, OSAWA T, et al. Prevalence and risk factors of a rotator cuff tear in the general population. J Shoulder Elbow Surg. 2010;19(1):116-120. [63] MALL NA, LEE AS, CHAHAL J, et al. An evidenced-based examination of the epidemiology and outcomes of traumatic rotator cuff tears. Arthroscopy. 2013;29(2):366-376. [64] BJORNSSON HC, NORLIN R, JOHANSSON K, et al. The influence of age, delay of repair, and tendon involvement in acute rotator cuff tears: structural and clinical outcomes after repair of 42 shoulders. Acta Orthop. 2011;82(2):187-192. [65] HAVIV B, RUTENBERG TF, BRONAK S, et al. Arthroscopic rotator cuff surgery following shoulder trauma improves outcome despite additional pathologies and slow recovery. Knee Surg Sports Traumatol Arthrosc. 2018;26(12):3804-3809. [66] JEONG HJ, KIM HS, RHEE SM, et al. Risk factors for and prognosis of folded rotator cuff tears: a comparative study using propensity score matching. J Shoulder Elbow Surg. 2021;30(4):826-835. [67] MELIS B, DEFRANCO MJ, CHUINARD C, et al. Natural history of fatty infiltration and atrophy of the supraspinatus muscle in rotator cuff tears. Clin Orthop Relat Res. 2010;468(6):1498-1505. [68] REES JL. The pathogenesis and surgical treatment of tears of the rotator cuff. J Bone Joint Surg Br. 2008;90(7):827-832. [69] FINGER L, DUNN R, HUGHES J, et al. Clinical outcomes secondary to time to surgery for atraumatic rotator cuff tears. J Shoulder Elbow Surg. 2022;31(6S):S18-S24. [70] 张清,向明,李一平,等. 肩袖损伤保守治疗失败的危险因素分析[J]. 中华肩肘外科电子杂志,2022,10(2):129-134. |
| [1] | Ran Yaqin, Chen Xi, Xie Yanne, Yuan Jun. Mechanism and potential application strategies of pyroptosis in breast cancer treatment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7880-7888. |
| [2] | Wen Huawei, Zhang Qingsong, Tang Ming, Li Yanan, Tan Hongfei, Fang Yushun. Effects of platelet-derived growth factor-DD on proliferation and multilineage differentiation of human tendon-derived stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(31): 6649-6655. |
| [3] | Yu Qinghe, Cai Ziming, Wu Jintao, Ma Pengfei, Zhang Xin, Zhou Longqian, Wang Yakun, Lin Xiaoqin, Lin Wenping. Vanillic acid inhibits inflammatory response and extracellular matrix degradation of endplate chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6391-9397. |
| [4] | Fan Jiaxin, Jia Xiang, Xu Tianjie, Liu Kainan, Guo Xiaoling, Zhang Hui, Wang Qian . Metformin inhibits ferroptosis and improves cartilage damage in osteoarthritis model rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6398-6408. |
| [5] | Zhou Ying, Tian Yong, Zhong Zhimei, Gu Yongxiang, Fang Hao. Inhibition of tumor necrosis factor receptor associated factor 6 regulates mTORC1/ULK1 signaling and promotes autophagy to improve myocardial injury in sepsis mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6434-6440. |
| [6] | Wang Wanchun, , Yi Jun, Yan Zhangren, Yang Yue, Dong Degang, Li Yumei. 717 Jiedu Decoction remodels homeostasis of extracellular matrix and promotes repair of local injured tissues in rats after Agkistrodon halys bite [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6457-6465. |
| [7] | Zhang Xin, Guo Baojuan, Xu Huixin, Shen Yuzhen, Yang Xiaofan, Yang Xufang, Chen Pei. Protective effects and mechanisms of 3-N-butylphthalide in Parkinson’s disease cell models [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6466-6473. |
| [8] | Zhang Songjiang, Li Longyang, Zhou Chunguang, Gao Jianfeng. Central anti-inflammatory effect and mechanism of tea polyphenols in exercise fatigue model mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6474-6481. |
| [9] | Hu Shujuan, Liu Dang, Ding Yiting, Liu Xuan, Xia Ruohan, Wang Xianwang. Ameliorative effect of walnut oil and peanut oil on atherosclerosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6482-6488. |
| [10] | Zhang Jian, Cai Feng, Li Tingwen, Ren Pengbo. Fatigue gait recognition of athletes based on fish swarm algorithm [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6489-6498. |
| [11] | Zhang Zihan¹, Wang Jiaxin¹, Yang Wenyi², Zhu Lei¹. Regulatory mechanism of exercise promoting mitochondrial biogenesis in skeletal muscle [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6499-6508. |
| [12] | Wang Jianxu, Dong Zihao, Huang Zishuai, Li Siying, Yang Guang. Interaction between immune microenvironment and bone aging and treatment strategies [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6509-6519. |
| [13] | Zhang Bochun, Li Wei, Li Guangzheng, Ding Haoqin, Li Gang, Liang Xuezhen, . Association between neuroimaging changes and osteonecrosis: a large sample analysis from UK Biobank and FinnGen databases [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6574-6582. |
| [14] | Xu Zhi, Chen Yundong, Sun Yujie, Gong Xiaonan, Li Yuwan. Data of spinal osteosarcoma patients in United States based on SEER database: construction and validation of a prediction model for treatment outcomes and prognosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6583-6590. |
| [15] | Zhao Xiaoxuan, Liu Shuaiyi, Xing Zheng, Li Qingwen, Chu Xiaolei, Li Qi. Research hotspots and trends in application of tissue engineering in peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6591-6600. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||