Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (2): 516-527.doi: 10.12307/2025.486
Previous Articles Next Articles
Functionalized biomimetic mineralized collagen modified orthopedic implants
Xu Wenhe, Li Xiaobing, Liu Fang
- Yueyang People’s Hospital, Yueyang 414399, Hunan Province, China
-
Received:2024-05-29Accepted:2024-08-17Online:2026-01-18Published:2025-07-03 -
Contact:Xu Wenhe, Yueyang People’s Hospital, Yueyang 414399, Hunan Province, China -
About author:Liu Fang, Yueyang People’s Hospital, Yueyang 414399, Hunan Province, China -
Supported by:Scientific Research Project of Hunan Provincial Health and Family Planning Commission, No. B2017236 (to LF)
CLC Number:
Cite this article
Xu Wenhe, Li Xiaobing, Liu Fang. Functionalized biomimetic mineralized collagen modified orthopedic implants[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 516-527.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
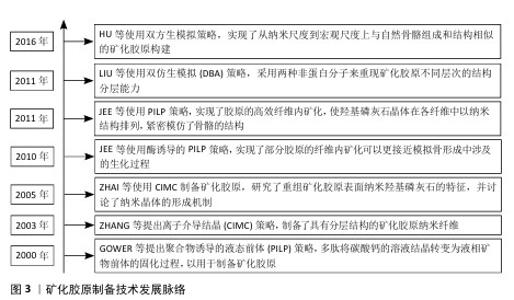
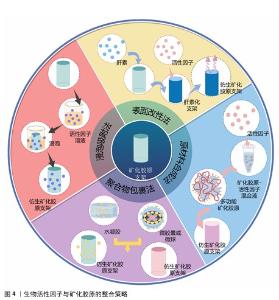
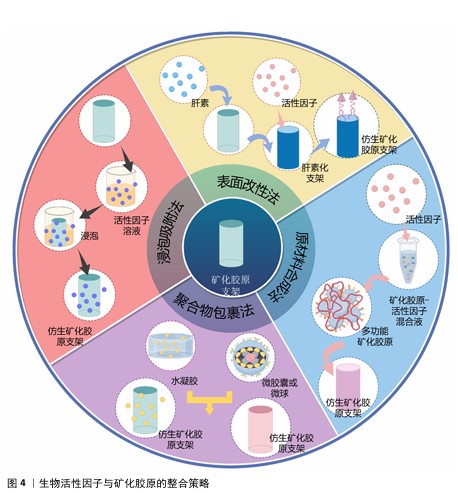
2.1 生物活性因子与矿化胶原的整合策略 矿化胶原作为一种理想的骨替代材料,已展现出在促进临界尺寸骨缺损修复方面的显著潜力(矿化胶原制备技术的发展历程见图3)。然而,针对更为复杂的骨缺损情况,如大节段骨缺损和感染性骨缺损等,其修复过程需要协调成血管、免疫调节、抗感染等多种功能,以期达到理想的治疗效果。为了强化BMC的功能性,生物活性因子的整合至关重要,这些生物活性因子与矿化胶原的结合方式不仅对因子的缓释效果产生影响,还可能对其生物活性造成影响。此外,随着生物活性因子的加入,矿化胶原中的羟基磷灰石含量、纳米结构、晶体形态等特性也可能发生变化。文章通过回顾相关文献,对功能化矿化胶原复合体系中活性因子与矿化胶原的结合方式进行了分类和分析,总结出4种主要的结合方式:浸泡吸附法、表面改性法、聚合物包裹法和原材料合成法(图4)。 "
2.1.1 浸泡吸附法 BMC是一种具有疏松多孔结构的生物纳米材料,其表面积较大,适合与蛋白质等生物分子进行相互作用。在体内,BMC显示出对骨形态发生蛋白2和血管内皮生长因子等关键生物活性因子的自然吸附和富集能力[12],同时,Ca2+和PO43-作为Ca-P表面的主要蛋白质结合部位,为蛋白质的吸附提供主要驱动力,并通过氢键或静电相互作用与生长因子的-OH、-NH2和-COOH基团结合。BMC吸附能力与羟基磷灰石的静电性能和磷酸钙的螯合能力密切相关[13]。羟基磷灰石的c平面带负电荷,而例如万古霉素这类药物的氨基被质子化后带正电荷,使其能够吸附在羟基磷灰石上[14]。双膦酸盐(Bisphosphonates)通过其膦酸基与钙离子间的螯合作用形成稳定的双齿结构与羟基磷灰石基质特异性结合,其R1和R2基团也能通过羟基或氢键与羟基磷灰石结合,进一步增加双方的结合亲和力[15]。这些特性使BMC成为理想的药物载体,能够保证生物活性因子的长期缓释,从而有效促进骨组织的修复。 BMC通过浸泡吸附法负载生长因子(如骨形态发生蛋白2和血管内皮生长因子)是一种常见的结合策略,这种方法通常伴有初期的突发释放和较高的累积释放量,这种突发释放为细胞增殖提供充足的刺激,并在早期阶段影响成骨分化[16]。然而,较高的初始释放可能会影响药物的持续释放时间和效果。该策略过程简单,对蛋白活性的影响较小,能够最大程度地降低结构设计的复杂性,便于临床应用的转化。 2.1.2 表面改性法 表面改性技术显著增强了BMC的表面活性,使其与生物活性因子形成稳定的结合。硫酸乙酰肝素作为骨细胞外基质的关键成分之一,其功能组分糖胺葡聚糖肝素是一种线性多糖,已证实能够促进体外培养的间充质基质细胞的增殖和成骨分化[17]。当肝素修饰用于生物材料时,它能特异性地结合生物活性因子并控制其释放,同时调节其活性[18]。与未经肝素修饰的BMC相比,肝素修饰的BMC可以实现生物活性因子的持续且受控释放[19]。通过调整肝素的掺杂量和修饰方式,可以有效地调控活性因子的释放速率,与单纯血管内皮生长因子相比,未经肝素修饰的BMC中血管内皮生长因子的生物活性有所降低,而经肝素修饰后血管内皮生长因子的生物活性基本保持不变。在肝素修饰的BMC中负载2种或以上生物活性因子时,虽然初期常伴有突发释放现象,但随后可实现持续释放,其缓释时间可长达6周,优于传统水凝胶的缓释效果[20]。不同的单因子和混合因子负载显示出不同的释放动力学特性,这归因于不同因子竞争支架上的自由结合部位,单个因子的结合效率可能因混合物中较高的蛋白含量而降低。因此,生物活性因子的结合和释放不仅取决于它们与支架之间的化学作用,而且还受到生物活性因子间相互作用的影响。 2.1.3 聚合物包裹法 生物活性因子在骨缺损部位的长效保留和控制释放是确保活性骨修复材料发挥其功能的前提和关键。通过浸渍吸附法负载生长因子的BMC植入体内后,其释放速率难以精确控制[21]。高分子聚合物具有优良的生物活性和生物降解性,能被加工成具有一定机械强度的可注射水凝胶、微胶囊及微球[22-23],利用高分子聚合物包裹生物活性因子,可以实现对其释放的调控。例如:聚乳酸-羟基乙酸共聚物(PLGA)与海藻酸盐相比,能更有效地缓释重组人骨形态发生蛋白2(rhBMP-2)[24];而海藻酸盐则可实现血管内皮生长因子的时空控释,并在较长时间内保持其生物活性[25]。将载有活性因子的水凝胶与BMC复合,或将负载活性因子的微球与BMC原材料混合,可获得功能化矿化胶原,功能化矿化胶原复合体系在体内微环境中通过缓释信号因子,在植入物周围形成浓度梯度,刺激骨髓间充质干细胞向支架中心定向迁移,完成细胞招募;同时,其促进血管生成的功能有助于加速骨缺损部位的修复[22]。 2.1.4 原材料合成法 在生物活性成分(例如生长因子、无机金属离子和药物等)与BMC原材料的混合过程中,创建功能化支架是一种普遍采用的负载策略。重组人骨形态发生蛋白2在酸性环境中表现出较高的稳定性,并能通过非共价键的方式与羟基磷灰石结合。在BMC的制备过程中,将重组人骨形态发生蛋白2加入到胶原/羟基磷灰石混合液中,并通过冷冻干燥技术制备出的矿化胶原支架,实现蛋白质的控制释放,减少初期的突发释放现象,延长其释放时间,并保持蛋白质的生物活性[26]。相较于浸泡吸附法,将活性因子在BMC的制备过程中掺入,不仅可以实现药物负载量的可控性,而且能够减弱突发释放现象[27]。天然骨中的羟基磷灰石含有大量的阳离子或阴离子,这些离子可以取代晶格中的钙或磷酸盐。与生长因子相比,无机金属元素价格较低,化学性质稳定。在BMC合成材料中掺入无机金属元素(如锶、锌、铁和镁等),可模仿哺乳动物骨骼的基本成分,从而提高BMC的骨诱导性能[28-29],这种方法不仅提高了BMC的功能性,还增强了其在骨组织工程中的应用潜力。"
2.2 增强矿化胶原促成骨能力的应用 成骨性能是评价骨替代材料在骨缺损修复重建和骨组织再生中的有效指标,该部分将主要从矿化胶原负载细胞、生长因子、药物、无机金属元素等方面进行综述(图5)。 2.2.1 负载成骨相关细胞 干细胞具有较强的增殖和多向分化潜能,与之相比,成骨细胞的增殖和分化能力不足。在骨修复过程中,骨髓间充质干细胞能够迁徙到骨缺损处,并定向分化为成骨细胞,分泌骨基质成分,在骨再生过程中发挥重要作用,以干细胞为基础的组织工程在再生受损组织工程方面具有巨大潜力;矿化胶原具有良好的生物相容性,可用作细胞的载体,两者共同作用显著促进体内骨再生[6]。在小型猪颅骨骨缺损修复的研究中,与载细胞羟基磷灰石支架相比,负载自体牙周膜干细胞的纤维内矿化胶原表现出了更好的骨再生,大量沉积具有与天然骨相似的纳米结构、力学性能及血管的新骨,高表达转录因子Osterix[6]。负载脂肪间充质干细胞的纳米羟基磷灰石-胶原-聚乳酸材料在兔脊柱融合过程中,达到了与自体髂骨移植相似的融合效果[30]。但是,目前干细胞的临床应用条件尚未达成共识,需建立统一标准和使用指南,对干细胞的发展具有重要意义。"

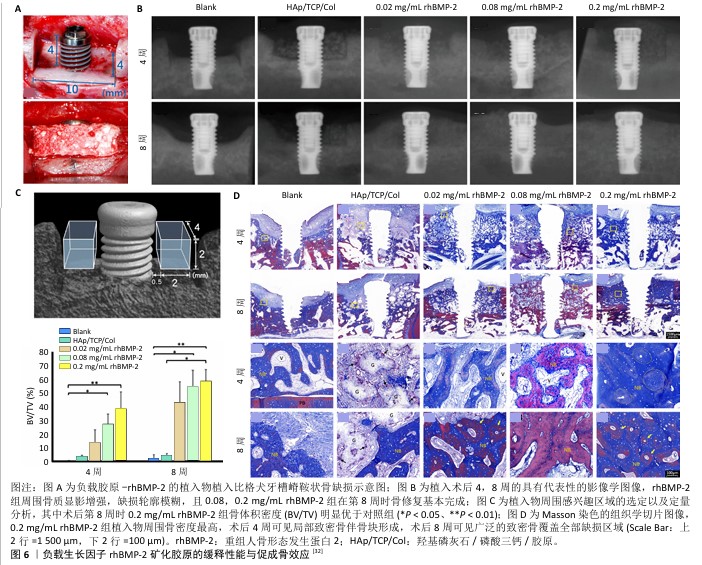
2.2.2 负载生长因子 BMC是多种生长因子的高效载体,在体内控制释放各种信号因子吸引并刺激周围宿主组织细胞,促进成骨细胞向内生长,促进支架内血管网络的形成,最终实现进一步骨生成。骨形态发生蛋白2在所有骨生长相关因子中对骨形成的促进作用最为显著,重组人骨形态发生蛋白2已被FDA批准并应用于各种骨科、口腔科疾病的临床治疗。然而,越来越多的证据表明重组人骨形态发生蛋白2的超生理剂量应用及植入后的非可控和非靶向性递送会导致一系列并发症[31]。有研究者在BMC制备过程中掺入低于临床金标准INFUSE? 30倍的重组人骨形态发生蛋白2,体外无明显的初始突发释放,21 d仅释放约25%的重组人骨形态发生蛋白2,显著提高了颅骨缺损的愈合程度,且未伴有骨异常或邻近骨吸收现象[27]。在大型动物模型中,低浓度的重组人骨形态发生蛋白2同样展现出强大的成骨能力[32](图6)。将包裹重组人骨形态发生蛋白2的聚乳酸-羟基乙酸共聚物微粒掺入矿化胶原支架,复合支架持续释放生物活性的重组人骨形态发生蛋白2,在体内表现出良好的骨再生和骨愈合能力[24]。 研究表明,相较于单一生长因子的应用,多种生长因子组合所展现的功能化效果更为显著。实验中,经肝素修饰的矿化胶原支架负载了不同剂量的骨形态发生蛋白2与基质细胞衍生因子1α,在体内实验中,基质细胞衍生因子1α有效地增强了低浓度骨形态发生蛋白2的骨诱导潜力,产生了与较高浓度骨形态发生蛋白2类似的再生效果,从而避免了使用大剂量骨形态发生蛋白2所可能引发的不良反 应[18]。骨形态发生蛋白2衍生肽是一类保留了能够诱导成骨细胞分化骨形态发生蛋白序列的多肽,目前已有众多骨形态发生蛋白2衍生肽被设计并验证,它们表现出了显著的骨诱导能力[16]。在体内应用中,吸附负载有骨形态发生蛋白2衍生肽的矿化胶原支架能够实现长达15周衍生肽的持续释放,为骨形成和重建提供持续刺激,其效果可与重组人骨形态发生蛋白2相媲美[16]。"
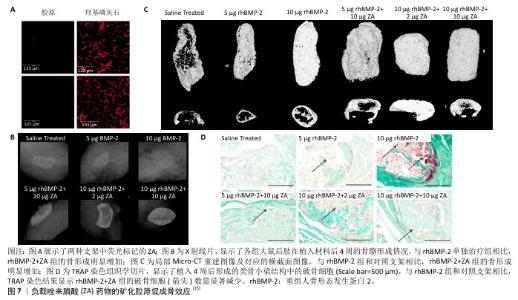
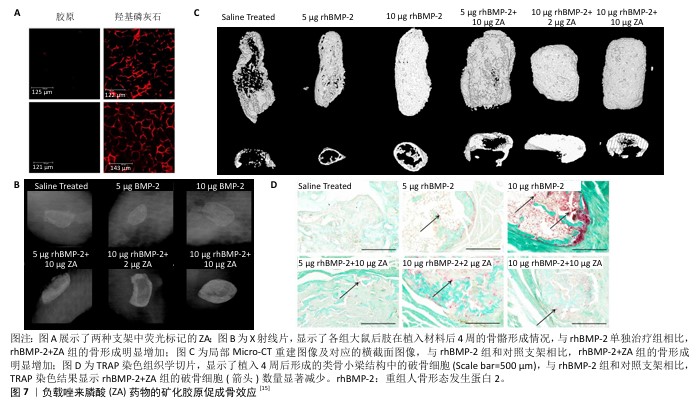
2.2.3 负载药物 双膦酸盐作为一类破骨细胞抑制剂,在临床上被广泛用于治疗骨质疏松症及其他代谢性骨病,它们能有效减少由应力屏蔽引起的骨质流失,并已被证实具有显著的成骨诱导能力。例如,负载有阿仑膦酸的胶原/羟基磷灰石材料已被证明能支持MC3T3-E1细胞的黏附和增殖[33]。在异位成骨模型中,与单独使用重组人骨形态发生蛋白2相比,将矿化胶原负载重组人骨形态发生蛋白2与唑来膦酸相结合,可使新生骨体积提高至6倍,表明唑来膦酸显著增强了重组人骨形态发生蛋白2的骨形成能力[15] (图7)。此外,相较于直接吸附负载策略,将包裹阿仑膦酸的聚乳酸-羟基乙酸共聚物微球掺入矿化胶原中,并后续浸渍吸附负载骨形态发生蛋白2,可构建一种联合传递促进骨形成合成与抗骨吸收分解药物的复合体系,该系统实现了骨形态发生蛋白2和阿仑膦酸的顺序释放,更有效地发挥了骨形态发生蛋白2与阿仑膦酸的协同作用,并显著促进了骨再生[11]。人甲状旁腺激素相关肽具备促进成骨和抑制骨吸收的双重功能。近期研究通过化学固定方法将甲状旁腺激素五肽负载至胶原-羟基磷灰石支架上,实现了体外多肽的持续缓释,相较于非功能化支架,该功能化支架显著促进了新骨的生成[34]。 "

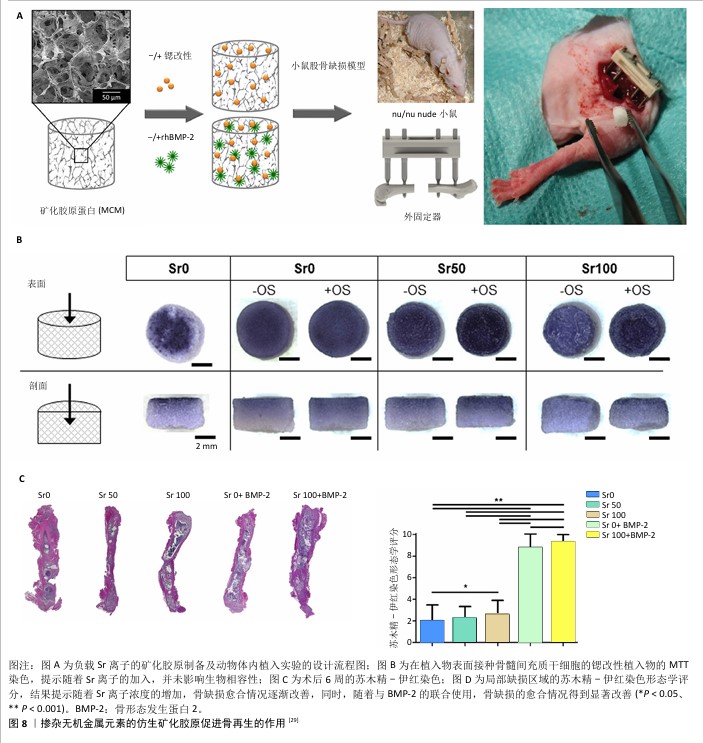
2.2.4 掺杂无机金属元素 锶元素因其抑制骨吸收和促进骨形成的双重功能,已成为当前研究的重点。在BMC中掺杂锶,可以通过激活Ras/MAPK和Wnt/β-catenin信号通路以及转录因子Runx2来促进成骨细胞的分化[35]。此外,锶还能与膜结合的钙敏感受体相互作用,影响破骨细胞的旁分泌功能[36]。在矿化胶原支架的合成过程中,通过用锶替代钙,形成了锶修饰的矿化胶原[29],这种复合材料能够持续释放锶离子,其中50%和100%的锶取代支架所释放的Sr2+浓度位于对骨代谢双重作用有利的范围内,锶改性的矿化胶原显著促进了骨髓间充质干细胞的增殖和成骨分化;将浸渍吸附了骨形态发生蛋白2的锶改性矿化胶原植入骨缺损部位后,6周内即实现了骨桥接,提高了力学性能,随着锶浓度的增加,新生骨组织的质量显著提高(图8)。 镁是年轻骨骼或新生骨中的主要离子之一,而在成熟和老化的骨骼中则倾向于减少,骨组织中镁离子的缺乏会影响晶体的形态、大小和生长速度。在骨形成过程中,Mg2+能够促进干细胞向成骨细胞的分化,增强成骨细胞的黏附和迁移,抑制破骨细胞,调节免疫反应,并通过诱导一氧化氮的产生促进血管生成,从而间接影响矿物质代谢[37]。含Mg2+的矿化胶原支架能高度模拟人类成骨生态位的组成和结构,具有良好的生物相容性,能促进间充质干细胞的附着、增殖以及新骨和软骨组织的形成[38];在异位成骨模型中,这种支架在2周内就能生成大量的松质骨,并逐渐成熟,最终形成成熟的皮质骨,展现出快速且高效的骨诱导能力。 体内骨再生过程中,各种微量元素扮演着关键角色,掺杂微量元素的矿化胶原已被证实能显著促进骨修复。锌是一种对人体必不可少的微量元素,锌缺乏与骨骼发育不良和骨质疏松症的发病密切相关。含锌的羟基磷灰石/Ⅰ型胶原材料,以其相互连通的孔洞结构和持续的锌离子释放特性,展现了良好的生物相容性,并能促进大鼠骨髓间充质干细胞的成骨分化及骨缺损的修复[39]。将Fe2+和Mn2+掺入高强度矿化胶原中,显著促进了成骨细胞的黏附、增殖及成骨分化。与单纯高强度矿化胶原支架或市售矿化胶原支架相比,负载新鲜骨髓细胞的Fe/Mn复合高强度矿化胶原支架在体内表现出更佳的骨再生能力[40]。 "
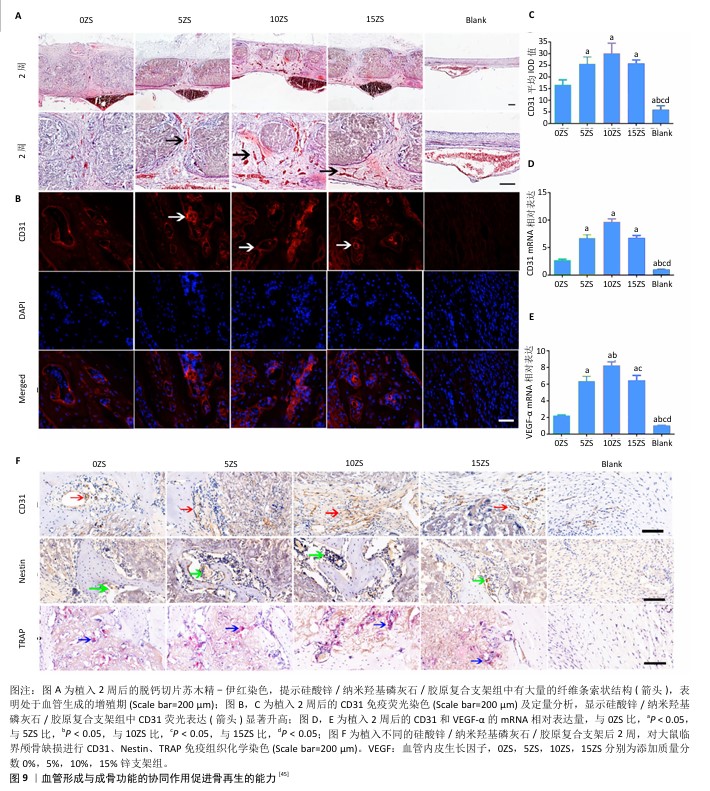
2.3 仿生矿化胶原的多功能协调 骨诱导和骨形成在生物体内是一个高度复杂且连续的过程,其顺利进行需要众多方面的精密协调。特别是在处理一些复杂类型的骨缺损时,不仅需要增强成骨性能,还必须综合考虑成骨、成血管、免疫调节以及抗感染等多重因素的协调,从而优化骨微环境,这种全方位的调控策略有助于创造一个更有利于骨再生的环境,促进骨修复和再生过程的有效进行。在这个复杂的生物学背景中,理解并利用多种相互作用的机制对于提高骨修复效率和质量至关重要。 2.3.1 血管生成与成骨功能协同作用 血管内皮生长因子是针对血管内皮细胞的一种特异性生长因子,能够调节内皮细胞的迁移、增殖及毛细血管的生成。研究表明,不同的血管内皮生长因子释放模式对血管生成过程有着不同的影响。肝素修饰的矿化胶原持续释放少量血管内皮生长因子,可能会影响血管结构的形成,比如稳定未成熟的血管结构;而无肝素修饰的矿化胶原伴随血管内皮生长因子的突发式释放,则似乎更有利于毛细血管的形成和发芽[17]。将含有血管内皮生长因子的海藻酸盐微球包埋于矿化胶原支架中,在体外可以促进血管内皮细胞形成毛细血管,在颅骨缺损模型中,显著促进血管生成和骨再生[25]。 此外,非硫化的阴离子糖胺聚糖透明质酸负载血管内皮生长因子后,在体内可与血管内皮生长因子发挥协同作用,共同促进血管生成[41]。而人工合成的血管内皮生长因子模拟肽也具有血管内皮生长因子的成血管功能[42]。这些研究凸显了通过精确控制血管内皮生长因子释放模式及其载体系统的重要性,对于促进有效的血管生成及骨再生具有重大临床意义。 通过成骨-血管生成耦合效应来模拟成熟的血管化骨组织,是生物材料改性领域的一个关键理念,这一理念可通过血管生成因子和成骨因子的联合应用来实现。将包裹重组人骨形态发生蛋白2的壳聚糖微球包埋进矿化胶原支架,并通过浸渍吸附负载血管内皮生长因子,可实现两种因子的顺序释放。其中,血管内皮生长因子首先有效地诱导血管生成,随后重组人骨形态发生蛋白2促进骨形成,充分发挥两者的协同和相加作用,有效促进骨再生[43]。骨髓间充质干细胞的缺氧条件培养液是各种信号因子的混合物,具有诱导细胞定向迁移的巨大潜力,并含有高浓度的血管生成因子,能促进血管结构的形成[44]。将缺氧条件培养液与海藻酸盐复合,并作为中心储存库整合到矿化胶原支架中,经钙交联形成的复合体系,能够缓慢释放信号因子,在支架周围形成浓度梯度,刺激人骨髓间充质干细胞向支架中心定向迁移,完成细胞招募,同时通过促进血管生成来提供氧气和营养,加速骨缺损的愈合[22]。此外,经肝素修饰的矿化胶原支架负载各种浓缩生长因子混合物,不仅能发挥促成骨作用,还能促进血管生成[22]。硅酸锌/纳米羟基磷灰石/胶原蛋白支架能够调节单核细胞,并通过p38 MAPK通路创造一个有利的成骨微环境,促进骨髓间充质干细胞的迁移、分化和血管生成[45](图9)。此外,一些天然聚合物,如糖氨聚糖、透明质酸、肝素等,因具有良好的生物活性和生物降解性,与矿化胶原复合后也显示出增强的成骨、成血管性能[46]。 "
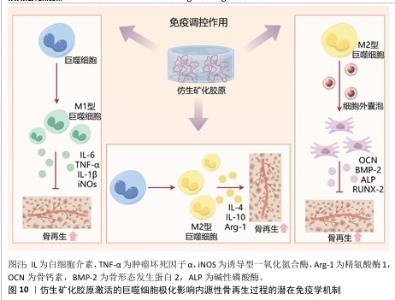
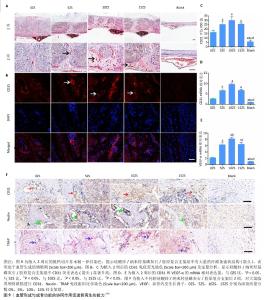
2.3.2 免疫调节与成骨功能协同作用 生物材料植入人体后,会产生一系列的免疫反应,这不仅决定了生物材料的命运,还会对骨再生的结果产生影响[47] (图10)。研究表明,过度的免疫反应会造成纤维包裹、组织破坏,甚至植入物-组织分离、排斥等不良预后[48]。巨噬细胞是急性和慢性炎症以及随后的伤口愈合或纤维化反应的主要细胞类型,激活的巨噬细胞表现出M1和M2表型,M1和M2表型之间的转换和平衡是组织修复所必需的,极化的巨噬细胞通过分泌不同细胞因子和小分子,招募其他免疫细胞到炎症部位,激活补体和适应性免疫系统[49]。 仿生矿化胶原是一种理想的骨修复材料,其纳米结构在骨再生过程中调节巨噬细胞的极化,影响骨再生的结果[47]。与纯胶原支架相比,矿化胶原培养的巨噬细胞与免疫和炎症相关基因的表达下调,增加了与细胞增殖、分化以及组织修复和重建相关基因的表达,而肾上腺髓质素会通过PI3K/Akt信号通路影响矿化胶原调节的巨噬细胞极化[8]。材料表面的粗糙度和纳米结构都会影响巨噬细胞的极化。在粗糙的纤维外矿化胶原支架表面,巨噬细胞表现为M1表型,高水平分泌炎症因子(肿瘤坏死因子α和白细胞介素6),而更光滑的纤维外矿化胶原支架表面则表现出M2表型[50]。细胞、蛋白及基因三个水平进行的研究,均表明纤维内矿化胶原及高强度矿化胶原促进M2巨噬细胞极化,高表达M2相关的抗炎细胞因子白细胞介素10和精氨酸酶1;而纤维外矿化胶原则刺激更多的巨噬细胞向M1极化,表达更多的M1相关基因诱导型一氧化氮合酶(iNOS)和白细胞介素6[47]。 "
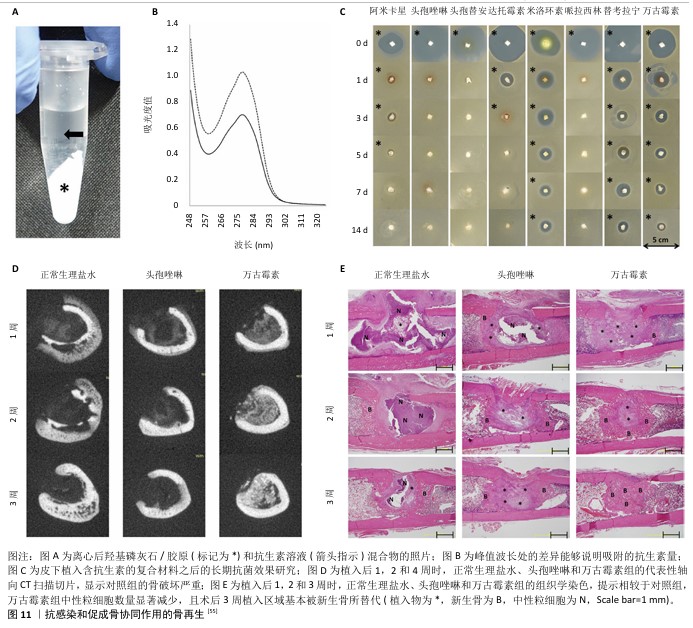
2.3.3 抗感染与成骨功能协同作用 感染性骨缺损是骨科领域常见的问题,其治疗难度主要源于感染区域血液供应的不足以及细菌耐药性的增强,导致全身应用抗生素疗效通常不佳。因此,开发既具有局部抗感染功能又能促进骨再生的多功能支架显得尤为重要。矿化胶原负载抗菌药物(例如抗生素、抗菌肽及某些中草药成分)是实现其抗菌性能的一种常见策略[51]。将抗生素与胶原、羟基磷灰石直接混合,是制备具备抗菌性能矿化胶原最简便的方法,此方法可以有效缓释万古霉素[52]。通过浸渍吸附的方式,将万古霉素和庆大霉素负载于胶原/羟基磷灰石电纺纤维膜上[53],可以在体外持续释放高浓度的具有抗菌活性的药物。庆大霉素/羟基磷灰石/胶原类骨纳米复合材料作为一种生物可吸收的抗感染骨空洞填充材料,无细胞毒性,适用于初期感染的预防[54]。这些策略在抗感染骨缺损治疗中显示出巨大的潜力,有助于解决传统方法面临的挑战。 矿化胶原吸附、活化及释放抗生素的效率受到多种因素的影响。例如,镁改性矿化胶原由于其卓越的成骨性能,通过浸渍吸附法负载抗生素(如万古霉素、庆大霉素),可以得到既具备成骨性能又具有抗感染特性的复合材料,镁的掺杂有助于提高药物的滞留时间,而且不会对药物的抗菌活性产生负面影响[51]。与未经肝素修饰的矿化胶原相比,经过肝素修饰的矿化胶原能实现更持久、更可控的万古霉素释放[14]。万古霉素加入到胶原/羟基磷灰石材料中的方式会影响其活性,能够展现出更加显著的抗菌效果[17]。矿化胶原中羟基磷灰石的修饰不会对万古霉素的持续释放产生负面影响[52],甚至可以保持万古霉素的稳定释放[53]。此外,不同抗生素在矿化胶原上的吸附能力存在差异,较高的吸附能力通常会导致更强的抗菌活性。在急性骨髓炎大鼠模型中,这一特性展示了更佳的治疗效果[55](图11)。这些发现强调了矿化胶原作为药物载体在抗感染骨修复中的重要作用,特别是在抗生素的有效载荷与释放方面。 银离子因其破坏细菌细胞膜、结合微生物DNA以及与细菌代谢酶的巯基相互作用等多重途径,表现出卓越的抗菌活性,它们可以被掺入各类天然及合成聚合物中,从而优化材料的抗菌效果。近期,有研究通过单宁酸与硝酸银的相互作用,成功制备了银纳米颗粒,并将其掺入胶原基质中。在模拟体液中浸泡后,通过胶原的自组装和矿化过程,得到了一种负载银纳米粒子的矿化胶原复合材料,该材料展现出良好的力学性能和抗菌活性,并对MG-63细胞和红细胞表现出良好的生物相容性[56]。在另一项研究中,通过共沉淀法制备了掺银的羟基磷灰石,并将其添加到胶原凝胶中,冷冻干燥处理后得到了掺银的矿化胶原复合材料,该材料同样展现了强大的抗菌性能,随着银离子浓度的增加,其抑菌区域也显著增大[57]。这些研究展示了通过纳米技术和材料科学的结合,可以大幅提升矿化胶原复合材料在骨再生和抗感染领域的应用潜力。"
| [1] SALHOTRA A, SHAH HN, LEVI B, et al. Mechanisms of bone development and repair. Nat Rev Mol Cell Biol. 2020;21(11): 696-711. [2] MANOOCHEHRI H, GHORBANI M, MOOSAZADEH MOGHADDAM M, et al. Strontium doped bioglass incorporated hydrogel-based scaffold for amplified bone tissue regeneration. Sci Rep. 2022; 12(1):10160. [3] EL-GAZZAR A, VORABERGER B, RAUCH F, et al. Bi-allelic mutation in SEC16B alters collagen trafficking and increases ER stress. EMBO Mol Med. 2023;15(4):e16834. [4] LYONS JG, PLANTZ MA, HSU WK, et al. Nanostructured Biomaterials for Bone Regeneration. Front Bioeng Biotechnol. 2020;8:922. [5] YU L, WEI M. Biomineralization of Collagen-Based Materials for Hard Tissue Repair. Int J Mol Sci. 2021;22(2):944. [6] ZHANG C, YAN B, CUI Z, et al. Bone regeneration in minipigs by intrafibrillarly-mineralized collagen loaded with autologous periodontal ligament stem cells. Sci Rep. 2017;7(1):10519. [7] 马士卿,王晓婧.仿生矿化胶原材料应用于引导骨再生术的研究进展[J].重庆医学,2023,52(7):1072-1077. [8] MENG C, LIU K, LV Z, et al. Inflammation and immunity gene expression profiling of macrophages on mineralized collagen. J Biomed Mater Res A. 2021;109(8): 1328-1336. [9] KUCKO SK, RAEMAN SM, KEENAN TJ. Current advances in hydroxyapatite-and β-tricalcium phosphate-based composites for biomedical applications: a review. Biomedical Materials Devices. 2023;1(1): 49-65. [10] LIAN K, LU H, GUO X, et al. The mineralized collagen for the reconstruction of intra-articular calcaneal fractures with trabecular defects. Biomatter. 2013;3(4):e27250. [11] LEE D, WUFUER M, KIM I, et al. Sequential dual-drug delivery of BMP-2 and alendronate from hydroxyapatite-collagen scaffolds for enhanced bone regeneration. Sci Rep. 2021;11(1):746. [12] LIU K, MENG CX, LV ZY, et al. Enhancement of BMP-2 and VEGF carried by mineralized collagen for mandibular bone regeneration. Regen Biomater. 2020;7(4):435-440. [13] ZHU X, WANG C, BAI H, et al. Functionalization of biomimetic mineralized collagen for bone tissue engineering. Mater Today Bio. 2023;20:100660. [14] COELHO CC, SOUSA SR, MONTEIRO FJ. Heparinized nanohydroxyapatite/collagen granules for controlled release of vancomycin. J Biomed Mater Res A. 2015; 103(10):3128-3138. [15] MURPHY CM, SCHINDELER A, GLEESON JP, et al. A collagen-hydroxyapatite scaffold allows for binding and co-delivery of recombinant bone morphogenetic proteins and bisphosphonates. Acta Biomater. 2014;10(5):2250-2258. [16] ZHANG X, GUO WG, CUI H, et al. In vitro and in vivo enhancement of osteogenic capacity in a synthetic BMP-2 derived peptide-coated mineralized collagen composite. J Tissue Eng Regen Med. 2016;10(2): 99-107. [17] QUADE M, KNAACK S, WEBER D, et al. Heparin modification of a biomimetic bone matrix modulates osteogenic and angiogenic cell response in vitro. Eur Cell Mater. 2017;33:105-120. [18] ZWINGENBERGER S, LANGANKE R, VATER C, et al. The effect of SDF-1α on low dose BMP-2 mediated bone regeneration by release from heparinized mineralized collagen type I matrix scaffolds in a murine critical size bone defect model. J Biomed Mater Res A. 2016;104(9):2126-2134. [19] KNAACK S, LODE A, HOYER B, et al. Heparin modification of a biomimetic bone matrix for controlled release of VEGF. J Biomed Mater Res A. 2014;102(10):3500-3511. [20] RATANAVARAPORN J, FURUYA H, KOHARA H, et al. Synergistic effects of the dual release of stromal cell-derived factor-1 and bone morphogenetic protein-2 from hydrogels on bone regeneration. Biomaterials. 2011; 32(11):2797-2811. [21] EPSTEIN NE. Pros, cons, and costs of INFUSE in spinal surgery. Surg Neurol Int. 2011;2:10. [22] QUADE M, MÜNCH P, LODE A, et al. The Secretome of Hypoxia Conditioned hMSC Loaded in a Central Depot Induces Chemotaxis and Angiogenesis in a Biomimetic Mineralized Collagen Bone Replacement Material. Adv Healthc Mater. 2020;9(2):e1901426. [23] LIN Q, LIM JYC, XUE K, et al. Polymeric hydrogels as a vitreous replacement strategy in the eye. Biomaterials. 2021;268:120547. [24] QUINLAN E, LÓPEZ-NORIEGA A, THOMPSON E, et al. Development of collagen-hydroxyapatite scaffolds incorporating PLGA and alginate microparticles for the controlled delivery of rhBMP-2 for bone tissue engineering. J Control Release. 2015; 198:71-79. [25] QUINLAN E, LÓPEZ-NORIEGA A, THOMPSON EM, et al. Controlled release of vascular endothelial growth factor from spray-dried alginate microparticles in collagen-hydroxyapatite scaffolds for promoting vascularization and bone repair. J Tissue Eng Regen Med. 2017;11(4):1097-1109. [26] QUINLAN E, THOMPSON EM, MATSIKO A, et al. Long-term controlled delivery of rhBMP-2 from collagen-hydroxyapatite scaffolds for superior bone tissue regeneration. J Control Release. 2015;207:112-119. [27] SUCHÝ T, ŠUPOVÁ M, KLAPKOVÁ E, et al. The release kinetics, antimicrobial activity and cytocompatibility of differently prepared collagen/hydroxyapatite/vancomycin layers: Microstructure vs. nanostructure. Eur J Pharm Sci. 2017;100:219-229. [28] QUADE M, SCHUMACHER M, BERNHARDT A, et al. Strontium-modification of porous scaffolds from mineralized collagen for potential use in bone defect therapy. Mater Sci Eng C Mater Biol Appl. 2018;84: 159-167. [29] QUADE M, VATER C, SCHLOOTZ S,et al. Strontium enhances BMP-2 mediated bone regeneration in a femoral murine bone defect model. J Biomed Mater Res B Appl Biomater. 2020;108(1):174-182. [30] TANG ZB, CAO JK, WEN N, et al. Posterolateral spinal fusion with nano-hydroxyapatite-collagen/PLA composite and autologous adipose-derived mesenchymal stem cells in a rabbit model. J Tissue Eng Regen Med. 2012;6(4): 325-336. [31] KIM SY, BAE EB, HUH JW, et al. Bone Regeneration Using a Three-Dimensional Hexahedron Channeled BCP Block Combined with Bone Morphogenic Protein-2 in Rat Calvarial Defects. Materials (Basel). 2019; 12(15):2435. [32] CHAO YL, WANG TM, CHANG HH, et al. Effects of low-dose rhBMP-2 on peri-implant ridge augmentation in a canine model. J Clin Periodontol. 2021;48(5): 734-744. [33] MA X, HE Z, HAN F, et al. Preparation of collagen/hydroxyapatite/alendronate hybrid hydrogels as potential scaffolds for bone regeneration. Colloids Surf B Biointerfaces. 2016;143:81-87. [34] QUINLAN E, THOMPSON EM, MATSIKO A, et al. Functionalization of a Collagen-Hydroxyapatite Scaffold with Osteostatin to Facilitate Enhanced Bone Regeneration. Adv Healthc Mater. 2015;4(17):2649-2656. [35] PENG S, LIU XS, HUANG S, et al. The cross-talk between osteoclasts and osteoblasts in response to strontium treatment: involvement of osteoprotegerin. Bone. 2011;49(6):1290-1298. [36] BAKKER AD, ZANDIEH-DOULABI B, KLEIN-NULEND J. Strontium ranelate affects signaling from mechanically-stimulated osteocytes towards osteoclasts and osteoblasts. Bone. 2013;53(1):112-119.. [37] HANG Z, BING L, HJ A, et al. Magnesium-based biomaterials as emerging agents for bone repair and regeneration: from mechanism to application. J Magnesium Alloys. 2021;9(3):779-804. [38] SARTORI M, PAGANI S, FERRARI A, et al. A new bi-layered scaffold for osteochondral tissue regeneration: In vitro and in vivo preclinical investigations. Mater Sci Eng C Mater Biol Appl. 2017;70(Pt 1):101-111. [39] POPA CL, BARTHA CM, ALBU M, et al. Synthesis, Characterization and cytotoxicity evaluation on zinc doped hydroxyapatite in collagen matrix. Digest J Nanomaterials Biostructures. 2015;10(2):681-691. [40] TIAN Y, CAO H, QIAO Y, et al. Antimicrobial and osteogenic properties of iron-doped titanium. Rsc Advances. 2016;6(52):46495-46507. [41] CARTON F, MALATESTA M. Nanotechnological Research for Regenerative Medicine: The Role of Hyaluronic Acid. Int J Mol Sci. 2024;25(7): 3975. [42] LU J, GUAN F, CUI F, et al. Enhanced angiogenesis by the hyaluronic acid hydrogels immobilized with a VEGF mimetic peptide in a traumatic brain injury model in rats. Regen Biomater. 2019;6(6):325-334. [43] DOU DD, ZHOU G, LIU HW, et al. Sequential releasing of VEGF and BMP-2 in hydroxyapatite collagen scaffolds for bone tissue engineering: Design and characterization. Int J Biol Macromol. 2019;123:622-628. [44] GABRIELYAN A, NEUMANN E, GELINSKY M, et al. Metabolically conditioned media derived from bone marrow stromal cells or human skin fibroblasts act as effective chemoattractants for mesenchymal stem cells. Stem Cell Res Ther. 2017;8(1):212. [45] SONG Y, WU H, GAO Y, et al. Zinc Silicate/Nano-Hydroxyapatite/Collagen Scaffolds Promote Angiogenesis and Bone Regeneration via the p38 MAPK Pathway in Activated Monocytes. ACS Appl Mater Interfaces. 2020;12(14):16058-16075. [46] LI M, JIA W, ZHANG X, et al. Hyaluronic acid oligosaccharides modified mineralized collagen and chitosan with enhanced osteoinductive properties for bone tissue engineering. Carbohydr Polym. 2021;260: 117780. [47] SUN Y, LIU S, FU Y, et al. Mineralized Collagen Regulates Macrophage Polarization During Bone Regeneration. J Biomed Nanotechnol. 2016;12(11): 2029-2040. [48] MARIANI E, LISIGNOLI G, BORZÌ RM, et al. Biomaterials: Foreign Bodies or Tuners for the Immune Response? Int J Mol Sci. 2019; 20(3):636. [49] ZHOU G, GROTH T. Host Responses to Biomaterials and Anti-Inflammatory Design-a Brief Review. Macromol Biosci. 2018;18(8):e1800112. [50] LI J, ZHANG YJ, LV ZY, et al. The observed difference of macrophage phenotype on different surface roughness of mineralized collagen. Regen Biomater. 2020;7(2):203-211. [51] MULAZZI M, CAMPODONI E, BASSI G, et al. Medicated Hydroxyapatite/Collagen Hybrid Scaffolds for Bone Regeneration and Local Antimicrobial Therapy to Prevent Bone Infections. Pharmaceutics. 2021;13(7):1090. [52] SUCHÝ T, ŠUPOVÁ M, KLAPKOVÁ E, et al. The Sustainable Release of Vancomycin and Its Degradation Products From Nanostructured Collagen/Hydroxyapatite Composite Layers. J Pharm Sci. 2016; 105(3):1288-1294. [53] SUCHÝ T, ŠUPOVÁ M, SAUEROVÁ P, et al. Evaluation of collagen/hydroxyapatite electrospun layers loaded with vancomycin, gentamicin and their combination: Comparison of release kinetics, antimicrobial activity and cytocompatibility. Eur J Pharm Biopharm. 2019;140:50-59. [54] OSHIMA S, SATO T, HONDA M, et al. Fabrication of Gentamicin-Loaded Hydroxyapatite/Collagen Bone-Like Nanocomposite for Anti-Infection Bone Void Fillers. Int J Mol Sci. 2020;21(2):551. [55] EGAWA S, HIRAI K, MATSUMOTO R, et al. Efficacy of Antibiotic-Loaded Hydroxyapatite/Collagen Composites Is Dependent on Adsorbability for Treating Staphylococcus aureus Osteomyelitis in Rats. J Orthop Res. 2020;38(4):843-851. [56] SOCRATES R, SAKTHIVEL N, RAJARAM A, et al. Novel fibrillar collagen–hydroxyapatite matrices loaded with silver nanoparticles for orthopedic application. Materials Letters. 2015;161:759-762. [57] PREDOI D, ICONARU SL, ALBU M, et al. Physicochemical and antimicrobial properties of silver-doped hydroxyapatite collagen biocomposite. Polymer Eng Sci. 2017;57(6):537-545. |
| No related articles found! |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||