Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (在线): 1-11.
Neuromechanism of the endocannabinoid system in regulating exercise motivation
Zhang Qingtong, Chen Leqin, Liu Chang, Chen Yuting, Guo Ruiwu
- Shanxi Normal University, Taiyuan 030031, Shanxi Province, China
-
Online:2026-01-01Published:2025-09-22 -
Contact:Chen Leqin, Shanxi Normal University, Taiyuan 030031, Shanxi Province, China -
About author:Zhang Qingtong, MS, Shanxi Normal University, Taiyuan 030031, Shanxi Province, China
CLC Number:
Cite this article
Zhang Qingtong, Chen Leqin, Liu Chang, Chen Yuting, Guo Ruiwu. Neuromechanism of the endocannabinoid system in regulating exercise motivation[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(在线): 1-11.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.2 内源性大麻素系统 2.2.1 内源性大麻素系统的构成 内源性大麻素系统由内源性大麻素、大麻素受体(大麻素1型受体和大麻素2型受体)以及参与其合成和代谢的相关酶组成。内源性大麻素中最主要的是花生四烯酸乙醇胺和2-花生四烯酸甘油[3]。 花生四烯酸乙醇胺和2-花生四烯酸甘油是人体内最丰富的内源性大麻素,它们在调控神经兴奋性和抑制性信号的平衡中发挥重要作用[3]。花生四烯酸乙醇胺是一种脂肪酸神经递质,可以很容易地穿过血脑屏障,具有大麻素大麻素1型受体和大麻素2型受体这,2个主要分子靶点[16]。大麻素1型受体和大麻素2型受体分别位于不同的组织和细胞中,大麻素1型受体主要在大脑的初级感觉和运动区域以及记忆、认知和情绪区域表达,所有这些都与自主神经系统和神经内分泌系统的区域重叠[17];而大麻素2型受体主要分布在外周组织和免疫系统中,主要负责参与免疫反应和炎症的调节[18]。内源性大麻素与这些受体能够调控神经传导、学习记忆、疼痛感知等生理反应[3,16]。 2.2.2 内源性大麻素系统作用 (1)内源性大麻素系统在神经系统中的作用:内源性大麻素系统受体在嗅球、齿状回等区域高表达,在额叶等区域中等表达,在丘脑和脑干核表达较低,在周围神经末梢和多种非神经元细胞中也有表达,作为神经调节剂,内源性大麻素系统受体可调节多种神经递质的突触传递[2]。内源性大麻素系统在神经性疼痛中起重要作用。大麻素1型受体在外周和脊髓上水平可抑制伤害性刺激、神经递质释放和疼痛传递,激活下行抑制途径;大麻素2型受体则更多参与调节脊髓慢性疼痛相关免疫反应,主要存在于免疫细胞及免疫系统器官中,也在大脑皮质等部位有表达,并且在胃肠道中调节肠道炎症反应[3]。 迷走神经是内源性大麻素发挥作用的一个重要途径,它在人体中主要起着调控多种生理功能的作用。迷走神经包含传入神经和传出神经,传入神经元主要通过大麻素敏感的瞬时受体电位通道释放谷氨酸,同时瞬态受体电位通道香草酸亚家族1型受体通道的激活与内源性大麻素中的花生四烯酸乙醇胺有着巨大关联,瞬态受体电位通道香草酸亚家族1型受体通道对花生四烯酸乙醇胺的敏感性需要大麻素1型受体介导的酶激活过程[19]。内源性大麻素系统通过瞬态受体电位通道香草酸亚家族1型受体通道、瞬时受体电位锚蛋白1和大麻素1型受体调节感觉神经元的兴奋性和神经肽释放,在炎症和神经病变中可能引发神经源性炎症和自主神经功能紊 乱[20]。总体而言,内源性大麻素系统在人体生理和病理过程中发挥着重要作用。 (2)内源性大麻素系统在情绪调节中的作用:研究表明,内源性大麻素系统可能与抑郁症的治疗相关,这一发现基于人类食用大麻时情绪的改善和食用时产生欣快感所得出的结 论[21]。内源性大麻素通过调节受体的敏感性来影响慢性疼痛和情绪障碍。大量研究发现,内源性大麻素受体并不都是良好的,有些受体虽然可以提供良好的治疗效果,但却也出现了不良反应,大麻素1型受体激动剂具有镇痛作用,但使用过度可能引发精神不良反应,而选择性大麻素2型受体激动剂和大麻二酚则较为安全[22]。在情绪调节过程中,内源性大麻素系统主要通过调控下丘脑-垂体-肾上腺轴以及谷氨酸和γ-氨基丁酸来调节情绪。随着对内源性大麻素以及其受体研究的深入,发现大麻素1型受体的反向激动剂可能诱发抑郁行为,而大麻素2型受体的激活及脂肪酸酰胺水解酶抑制则显示出抗抑郁效果[23]。在情绪调节过程中,大麻素1型受体通过调控多巴胺、γ-氨基丁酸等神经递质调节情绪;大麻二酚则通过5-羟色胺1A受体、瞬态受体电位通道香草酸亚家族1型受体通道和大麻素1型受体通路以及上调花生四烯酸乙醇胺和脑源性神经营养因子来抗焦虑和抗抑郁[24]。 在对肠道菌群的研究中发现,益生元和益生菌通过迷走神经调节肠道菌群来改善焦虑和抑郁,这更有利于同时伴有胃肠疾病的焦虑抑郁患者。与之类似的植物大麻素以及内源性大麻素类似物能够重塑肠道菌群并缓解神经炎症,从而在调节昼夜节律协同下来改善脑肠健康[25]。 综上所述,内源性大麻素系统通过大麻素1型受体和大麻素2型受体调控神经递质、下丘脑-垂体-肾上腺轴以及脑肠轴,参与情绪调节。大麻二酚及大麻素2型受体激活在抗抑郁的同时更具有安全性,因此,结合菌群-脑轴调控与神经炎症干预可能为抑郁症治疗提供新的方向。"

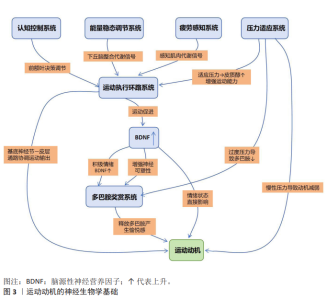
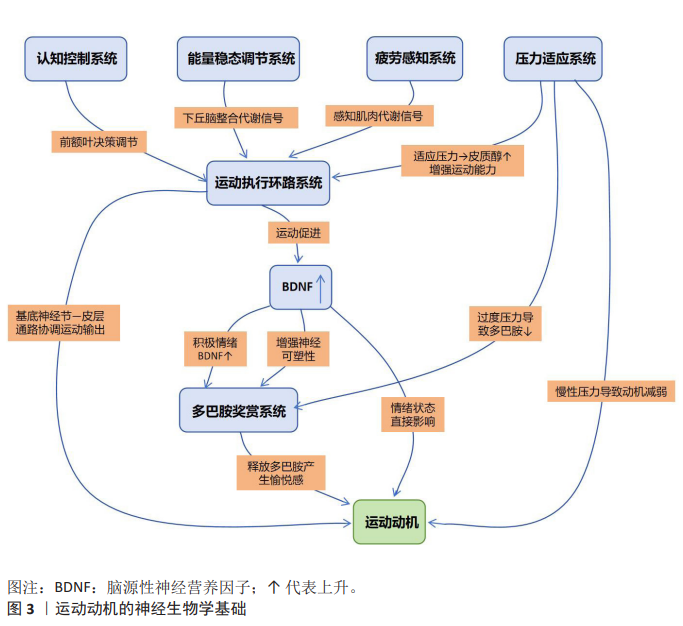
2.3 运动动机的神经生物学基础 运动动机是人类和动物进行身体活动的主要因素。近年来的研究表明,运动动机不仅依赖于运动相关的神经通 路[26],还依赖于大脑内多巴胺奖赏系统[27]、运动执行环路系统[28]、认知控制系统[29]、能量稳态调节系统[30]、压力适应系统[31]、情绪调控网络以及疲劳感知系统等多个神经网络的协同作用[28,32],如图3所示。 2.3.1 多巴胺奖赏系统 多巴胺系统对运动动机中有着重要作用[33]。多巴胺是多巴胺系统中的重要激素,主要存在于中脑的黑质和腹侧被盖区等区域,它主要通过纹状体、前额叶皮质等脑区调节个体行为。运动通过多巴胺的释放激活奖赏系统,从而增强个体的愉悦感和满足感,进一步使个体产生积极的运动动机,从而促进个体进行运动,以此反复加强个体的运动动机[34]。研究表明,个体从事高强度运动会提升体内多巴胺水平,这便会导致运动后产生的愉悦感和满足 感[33];与此同时,多巴胺系统不仅参与奖赏的感知,还调节运动行为的执行[33]。 2.3.2 运动执行环路系统 运动执行环路系统是将运动动机转化为实际动作的关键神经基础,这些区域包括初级运动皮质、辅助运动区、前运动皮质、基底神经节、小脑及脑干运动核团等[35]。当有运动需要时,由前运动区和辅助运动区完成对运动计划的制定与准备,然后由初级运动皮质发出具体的运动指令,而基底神经节和小脑在运动的选择、发动和准确地协调上起着关键作用,并且它们通过丘脑把调控信息传回皮质,形成了一个精巧的运动控制闭环[36]。最近的研究表明,这个环路内连接的有效性和可塑性决定了个体能否有效地将运动动机转换为持久性、连贯的运动表现,如果存在异常,则会导致启动困难或者动作进行得不够顺畅,进而导致运动动机不能被保持[37]。 2.3.3 认知控制系统 认知控制系统主要由前额叶皮质,特别是背外侧前额叶皮质和前扣带回皮质主导,负责高级认知功能对运动动机的调控[38]。认知控制系统的执行受工作记忆、目标设置、决策制定、冲突监控及抑制控制的影响,它决定了人们何时开始行动,如何选择适当的运动方式,以什么样的强度进行锻炼,并且当出现外部干扰或者内部疲乏时是否会按照既定的目标完成任务。背外侧前额叶皮质参与了运动目标的选择、信息保持以及动作模式的学习[39];前扣带回皮质则负责对当前正在进行的动作进行监督,同时评价所付出努力的成本代价。最近的研究发现,背外侧前额叶皮质的功能活动及其与其他脑区之间的功能连接能够很好地预测个人对于运动惰性的抵抗能力以及长期坚持运动的习惯[40]。那些具有较强认知控制能力的人们更倾向于抵制短期奖励诱惑力,从而根据自己的长期目标来做出决定。 2.3.4 能量稳态调节系统 能量稳态调节系统主要定位于下丘脑及其与其他脑区和外围器官的广泛连接网络,这一系统能够持续地检测身体的能量水平,并将这一信息输入到对运动动机进行控制的动力源之中,在感觉不到足够的可用能源或者感觉到危险即将来临时,会发出一个负性反馈信号来减少活动的意愿,以便为维持生命所必需的身体机能提供更多能源。位于下丘脑弓状核中的特定神经元组可以引起强烈的抑制效应,从而终止不必要的自发性运动行为并激发摄取食物行为[41]。最近的研究已发现,在下丘脑内部整合着来自外周的信息并通过作用于下游奖励和动机回路来精确地调整动力源,进而改变运动动机的强度,使得运动行为能够符合目前的能量状况[42]。 2.3.5 压力适应系统 压力反应系统也是调节运动动机的关键神经系统,在调节运动动机过程中发挥着重要作用[43]。研究表明,适当的压力可以激活下丘脑-垂体-肾上腺轴刺激皮质醇等应激激素分泌,致使个体的反应力和运动能力得到增强[44],但高水平的压力和应激反应会干扰多巴胺系统释放多巴胺的能力,进而导致运动动机下降[45]。因此,适当的压力也是促进运动动机提升的主要因素,过高的压力则会对运动动机产生不良影响。下丘脑-垂体-肾上腺轴是压力反应的核心通路,适度的压力激活下丘脑-垂体-肾上腺轴,促使糖皮质激素释放,通过作用于边缘系统和前额叶皮质短期内可增强警觉性、提升认知功能和运动表现[46];然而,慢性或过强的压力会导致下丘脑-垂体-肾上腺轴功能失调、杏仁核过度激活及前额叶皮质功能抑制,这种失调会削弱多巴胺系统的功能,损害基于奖赏的动机形成并引发焦虑和快感缺乏,最终导致运动动机显著下降[47]。 2.3.6 情绪调控网络 研究表明,情绪状态的好坏可以直接影响运动动机的高低,负面情绪会降低运动动机,而积极情绪则能显著增强个体的运动动机[48-49]。运动可以通过促进脑源性神经营养因子的释放增加大脑的神经可塑性、提高情绪调节的能力[49]。情绪调节能力较强的个体,在压力面前可以通过调节情绪来保持较高的运动动机;而情绪调控能力较差的个体,则可能因负面情绪导致运动动机的下降。情绪调控涉及一个复杂的神经网络,主要包括前额叶皮质对边缘系统的抑制性调控。积极的情绪状态与多巴胺能、5-羟色胺能和内源性大麻素能系统活动增强相关,能显著促进运动启动和坚持;相反,负面情绪会过度激活杏仁核,减弱前额叶皮质的调控能力,损害奖赏处理和执行功能,形成恶性循环[50]。运动本身是强效的情绪调节剂,其部分机制即通过促进神经营养因子释放和增强前额叶-边缘环路的可塑性来提升情绪调控能 力[51]。 2.3.7 疲劳感知系统 疲劳感知系统是监测身体状态、防止过度消耗并调节运动动机的重要神经机制,其中的核心脑区主要包括岛叶、前扣带回皮质等区域。岛叶负责将躯体各个部位产生的内部感觉信号及大脑发送来的努力感信号进行综合处理;而前扣带回皮质负责对完成某一任务所付出的成本做出评价,并产生主观上的疲乏体验。只有当这一系统检测出机体的生理或心理疲劳已超过一定的阀限水平后,才会向更上一级别的动机-决定脑区发放抑制信息,进而减弱执行活动的愿望并减少肌肉工作量,直至中止活动,以免发生组织损伤或者过多的能量耗损[28]。最近有学者运用功能磁共振成像技术,证明了运动过程中的岛叶、前扣带回皮质等脑区的功能激活程度与自我评定的主观疲劳感呈显著正相关关系;同时还发现这些脑区都位于认知控制网络,与注意力网络一起构成了整个脑的两个主要功能网络之一[52]。因此,在人体出现疲劳状态时,这2个脑区之间的交互作用就决定了人们是在竭尽全力地去克服这种疲倦的感觉而继续做下去,还是会停下来休息一下以便于恢复精力再开始新的锻炼。经过长年累月的专项训练可以使得疲劳感知系统的灵敏度发生变化,并且影响到了这个系统与动机系统的联结情况,这样就可以让运动员即使处于相同的生理负荷条件下也会感觉到较少的身体疲劳,因而能够保持较高的运动动机水平[53]。"
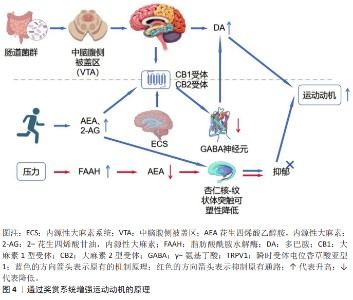
2.4 内源性大麻素系统对运动动机的作用机制 2.4.1 通过奖赏系统增强运动动机 (1)调节多巴胺释放:运动可通过介导内源性大麻素来调节奖赏系 统[27]。研究发现,肠道微生物可以通过激活内源性大麻素代谢物增强运动过程中大脑多巴胺释放的信号来提高运动表现,表明肠脑连接在运动动机中的作用[54]。MLOST等[55]研究发现,大麻素1型受体具有调节多巴胺释放的能力,因此,内源性大麻素对多巴胺的释放起着积极的调节作用。在运动过程中,随着内源性大麻素水平升高并结合大麻素1型受体后,可以起到调节腹侧被盖区-伏隔核多巴胺能通路中多巴胺释放的作用[56]。多巴胺神经元具备合成内源性大麻素系统的分子机制,内源性大麻素系统信号转导与正常的奖励处理、学习以及成瘾等动机障碍密切相关。多巴胺神经元通过作用于大麻素1型受体来调控多巴胺能神经元对奖励和线索的反应,全身阻断大麻素1型受体会减少N-乙酰多巴胺的释放,但由于腹侧被盖区内的多巴胺神经元上没有大麻素1型受体,因此这种调节作用是间接 的[55]。研究表明,内源性大麻素系统通过调节内源性大麻素在腹侧被盖区以及伏隔核中的水平来调节多巴胺的释放,从而达到增强大脑奖励底物的作用[57]。当多巴胺信号传导受到破坏时,个体不再根据奖励的变化来调整他们的行为[58]。功能性磁共振成像显示,运动后伏隔核激活程度与血浆花生四烯酸乙醇胺水平正相关[3],表明尽管内源性大麻素系统不能直接调节多巴胺,但在促进多巴胺释放方面起着重要作用。 (2)影响奖赏敏感性:内源性大麻素系统可以通过大麻素1型受体调控腹侧被盖区、多巴胺信号以及伏隔核中多巴胺的释放,还能够改变大脑对奖赏的敏感性[59]。RADEMACHER等[59] 通过改变急性和亚慢性约束压力来抑制大麻素1型受体活性从而降低小鼠对蔗糖偏好,导致内源性大麻素系统通过激活大麻素1型受体拮抗压力诱导的快感缺失,反复操作后反而导致内源性大麻素的张力增强,揭露了内源性大麻素系统在保护性调节奖赏敏感性方面的作用可能为抑郁症等提供治疗靶点。研究发现,选择性敲除腹侧被盖区γ-氨基丁酸能神经元上大麻素1型受体的小鼠模型表现出运动诱导的多巴胺释放显著减弱,同时伴随自发运动轮跑动机和持续时间的明显降低,有力证明了大麻素1型受体在该关键节点调控多巴胺释放对运动动机的必要性[30]。MEIER等[60]研究发现,人类μ-阿片系统通过微调奖励与惩罚的反应来增强对食物、社交等奖励的动机,但它的作用有限。内源性大麻素系统通过影响多巴胺、血清素的释放来提高调节奖赏敏感性,在压力和快感降低中发挥关键的作用。 内源性大麻素系统在向奖励事件传递信号方面具有重要意义。脂肪酸酰胺水解酶基因变异与压力的交互作用增强岛叶对食欲线索的反应,抑制脂肪酸酰胺水解酶可以缓解压力诱导的杏仁核功能异常;大麻使用者的脂肪酸酰胺水解酶A等位基因等位基因与多巴胺D3受体上调相关,降低压力的负面影响,但却增加物质使用倾向,提示内源性大麻素系统通过多巴胺调控奖赏敏感性[8,61]。在人类试验中,青春期与成年期的 Δ?-四氢大麻酚暴露通过下调不同脑区的大麻素1型受体增强中脑边缘多巴胺系统的活性,提升非药物奖赏动机;成年期暴露后对大麻素1型受体拮抗剂敏感,而青少年暴露后则出现脱敏,提示内源性大麻素系统调控奖赏敏感性的年龄依赖性神经适应[62]。 内源性大麻素系统通过大麻素1型受体和大麻素2型受体及内源性配体对奖赏敏感性进行多维度调控。小鼠实验证明,剔除大麻素1型受体基因的小鼠对自然奖赏和食物奖赏的反应显著降低,而外源性大麻素激动剂能够增强小鼠对自然奖励和食物奖赏的敏感性[63]。在人体试验中,内源性大麻素系统与多巴胺系统协同作用调控杏仁核-下丘脑-纹状体网络的突触可塑性,从而调节奖赏敏感性和行为适应性[64]。近期一项结合功能性磁共振成像和血液内源性大麻素检测的研究发现,在急性中等强度运动后,健康受试者伏隔核对奖赏线索的反应性增强程度与血浆花生四烯酸乙醇胺水平升高呈显著正相关,这为内源性大麻素系统通过增强奖赏敏感性提升人类运动动机提供了直接的行为-生理关联证据[65]。内源性大麻素系统通过大麻素1型受体来调控腹侧被盖区多巴胺信号及伏隔核多巴胺能神经递质的释放,从而驱动奖赏寻求行为,并且内源性大麻素系统协同催产素来拮抗压力导致的快感下降,从而维持敏感性,如图4所示。"
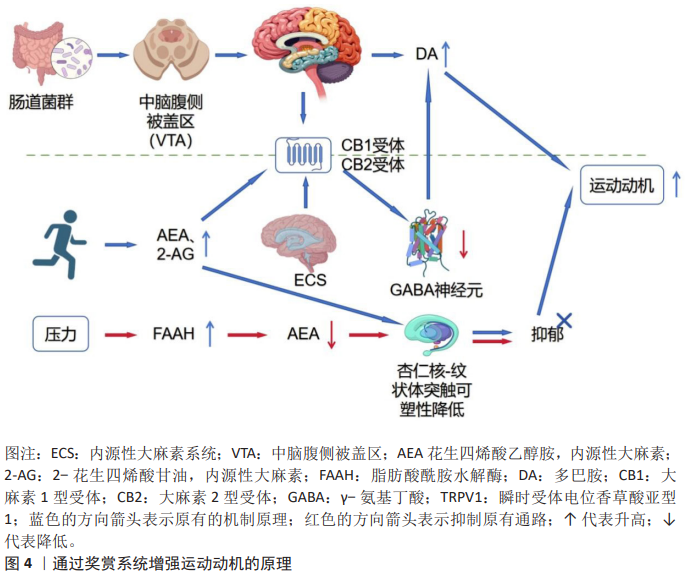
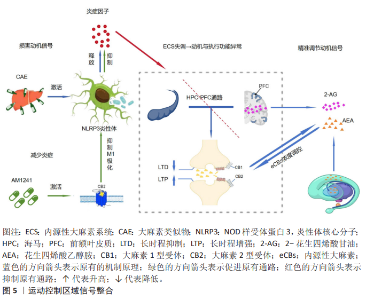
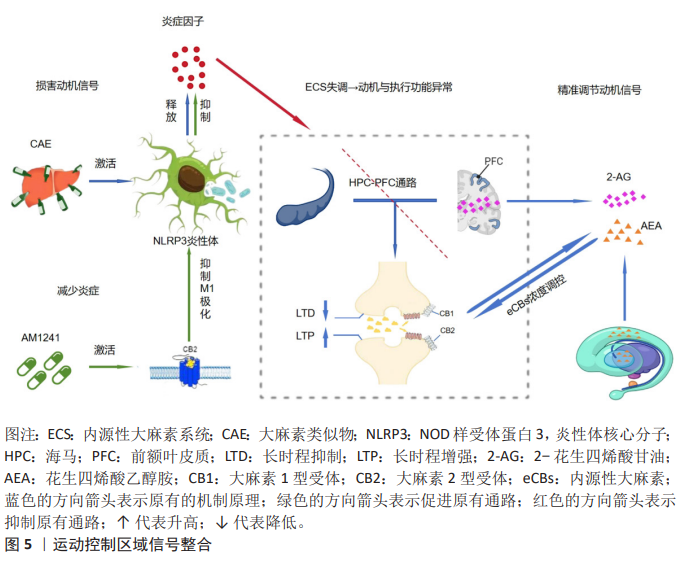
2.4.2 运动控制区域信号整合 见图5。 (1)在前额叶皮质的作用:慢性酒精暴露通过激活前额叶皮质小胶质细胞中的核苷酸结合寡聚化结构域样受体家族3炎性体及白细胞介素1β释放损害了动机信号;大麻素2型受体激动剂AM1241能够抑制小胶质细胞M1极化以及神经炎症从而逆转焦虑行为。有研究发现,内源性大麻素系统通过大麻素2型受体调控神经免疫稳态来维持运动动机[66]。近期研究发现,腹内侧前额叶皮质通过内源性大麻素调节突触的可塑性以及压力可控性来提高应对压力的能力,并且内源性大麻素系统通过调节腹内侧前额叶皮质回路导致动机信号适应性的增强,从而降低人患精神疾病的风 险[67]。内源性大麻素系统通过调控海马-前额叶皮质通路的突触可塑性以及神经递质的协同作用,维持动机信号的稳态[68]。利用光遗传学技术特异性抑制腹内侧前额叶皮质神经元活动会损害小鼠基于努力的成本-收益决策,而局部注射大麻素1型受体激动剂则能模拟运动对决策优化的效果,增强小鼠付出更高努力获取更大奖励的动机,这直接支持了内源性大麻素系统通过腹内侧前额叶皮质调控动机信号整合[69]。 有研究发现,内源性大麻素系统通过调控大麻素1型受体在γ-氨基丁酸和谷氨酸神经元中的水平以及动态平衡突触可塑性和神经微环路活性,从而实现对动机信号的精准调节[70]。 DOMINGOS等[71]的研究中发现,大麻二酚通过增强前额叶皮质突触体细胞外信号调节激酶1的磷酸化以及突触素水平,来进一步调控大麻素1型受体和大麻素2型受体的相互作用,从而改善动机信号的传导;花生四烯酸乙醇胺水平与不动行为呈负相关,表明内源性大麻素系统通过突触可塑性与神经递质协调配合共同维持运动动机的稳态。 (2)纹状体-皮质环路中内源性大麻素代谢酶的空间特异性调控:内源性大麻素代谢酶在纹状体-皮质环路中分布具有区域特异性,该酶能够通过动态调节突触中内源性大麻素浓度精准地调控与运动控制相关的动机信号。ALEGRE-ZURANO等[72]的研究发现,脂肪酸酰胺水解酶抑制剂通过上调腹侧纹状体中大麻素1型受体的表达抑制伏隔核棘神经元的激活,从而减少人体对可卡因的渴望,说明纹状体-皮质环路中代谢酶的空间特异性能够调控成瘾动机。在动物研究中,脂肪酸酰胺水解酶抑制剂URB597通过升高花生四烯酸乙醇胺、油酰胺和棕榈酰胺水平下调海马和下丘脑中脂肪酸酰胺水解酶以及纹状体中大麻素1型受体的表达,来达到抑制神经炎症和凋亡的目的,并且脂肪酸酰胺水解酶抑制剂URB597可以调控纹状体-皮质环路中代谢酶的空间分布,表明URB597通过多靶点整合机制来调节运动控制区域的动机信号[73]。在人体研究中发现,酒精依赖者的腹侧纹状体大麻素1型受体表达以及脂肪酸酰胺水解酶活性有所降低;而自杀者则表现出大麻素1型受体表达降低和脂肪酸酰胺水解酶活性的升高,表明了纹状体-皮质环路中代谢酶空间特异性与成瘾以及自杀动机信号紊乱之间的重要关联[74]。 有机磷杀虫剂通过抑制纹状体中脂肪酸酰胺水解酶和单酰甘油脂肪酶的活性以及调控内源性大麻素和类内源性大麻素代谢物水平,使得代谢酶空间特异性下降[75]。在与艾滋病相关的研究中发现,单酰甘油脂肪酶抑制剂通过降低纹状体中羟基二十碳四烯酸炎症脂质水平发挥抗炎和神经保护作用[76]。 综上所述,调控纹状体-皮质环路中代谢酶的空间特异性能够精确调控内源性大麻素水平,从而精准调节运动控制区域的动机信号,参与成瘾及神经疾病的病理过程。通过注射病毒载体在背外侧纹状体特异性过表达脂肪酸酰胺水解酶后,小鼠表现出运动协调性任务学习动机的显著下降,而局部注射脂肪酸酰胺水解酶抑制剂则可逆转此效应,直接证明了纹状体脂肪酸酰胺水解酶的空间特异性表达在调控运动学习动机中的关键作 用[77]。"
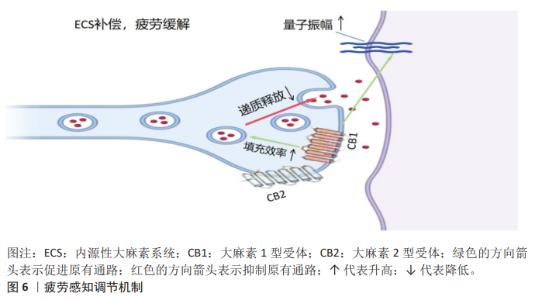
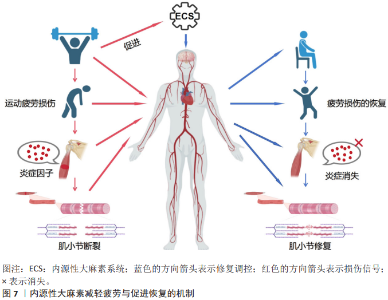
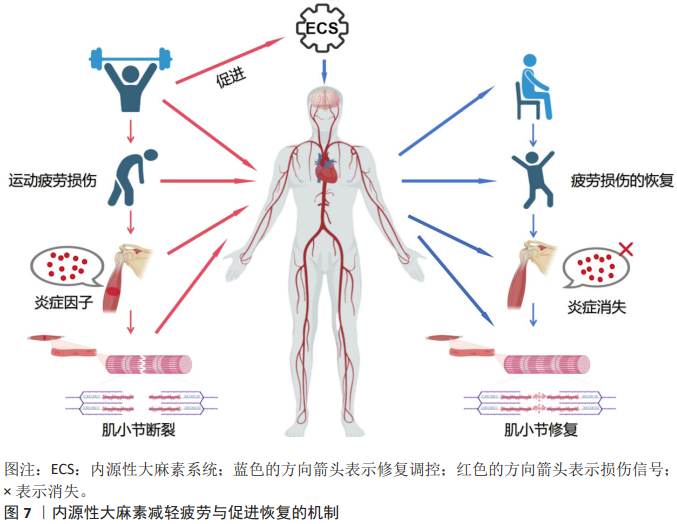
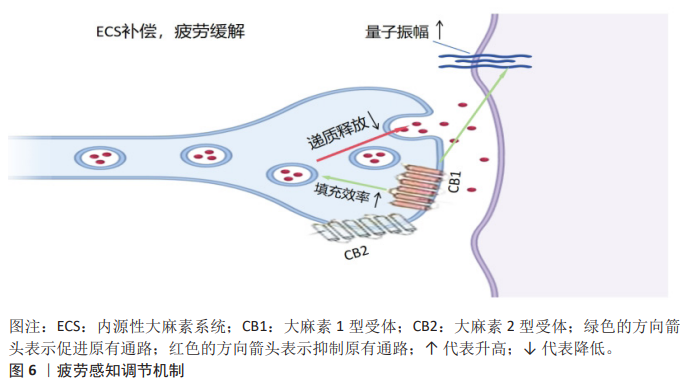
2.4.3 减轻疲劳与促进恢复 疲劳感知调节:系统通过调节疲劳感知减轻运动后疲劳感,从而提升运动参与的积极性。内源性大麻素通过与大麻素1型受体结合减轻运动后引发的疲劳感知,从而促进恢复过程。在运动训练和恢复中,内源性大麻素通过调节大脑对疲劳的处理达到提高运动动机的目的。运动后,内源性大麻素水平升高与大脑皮质的神经活动有关,正是这种关联促进了恢复性行为的产生。内源性大麻素对肌肉和运动耐力的影响也是通过调节中枢神经系统来发挥作用,从而减少运动过程中的身体不适感,达到提升持续运动动机的目的。在重症肌无力小鼠模型中发现,内源性大麻素系统通过大麻素1型受体和大麻素2型受体增强神经肌肉接头突触小泡的活性,提升量子振幅,从而补偿运动过程中递质释放的减少,这就是通过调节神经传递效能来缓解疲劳感知的新机制[78]。血流限制性训练通过内源性大麻素调节疼痛抑制以及代谢物积累模拟高强度运动产生的效应,降低痛觉敏感性,揭示了血流限制性训练通过改变局部组织生理学来调节疲劳感知的能 力[79]。内源性大麻素系统通过大麻素1型受体和大麻素2型受体减少身体运动所带来的疲劳感,同时也通过降低疼痛敏感性减轻运动后的痛苦,从而增强人们的运动动机,如图6所示。 促进运动后恢复:研究表明,急性运动可以提升花生四烯酸乙醇胺水平、脑源性神经营养因子的释放及作用时间,增强神经可塑性,证明内源性大麻素通过调节花生四烯酸乙醇胺-脑源性神经营养因子轴缓解运动疲劳和调节运动动机[80]。大麻素1型受体拮抗剂利莫那班可以抑制肌肉炎症和凋亡制、促进肌肉再生肌纤维生长能力、提升损伤后肌肉力量恢复速度,揭示内源性大麻素系统在运动后组织修复的能力[81]。内源性大麻素参与控制运动的临时动机[82]。研究表明,内源性大麻素系统通过调控细胞因子和炎症反应增强免疫系统反应性,减少运动后的炎症、促进身体恢复[83],这一过程通过调节大麻素1型受体优化神经修复机制,从而减轻由过度运动带来的负面影响;内源性大麻素还可以通过调节神经内分泌系统改善压力对运动后恢复过程的影响,帮助个体更快地消除运动后的压力和焦虑,恢复到运动前的状态[84],如图7所示。"
| [1] 洪金涛,陈思同,刘阳.《身体活动汇编》(Compendium of Physical Activities):内容、应用与发展[J].上海体育学院学报,2020,44(9):53-63. [2] LOWE H, TOYANG N, STEELE B, et al. The Endocannabinoid System: A Potential Target for the Treatment of Various Diseases. Int J Mol Sci. 2021;22(17):9472. [3] MATEI D, TROFIN D, IORDAN DA, et al. The Endocannabinoid System and Physical Exercise. Int J Mol Sci. 2023;24(3):1989. [4] Koutek B, Prestwich GD, Howlett AC, et al. Inhibitors of arachidonoyl ethanolamide hydrolysis. J Biol Chem. 1994;269(37):22937-22940. [5] KONRAD RJ, MAJOR CD, WOLF BA. Diacylglycerol hydrolysis to arachidonic acid is necessary for insulin secretion from isolated pancreatic islets: sequential actions of diacylglycerol and monoacylglycerol lipases. Biochemistry. 1994;33(45):13284-13294. [6] MATSUDA LA, LOLAIT SJ, BROWNSTEIN MJ, et al. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature. 1990;346(6284):561-564. [7] VOGEL Z, BARG J, LEVY R, et al. Anandamide, a brain endogenous compound, interacts specifically with cannabinoid receptors and inhibits adenylate cyclase. J Neurochem. 1993;61(1):352-355. [8] RICE AS, FARQUHAR-SMITH WP, NAGY I. Endocannabinoids and pain: spinal and peripheral analgesia in inflammation and neuropathy. Prostaglandins Leukot Essent Fatty Acids. 2002;66(2-3):243-256. [9] GAMBI F, DE BERARDIS D, SEPEDE G, et al. Cannabinoid receptors and their relationships with neuropsychiatric disorders. Int J Immunopathol Pharmacol. 2005;18(1):15-19. [10] TAM J, TREMBOVLER V, DI MARZO V, et al. The cannabinoid CB1 receptor regulates bone formation by modulating adrenergic signaling. FASEB J. 2008;22(1):285-294. [11] RAJESH M, BÁTKAI S, KECHRID M, et al. Cannabinoid 1 receptor promotes cardiac dysfunction, oxidative stress, inflammation, and fibrosis in diabetic cardiomyopathy. Diabetes. 2012;61(3):716-727. [12] BÁTKAI S, MUKHOPADHYAY P, HORVÁTH B, et al. Δ8-Tetrahydrocannabivarin prevents hepatic ischaemia/reperfusion injury by decreasing oxidative stress and inflammatory responses through cannabinoid CB2 receptors. Br J Pharmacol. 2012;165(8):2450-2461. [13] MACCARRONE M, BAB I, BÍRÓ T, et al. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol Sci. 2015;36(5):277-296. [14] COLUCCI S, COLAIANNI G, BRUNETTI G, et al. Irisin prevents microgravity-induced impairment of osteoblast differentiation in vitro during the space flight CRS-14 mission. FASEB J. 2020;34(8):10096-10106. [15] LIU M, WANG D, QI C, et al. Brain ischemia causes systemic Notch1 activity in endothelial cells to drive atherosclerosis. Immunity. 2024;57(9):2157-2172.e7. [16] Dietrich A, McDaniel WF. Endocannabinoids and exercise. Br J Sports Med. 2004;38(5):536-541. [17] GUZMAN M. Cannabinoids: Potential anticancer agents. Nat Rev Cancer. 2003;3(10):745-755. [18] BOROWSKA M, CZARNYWOJTEK A, SAWICKA-GUTAJ N, et al. The effects of cannabinoids on the endocrine system. Endokrynol Pol. 2018;69(6):705-719. [19] SRIVASTAVA RK, LUTZ B, RUIZ DE AZUA I. The Microbiome and Gut Endocannabinoid System in the Regulation of Stress Responses and Metabolism. Front Cell Neurosci. 2022;16:867267. [20] WELLER K, REEH PW, SAUER SK. TRPV1, TRPA1, and CB1 in the isolated vagus nerve--axonal chemosensitivity and control of neuropeptide release. Neuropeptides. 2011;45(6):391-400. [21] GORZALKA BB, HILL MN. Putative role of endocannabinoid signaling in the etiology of depression and actions of antidepressants. Prog Neuropsychopharmacol Biol Psychiatry. 2011;35(7):1575-1585. [22] REZENDE B, ALENCAR AKN, DE BEM GF, et al. Endocannabinoid System: Chemical Characteristics and Biological Activity. Pharmaceuticals (Basel). 2023;16(2):148. [23] ZAJKOWSKA ZE, ENGLUND A, ZUNSZAIN PA. Towards a personalized treatment in depression: endocannabinoids, inflammation and stress response. Pharmacogenomics. 2014;15(5):687-698. [24] FILBEY FM, BEATON D, PRASHAD S. The contributions of the endocannabinoid system and stress on the neural processing of reward stimuli. Prog Neuropsychopharmacol Biol Psychiatry. 2021;106:110183. [25] TURCO F, BRUGNATELLI V, ABALO R. Neuro-Gastro-Cannabinology: A Novel Paradigm for Regulating Mood and Digestive Health. Med Cannabis Cannabinoids. 2023;6(1):130-137. [26] GROENEWEGEN HJ. The basal ganglia and motor control. Neural Plast. 2003;10(1-2):107-120. [27] DOHNALOVÁ L, LUNDGREN P, CARTY JRE, et al. A microbiome-dependent gut-brain pathway regulates motivation for exercise. Nature. 2022;612(7941):739-747. [28] 王其飞,杜兴彬,孔健达.中枢疲劳的神经生理基础及运动诱发机制[J].中国组织工程研究,2025,29(32):6979-6988. [29] 牟连伟,葛未未,王海英,等.运动奖赏效应及其神经生物学机制的研究进展[J].生命科学,2023,35(3):360-366. [30] 王海军,牛亚凯,陈巍.内源性大麻素系统在运动促进脑健康中的研究进展[J].生命科学,2021,33(09):1096-1103. [31] STEEL RP, BISHOP NC, TAYLOR IM. The effect of autonomous and controlled motivation on self-control performance and the acute cortisol response. Psychophysiology. 2021;58(11):e13915. [32] BOSTAN AC, STRICK PL. The basal ganglia and the cerebellum: nodes in an integrated network. Nat Rev Neurosci. 2018;19(6):338-350. [33] BROMBERG-MARTIN ES, MATSUMOTO M, HIKOSAKA O. Dopamine in motivational control: rewarding, aversive, and alerting. Neuron. 2010;68(5):815-834. [34] OTT T, NIEDER A. Dopamine and Cognitive Control in Prefrontal Cortex. Trends Cogn Sci. 2019;23(3):213-234. [35] STUBER GD. Neurocircuits for motivation. Science. 2023;382(6669):394-398. [36] 陈依琪,韩曼,邹佳,等.运动技能学习的小脑环路机制[J].生命科学,2023,35(2):157-164. [37] 魏龙威,王寅昊,杨子铮,等.伏隔核多巴胺受体与MSNs调控运动动机的神经机制[J].体育科学,2024,44(12):58-69. [38] 蔡厚德,刘昌.大脑前扣带回皮层与执行功能[J].心理科学进展,2004,12(5):643-650. [39] WONG R, SESA-ASHTON G, DATTA S, et al. The role of the dorsolateral prefrontal cortex in control of skin sympathetic nerve activity in humans. Cereb Cortex. 2023;33(13):8265-8272. [40] 曹娜,孟海江,王艳秋,等.左侧背外侧前额叶在程序性运动学习中的作用[J].心理学报,2020,52(5):597-608. [41] 黄嘉雯,叶懂焕,庄中天,等.冷环境、运动与限食通过ghrelin/Goat/GHS-R系统调节能量平衡的研究进展[J].生命科学,2022,34(12):1540-1549. [42] 马震武,朱浩,王晓东.下丘脑神经干细胞调控能量平衡与肥胖的研究进展[J].南京医科大学学报(自然科学版),2024,44(5):738-742. [43] HERMAN JP, MCKLVEEN JM, GHOSAL S, et al. Regulation of the Hypothalamic-Pituitary-Adrenocortical Stress Response. Compr Physiol. 2016;6(2):603-321. [44] MYERS B, MCKLVEEN JM, HERMAN JP. Neural Regulation of the Stress Response: The Many Faces of Feedback. Cell Mol Neurobiol. 2012;32(5):683-694. [45] REIS-SILVA TM, SANDINI TM, CALEFI AS, et al. Stress resilience evidenced by grooming behaviour and dopamine levels in male mice selected for high and low immobility using the tail suspension test. Eur J Neurosci. 2019;50(6):2942-2954. [46] 陈爱萍,王惠芹,陈乃宏.抑郁症发病与HPA轴紊乱研究进展[J].生命科学,2025,37(3):250-260. [47] XU X, ZHENG S, REN J, et al. Hypothalamic CRF neurons facilitate brain reward function. Curr Biol. 2024;34(2):389-402.e5. [48] HORENSTEIN A, KAPLAN SC, BUTLER RM, et al. Social anxiety moderates the relationship between body mass index and motivation to avoid exercise. Body Image. 2021;36:185-192. [49] WALSH JJ, TSCHAKOVSKY ME. Exercise and circulating BDNF: Mechanisms of release and implications for the design of exercise interventions. Appl Physiol Nutr Metab. 2018;43(11):1095-1104. [50] 魏高峡,盖力锟,林萱.运动认知神经科学研究(2012-2022):10年回顾与未来展望[J].科学通报,2024,69(24):3492-3514. [51] 王少堃,王世强,王一杰,等.运动对抑郁症的影响及其神经生物学机制研究进展[J].中国全科医学,2022,25(27):3443-3451. [52] 朱昭红,马骁,张俊峰.心理疲劳对认知控制和动机影响的外周生理机制[J].心理与行为研究,2013,11(6):752-758. [53] QI P, RU H, GAO LY, et al. Neural Mechanisms of Mental Fatigue Revisited: New Insights from the Brain Connectome. Engineering. 2019;5(2):276-286. [54] PETERS KZ, CHEER JF, TONINI R. Modulating the Neuromodulators: Dopamine, Serotonin, and the Endocannabinoid System. Trends Neurosci. 2021;44(6):464-477. [55] MLOST J, WĄSIK A, STAROWICZ K. Role of endocannabinoid system in dopamine signalling within the reward circuits affected by chronic pain. Pharmacol Res. 2019;143:40-47. [56] GARDNER EL. Endocannabinoid signaling system and brain reward: emphasis on dopamine. Pharmacol Biochem Behav. 2005;81(2):263-284. [57] HERNANDEZ G, CHEER JF. To Act or Not to Act: Endocannabinoid/Dopamine Interactions in Decision-Making. Front Behav Neurosci. 2015;9:336. [58] VOLKOW ND, HAMPSON AJ, BALER RD. Don’t Worry, Be Happy: Endocannabinoids and Cannabis at the Intersection of Stress and Reward. Annu Rev Pharmacol Toxicol. 2017;57:285-308. [59] RADEMACHER DJ, HILLARD CJ. Interactions between endocannabinoids and stress-induced decreased sensitivity to natural reward. Prog Neuropsychopharmacol Biol Psychiatry. 2007;31(3):633-641. [60] MEIER IM, EIKEMO M, LEKNES S. The Role of Mu-Opioids for Reward and Threat Processing in Humans: Bridging the Gap from Preclinical to Clinical Opioid Drug Studies. Curr Addict Rep. 2021;8(2):306-318. [61] HALBOUT B, HUTSON C, HUA L, et al. Long-term effects of THC exposure on reward learning and motivated behavior in adolescent and adult male rats. Psychopharmacology (Berl). 2023;240(5):1151-1167. [62] BRAND T, SPANAGEL R, SCHNEIDER M. Decreased reward sensitivity in rats from the Fischer344 strain compared to Wistar rats is paralleled by differences in endocannabinoid signaling. PLoS One. 2012;7(2):e31169. [63] LARICCHIUTA D, PETROSINI L. Individual differences in response to positive and negative stimuli: endocannabinoid-based insight on approach and avoidance behaviors. Front Syst Neurosci. 2014;8:238. [64] LI J, WANG H, LIU D, et al. CB2R activation ameliorates late adolescent chronic alcohol exposure-induced anxiety-like behaviors during withdrawal by preventing morphological changes and suppressing NLRP3 inflammasome activation in prefrontal cortex microglia in mice. Brain Behav Immun. 2023;110:60-79. [65] 梁翊昆,严舒雅,张美淇,等.暴食障碍神经心理机制研究进展[J].中国神经精神疾病杂志,2025,51(4):252-256. [66] WORLEY NB, HILL MN, CHRISTIANSON JP. Prefrontal endocannabinoids, stress controllability and resilience: A hypothesis. Prog Neuropsychopharmacol Biol Psychiatry. 2018;85:180-188. [67] RUGGIERO RN, ROSSIGNOLI MT, MARQUES DB, et al. Neuromodulation of Hippocampal-Prefrontal Cortical Synaptic Plasticity and Functional Connectivity: Implications for Neuropsychiatric Disorders. Front Cell Neurosci. 2021;15:732360. [68] DOW-EDWARDS D, SILVA L. Endocannabinoids in brain plasticity: Cortical maturation, HPA axis function and behavior. Brain Res. 2017;1654(Pt B):157-164. [69] 黄文强,杨沙沙,于萍.风险决策的神经机制:基于啮齿类动物研究[J].心理科学进展,2016,24(11):1767-1779. [70] SARIKAHYA MH, COUSINEAU SL, DE FELICE M, et al. Prenatal THC exposure induces long-term, sex-dependent cognitive dysfunction associated with lipidomic and neuronal pathology in the prefrontal cortex-hippocampal network. Mol Psychiatry. 2023;28(10):4234-4250. [71] DOMINGOS LB, MÜLLER HK, DA SILVA NR, et al. Repeated cannabidiol treatment affects neuroplasticity and endocannabinoid signaling in the prefrontal cortex of the Flinders Sensitive Line (FSL) rat model of depression. Neuropharmacology. 2024;248:109870. [72] ALEGRE-ZURANO L, GARCÍA-BAOS A, CASTRO-ZAVALA A, et al. The FAAH inhibitor URB597 reduces cocaine intake during conditioned punishment and mitigates cocaine seeking during withdrawal. Biomed Pharmacother. 2023;165:115194. [73] RIVERA P, BINDILA L, PASTOR A, et al. Pharmacological blockade of the fatty acid amide hydrolase (FAAH) alters neural proliferation, apoptosis and gliosis in the rat hippocampus, hypothalamus and striatum in a negative energy context. Front Cell Neurosci. 2015;9:98. [74] VINOD KY, KASSIR SA, HUNGUND BL, et al. Selective alterations of the CB1 receptors and the fatty acid amide hydrolase in the ventral striatum of alcoholics and suicides. J Psychiatr Res. 2010;44(9):591-597. [75] LIU J, PARSONS L, POPE C. Comparative effects of parathion and chlorpyrifos on endocannabinoid and endocannabinoid-like lipid metabolites in rat striatum. Neurotoxicology. 2015;50:20-27. [76] LEAGUE AF, YADAV-SAMUDRALA BJ, KOLAGANI R, et al. A helping HAND: therapeutic potential of MAGL inhibition against HIV-1-associated neuroinflammation. Front Immunol. 2024;15:1374301. [77] RAFIEI D, DE POL M, MEYER JH, et al. Fatty acid amide hydrolase in major depressive episodes: A [11C]CURB positron emission tomography study. Neuropsychopharmacology. 2025;50(10):1536-1543. [78] MORSCH M, PROTTI DA, CHENG D, et al. Cannabinoid-induced increase of quantal size and enhanced neuromuscular transmission. Sci Rep. 2018;8(1):4685. [79] HUGHES L, PATTERSON SD. Low intensity blood flow restriction exercise: Rationale for a hypoalgesia effect. Med Hypotheses. 2019;132:109370. [80] HEYMAN E, GAMELIN FX, GOEKINT M, et al. Intense exercise increases circulating endocannabinoid and BDNF levels in humans--possible implications for reward and depression. Psychoneuroendocrinology. 2012;37(6):844-851. [81] DALLE S, SCHOUTEN M, VANDERBEKE K, et al. The CB1 antagonist Rimonabant improves muscle regeneration and remodels the inflammatory and endocannabinoid profile upon injury in male mice. Life Sci. 2025;361:123296. [82] FORTEZA F, GIORGINI G, RAYMOND F. Neurobiological Processes Induced by Aerobic Exercise through the Endocannabinoidome. Cells. 2021;10(4):938. [83] AMERSFOORT J, EELEN G, CARMELIET P. Immunomodulation by endothelial cells - partnering up with the immune system? Nat Rev Immunol. 2022;22(9):576-588. [84] FORNER-PIQUER I, GIOMMI C, SELLA F, et al. Endocannabinoid System and Metabolism: The Influences of Sex. Int J Mol Sci. 2024;25(22):11909. |
| [1] | Leng Xiaoxuan, Zhao Yuxin, Liu Xihua. Effects of different neuromodulatory stimulation modalities on non-motor symptoms in Parkinson’s patients: a network meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1282-1293. |
| [2] | Zhang Qingtong, Chen Leqin, Liu Chang, Chen Yuting, Guo Ruiwu. Neuro mechanism of the endocannabinoid system in regulating exercise motivation [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(18): 4726-4736. |
| [3] | Gao Shiai, Yu Zifu, Chen Jinhui, Cao Xinyan, Leng Xiaoxuan, Liu Xihua. Efficacy of non-invasive neuromodulation techniques on autism spectrum disorder: a network meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2550-2559. |
| [4] | Zhang Shuai, You Shengnan, Du Wenjing, Wang Lei, Xu Guizhi. Effects of transcranial magneto-acoustical stimulation on beta oscillations in neural circuits of healthy and Parkinson’s disease rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(16): 2519-2526. |
| [5] | Fan Danyang, Fu Runze, Mi Jiajing, Liu Chunyan. Expression and role of cannabinoid receptors during bone remodeling [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(2): 283-288. |
| [6] | Cao Qingjun, Yang Fenghua, Wang Hua. Hippocampal astrocytes in juvenile rats with persistent epilepsy: the role of cannabinoid receptor type 2 in regulating MAPK pathway [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(32): 5179-5185. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||