Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (1): 204-217.doi: 10.12307/2025.543
Previous Articles Next Articles
Engineered exosomes for repairing tissue damage: application potential, excellent biological stability, and targeting specificity
Luo Wenbin1, Li Ruoyun1, Pan Chaofan1, Luo Changjiang2
- 1Second Clinical Medical School, Lanzhou University, Lanzhou 730030, Gansu Province, China; 2Department of Hernia and Abdominal Wall Surgery, Second Hospital of Lanzhou University, Lanzhou 730030, Gansu Province, China
-
Received:2024-07-16Accepted:2024-09-06Online:2026-01-08Published:2025-07-02 -
Contact:Luo Changjiang, Chief physician, Master’s supervisor, Department of Hernia and Abdominal Wall Surgery, Second Hospital of Lanzhou University, Lanzhou 730030, Gansu Province, China -
About author:Luo Wenbin, Master candidate, Second Clinical Medical School, Lanzhou University, Lanzhou 730030, Gansu Province, China -
Supported by:Natural Science Foundation of Gansu Province, No. 21JR1RA139 (to LCJ)
CLC Number:
Cite this article
Luo Wenbin, Li Ruoyun, Pan Chaofan, Luo Changjiang. Engineered exosomes for repairing tissue damage: application potential, excellent biological stability, and targeting specificity[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(1): 204-217.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
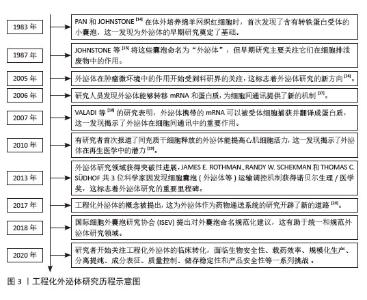
2.1 工程化外泌体与组织修复的研究历程 工程化外泌体在组织修复领域的研究历程充满着创新和突破。在1983年,外泌体首次被PAN和JOHNSTONE[14]发现,他们在体外培养的绵羊网织红细胞上清液中观察到存在小囊泡。随后在1987年,JOHNSTONE等[15]首次将这些小囊泡命名为“exosome”,即外泌体。早期的科学研究中,外泌体一直被认为是细胞代谢废物,并未对其功能机制深入探索。从2005年开始,外泌体在细胞中的作用开始受到关注,研究人员认识到外泌体可能与细胞间通讯有关[16-17],直到2007年,VALADI等[18]首次发现外泌体的机制,并认识到其是一种介导细胞间通讯的重要载体,自此外泌体开始被广泛研究。在2010年,有研究首次发现并报道了外泌体提高心肌活力,这预示着外泌体在再生医学中的应用潜力[19]。在2013年,外泌体的研究获得突破性进展,3位科学家因发现外泌体运输调控机制获得诺贝尔生理/医学奖,这标志着外泌体研究的重要里程碑,极大地推动了外泌体研究的热潮。此后,随着工程化外泌体概念的提出和外泌体命名的规范化[20],外泌体作为药物递送载体在全球范围内被广泛研究。在2020年以后,研究者们开始关注工程化外泌体在的临床转化,这带来了一系列挑战。直到今天,工程化外泌体的研究迅速发展,它们在肿瘤、心血管疾病、组织再生与修复以及神经系统疾病等领域展现出良好的临床应用潜力,并且比天然外泌体展现出了更好的治疗效果及靶向性。外泌体的工程化与组织修复的研究时间线见图3。 "

2.2 外泌体的来源 外泌体可从多种细胞类型中提取,包括但不限于干细胞、巨噬细胞、免疫细胞和肿瘤细胞[21]。不同细胞来源的外泌体各自表现出独特的生物学效应。例如,肿瘤来源的外泌体不仅参与肿瘤增殖、侵袭、转移和免疫,还可以用作癌症诊断和治疗的生物标志物[22]。间充质干细胞外泌体在组织再生中具有关键功能,POMATTO等[23]研究了骨髓间充质干细胞和脂肪源性干细胞外泌体在促进伤口愈合方面的生物活性,对比分析发现,间充质干细胞外泌体主要携带与血管生成相关的分子,而脂肪源性干细胞外泌体则主要与细胞增殖过程相关。免疫细胞产生的外泌体,包括单核细胞、白细胞、粒细胞和淋巴细胞,在新生血管形成、凝血和炎症细胞的招募中发挥着关键作用,这对于损伤后的适当炎症反应和组织修复至关重要[24]。 2.3 外泌体的工程化 尽管不同来源的外泌体表现出多种多样的功能,但天然外泌体在临床应用中也暴露出半衰期短、靶向特性差及靶向部位浓度低的特点[25]。同时,不加载任何药物的天然外泌体常治疗效果有限,因此,可根据临床需要应用相应的生物技术对外泌体进行修饰,从而产生工程化外泌体[26]。与天然外泌体相比,工程化外泌体可提高其在损伤组织中的靶向性、增强生物活性以及改善稳定性[27-28]。修饰外泌体有两种策略,分别为内部策略(功能装载)和外部策略(表面修饰)。此外,也可通过对细胞进行预处理使其释放的外泌体获得更特异的生物活性,产生更好的治疗效果[7]。 2.3.1 功能装载 在组织修复的研究中,外泌体能够搭载特定的治疗性分子,从而转化为具有特定疗效的制剂,这有助于促进受损组织的修复和再生[29]。外泌体由于在稳定性、非免疫原性以及对靶向受体细胞的特异性中展现出了作为药物传递的理想治疗载体的巨大潜力,其功能装载方式包括分泌前载药和分泌后载药[30],具体取决于其应用于外泌体生成前还是生成后。 分泌前载药是指将治疗剂负载在母细胞上以分泌工程化外泌体,包括病毒转染、共孵育等方式,病毒转染以慢病毒为载体,将特定功能的微小RNA转染进干细胞,获得的工程化外泌体可通过表达特定功能促进组织修复[31]。共孵育是指利用母细胞的内吞作用将细胞质中的部分治疗剂加载到分泌的外泌体中的方式,将治疗药物与母细胞共孵育后,从中提取的工程化外泌体根据所含药物分子多少可不同程度的获得该药物的功能[32]。这种直接处理母细胞的方式相对操作简单,但难以控制载药效率,故而应用较少。 分泌后载药是指治疗剂以某种方式直接加入到外泌体中,由于是在外泌体分离后进行,因而在更好地控制外泌体量的同时可以保证更高的装载效率,包括电穿孔、孵育、超声处理、冻融循环、挤压法和低渗透析等方式。电穿孔是将外泌体和治疗剂的悬浮液暴露在电场中,治疗剂经由外泌体膜在短高压脉冲下产生的孔隙渗入。通过电穿孔可封装药物或特定微小RNA以获得特定功能的工程化外泌体[33-34],该方法负载药物简单且高效,但也会破坏膜结构完整性并降低药物负载效率。分泌后载药中的孵育与分泌前载药中的共孵育相似,治疗剂直接与外泌体在适当条件下孵育混合而非母细胞。外泌体可通过与不同的治疗药物或微小RNA孵育以获得期望的治疗效果[35-36],该方法不影响外泌体膜结构的完整性,但需要大量的治疗药物进行孵育,仍有负载效率低的缺点。超声处理相对于以上两种方式有着高效的负载效率,YERNENI等[37]的研究就发现通过超声处理将姜黄素封装入外泌体中可以获得更好的装载效率。冻融循环是将外泌体与药物混合并在-80 ℃或液氮下冷冻,然后在室温下解冻,但其负载效率相比超声处理常较低。HAJIPOUR等[38]同时应用超声处理和冻融循环两种方式封装外泌体,发现超声处理法的封装效率平均值为(40.55±4.21)%,冻融循环法的平均值为(14.02±5.46)%。挤出通常使用挤出机来负载药物,挤出过程中外泌体膜破裂并与治疗剂剧烈混合,挤出法可以获得更高的载药量。皂苷能选择性地与结合在外泌体膜上的胆固醇形成复合物,在膜表面形成多孔结构,从而促进外泌体与药物的结合。一项研究分别利用皂苷透化和挤出法将超氧化物歧化酶装载到外泌体中,封装效率分别为(12.80±1.05)%和(25.22±0.45)%[39]。不同的工程化策略各有优劣差异,见表1。高负载效率的装载方式有超声处理和挤出法两种,但这2种方式都有破坏质膜结构而导致药物泄露的风险,尤其是挤出法风险更大,更有产生细胞毒性的可能,未来的研究可以以较为温和的超声处理为研究方向处理外泌体,在获得高负载效率的同时不致破坏外泌体膜结构。"

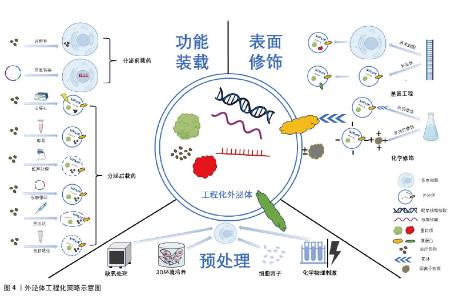
2.3.2 表面修饰 外泌体的表面修饰是将外泌体表面蛋白作为锚定装置处理的过程,并通过一定手段引入特定的靶向配体、肽段或抗体,进而提高外泌体的靶向性、稳定性和治疗效率[40],其修饰方式包括基因工程和化学修饰。外泌体表面膜蛋白或亲本细胞可以通过基因工程进行修饰,来调控外泌体表面特异性蛋白质的表达,进而有效地调控受体细胞的功能。又或是通过基因工程在不影响外泌体的结构完整性和特性情况下引入具有关键治疗效果的分子(如蛋白质和微小RNA)[41]。外泌体的基因工程常通过CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)技术进行,这是一种源自细菌的基因组编辑技术,已在生命科学领域得到广泛应用。利用CRISPR技术可构建活性酶表达载体并转染到外泌体供体细胞,最终得到的工程化外泌体可通过诱导基因的改变以调节蛋白表达[42]。 此外,外泌体还可以作为一种有效的基因编辑工具载体,通过调控基因表达治疗疾病。CHEN等[43]基于技术,将成纤维细胞生长因子18靶向基因编辑工具载入外泌体,发现其在体内基因组水平能够有效激活成纤维细胞生长因子18基因。另一项研究中同样发现外泌体作为载体能介导CRISPR核糖核蛋白复合体以靶向小鼠肝细胞中的前蛋白转化酶枯草杆菌蛋白酶基因的传递和编辑[44]。上述研究表明,基因工程可通过调控基因表达实现更为精细高效的治疗手段。然而,基因工程修饰需综合考虑多种因素,包括亲本细胞的特性、调控基因表达载体的设计、高度靶向性的实现以及预期疗效。因此,该方法需要严格的实验设计和验证来确定最合适的基因编辑工具载体和实验条件。尽管基因工程有诸多优点,然而,基因工程的可重复性仍然存在争议,相较而言,化学修饰已经发展成为一种更为通用的方法[45]。 化学修饰通过共价修饰(如点击化学)和非共价修饰(如静电相互作用)外泌体表面膜蛋白来制备工程化外泌体。点击化学可以将配体直接化学偶联到外泌体表面,以提高外泌体靶向性,如利用点击化学技术将神经元靶向肽狂犬病病毒糖蛋白连接于外泌体可获得更高的神经元靶向效率[46]。或将梭状芽胞杆菌神经毒素以点击化学方法连接于外泌体表面可增强其向神经肌肉接头和坐骨神经组织中的转运[47]。但其应用不止于此,利用点击化学修饰外泌体原理还可调节体内外泌体,DENG等[48]发现二苄基-环炔修饰的纳米颗粒可以通过生物正交点击反应与肿瘤细胞和肿瘤细胞源性外泌体发生特异性反应来抑制外泌体通讯,进而抑制肿瘤的远处转移,这可能为未来肿瘤性疾病的治疗提供新的策略。共价修饰可以简单高效的将所需的配体连接于外泌体表面,这种方式有着更高的稳定性和可重复性,修饰后的外泌体可以有效地将小分子递送至靶向器官;但其缺点在于需要有毒化学物质诱导稳定键的形成,从而破坏外泌体表面膜蛋白的结构完整性,因此在体内或体外实验中应用共价修饰必须谨慎。非共价修饰中的静电相互作用是基于外泌体高度带负电荷的的磷脂双层膜,高价阳离子物质可通过静电相互作用与外泌体表面结合,利用静电力将阳离子物质负载到外泌体表面,这种方式操作简单且能够有效提高外泌体靶向能力,但对比共价修饰加载效率低下。一项研究将软骨靶向的带正电荷精氨酸阳离子基序锚定到外泌体表面,获得了能够穿透人类关节炎软骨全层并有效靶向组织深层软骨细胞的工程化外泌体[49]。另一项研究用同样的方式构建出仅通过局部途径就可将信使RNA定向递送至视网膜光感受器的工程化外泌体[50]。可以看到,静电相互作用形成的阳离子外泌体在治疗疾病中有着更好的穿透力和靶向性,其渗透机制不单纯是静电相互作用连接阳离子物质,可能涉及到膜成分和孔径的变化,具体仍需要进一步研究。 2.3.3 预处理 细胞预处理的方式主要包括缺氧、3D培养、细胞因子、各种物理或化学刺激等。低氧条件下培养的许多特定细胞类型,包括间充质干细胞,常有着更强的增殖能力。研究表明,缺氧可能通过激活糖酵解来提高间充质干细胞的增殖和遗传稳定性[51]。此外,缺氧还可诱导缺氧诱导因子的激活,进而激活血管内皮生长因子和C-X-C基序趋化因子受体4等血管生成基因的转录来促进血管生成[52]。由于2D培养环境和体内3D微环境存在差异,3D培养下的间充质干细胞有着更好的增殖分化特性,进而增强外泌体的治疗特性[53]。目前,3D-外泌体在内皮细胞增殖、迁移和血管生成等多种损伤修复方面具有独特的优势[54]。细胞因子已被证明可以提高旁分泌效率,并调节间充质干细胞中不同潜在治疗因子(包括外泌体)的产生和释放。一项研究就发现白细胞介素1β处理间充质干细胞分离得到的外泌体显著抑制星形胶质细胞炎症反应[55]。除以上处理外,间充质干细胞还易受到化学和物理刺激信号影响并改变其特性,进而调节外泌体分泌,这对组织修复和免疫调节具有关键作用[56]。众多预处理方式,目前仅缺氧处理获得的工程化外泌体促组织修复机制研究较明确,因此应用较广泛,其余处理方法的潜在机制有待进一步研究。外泌体的3种工程化策略示意图见图4。 "
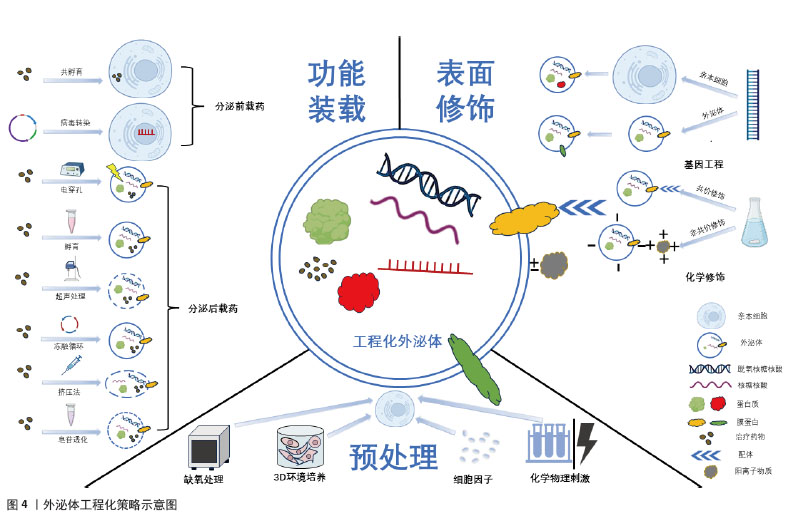
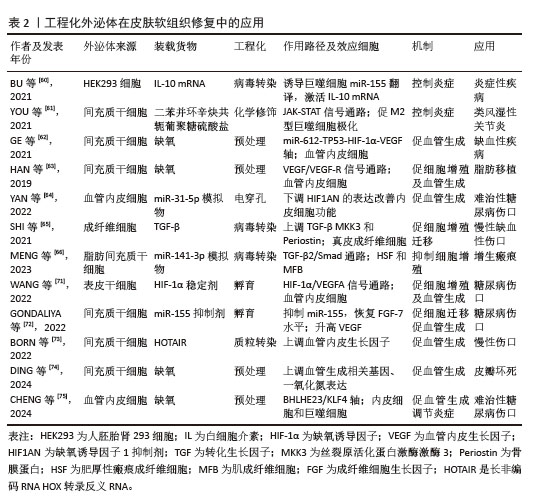
2.4 工程化外泌体在不同组织修复中的应用 尽管外泌体治疗自身在促进组织修复方面已有相当的进展,但其应用效果尚未满足临床需求。先前的研究已发现外泌体促进组织修复是通过疾病特异性的细胞组织反应和组织特异性分子信号通路来实现的[30],因此,通常选用疾病相关细胞来源的外泌体对该疾病造成的组织损害进行修复,如在皮肤软组织修复中使用真皮成纤维细胞或是来自上皮组织的血管内皮细胞获得外泌体,以不同策略进行工程化后,获得的工程化外泌体可通过作用于特异的分子信号通路来调节控制炎症、促进细胞增殖分化以及促进血管生成进而促进皮肤软组织修复。同样的,骨组织修复中利用骨髓细胞来源外泌体或是神经组织修复利用神经细胞来源外泌体,均可获得良好的治疗效果。然而在具体的治疗过程中,研究人员发现有着高度扩增能力和多分化潜能的间充质干细胞释放的外泌体有着更好的促再生活性[57],基于此对特异组织细胞的间充质干细胞分泌的外泌体工程化后,发现其在骨组织中改善骨损害周围血供、调节炎症、促进新骨生成及成骨分化,在神经组织修复中促神经细胞增殖迁移,抑制炎症和凋亡及促进新血管生成,均有着比原始组织细胞来源外泌体更好的促再生效果。在以抗纤维化为主要机制的心脏组织修复和肝组织修复中,间充质细胞来源外泌体促再生的能力也同样适用,此来源的外泌体工程化后均可以获得抗纤维化的能力并与其自身能力协同治疗心肌梗死后异常修复和肝纤维化。但与肝组织不同的是,工程化外泌体用于心脏组织的修复也可选用心脏祖细胞来源的外泌体,因其自身就有抗纤维化活性,故在改善心脏纤维化方面要更优于间充质细胞来源外泌体。基于以上发现,科研人员开始采用多样化的工程技术策略,生成具有特定功能的工程化外泌体,以更有效地应对多种组织修复的特定需求。 2.4.1 皮肤和软组织修复 皮肤及软组织的修复主要为表现为伤口修复,伤口修复是一个复杂的过程,涉及止血、炎症、血管生成、增殖和重塑[58]。工程化外泌体多通过调节炎症、促进血管生成、促进细胞增殖和迁移来促进伤口修复。在皮肤软组织修复中,利用来源于间充质干细胞和血管内皮细胞等。 在炎症管理中,关键的治疗策略并非抑制免疫反应,而是维持免疫平衡。单纯的外泌体治疗可能效果有限,因此,研究人员开始探索将外泌体与抗炎成分结合或对它们进行改造,以提升治疗效果和靶向性[59]。白细胞介素10是一种具有显著抗炎作用的细胞因子。BU等[60]通过将白细胞介素10表达质粒转染到人类胚胎肾细胞中,使得这些细胞释放的外泌体展现出改善的抗炎效果和增强的靶向能力。此外,另一项研究对脂肪来源的干细胞外泌体进行了修饰,引入了具有免疫调节作用并能促进巨噬细胞极化的二苯并环辛炔共轭葡聚糖硫酸盐,这种修饰不仅赋予了外泌体新的生物学功能,如免疫调节和组织修复,而且还显著增强了它们促进M2型巨噬细胞极化的能力,这是一种关键的抗炎机制,M2型巨噬细胞具有抗炎和组织修复功能,有助于减轻炎症。通过与抗炎成分结合的方式,外泌体调节炎症的效果得到了显著提升[61]。值得注意的是,外泌体调节炎症能力与细胞来源相关,干细胞来源的外泌体表现出抗炎效应,免疫细胞来源的外泌体则可以促进炎症反应,甚至加剧炎症性疾病进展,这提示免疫平衡的保持不仅可以通过携带抗炎药物实现,选择不同细胞来源的外泌体以适应不同的疾病也是一种潜在的治疗策略。 血管生成在组织修复的过程中为修复细胞提供所需的氧气和营养物质,对于伤口愈合和组织再生至关重要。研究表明,细胞培养环境的变化,尤其是缺氧条件,可以显著影响外泌体的功能,GE等[62]发现在缺氧条件下培养的间充质干细胞衍生外泌体具有更强的血管生成刺激活性。HAN等[63]进一步证实,经过缺氧预处理的脂肪来源的充质干细胞外泌体通过激活血管内皮生长因子受体信号通路,在裸鼠脂肪移植模型中展现出更显著的促血管生成效果。此外,已知能够促进内皮细胞血管生成的微小RNA,如miR-31-5p,当封装进外泌体后,可以利用外泌体的生物相容性、安全性和有效性等特性,更有效地发挥其促血管生成作用。因此,研究者探索将外泌体作为miR-31-5p的递送载体,发现这种封装有miR-31-5p的外泌体显著提升了内皮细胞的功能,促进了新血管的形成,并加速了皮肤伤口的愈合过程[64]。这些研究表明,通过特定的预处理和微小RNA封装,外泌体可以作为一种有效的促血管生成工具,用于组织工程和再生医学。 在促进细胞增殖和迁移方面,SHI等[65]发现,携带转化生长因子β的外泌体在体外实验中显著增强了细胞的增殖、迁移能力、管状结构形成以及皮肤类器官的发育。另一项研究中,经缺氧处理的脂肪间充质干细胞源外泌体被证实能显著提升人脐静脉内皮细胞的增殖、迁移和管状结构形成[63]。尽管细胞增殖和迁移的促进对组织修复极为有利,但在特定疾病治疗中,抑制这些过程同样重要。例如,肥厚性瘢痕是深层皮肤损伤后异常愈合导致的纤维增生性疾病。MENG等[66]研究者通过病毒转染技术将抑制细胞增殖的特定miRNAs装载至脂肪干细胞源外泌体中,所得到的工程化外泌体能有效抑制肥厚性瘢痕成纤维细胞的增殖、迁移和向肌成纤维细胞的转分化,减少瘢痕形成。这些研究表明,外泌体的处理方式、携带的药物和来源细胞类型均会影响其生物学效应。总体而言,通过修饰,外泌体不仅能增强其原有的生物学活性,还能获得新的生物学功能。随着对外泌体在促进组织修复中作用机制的深入研究,研究者们可以设计出高度靶向的工程化外泌体,以满足未来精准医疗的需求。 近期,外泌体在促进急性创伤伤口愈合领域的应用取得了显著的进展。在急性创伤伤口的治疗中,除了促进组织修复,还需要满足止血、抗感染等多重需求。然而,与体外实验不同,单纯的外泌体在应用于急性创伤伤口时,常因无法提供足够的药物剂量和理想的缓释效果,导致治疗效果不佳。因此,将外泌体与生物材料结合成为一种有前景的策略,常见的方法是将外泌体与水凝胶结合,利用水凝胶的优良生物相容性和物理特性作为载体,结合外泌体的组织修复特性,设计出复合材料。例如,脂肪间充质干细胞衍生的外泌体与壳聚糖水凝胶结合制成的敷料,利用外泌体的抗炎和组织修复能力,显著促进了大鼠皮肤损伤模型中的伤口愈合[67]。还有研究将外泌体包裹在氧气纳米泡中,并整合到聚乙烯醇/明胶混合水凝胶中,这种水凝胶不仅能够缓解伤口缺氧,还为在缺氧环境下传递包裹外泌体的纳米颗粒提供了一种高效途径[68]。LV等[69]利用透明质酸、甲基丙烯酰化明胶和季铵化壳聚糖制备了一种复合水凝胶,并加载了间充质干细胞衍生外泌体,证明其可以有效促进全层皮肤缺损伤口的愈合。这些研究表明,通过将外泌体与水凝胶等生物材料结合,可以开发出既具良好生物相容性又可促进伤口愈合的复合材料,这种复合材料能够负载更多的外泌体而不会导致外泌体聚集,并通过保持外泌体活性和促进外泌体缓慢释放来延长外泌体作用,有效促进急性创伤伤口修复。目前的研究多集中于单纯外泌体与生物材料的结合,工程化外泌体与生物材料相结合的研究较少,未来的研究可侧重于工程化外泌体,虽然技术难度较高,但可为促进急性创伤伤口的快速愈合提供新的可能性。 与急性创伤伤口相比,慢性皮肤伤口的愈合尤其是糖尿病患者的伤口愈合,一直是医学领域面临的重大挑战。这些伤口的愈合过程更为复杂,常伴随着血管生成功能障碍。工程化外泌体可以有效地促进血管生成、胶原蛋白合成和调节炎症,因而在糖尿病伤口愈合方面有巨大潜力[70]。针对血管生成障碍这一糖尿病伤口不愈合的主要原因,外泌体作为一种新型的治疗载体,通过携带药物有效成分到病变细胞,可促血管再生。例如,携带缺氧诱导因子1α稳定剂的外泌体可促进伤口的血管生成和愈合[71]。基于微小RNA-155能够通过靶向特定基因来调节细胞周期进程和细胞死亡的特性,有研究将miR-155抑制剂装载到外泌体中,发现其可促进糖尿病伤口模型中的胶原蛋白沉积和血管生成[72]。另外一项研究发现转染了过表达长非编码RNA HOX转录反义RNA的外泌体可以显著促进糖尿病小鼠的血管生成和伤口愈合[73]。 此外,缺氧处理引起缺氧诱导因子的生成进而促进血管再生的机制已被广泛研究,但其促进组织修复的机制并非单一,其促血管生成的作用还可通过上调血管生成相关基因和一氧化氮的表达实现[74]。此外,缺氧预处理外泌体还可显著增强高糖环境下内皮细胞的增殖和迁移,加速糖尿病伤口愈合[75],可以看到工程化外泌体可通过多种途径促进慢性伤口尤其是糖尿病伤口愈合,然而,外泌体在体内的快速清除使得工程化外泌体难以在慢性伤口周围维持必要的治疗浓度,因此慢性伤口的治疗同样需要一定的载体在保证外泌体体内活性的同时控制外泌体缓释,例如选用合适的生物相容性支架负载工程化外泌体以提高其在体内的稳定性和疗效维持。未来的研究需要进一步探索这些策略,并解决外泌体在临床应用中的相关问题。 2.4.2 骨组织修复 工程化外泌体在骨再生中的潜在作用已被广泛研究,其提供了一种无细胞递送成骨载体以促进骨形成的策略,这种方法在异源使用时不会引起免疫反应,因此前景非常广阔[76]。骨再生的过程涉及多种细胞类型的招募和分化及新骨基质的沉积[77]。而工程化外泌体主要通过促进骨再生过程中成骨细胞的增殖分化、重塑骨组织周围血管系统及调节免疫反应来促进骨组织修复。多种生物活性分子,包括生长因子、细胞因子和microRNA,可以调节基因表达并调节参与骨再生的细胞过程。微小RNA-182-5p被发现具有抗成骨作用,ZHU等[78]用微小RNA-182-5p抑制剂转染母细胞,发现抗微小RNA-182-5p修饰后的外泌体能有效促进新骨形成及成骨分化。此外,工程化外泌体还可以通过促血管生成、改善新生骨血供以促进其修复。一项研究发现缺氧预处理的外泌体通过向内皮细胞转移微小RNA-126来发挥其促血管生成效应,进而促进骨折愈合[79]。YUAN等[80]也发现,缺氧预处理后的大鼠骨髓间充质干细胞衍生的外泌体,相较于常氧环境下具有更高的血管内皮生长因子及表皮生长因子等促血管生成因子水平,故在大鼠股骨头坏死模型中有更好的促血管生成效果。骨再生或骨折愈合过程中,局部环境中的免疫反应和炎症也起着至关重要的作用。在骨折愈合的早期炎症阶段,急性炎症反应导致趋化因子的释放,吸引骨髓间充质干细胞并促进其成骨分化,从而加速骨形成。因此,建立一个适宜的局部免疫微环境对于实现有效的骨再生至关重要,而巨噬细胞从M1型(促炎型)向M2型(抗炎型)的转变是促进炎症消退和骨再生的关键步骤。HUANG等[81]证明了这一点,他们通过沉默特定基因促进M2型巨噬细胞的极化,得到了具有持久M2样表型的巨噬细胞,这些细胞衍生的外泌体能够通过调节局部免疫微环境来促进炎症条件下的骨质再生。 然而多数的骨组织再生延迟常是由多种因素共同作用的结果,例如年龄增长引起的骨质疏松、炎症和感染对骨愈合的阻碍,伤口血液供应不足导致的骨营养状况不佳,以及糖尿病等代谢性疾病对骨组织健康状况的负面影响。在治疗骨组织损伤时,需要全面考虑这些因素,因此,用于促进骨组织修复的工程化外泌体也应具备多重功能,以应对多样化的骨损伤因素。因此,有研究者利用软骨前体细胞衍生的外泌体搭载血管内皮生长因子基因,这些工程化外泌体既能作为成骨基质诱导间充质干细胞的成骨分化,也能作为基因载体,实现血管内皮生长因子基因的可控释放以重塑血管系统[82]。PAN等[83]将微小RNA(miR-29a)转染入骨髓间充质干细胞,证实了miR-29a的过表达能够激活成骨转录因子,并上调血管内皮生长因子的表达,实现成骨和血管生成的耦合,加速骨愈合过程。这种具备双重功能的工程化外泌体在处理多因素引起的骨愈合延迟方面展现出显著优势。ZHOU等[84]同样设计了具有双重特性的工程化外泌体,硫化氢预处理能够促进M2型巨噬细胞的极化,这些经过硫化氢预处理的M2型外泌体可以通过重新构建局部免疫微环境来促进骨再生。同时,硫化氢还能通过改变外泌体的蛋白质谱,直接增强骨再生能力。可以看到在慢性骨关节炎的病理过程中,局部免疫微环境对炎症条件下的骨修复机制具有显著的影响。然而,对于创伤性骨折的治疗,通常需要一种能够直接促进骨组织再生的策略。鉴于此,具备调节免疫反应和促进骨再生的双重特性的工程化外泌体展现出更为广阔的应用潜力,为创伤性骨折的治疗提供了一种新策略。 工程化外泌体还可通过改善损伤周围环境来促进骨组织修复。骨缺损时,氧气供应不足是阻断血管生成及成骨而加剧疾病的重要因素。为克服这一难题,ZHANG等[85]将外泌体与作为氧源的供氧复合支架结合,支架既作为氧源又作为羟基磷灰石前体,实验证明,外泌体与氧源的结合显著促进了新骨形成,表现出优异的成骨性能。同样,高血糖也是由于环境因素导致骨愈合延迟的一个例子,高血糖引发的内质网应激会损害固有的愈合过程而导致糖尿病性骨折和骨愈合延迟。因此,LIU等[86]通过将小分子化合物蛋白精氨酸1整合到间充质干细胞外泌体中,利用其保持内质网蛋白质稳态的功能促进了糖尿病骨再生。工程化外泌体改善骨损伤环境的能力可以与其携带治疗性分子的能力相耦合以更好地发挥其促骨组织修复的能力。为治疗伴有糖尿病、骨筋膜室综合征等并发症的骨组织损害提供了一种新的策略。 在软骨修复领域,外泌体同样展现出巨大潜力。软骨因有限的自我修复能力,损伤或退化后常难以恢复。而利用外泌体作为细胞间通讯的载体,传递特定的生物分子,可以促进软骨细胞的修复和再生。SHEN等[87]比较了缺氧和常氧预处理的间充质干细胞外泌体,发现缺氧预处理外泌体中微小RNA-205-5p表达增加进而有效促进软骨细胞的增殖和迁移。软骨终板退化是椎间盘退变的一个重要因素,针对该问题,有研究者设计了一种表面带有软骨细胞亲和肽并携带抗氧化转录因子Nrf2的工程化外泌体,这种设计旨在提高外泌体与软骨终板细胞的亲和力,并促进Nrf2的靶向传递,该外泌体在大鼠椎间盘退变模型中显示出更好的修复能力[88]。HU等[89]将微小RNA-378加载到骨髓间充质干细胞衍生的外泌体中,微小RNA-378的过表达有助于修复纤维环,为椎间盘退变提供了一种新的治疗策略。尽管目前众多研究工作仍局限于实验室,但工程化外泌体在软骨修复领域的应用已经展现出显著的临床应用前景。为了推动其在临床上的应用,未来的研究需要进一步探索其作用机制,优化治疗策略,并确保其安全性和有效性。 2.4.3 神经组织修复 神经组织因其有限的再生能力导致严重的神经损伤在临床上常难以恢复到令人满意的程度。而外泌体可在中枢神经系统损伤或疾病后恢复和诱导神经组织的增殖[90]。作为一种天然纳米载体,外泌体不仅能通过血脑屏障,还能将特定的生物分子传递到受损的神经组织,从而促进神经细胞的修复和再生。例如,它们可以携带抗凋亡分子以减少神经细胞凋亡,或携带神经营养因子以促进受损神经轴突的再生并提高神经传导功能。此外,工程化外泌体可调节受损神经组织周围的免疫反应来减少炎症和瘢痕形成,同时促进血管新生来改善局部微循环,为神经修复提供有利环境。基于这些优势,工程化外泌体在神经组织修复方面的应用被广泛研究,研究主要集中在将外泌体与生物活性蛋白或微小RNA结合,以增强治疗效果。共价结合了生物活性蛋白的M2巨噬细胞来源工程化外泌体可通过调节炎症微环境和促进神经再生显著促进脊髓损伤小鼠的运动功能恢复[91]。XIE等[92]将能表达生物活性蛋白精-甘-天冬氨酸肽的基因序列导入选定的间充质干细胞亚群中,获得的工程化外泌体能减少紧密连接的破坏,增强血-脊髓屏障的稳定,并最终促进脊髓损伤小鼠的神经功能恢复。同样还有SUN等[93]将过表达核 FMR1 相互作用蛋白 1基因的序列转染入间充质干细胞,发现过表达该生物活性蛋白的工程化外泌体显著减少促凋亡蛋白表达并增加抗凋亡蛋白的表达,具有调节神经细胞凋亡和减轻神经损伤的潜力。另一项研究则通过微小RNA-218质粒转染脂肪来源干细胞外泌体,miR-218能够增强神经内分泌细胞活性和迁移能力,最终该工程化外泌体在坐骨神经损伤模型中促进了神经再生[94]。由此可见,不同的生物活性蛋白或是miRNA的加入让工程化外泌体获得了促进神经细胞增殖、减轻凋亡、促进新血管生成以及调节免疫微环境的多重作用并共同促进神经组织修复。 外泌体的来源对其在神经组织修复中的效果有显著影响。如小胶质细胞衍生的外泌体能够通过减少氧化应激来保护脊髓微血管内皮细胞,进而表现出促进血管再生和细胞增殖的作用[95]。XUE等[96]发现间充质干细胞来源的外泌体通过促进巨噬细胞M2极化并降低M1-M2极化比,进而减轻局部和全身炎症,促进轴突再生和髓鞘形成。LIU等[97]将人脂肪来源的间充质干细胞分化为施万细胞,分别提取出未分化细胞外泌体(uExo)和分化细胞外泌体(dExo),证明分化细胞外泌体在下调促炎基因表达和细胞因子分泌,以及促进人诱导多能干细胞分化的感觉神经元的轴突生长方面表现更好。尽管间充质干细胞来源外泌体再生效果优于神经细胞来源的外泌体,但神经细胞来源的外泌体着更高的特异性和靶向性。通过选择适宜的外泌体来源并对其进行工程化改造,可以针对由不同原因引起的神经损伤疾病,为未来的神经系统疾病治疗提供了广阔的应用前景。 外泌体联合其他生物材料,也是一种前景广阔的促神经组织修复的方法,生物材料可作为外泌体的生物支架载体,提高其负载量并减少体内灭活。例如外泌体可联合明胶海绵植入脊髓损伤部位,可以通过促进神经再生、再髓鞘化、抗炎和抗凋亡等作用改善脊髓损伤引起的运动功能障碍[98]。还可联合水凝胶作用于神经损伤部位,通过减少早期炎症,增强神经干细胞募集,以促进神经元和髓鞘相关轴突再生[99]。同样还有将外泌体与纳米粒子共价结合,WANG等[100]基于此构建了一种工程外泌体纳米治疗平台,在体外实验中表现出对受损细胞的高度靶向能力,体内实验中可有效地减少帕金森疾病模型中的氧化应激和神经炎症。这种生物支架载体与工程化外泌体的结合也是一种创伤性脑损伤的潜在治疗策略,支架提供支持作用的同时,工程化外泌体也能更好地发挥其促进神经组织修复的作用,进而提高脑外伤的治疗效果。有研究用胶原/壳聚糖支架装载类胰岛素生长因子1预处理的外泌体,应用于创伤性脑损伤模型后,显著促进了受损区域神经组织的修复[101]。同样的胶原/壳聚糖支架还可装载干扰素预处理的外泌体,该工程化外泌体在创伤性脑损伤模型中显示出促神经干细胞分化成熟及减少神经炎症的强大能力[102]。综上所述,生物支架与工程化外泌体的整合为创伤性脑损伤的治疗提供了新策略。然而,这种整合策略的有效性建立在对外泌体治疗作用潜在分子机制的深入理解之上,同时需要明确生物支架自身的作用,以实现与负载的工程化外泌体的协同效应。未来的研究需要进一步探索这些策略,并解决外泌体在神经损伤疾病应用中的相关问题。 2.4.4 心脏组织修复 心肌梗死是心血管疾病死亡的主要原因,因此,制定有效的治疗策略以预防或减轻心肌梗死至关重要。干细胞移植是治疗心肌梗死的一种方法,但直接移植的干细胞面临着存活率低和免疫排斥等风险。研究表明,间充质干细胞和心肌细胞来源的外泌体具有改善心脏功能和促进心脏再生的潜力,它们能够激活发育成心脏组织的细胞、促进心脏细胞和血管生长,并调节受损区域的炎症反应[103]。经过工程化改造的这两种来源的外泌体展现出更特异性的生物活性,并带来更显著的治疗效果,例如,过表达生长分化因子15基因的心肌细胞来源外泌体在心肌梗死疾病模型中减少了炎症细胞浸润,抑制了细胞凋亡,并促进了心脏血管生成,有效减小了梗死面积[104]。装载了微小RNA-302模拟物的间充质干细胞来源外泌同时减弱炎症反应和细胞凋亡[105]。由此可见,通过筛选和工程化改造这两种细胞来源的外泌体,可以用于心肌梗死后的心脏组织修复。 心肌梗死后的心脏纤维化常是导致死亡的主要原因,因此,预防和减少纤维化进展对于心脏修复至关重要。缺氧条件下,心脏祖细胞来源的外泌体能够减少成纤维细胞中促纤维化基因的表达,进而减少纤维化以改善了心肌梗死模型的心脏功能[106]。巨噬细胞迁移抑制因子作为一种多功能的细胞因子,在多种生物学过程中发挥作用,包括免疫反应、炎症、细胞增殖及细胞分化,而过表达巨噬细胞迁移抑制因子的间充质干细胞来源外泌体可通过减少纤维化和维持心脏功能来诱导心脏保护作用[107]。由此可见,工程化外泌体不仅通过携带的治疗性分子促进心肌组织修复,还能通过预防和减少纤维化进一步治疗心肌梗死。 工程化外泌体在抗纤维化方面的潜力也可通过与生物材料的结合得到增强。WANG等[108]将间充质干细胞来源的外泌体整合到纤维蛋白心脏贴片中,该复合贴片在心肌梗死小鼠模型中显示出抑制纤维化和改善心脏功能的能力。另一项研究将间充质干细胞来源外泌体整合到明胶微针贴片中,当植入小鼠心肌梗死模型的心脏时,能够有效抑制纤维化并提升心脏功能[109]。还有研究将封装有姜黄素的间充质干细胞外泌体与可注射复合水凝胶结合,在心肌梗死小鼠体内可抑制纤维化,从而促进心肌梗死后的心脏修复[33]。心脏组织在损伤后的自然修复过程中常常伴随着纤维化的形成,这可能会影响心脏的长期功能。因此,抑制纤维化对于心肌梗死后的心脏修复至关重要。携带工程化外泌体的生物材料为心肌梗死后的心脏组织修复提供了一种有前景的策略。然而,这种方法的实际应用还需要进一步的科学研究来验证其安全性、有效性和长期效果。 2.4.5 肝脏组织修复 肝脏是人体中具有强大再生能力的器官之一,在急性损伤后通常能够通过肝细胞的增殖来修复并恢复正常结构。慢性肝损伤常因持续性炎症和修复反应导致细胞外基质的累积,进而引起肝纤维化,因而治疗的关键在于抗纤维化。天然外泌体就能够通过刺激肝细胞的增殖和分化,以及抑制肝纤维化的发展,来促进肝脏组织的再生[110]。但有研究者比较了天然外泌体和加载有微小RNA-124的工程化外泌体治疗肝纤维化的效果,发现后者可以显著降低肝纤维化指标[111]。显然负载了各种生物活性分子的工程化外泌体有着更好的抗纤维化效果。例如:骨桥蛋白、信号转导和转录激活因子 3 (STAT3)都是肝纤维化发病机制中的重要分子,一项研究通过载入小干扰RNA改造外泌体降低骨桥蛋白的表达进而抑制肝纤维化[112];另一项研究将靶向抑制STAT3表达的小干扰RNA加载到外泌体中并用于肝纤维化模型,发现肝纤维化显改善[113]。 还有研究同样通过设计发夹型诱饵寡脱氧核苷酸并载入外泌体以抑制肝纤维化相关的转录因子的表达,最终改善肝纤维化[114]。除了通过抑制肝纤维化相关分子来实现抗纤维化,还可通过直接靶向损伤肝细胞的方式来治疗肝纤维化,LIN等[115] 利用能特异性结合肝星状细胞的靶向肽修饰的外泌体,实现了对肝组织中肝星状细胞损伤的精确治疗,为临床肝纤维化治疗提供了新策略。尽管工程化外泌体在肝组织修复中的应用仍处于研究阶段,但已展现出显著的临床潜力,未来可能成为治疗肝病的新疗法。目前,仍需克服一些挑战,包括提高靶向性、确保长期稳定性以及深入理解其在体内的具体作用机制。 工程化外泌体在皮肤软组织修复中的应用见表2,在骨及神经组织修复中的应用见表3,在心脏及肝组织修复中的应用见表4。 "
| [1] YANG G, WAHEED S, WANG C, et al. Exosomes and their bioengineering strategies in the cutaneous wound healing and related complications: current knowledge and future perspectives. Int J Biol Sci. 2023;19:1430-1454. [2] YE H, WANG F, XU G, et al. Advancements in engineered exosomes for wound repair: current research and future perspectives. Front Bioeng Biotechnol. 2023;11:1301362. [3] BEETLER DJ, DI FLORIO DN, BRUNO KA, et al. Extracellular vesicles as personalized medicine. Mol Aspects Med. 2023;91:101155. [4] SEN S, XAVIER J, KUMAR N, et al. Exosomes as natural nanocarrier-based drug delivery system: recent insights and future perspectives. 3 Biotech. 2023;13:101. [5] HU W, WANG W, CHEN Z, et al. Engineered exosomes and composite biomaterials for tissue regeneration. Theranostics. 2024; 14:2099-126. [6] KRYLOVA SV, FENG D. The machinery of exosomes: biogenesis, release, and uptake. Int J Mol Sci. 2023;24:1337. [7] CHEN S, SUN F, QIAN H, et al. Preconditioning and engineering strategies for improving the efficacy of mesenchymal stem cell-derived exosomes in cell-free therapy. Stem Cells Int. 2022; 2022:1779346. [8] MICELI V, BULATI M, IANNOLO G, et al. Therapeutic properties of mesenchymal stromal/stem cells: the need of cell priming for cell-free therapies in regenerative medicine. Int J Mol Sci. 2021;22:763. [9] WANG J, WU H, PENG Y, et al. Hypoxia adipose stem cell-derived exosomes promote high-quality healing of diabetic wound involves activation of PI3K/Akt pathways. J Nanobiotechnology. 2021; 19:202. [10] ZENG Y, FU BM. Angiogenesis and microvascular permeability. Cold Spring Harb Perspect Med. 2024;15:a041163. [11] NIE YF, SHANG JM, LIU DQ, et al. Apical papilla stem cell-derived exosomes regulate lipid metabolism and alleviate inflammation in the MCD-induced mouse NASH model. Biochem Pharmacol. 2024; 222:116073. [12] LIU X, SHEN L, WAN M, et al. Peripheral extracellular vesicles in neurodegeneration: pathogenic influencers and therapeutic vehicles. J Nanobiotechnology. 2024;22:170. [13] LI X, QU S, OUYANG Q, et al. A multifunctional composite nanoparticle with antibacterial activities, anti-inflammatory, and angiogenesis for diabetic wound healing. Int J Biol Macromol. 2024; 260:129531. [14] PAN BT, JOHNSTONE RM. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor. Cell. 1983; 33:967-978. [15] JOHNSTONE RM, ADAM M, HAMMOND JR, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987;262: 9412-9420. [16] TAYLOR DD, GERÇEL-TAYLOR C. Tumour-derived exosomes and their role in cancer-associated T-cell signalling defects. Br J Cancer. 2005;92:305-311. [17] THÉRY C, AMIGORENA S, RAPOSO G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. 2006;Chapter 3:Unit 3.22. [18] VALADI H, EKSTRÖM K, BOSSIOS A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007;9:654-659. [19] LAI RC, ARSLAN F, LEE MM, et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010;4:214-222. [20] LUAN X, SANSANAPHONGPRICHA K, MYERS I, et al. Engineering exosomes as refined biological nanoplatforms for drug delivery. Acta Pharmacol Sin. 2017;38:754-763. [21] LI M, LI S, DU C, et al. Exosomes from different cells: characteristics, modifications, and therapeutic applications. Eur J Med Chem. 2020; 207:112784. [22] LUO S, CHEN J, XU F, et al. Dendritic cell-derived exosomes in cancer immunotherapy. Pharmaceutics. 2023; 15:2070. [23] POMATTO M, GAI C, NEGRO F, et al. Differential therapeutic effect of extracellular vesicles derived by bone marrow and adipose mesenchymal stem cells on wound healing of diabetic ulcers and correlation to their cargoes. Int J Mol Sci. 2021;22:3851. [24] ZOU J, PENG H, LIU Y. The roles of exosomes in immunoregulation and autoimmune thyroid diseases. Front Immunol. 2021; 12:757674. [25] KHAN H, PAN JJ, LI Y, et al. Native and bioengineered exosomes for ischemic stroke therapy. Front Cell Dev Biol. 2021; 9:619565. [26] RAPOSO G, STOORVOGEL W. Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol. 2013;200:373-383. [27] HUANG L, WU E, LIAO J, et al. Research advances of engineered exosomes as drug delivery carrier. ACS Omega. 2023;8: 43374-43387. [28] POORESMAEIL F, ANDI S, HASANNEJAD-ASL B, et al. Engineered exosomes: a promising vehicle in cancer therapy. Ther Deliv. 2023;14:775-794. [29] FERREIRA D, MOREIRA JN, RODRIGUES LR. New advances in exosome-based targeted drug delivery systems. Crit Rev Oncol Hematol. 2022; 172:103628. [30] ROSZKOWSKI S. Therapeutic potential of mesenchymal stem cell-derived exosomes for regenerative medicine applications. Clin Exp Med. 2024;24:46. [31] GE L, WANG K, LIN H, et al. Engineered exosomes derived from miR-132-overexpresssing adipose stem cells promoted diabetic wound healing and skin reconstruction. Front Bioeng Biotechnol. 2023;11:1129538. [32] ZHANG X, HUANG J, ZHAO J, et al. Exosome-mimetic vesicles derived from fibroblasts carrying matrine for wound healing. Burns Trauma. 2024;12:tkae015. [33] WANG Y, WANG J, LIU C, et al. Injectable decellularized extracellular matrix hydrogel loaded with exosomes encapsulating curcumin for prevention of cardiac fibrosis after myocardial infarction. J Mater Sci Tech. 2023;167:50-58. [34] XIONG QH, ZHAO L, WAN GQ, et al. Engineered BMSCs-derived exosomal miR-542-3p promotes cutaneous wound healing. Endocr Metab Immune Disord Drug Targets. 2023;23:336-346. [35] HOU C, ZHANG Y, LV Z, et al. Macrophage exosomes modified by miR-365-2-5p promoted osteoblast osteogenic differentiation by targeting OLFML1. Regen Biomater. 2024;11:rbae018. [36] CHEN H, HUANG Z, LEI A, et al. miRNA-211-5p inhibition enhances the protective effect of hucMSC-derived exosome in Aβ1-40-induced SH-SY5Y cells by increasing NEP expression. J Biochem Mol Toxicol. 2024;38:e23624. [37] YERNENI SS, YALCINTAS EP, SMITH JD, et al. Skin-targeted delivery of extracellular vesicle-encapsulated curcumin using dissolvable microneedle arrays. Acta Biomaterialia. 2022;149:198-212. [38] HAJIPOUR H, FARZADI L, ROSHANGAR L, et al. A human chorionic gonadotropin (hCG) delivery platform using engineered uterine exosomes to improve endometrial receptivity. Life Sci. 2021;275:119351. [39] SHAO X, ZHANG M, CHEN Y, et al. Exosome-mediated delivery of superoxide dismutase for anti-aging studies in Caenorhabditis elegans. Int J Pharm. 2023;641:123090. [40] ZHANG Y, BI J, HUANG J, et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. Int J Nanomedicine. 2020;15:6917-6934. [41] LIANG Y, IQBAL Z, LU J, et al. Cell-derived nanovesicle-mediated drug delivery to the brain: Principles and strategies for vesicle engineering. Mol Ther. 2023;31: 1207-1224. [42] KONG W, LI X, GUO X, et al. Ultrasound-assisted CRISPRi-exosome for epigenetic modification of α-synuclein gene in a mouse model of parkinson’s disease. ACS Nano. 2024;18:7837-7851. [43] CHEN M, LU Y, LIU Y, et al. Injectable microgels with hybrid exosomes of chondrocyte-targeted FGF18 gene-editing and self-renewable lubrication for osteoarthritis therapy. Adv Mater. 2024;36:2312559. [44] ILAHIBAKS NF, KLUIVER TA, DE JONG OG, et al. Extracellular vesicle-mediated delivery of CRISPR/Cas9 ribonucleoprotein complex targeting proprotein convertase subtilisin-kexin type 9 (Pcsk9) in primary mouse hepatocytes. J Extracell Vesicles. 2024;13:12389. [45] WANG J, WANG M, JIANG N, et al. Emerging chemical engineering of exosomes as “bioscaffolds” in diagnostics and therapeutics. Genes Dis. 2023;10: 1494-512. [46] HAROON K, ZHENG H, WU S, et al. Engineered exosomes mediated targeted delivery of neuroprotective peptide NR2B9c for the treatment of traumatic brain injury. Int J Pharm. 2024; 649:123656. [47] KRISHNAN MA, ALIMI OA, PAN T, et al. Engineering neurotoxin-functionalized exosomes for targeted delivery to the peripheral nervous System. Pharm. 2024; 16:102. [48] DENG M, GUO R, WANG Y, et al. Curbing exosome communications via introducing artificial membrane receptors for metastatic pancreatic cancer therapy. Adv Mater. 2023;35:2303736. [49] ZHANG C, PATHRIKAR TV, BABY HM, et al. Charge-reversed exosomes for targeted gene delivery to cartilage for osteoarthritis treatment. Small Methods. 2024;8:e2301443. [50] COTTO HAM, PATHRIKAR TV, HAKIM B, et al. Cationic-motif-modified exosomes for mRNA delivery to retinal photoreceptors. J Mater Chem B. 2024;12:7384-400. [51] HUNG S, HO JH, SHIH YV, et al. Hypoxia promotes proliferation and osteogenic differentiation potentials of human mesenchymal stem cells. J Orthop Res. 2012;30:260-266. [52] SEMENZA GL. Targeting hypoxia-inducible factor 1 to stimulate tissue vascularization. J Investig Med. 2016;64:361-363. [53] LECHANTEUR C, BRIQUET A, GIET O, et al. Clinical-scale expansion of mesenchymal stromal cells: a large banking experience. J Transl Med. 2016;14:145. [54] GAO W, LIANG T, HE R, et al. Exosomes from 3D culture of marrow stem cells enhances endothelial cell proliferation, migration, and angiogenesis via activation of the HMGB1/AKT pathway. Stem Cell Res. 2020;50:102122. [55] LIU K, CAI GL, ZHUANG Z, et al. Interleukin-1β-treated mesenchymal stem cells inhibit inflammation in hippocampal astrocytes through exosome-activated nrf-2 signaling. Int J Nanomedicine. 2021;16:1423-1434. [56] MIRABEL C, PUENTE-MASSAGUER E, DEL MAZO-BARBARA A, et al. Stability enhancement of clinical grade multipotent mesenchymal stromal cell-based products. J Transl Med. 2018;16:291. [57] REZAIE J, FEGHHI M, ETEMADI T. A review on exosomes application in clinical trials: perspective, questions, and challenges. Cell Commun Signal. 2022;20:145. [58] WANG Z, LIANG X, WANG G, et al. Emerging bioprinting for wound healing. Adv Mater. 2023. doi: 10.1002/adma.202304738. [59] MA X, LIU B, FAN L, et al. Native and engineered exosomes for inflammatory disease. Nano Res. 2023;16:6991-7006. [60] BU T, LI Z, HOU Y, et al. Exosome-mediated delivery of inflammation-responsive IL-10 mRNA for controlled atherosclerosis treatment. Theranostics. 2021;11: 9988-10000. [61] YOU DG, LIM GT, KWON S, et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Sci Adv. 2021;7:eabe0083. [62] GE L, XUN C, LI W, et al. Extracellular vesicles derived from hypoxia-preconditioned olfactory mucosa mesenchymal stem cells enhance angiogenesis via miR-612. J Nanobiotechnology. 2021;19:380. [63] HAN Y, REN J, BAI Y, et al. Exosomes from hypoxia-treated human adipose-derived mesenchymal stem cells enhance angiogenesis through VEGF/VEGF-R. Int J Biochem Cell Biol. 2019;109:59-68. [64] YAN C, CHEN J, WANG C, et al. Milk exosomes-mediated miR-31-5p delivery accelerates diabetic wound healing through promoting angiogenesis. Drug Deliv. 2022; 29:214-228. [65] SHI A, LI J, QIU X, et al. TGF-β loaded exosome enhances ischemic wound healing in vitro and in vivo. Theranostics. 2021;11:6616-6631. [66] MENG S, WEI Q, CHEN S, et al. MiR-141-3p-functionalized exosomes loaded in dissolvable microneedle arrays for hypertrophic scar treatment. Small. 2024; 20:e2305374. [67] WU D, TAO S, ZHU L, et al. Chitosan hydrogel dressing loaded with adipose mesenchymal stem cell-derived exosomes promotes skin full-thickness wound repair. ACS Appl Bio Mater. 2024;7:1125-1134. [68] HAN X, SAENGOW C, JU L, et al. Exosome-coated oxygen nanobubble-laden hydrogel augments intracellular delivery of exosomes for enhanced wound healing. Nat Commun. 2024;15:3435. [69] LV Y, LI L, ZHANG J, et al. Visible-light cross-linkable multifunctional hydrogels loaded with exosomes facilitate full-thickness skin defect wound healing through participating in the entire healing process. ACS Appl Mater Interfaces. 2024; 16:25923-25937. [70] DONG J, WU B, TIAN W. How to maximize the therapeutic effect of exosomes on skin wounds in diabetes mellitus: review and discussion. Endocrinol (Lausanne). 2023;14:1146991. [71] WANG Y, CAO Z, WEI Q, et al. VH298-loaded extracellular vesicles released from gelatin methacryloyl hydrogel facilitate diabetic wound healing by HIF-1α-mediated enhancement of angiogenesis. Acta Biomaterialia. 2022;147:342-355. [72] GONDALIYA P, SAYYED AA, BHAT P, et al. Mesenchymal stem cell-derived exosomes loaded with mir-155 inhibitor ameliorate diabetic wound healing. Mol Pharm. 2022; 19:1294-308. [73] BORN LJ, CHANG K-H, SHOURESHI P, et al. HOTAIR-loaded mesenchymal stem/stromal cell extracellular vesicles enhance angiogenesis and wound healing. Adv Healthc Mater. 2022;11:e2002070. [74] DING J, SUN Y, CHEN B, et al. Sequential transplantation of exosomes and BMSCs pretreated with hypoxia efficiently facilitates perforator skin flap survival area in rats. Br J Oral Maxillofac Surg. 2024; 62(4):361-366. [75] CHENG P, XIE X, HU L, et al. Hypoxia endothelial cells-derived exosomes facilitate diabetic wound healing through improving endothelial cell function and promoting M2 macrophages polarization. Bioact Mater. 2024;33:157-173. [76] GAO X, RUZBARSKY JJ, LAYNE JE, et al. Stem cells and bone tissue engineering. Life (Basel). 2024;14:287. [77] THEODOSAKI AM, TZEMI M, GALANIS N, et al. Bone regeneration with mesenchymal stem cells in scaffolds: systematic review of human clinical trials. Stem Cell Rev Rep. 2024;20:938-966. [78] ZHU Q, TANG Y, ZHOU T, et al. Exosomes derived from mesenchymal stromal cells promote bone regeneration by delivering miR-182-5p-inhibitor. Pharmacol Res. 2023;192:106798. [79] LIU W, LI L, RONG Y, et al. Hypoxic mesenchymal stem cell-derived exosomes promote bone fracture healing by the transfer of miR-126. Acta Biomater. 2020; 103:196-212. [80] YUAN N, GE Z, JI W, et al. Exosomes secreted from hypoxia-preconditioned mesenchymal stem cells prevent steroid-induced osteonecrosis of the femoral head by promoting angiogenesis in rats. BioMed Res Int. 2021;2021:6655225. [81] HUANG X, DENG Y, XIAO J, et al. Genetically engineered M2-like macrophage-derived exosomes for P. gingivalis-suppressed cementum regeneration: From mechanism to therapy. Bioact Mater. 2024;32:473-487. [82] ZHA Y, LI Y, LIN T, et al. Progenitor cell-derived exosomes endowed with VEGF plasmids enhance osteogenic induction and vascular remodeling in large segmental bone defects. Theranostics. 2021;11: 397-409. [83] PAN S, YIN Z, SHI C, et al. Multifunctional injectable hydrogel microparticles loaded with miR-29a abundant BMSCs derived exosomes enhanced bone regeneration by regulating osteogenesis and angiogenesis. Small. 2024;20:2306721. [84] ZHOU Y, HAN C, ZHU Z, et al. M2 exosomes modified by hydrogen sulfide promoted bone regeneration by moesin mediated endocytosis. Bioact Mater. 2024;31: 192-205. [85] ZHANG Y, FANG M, ZHU J, et al. Exosome-loaded hyaluronic acid hydrogel composite with oxygen-producing 3D printed polylactic acid scaffolds for bone tissue repair and regeneration. Int J Biol Macromol. 2024;274:132970. [86] LIU Y, LIN S, XU Z, et al. High-performance hydrogel-encapsulated engineered exosomes for supporting endoplasmic reticulum homeostasis and boosting diabetic bone regeneration. Adv Sci (Weinh). 2024;11:e2309491. [87] SHEN K, DUAN A, CHENG J, et al. Exosomes derived from hypoxia preconditioned mesenchymal stem cells laden in a silk hydrogel promote cartilage regeneration via the miR-205-5p/PTEN/AKT pathway. Acta Biomaterialia. 2022; 143:173-188. [88] LIN Z, XU G, LU X, et al. Chondrocyte-targeted exosome-mediated delivery of Nrf2 alleviates cartilaginous endplate degeneration by modulating mitochondrial fission. J Nanobiotechnology. 2024;22:281. [89] HU S, ZHU M, XING H, et al. Thread-structural microneedles loaded with engineered exosomes for annulus fibrosus repair by regulating mitophagy recovery and extracellular matrix homeostasis. Bioact Mater. 2024;37:1-13. [90] CHING RC, KINGHAM PJ. The role of exosomes in peripheral nerve regeneration. Neural Regen Res. 2015;10:743-747. [91] ZENG J, GU C, SUN Y, et al. Engineering of M2 macrophages-derived exosomes via click chemistry for spinal cord injury repair. Adv Healthc Mater. 2023;12:2203391. [92] XIE Y, SUN Y, LIU Y, et al. Targeted delivery of RGD-CD146+CD271+ human umbilical cord mesenchymal stem cell-derived exosomes promotes blood-spinal cord barrier repair after spinal cord injury. ACS Nano. 2023;17: 18008-18024. [93] SUN W, ZHAO P, HU S, et al. NUFIP1-engineered exosomes derived from hUMSCs regulate apoptosis and neurological injury induced by propofol in newborn rats. Neurotoxicology. 2024;102:81-95. [94] WANG Y, YU T, HU F. Hypocapnia stimuli-responsive engineered exosomes delivering mir-218 facilitate sciatic nerve regeneration. Front Bioeng Biotechnol. 2022;10:825146. [95] PENG W, WAN L, LUO Z, et al. Microglia-derived exosomes improve spinal cord functional recovery after injury via inhibiting oxidative stress and promoting the survival and function of endothelia cells. Oxid Med Cell Longev. 2021;2021:1695087. [96] XUE R, XIE M, WU Z, et al. Mesenchymal stem cell-derived exosomes promote recovery of the facial nerve injury through regulating macrophage M1 and M2 polarization by targeting the p38 MAPK/NF-Κb pathway. Aging Dis. 2024;15:851-868. [97] LIU B, KONG Y, SHI W, et al. Exosomes derived from differentiated human ADMSC with the Schwann cell phenotype modulate peripheral nerve-related cellular functions. Bioact Mater. 2021;14:61-75. [98] POONGODI R, YANG TH, HUANG YH, et al. Stem cell exosome-loaded Gelfoam improves locomotor dysfunction and neuropathic pain in a rat model of spinal cord injury. Stem Cell Res Ther. 2024;15:143. [99] FAN L, LIU C, CHEN X, et al. Exosomes-loaded electroconductive hydrogel synergistically promotes tissue repair after spinal cord injury via immunoregulation and enhancement of myelinated axon growth. Advanced Science. 2022;9:2105586. [100] WANG Q, LI T, YANG J, et al. Engineered exosomes with independent module/cascading function for therapy of Parkinson’s disease by multistep targeting and multistage intervention method. Adv Mater. 2022;34:e2201406. [101] LIU XY, FENG YH, FENG QB, et al. Low-temperature 3D-printed collagen/chitosan scaffolds loaded with exosomes derived from neural stem cells pretreated with insulin growth factor-1 enhance neural regeneration after traumatic brain injury. Neural Regen Res. 2023;18:1990-1998. [102] CHEN C, CHANG ZH, YAO B, et al. 3D printing of interferon γ-preconditioned NSC-derived exosomes/collagen/chitosan biological scaffolds for neurological recovery after TBI. Bioact Mater. 2024;39:375-391. [103] KISHORE R, KHAN M. More Than tiny sacks: stem cell exosomes as cell-free modality for cardiac repair. Circ Res. 2016;118:330-843. [104] ZOU A, XIAO T, CHI B, et al. Engineered exosomes with growth differentiation factor-15 overexpression enhance cardiac repair after myocardial injury. Int J Nanomedicine. 2024;19:3295-314. [105] GU J, YOU J, LIANG H, et al. Engineered bone marrow mesenchymal stem cell-derived exosomes loaded with miR302 through the cardiomyocyte specific peptide can reduce myocardial ischemia and reperfusion (I/R) injury. J Transl Med. 2024;22:168. [106] BRYL R, KULUS M, BRYJA A, et al. Cardiac progenitor cell therapy: mechanisms of action. Cell Biosci. 2024;14:30. [107] ZHU W, SUN L, ZHAO P, et al. Macrophage migration inhibitory factor facilitates the therapeutic efficacy of mesenchymal stem cells derived exosomes in acute myocardial infarction through upregulating miR-133a-3p. J Nanobiotechnology. 2021;19:61. [108] WANG X, WANG J, ZHANG Y, et al. A fibrin patch loaded with mesenchymal stem cells-derived exosomes improves cardiac functions after myocardial infarction. Coll Interface Sci Commun. 2024;59:100775. [109] YUAN J, YANG H, LIU C, et al. Microneedle patch loaded with exosomes containing microrna-29b prevents cardiac fibrosis after myocardial infarction. Adv Healthc Mater. 2023;12:2202959. [110] WANG T, LI T, NIU X, et al. ADSC-derived exosomes attenuate myocardial infarction injury by promoting miR-205-mediated cardiac angiogenesis. Biol Direct. 2023; 18:6. [111] NIKNAM B, BAGHAEI K, MAHMOUD HASHEMI S, et al. Human Wharton’s jelly mesenchymal stem cells derived-exosomes enriched by miR-124 promote an anti-fibrotic response in an experimental model of liver fibrosis. Int Immunopharmacol. 2023;119:110294. [112] TANG M, GUO C, SUN M, et al. Effective delivery of osteopontin small interference RNA using exosomes suppresses liver fibrosis via TGF-β1 signaling. Front Pharmacol. 2022;13:882243. [113] TANG M, CHEN Y, LI B, et al. Therapeutic targeting of STAT3 employing small interference RNAs and antisense oligonucleotides embedded exosomes in liver fibrosis. FASEB J. 2021;35:e21557. [114] HE F, LI WN, LI XX, et al. Exosome-mediated delivery of RBP-J decoy oligodeoxynucleotides ameliorates hepatic fibrosis in mice. Theranostics. 2022;12: 1816-1828. [115] LIN Y, YAN M, BAI Z, et al. Huc-MSC-derived exosomes modified with the targeting peptide of aHSCs for liver fibrosis therapy. J Nanobiotechnology. 2022;20:432. |
| [1] | Haonan Yang, Zhengwei Yuan, Junpeng Xu, Zhiqi Mao, Jianning Zhang. Preliminary study on the mechanisms and efficacy of deep brain stimulation in treating depression [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(在线): 1-9. |
| [2] | Wang Qisa, Lu Yuzheng, Han Xiufeng, Zhao Wenling, Shi Haitao, Xu Zhe. Cytocompatibility of 3D printed methyl acrylated hyaluronic acid/decellularized skin hydrogel scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1912-1920. |
| [3] | Tan Jing, Li Li, Wang Liangliang, Qin Xiangyu. Bionic functional coating improves the integration of titanium implants and skin tissue interface [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2014-2022. |
| [4] | Wang Songpeng, Liu Yusan, Yu Huanying, Gao Xiaoli, Xu Yingjiang, Zhang Xiaoming, Liu Min. Bidirectional regulation of reactive oxygen species based on zeolitic imidazolate framework-8 nanomaterials: from tumor therapy and antibacterial activity to cytoprotection [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2033-2013. |
| [5] | Liu Yang, Liu Donghui , Xu Lei, Zhan Xu, Sun Haobo, Kang Kai. Role and trend of stimuli-responsive injectable hydrogels in precise myocardial infarction therapy [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2072-2080. |
| [6] | Fu Lyupeng, Yu Peng, Liang Guoyan, Chang Yunbing. Electroactive materials applied in spinal surgery [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2113-2123. |
| [7] | Lai Yu, Chen Yueping, Zhang Xiaoyun. Research hotspots and frontier trends of bioactive materials in treating bone infections [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2132-2144. |
| [8] | Peng Zhiwei, Chen Lei, Tong Lei. Luteolin promotes wound healing in diabetic mice: roles and mechanisms [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1398-1406. |
| [9] | Yu Huifen, Mo Licun, Cheng Leping. The position and role of 5-hydroxytryptamine in the repair of tissue injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1196-1206. |
| [10] | Wang Mingqi, Feng Shiya, Han Yinhe, Yu Pengxin, Guo Lina, Jia Zixuan, Wang Xiuli. Construction and evaluation of a neuralized intestinal mucosal tissue engineering model in vitro [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 892-900. |
| [11] | Yu Shiyu, Yu Sutong, Xu Yang, Zhen Xiangyan, Han Fengxuan. Advances in research and application of tissue engineering therapeutic strategies in oral submucous fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 936-948. |
| [12] | Yang Hu, Zheng Yu, Jia Chengming, Wang Tong, Zhang Guangfei, Ji Yaoyao. Immune microenvironment regulates bone regeneration [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 701-710. |
| [13] | Wang Yu, Fan Minjie, Zheng Pengfei. Application of multistimuli-responsive hydrogels in bone damage repair: special responsiveness and diverse functions [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 469-479. |
| [14] | Zhang Qiya, Tong Yixiang, Yang Shijiao, Zhang Yumeng, Deng Ling, Wu Wei, Xie Yao, Liao Jian, Mao Ling. In vitro biocompatibility of graded glass infiltrated ultra-translucent zirconia [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 443-450. |
| [15] | Wang Zhuo, Sun Panpan, Cheng Huanzhi, Cao Tingting. Application of chitosan in repair and regeneration of oral hard and soft tissues [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 459-468. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||