Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (26): 5713-5720.doi: 10.12307/2025.718
Immune-associated peripheral ulcerative keratitis: feasibility of systemic immunomodulation combined with surgical treatment
Liu Xiaohan1, Chen Yingxin2, Gao Minghong2
- 1Graduate School of Dalain Medical University, Dalian 116000, Liaoning Province, China; 2General Hospital of Northern Theater Command, Shenyang 110000, Liaoning Province, China
-
Received:2024-08-14Accepted:2024-10-16Online:2025-09-18Published:2025-02-28 -
Contact:Chen Yingxin, MD, Associate chief physician, General Hospital of Northern Theater Command, Shenyang 110000, Liaoning Province, China -
About author:Liu Xiaohan, Master’s candidate, Dalain Medical University, Dalian 116000, Liaoning Province, China Gao Minghong, MD, Chief physician, General Hospital of Northern Theater Command, Shenyang 110000, Liaoning Province, China Liu Xiaohan and Gao Minghong contributed equally to this work.
CLC Number:
Cite this article
Liu Xiaohan, Chen Yingxin, Gao Minghong. Immune-associated peripheral ulcerative keratitis: feasibility of systemic immunomodulation combined with surgical treatment[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(26): 5713-5720.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 免疫相关性周边溃疡性角膜炎研究进展 见表1。 2.2 发病机制 睑缘炎相关角膜结膜病:睑缘炎相关角膜结膜病过去常被认为与睑缘的睑板腺功能异常、蠕形螨感染、机械性刺激和细菌定植引发的免疫反应相关,最近该病也被认为与化疗药物的使用相关[7]。AVILéS-PRIETO等[19]报道了使用硼替佐米治疗多发性骨髓瘤后并发睑缘炎相关角膜结膜病患者1例,在停用硼替佐米后角膜溃疡得到愈合。硼替佐米抑制泛素-蛋白酶体途径,睑板腺中降解蛋白的积累导致了睑缘炎的发生;除此之外,硼替佐米还能影响某些炎症通路,包括核因子κB、Janus激酶/信号传导及转录激活因子通路和促分裂原活化的蛋白激酶,促进炎症因子的释放,引起睑缘炎或睑板腺囊肿,进而引起角膜损伤。"

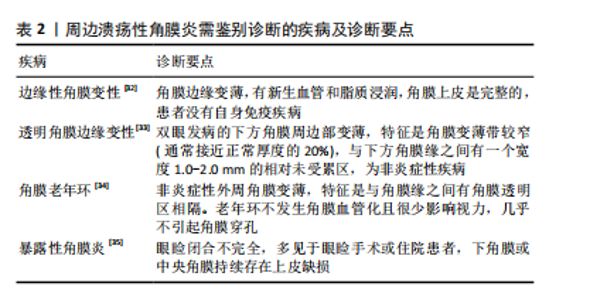
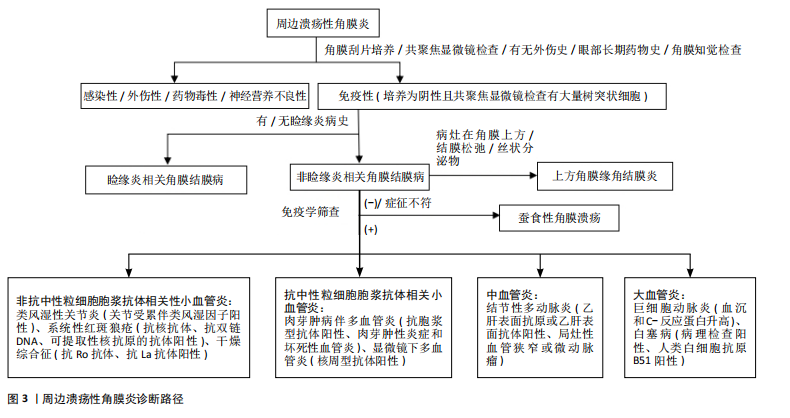
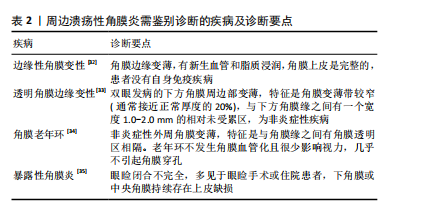
蚕食性角膜溃疡:早有学者认为蚕食性角膜溃疡是角膜特异性的自身免疫病,与全身其他器官无关,经组织样本免疫组化分析显示,CD4+ T细胞、巨噬细胞和B淋巴细胞的免疫细胞群导致角膜缘炎症细胞渗透加剧。也有观点认为抗角膜相关抗原和补体系统的自身抗体也与蚕食性角膜溃疡发病有关,自身抗体可以通过抗体依赖的细胞介导的细胞毒作用发挥功能,然而,在过去针对角膜相关抗原的自身抗体几乎是未知的。最近,CHI等[20]通过压力循环计数-数据非依赖采集蛋白质组学方法发现,角膜病灶组织中的中性粒细胞胞外杀菌网络的相关成分显著增加,肽基精氨酸脱亚胺酶4介导的瓜氨酸化可能导致抗瓜氨酸蛋白抗体的产生,从而参与该疾病的免疫病理过程,该研究强调了中性粒细胞胞外杀菌网络在蚕食性角膜溃疡发病机制中的作用,以及肽基精氨酸脱亚胺酶4介导瓜氨酸化的致病作用。 上方角膜缘角结膜炎:机械性损伤、泪膜不稳定性、炎症和自身免疫反应早已作为发病机制被提出。甲状腺功能亢进相关性眼病、干眼症、眼部的移植物抗宿主病、结膜松弛、隐形眼镜和眼睑疾病被认为是该疾病的风险因素[9]。患者的泪膜全层受损,所以这种疾病与干眼症密切相关且互相促进。有研究发现,与对照组相比,上方角膜缘角结膜炎患者结膜的肥大细胞数量增加,对肥大细胞驱动机制的进一步研究阐明了脱颗粒引发的各种炎症途径,这些途径可能在发病机制中发挥重要作用;眼部摩擦和机械应力将肥大细胞吸引到结膜并诱导其脱颗粒,停留在结膜的肥大细胞,加上结膜微创伤后被吸引的肥大细胞,会释放多种炎症递质,包括肿瘤坏死因子α、白细胞介素1和白细胞介素6[21]。最近的研究发现,睑板腺功能障碍和水样液缺乏与上方角膜缘角结膜炎高度相关[22]。 自身免疫性疾病相关的周边溃疡性角膜炎:过去常认为自身免疫性疾病相关的周边溃疡性角膜炎主要是由于基质金属蛋白酶和角膜基质中基质金属蛋白酶组织抑制剂水平失衡导致的角膜基质转换紊乱,促使角膜组织破坏和溃疡发生[23]。最近随着自身免疫性疾病的研究进展,人们将重心转移至角膜缘处的细胞免疫和体液免疫。目前,已有大量证据表明T细胞介导的免疫反应参与了该疾病的发病过程[24]。近年来,随着类风湿性关节炎等自身免疫性疾病发病机制的进一步探索,人辅助性T细胞1和17通路的作用机制研究越来越清晰,这些T淋巴细胞产生细胞因子,如白细胞介素2、白细胞介素6、白细胞介素17、白细胞介素23、干扰素γ和肿瘤坏死因子,从循环中募集白细胞导致角膜组织损伤[25]。在体液免疫方面,除了早已为人所熟知的经典补体途径,越来越多的研究表明B细胞通过更多其他机制导致自身免疫性疾病。类风湿性关节炎患者体内抗环瓜氨酸肽抗体、系统性红斑狼疮患者体内抗核抗体以及肉芽肿伴多血管炎患者体内抗中性粒细胞胞浆抗体均可与相应受体结合,诱导组织炎症反应[26]。除了产生自身抗体外,B 细胞还可与T细胞相互作用介导免疫反应。最新研究发现,自身免疫病患者炎症组织存在淋巴细胞聚集体,可激活外周辅助性T细胞,分泌稳态趋化因子CXCL13以募集B细胞及尚未激活的辅助性T细胞,并产生白细胞介素21推动B细胞分化为浆细胞,参与自身抗体生成,这可能也与自身免疫疾病介导的周边溃疡性角膜炎有关[27]。 2.3 临床表现 免疫性周边溃疡性角膜炎的主要症状是急性期的畏光、眼红、疼痛及慢性期由瘢痕性散光继发的视力下降。裂隙灯检查的主要体征是周边角膜基质新月形变薄、溃疡边缘下垂及不同程度的炎性细胞浸润。由于周边角膜神经支配较少,痛觉较中央角膜不敏感且病变部位不影响视轴,部分患者就诊时已达角膜穿孔或后弹力层膨出等重度病损情况。不同类型的免疫相关性周边溃疡性角膜炎的临床特征如下: 睑缘炎相关角膜结膜病:多见于好发睑板腺囊肿的人群,睑缘部的炎症累及到结膜和角膜,出现结膜充血、滤泡形成、乳头增生,点状角膜糜烂进展至角膜基质浸润和角膜溃疡,角膜浅基质层可见新生血管形成,病变多见于睑裂区[28]。 蚕食性角膜溃疡:是一种特发性形式,尽管它的确切发病机制尚不清楚,但通常被认为是一种针对角膜的自身免疫性疾病,而不与全身系统性疾病相关。蚕食性角膜溃疡是一种慢性、疼痛性溃疡,患者的眼部疼痛程度常与体征不相符,溃疡边缘为潜掘状,溃疡面好发于睑裂区和下方角膜缘,沿角膜周边部延伸,再向中央发展,最终可累及全角膜。恶性发展的蚕食性角膜溃疡穿孔率高达36%[29]。 上方角膜缘角结膜炎:患者常感觉有眼部刺激症状、灼热感、眼干、畏光和眼睑痉挛,一般没有慢性的视力损害。裂隙灯检查最常见的体征包括上睑结膜乳头状充血,上方球结膜松弛、水肿和充血,上皮角膜缘及周围结膜增厚以及上方角膜缘和邻近结膜细小点状染色,少数患者的上方角膜缘可见丝状分泌物。球结膜炎症通常发生在10:30到1:30点位,最明显的部位在上角膜缘附近。蚕食性角膜溃疡的疾病病程分为急性期、慢性期、缓解期及复发期。最近,CHENG等[30]根据该疾病的五大体征对该疾病制定了评分分级法则,其中包括上方球结膜充血、上方睑结膜乳头状充血水肿、上方球结膜松弛、上方角膜缘邻近结膜染色、角膜染色,而下角膜缘及邻近结膜的荧光素染色是该实验最新发现的疾病体征。 自身免疫性疾病相关周边溃疡性角膜炎:周边部角膜出现上皮缺损、基质炎症细胞浸润,形成新月形溃疡,与角膜缘有透明区相隔,不累及巩膜。患者有类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病史且多处于疾病活动期。最近,更多研究集中在抗中性粒细胞胞浆抗体相关性血管炎引发的溃疡性角膜炎。抗中性粒细胞胞浆抗体相关性血管炎是最常见的小血管炎,包括显微镜下多血管炎、肉芽肿病伴多血管炎、嗜酸性肉芽肿病伴多血管炎和某些类型药物诱导的血管炎。巩膜炎、巩膜外层炎和周边溃疡性角膜炎等眼表疾病是中性粒细胞胞浆抗体相关血管炎中最常见的眼部表现,当患者发生周边溃疡性角膜炎时,筛查核周型抗体是十分重要的。在LIM等[31]的报道中,5例并发眼部症状的抗髓过氧化物酶抗体阳性患者中有4例表现为角膜缘溃疡。 2.4 诊断方法 免疫性周边溃疡性角膜炎可以根据病史、临床特征、眼前节光学相干断层扫描检查、共聚焦显微镜检查、生物标志物和其他基础系统性疾病完成诊断,共聚焦显微镜通常显示病灶区及临近结膜处有大量的树突状细胞浸润,诊断路径见图3。免疫性周边溃疡性角膜炎还应与易发生在角膜缘处的其他疾病相鉴别,鉴别要点见表2。"

减少基质损害并优化眼表情况。对于角膜溃疡累及后弹力层或角膜穿孔的患者,通常需要手术干预。 2.5.1 局部治疗 药物治疗:局部应用人工泪液、糖皮质激素滴眼液、他克莫司滴眼液已被证明对于缓解免疫性周边溃疡性角膜炎有效,尤其针对蚕食性角膜溃疡这类角膜原位性免疫疾病。糖皮质激素具有显著的抗炎特性,但会抑制胶原蛋白的生成和角膜上皮修复,因此继发于自身免疫病的患者,不建议局部使用糖皮质激素治疗,避免其抑制成纤维细胞浸润致使伤口愈合延迟[37]。而对于上方角膜缘角结膜炎治疗,结膜囊内局部应用糖皮质激素滴眼液一直没有被证实有很好的治疗效果。KISER等[38]的研究发现,对照组在结膜囊内滴用糖皮质激素后,泪膜的前段光学相干断层扫描检查显示药物更多停留在了角膜下方,这可能是由于患者上眼睑紧绷、上球结膜松弛或泪膜不稳定导致了滴眼液不能准确作用于角膜上方的病灶区,因此在上方球结膜处应用糖皮质激素滴眼效果更显著。 物理治疗:睑缘炎相关角膜结膜病和上方角膜缘角结膜炎这类易合并睑缘炎的患者可以行眼表雾化熏蒸联合睑板腺按摩及佩戴治疗性绷带镜治疗,以减轻睑缘肥厚对角膜的刺激作用。合并干眼症或者泪膜不稳定的患者可以行泪小点栓塞术,尤其适用于上方角膜缘角结膜炎[38]。佩戴绷带镜同样适用于缓解蚕食性角膜溃疡或溃疡灶较深患者的疼痛症状。 2.5.2 全身系统性药物治疗 伴随自身免疫疾病的周边角膜溃疡和常规治疗无效的蚕食性角膜溃疡,均应接受糖皮质激素联合免疫抑制剂的系统免疫调节治疗[8],全身使用免疫抑制剂能有效治疗自身免疫病并延缓溃疡的进展。有研究表明,即使周边溃疡性角膜炎的患者没有诊断出任何自身免疫性疾病,也推荐首先使用系统免疫调节治疗[39]。OGRA等[36]报道在因各种基础疾病(如类风湿性关节炎、系统性红斑狼疮、肉芽肿伴多血管炎)导致周边溃疡性角膜炎及巩膜炎的患者中,接受系统免疫调节治疗的患者平均死亡时间为24.7年,而未接受治疗的患者平均死亡时间为10.7年。相比于晚期接受系统免疫调节治疗的患者,早期接受治疗的患者更不易出现眼部病灶的复发,出现原病复发的时机更迟[39]。在OGRA等[36]长达10年的单中心回顾性病例分析中得出结论,自身免疫性疾病相关周边溃疡性角膜炎有可能在第一次用药干预后的最初2年复发。相较于坏死性巩膜炎,周边溃疡性角膜炎的受试者复发率更高,并且并发穿孔的患者易多次复发,还可能累及对侧眼,因此维持治疗十分必要。 系统免疫调节治疗中免疫抑制剂的选择因基础疾病不同而略有差异。在过去的20年里,免疫抑制剂作为周边溃疡性角膜炎的治疗手段逐渐应用,降低了患者的死亡率和角膜穿孔情况,延缓了手术治疗的时机。目前可治疗眼部炎症的免疫抑制剂包括抗代谢物、烷基化剂、T细胞抑制剂、生物制剂、Janus激酶抑制剂。 抗代谢物和烷基化剂:甲氨蝶呤、硫唑嘌呤和霉酚酸酯已被证实治疗免疫相关性周边溃疡性角膜炎有效。但甲氨蝶呤和硫唑嘌呤都较容易发生胃肠道反应和骨髓抑制,相比前两者,霉酚酸酯的安全性及有效性相对更高[40]。烷基化剂包括环磷酰胺和氨丁酸氮芥,能有效控制眼部及全身症状,但耐受性较低[41],并且存在骨髓抑制、诱发黏膜炎和膀胱炎等不良反应[42]。 T细胞抑制剂:环孢素属于T细胞抑制剂,与抗代谢物和烷基化剂相比对于严重的自身免疫病疗效一般,所以更适用于尚未发生自身免疫疾病或蚕食性角膜溃疡的患者。但环孢素具有肾毒性,肾功能不全的患者应慎用[43]。 生物制剂:目前常用生物制剂包括CD20单克隆抗体和肿瘤坏死因子抑制剂。利妥昔单抗是一种与B细胞表面CD20位点结合的嵌合单克隆抗体,一旦二者结合,抗体通过抗体依赖细胞介导的细胞毒作用、补体激活和凋亡来消除B细胞,以达到调节体液免疫的目的。英夫利昔单抗作为肿瘤坏死因子抑制剂,已被验证在治疗与免疫疾病相关的溃疡性角膜炎、葡萄膜炎和巩膜炎中发挥重要作用[44]。肿瘤坏死因子α是巨噬细胞和其他免疫细胞释放的促炎细胞因子,在类风湿性关节炎和其他自身免疫性疾病的治疗中被作为靶点。抗肿瘤坏死因子药物可以有效阻止角膜免疫角化[45]。目前利妥昔单抗和英夫利昔单抗是生物制剂中研究最频繁、相关证据水平最高的一线疗法。角膜缘中除了肿瘤坏死因子α,白细胞介素6也可以上调成纤维细胞、单核细胞及粒细胞产生基质金属蛋白酶,促进溃疡进展和免疫细胞浸润。托珠单抗是一种重组人源化白细胞介素6受体的单克隆抗体,通过与人白细胞介素6受体结合竞争性抑制白细胞介素6经典信号通路和反式信号通路,进而起到抑制细胞促炎因子活性和阻断炎症反应的作用[46]。目前托珠单抗已被中国、美国、日本、欧盟等批准用于治疗自身免疫性疾病和炎症性疾病,如类风湿性关节炎、巨细胞动脉炎和大血管炎等。托珠单抗阻断白细胞介素6促炎通路的作用有望在免疫性周边溃疡性角膜炎治疗中提供一定的价值。目前已有报道托珠单抗对于抑制自身免疫病相关周边溃疡性角膜炎和蚕食性角膜溃疡的疾病进展、延缓手术时机是有效的[8]。但也有学者认为在托珠单抗作为羊膜移植治疗类风湿性关节炎合并周边溃疡性角膜炎的维持治疗时导致了复发,这可能与白细胞介素6表达水平的降低致使角膜上皮组织再生受抑制有关[47],故托珠单抗能否成为免疫性周边溃疡性角膜炎的有效治疗手段,仍需更多的临床试验来证明。 Janus激酶抑制剂:Janus激酶信号传导及转录激活因子通路也与多种自身免疫性疾病的发病机制有关。包括白细胞介素6在内的多种促炎细胞因子与其受体结合致使细胞内Janus激酶活化并激活该通路,使转录因子信号传导及转录激活蛋白磷酸化,细胞核中相应的基因表达增加,进而刺激炎症细胞活化,诱发局部炎症反应,导致组织损伤[48]。因此,抑制Janus激酶介导的下游信号转导可能是一种有价值的治疗选择。目前,第一代非选择性Janus激酶抑制剂巴瑞替尼、托法替尼和第二代的高选择性Janus激酶1抑制剂乌帕替尼、非戈替尼,已经被美国和欧盟批准用于多种难治性自身免疫性结缔组织病的治疗中,疗效显著且安全性良好[49]。免疫性周边溃疡性角膜炎的发病机制目前尚未阐明,但广泛共识是该疾病通常是全身高度活动性炎症的眼部表现,所以Janus激酶抑制剂有治疗潜力。已有研究表明,多种难治性自身免疫病相关眼部炎症性疾病在应用Janus激酶抑制剂治疗后症状明显改善,并且无明显不良反应[50]。CALVO-RíO等[51]的病例报告也支持了这一观点。目前,虽然Janus激酶抑制剂有一定的应用前景,但仍需进行更大范围的队列研究来验证。 2.5.3 手术治疗 当出现角膜后弹力层膨出或角膜穿孔时通常需要手术干预。同时,术后联合足够的免疫抑制治疗可控制溃疡的基础炎症、降低移植手术后的植片自溶和排斥反应发生率,从而提高植片生存率和手术成功率。LIU等[52]在25人、31眼的前瞻性试验中,采用共聚焦显微镜监测改良板层角膜移植术后角膜植片树突细胞密度变化,以指导糖皮质激素和免疫抑制剂的使用,减少了恶性蚕食性角膜溃疡的复发,随访期间所有眼均未见异体移植物自溶或免疫排斥反应发生。目前,根据患者溃疡类型、深度、形态不同,采用的术式也有所不同,常见术式及其适应证见表3。"


羊膜移植术:羊膜能减轻眼表炎症、促进角膜上皮愈合、加强局部免疫抑制,适用于角膜上皮缺损和角膜基质溃疡。羊膜中的Fas配体和蛋白酶抑制剂被证明可以通过免疫调节来降低角膜的炎症反应[53-54];此外,羊膜含有大量的神经生长因子,可以改善角膜移植术后持续性角膜上皮缺损的并发症[55]。但因羊膜结构强度较低且吸收速度较快,不适用于较深较大的溃疡灶,临床应用时局限性较大。 结膜瓣掩盖术:能控制炎症,阻止角膜穿孔的发生,以稳定病情、推迟角膜移植术的时机。但该术式导致角膜混浊、角膜结膜化甚至角膜血管化的风险很高[55],目前已很少用于周边溃疡性角膜炎的治疗。 Tenons囊移植术:Tenons囊是一种致密的纤维组织,由眼眶平滑肌网组成,能调节所有眼外肌的张力。与角膜植片移植相比,Tenons囊是一种自体组织,更容易获得,经济效益较好,并且不参与机体免疫反应,术后不会发生排斥。但由于Tenons囊是一种不透明的组织,尤其是当其位于视轴中央时,术后视功能恢复结果可能不甚理想,相当一部分患者可能需要随后的角膜移植术以康复视力,因此,仅在紧急情况或供体植片不足的情况下可作为一种临时选择[56]。 穿透性角膜移植术:当角膜穿孔较大时需行穿透性角膜移植术,大直径的穿透性角膜移植术可去除发炎的周边角膜,但由于邻近角膜缘血管的存在术后排斥风险较高[57]。穿透性角膜移植术在6个月内植片存活率较低,仅不足40%,因此许多患者需要多次移植[58]。为了降低移植物排斥反应的风险,对于远离视轴的偏心穿孔,可使用直径为3.0-5.5 mm的小直径穿透性角膜移植,但大多数情况下植片生存率和视功能恢复结果并不令人满意。 板层角膜移植术:新月形板层角膜移植术已成为治疗小直径或新月形的周边角膜穿孔或后弹力层膨出的首选技术[59]。相比穿透性角膜移植手术和内皮移植手术,板层角膜移植手术仅移植角膜基质层,术后发生排斥的可能性更低[60],降低了虹膜周边前粘连、眼内炎、继发性青光眼或并发性白内障的风险。YOKOYAMA等[61]认为周边溃疡性角膜炎的角膜水肿是由基质炎症引起,而不是角膜内皮细胞损伤。因此,可采用板层角膜移植术保留宿主角膜内皮细胞,以避免穿透性角膜移植带来的更多并发症。但当溃疡位于旁中心位置时,应避免将植片的边界放置于视轴附近,可以使用改良版的浅层前板层角膜移植术。ARTAECHEVARRIA ARTIEDA等[62]用飞秒激光对供体植片进行整形,将植片偏中心地移植至1例周边溃疡性角膜炎的患者眼表,术后患者视力得到明显改善。此外,双板层角膜移植术可以用于蚕食性角膜溃疡所引起的角膜变薄,即使用带内皮层的薄板层植片修复穿孔,另一不带内皮的板层植片覆盖在角膜表面[52]。板层角膜移植手术对于术后局部应用糖皮质激素的长期需求更少,植片的长期存活率更高[63]。与穿透性角膜移植手术相比,板层角膜移植手术的另一个好处是如果没有新鲜的供体植片,可以使用甘油保存的供体角膜来完成手术[64]。但即使以新鲜供体角膜为材料的板层角膜移植手术后仍可能发生上皮和基质排斥反应,新鲜供体角膜的细胞成分包括上皮细胞、基质形成细胞和来源于骨髓的细胞,可能与板层角膜移植手术的排斥反应有关,因此术后抗免疫排斥反应十分重要[65]。 当供体角膜缺乏时可采用脱细胞猪角膜基质进行移植[66]。人工制备的脱细胞猪角膜基质具有良好的生物相容性、安全性、低抗原性。与人角膜植片有所不同,随着术后随访时间的延长,脱细胞猪角膜基质植片会变得更加透明[60]。目前关于脱细胞猪角膜基质治疗免疫相关性周边溃疡性角膜炎尚未有高质量的循证医学研究,但目前已有大量证据表明,脱细胞猪角膜基质移植是一种针对感染性周边溃疡性角膜炎的有效和安全的治疗方法[67]。鉴于感染性和免疫相关性周边溃疡性角膜炎的病理生理机制基本相同,脱细胞猪角膜基质植片用于治疗免疫相关性周边溃疡性角膜炎也有良好的前景。随着制备及预处理方法的迭代,用天冬氨酸修饰的脱细胞猪角膜基质支架的水化程度、超微结构规则性、角膜黏弹性和抗降解能力等方面均显著增强,在角膜的生物力学方面显示出巨大潜力[68]。"

| [1] LI Y, MCKELVIE J, MCLINTOCK C. Visual Outcomes of Patients With Peripheral Ulcerative Keratitis and the Effect of Immunosuppression-A 6-Year Experience in Queensland, Australia. Eye Contact Lens. 2022;48(7):283-288. [2] FU L, JONES S. Peripheral Ulcerative Keratitis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024. [3] SHARMA N, SINHA G, SHEKHAR H, et al. Demographic profile, clinical features and outcome of peripheral ulcerative keratitis: a prospective study. Br J Ophthalmol. 2015;99(11):1503-1508. [4] CóRDOBA A, MEJíA LF, GONZáLEZ N, et al. Unusual Corneal Sarcoidosis Manifestations. Ocul Immunol Inflamm. 2023;31(5):940-944. [5] ARTIFONI M, ROTHSCHILD PR, BRÉZIN A, et al. Ocular inflammatory diseases associated with rheumatoid arthritis. Nat Rev Rheumatol. 2014;10(2):108-116. [6] WATANABE R, ISHII T, YOSHIDA M, et al. Ulcerative keratitis in patients with rheumatoid arthritis in the modern biologic era: a series of eight cases and literature review. Int J Rheum Dis. 2017;20(2):225-230. [7] TAVASSOLI S, WONG N, CHAN E. Ocular manifestations of rosacea: A clinical review. Clin Exp Ophthalmol. 2021;49(2):104-117. [8] XIA A, DIETRICH-NTOUKAS T, PLEYER U. Effect of Anti-TNF Treatment on Mooren’s Ulcer: A Case Series and Review of the Literature. Ocul Immunol Inflamm. 2023; 31(4):675-681. [9] LAHOTI S, WEISS M, JOHNSON DA, et al. Superior limbic keratoconjunctivitis: a comprehensive review. Surv Ophthalmol. 2022;67(2):331-341. [10] BAQUET-WALSCHEID K, NEß T, MAIER PC, et al. Peripheral Ulcerative Keratitis: Clinical Characteristics, Differential Diagnoses and Therapeutic Concepts. Klin Monbl Augenheilkd. 2024;241(5):633-643. [11] SCHAAP OL, FELTKAMP TE, BREEBAART AC. Circulating antibodies to corneal tissue in a patient suffering from Mooren’s ulcer (ulcus rodens corneae). Clin Exp Immunol. 1969;5(4):365-370. [12] ALLANSMITH MR, MCCLELLAN BH. Immunoglobulins in the human cornea. Am J Ophthalmol. 1975;80(1):123-132. [13] MONDINO BJ, BRADY KJ. Distribution of hemolytic complement in the normal cornea. Arch Ophthalmol. 1981;99(8):1430-1433.
[14] MüLLER LJ, PELS E, SCHURMANS LR, et al. A new three-dimensional model of the organization of proteoglycans and collagen fibrils in the human corneal stroma. Exp Eye Res. 2004;78(3):493-501. [15] MARSOVSZKY L, RESCH MD, NÉMETH J, et al. In vivo confocal microscopic evaluation of corneal Langerhans cell density, and distribution and evaluation of dry eye in rheumatoid arthritis. Innate Immun. 2013;19(4):348-354. [16] DOMINGUEZ-CASAS LC, SáNCHEZ-BILBAO L, CALVO-RíO V, et al. Biologic therapy in severe and refractory peripheral ulcerative keratitis (PUK). Multicenter study of 34 patients. Semin Arthritis Rheum. 2020;50(4):608-615. [17] 中华医学会眼科学分会角膜病学组.中国免疫相关性边缘性角膜病临床诊疗专家共识(2022年)[J].中华眼科杂志,2022,58(2):90-95. [18] LUCCHINO L, MASTROGIUSEPPE E, GIOVANNETTI F, et al. Anterior Segment Optical Coherence Tomography for the Tailored Treatment of Mooren’s Ulcer: A Case Report. J Clin Med. 2024;13(18):5384. [19] AVILÉS-PRIETO J, CARO-MAGDALENO M, RODRÍGUEZ-DE-LA-RÚA-FRANCH E. Peripheral Ulcerative Keratopathy following Systemic Treatment with Bortezomib: A Case Report. Ocul Immunol Inflamm. 2024;32(4):470-472. [20] CHI H, HAO W, QI X, et al. A proteomic approach towards understanding the pathogenesis of Mooren’s ulcer. Exp Eye Res. 2021;205:108509. [21] LEE DH, MARGOLIS MS, IOVIENO A, et al. Superior limbic keratoconjunctivitis: Update on pathophysiology and management. Ocul Surf. 2023;28:144-152. [22] AHN H, JI YW, JUN I, et al. Effects of meibomian gland dysfunction and aqueous deficiency on friction-related disease. Ocul Surf. 2022;26:295-299. [23] KARAMPATAKIS V, KONIDARIS V, MICHAILIDOU M, et al.Peripheral corneal ulceration associated with rheumatoid arthritis. The American journal of case reports. 2013;14:318-321. [24] HASSANPOUR K, H ELSHEIKH R, ARABI A, et al. Peripheral Ulcerative Keratitis: A Review. Ophthalmic Vis Res. 2022;17(2):252-275. [25] LEE GR. The Balance of Th17 versus Treg Cells in Autoimmunity. Int J Mol Sci. 2018;19(3):730. [26] RAZA IGA, CLARKE AJ. B Cell Metabolism and Autophagy in Autoimmunity. Front Immunol. 2021;12:681105. [27] HUANG Y, BA X, HAN L, et al. T peripheral helper cells in autoimmune diseases: What do we know? Front Immunol. 2023;14:1145573. [28] ROUSTA ST. Pediatric blepharokeratoconjunctivitis: is there a ‘right’ treatment? Curr Opin Ophthalmol. 2017;28(5):449-453. [29] ANITHA V, GHORPADE A, RAVINDRAN M. A modified Tenons sling annular graft for advanced peripheral ulcerative keratitis with an hourglass cornea. Indian J Ophthalmol. 2022;70(2):655-657. [30] CHENG C, ZHU M, LIN T, et al. Recharacterization of superior limbic keratoconjunctivitis via a subdividing grading method in 236 Chinese patients. Graefes Arch Clin Exp Ophthalmol. 2022;260(7):2291-2298. [31] LIM YW, LIEW OH. Perinuclear Antineutrophil Cytoplasmic Antibody-Associated Ocular Manifestations: Case Series and Literature Review. Ocul Immunol Inflamm. 2024:1-4.doi: 10.1080/09273948.2024.2346820. [32] RUUTILA M, FAGERHOLM P, LAGALI N, et al. Diagnostic Criteria for Terrien Marginal Degeneration: Nordic Terrien Degeneration Study. Cornea. 2021;40(2): 133-141. [33] MOUNIR A, ABDELLAH MM, AWNY I, et al. Demographic, clinical and tomographic characteristics of pellucid marginal degeneration patients in South Egyptian population. Int Ophthalmol. 2022;42(10):3237-3242. [34] DING Y, MURRI MS, BIRDSONG OC, et al. Terrien marginal degeneration. Survey of Ophthalmology. 2019;64(2):162-174. [35] ADEBAYO A, TAUBER J, TINGLEY J, et al. Assessing an Exposure Keratopathy Prevention Strategy in Mechanically Ventilated Patients: A Retrospective Study. Eye Contact Lens. 2024;50(2):70-72. [36] OGRA S, SIMS JL, MCGHEE CNJ, et al. Ocular complications and mortality in peripheral ulcerative keratitis and necrotising scleritis: The role of systemic immunosuppression. Clin Exp Ophthalmol. 2020;48(4):434-441. [37] CAO Y, ZHANG W, WU J, et al. Peripheral Ulcerative Keratitis Associated with Autoimmune Disease: Pathogenesis and Treatment. J Ophthalmol. 2017;2017:1-12. [38] KISER KA, HONG AR, LUBNIEWSKI A, et al. Topical steroids to the superior bulbar conjunctiva for the treatment of superior limbic keratoconjunctivitis (SLK). Ocul Surf. 2022;23:114-115. [39] RUIZ-LOZANO RE, RAMOS-DAVILA EM, GARZA-GARZA LA, et al. Rheumatoid arthritis-associated peripheral ulcerative keratitis outcomes after early immunosuppressive therapy. Br J Ophthalmol. 2023;107(9):1246-1252. [40] BURSKA AN, HUNT L, BOISSINOT M, et al. Autoantibodies to posttranslational modifications in rheumatoid arthritis. Mediators Inflamm. 2014;2014:492873. [41] CLEWES AR, DAWSON JK, KAYE S, et al. Peripheral ulcerative keratitis in rheumatoid arthritis: successful use of intravenous cyclophosphamide and comparison of clinical and serological characteristics. Ann Rheum Dis. 2005; 64(6):961-962. [42] KARACA I, TRAN EM, PARK S, et al. Intravenous cyclophosphamide therapy for patients with severe ocular inflammatory diseases who failed other immunomodulatory therapies. J Ophthalmic Inflamm Infect. 2024;14(1):12. [43] HATA M, NAKAMURA T, SOTOZONO C, et al. Atypical continuous keratitis in a case of rheumatoid arthritis accompanying severe scleritis. Cornea. 2012;31(12):1493. [44] DOMINGUEZ-CASAS LC, SáNCHEZ-BILBAO L, CALVO-RíO V, et al. Biologic therapy in severe and refractory peripheral ulcerative keratitis (PUK). Multicenter study of 34 patients. Semin Arthritis Rheum. 2020;50(4):608-615. [45] ILIOU C, ANTHIS N, TSIFETAKI N, et al. Clinical images: Corneal melt in a woman with longstanding rheumatoid arthritis. Arthritis Rheum. 2012;64(1):253. [46] SHEPPARD M, LASKOU F, STAPLETON PP, et al. Tocilizumab (Actemra). Hum Vaccin Immunother. 2017;13(9):1972-1988. [47] COHEN F, GABISON EE, STéPHAN S, et al. Peripheral ulcerative keratitis in rheumatoid arthritis patients taking tocilizumab: paradoxical manifestation or insufficient efficacy? Rheumatology (Oxford). 2021; 60(11):5413-5418. [48] BENUCCI M, BERNARDINI P, COCCIA C, et al. JAK inhibitors and autoimmune rheumatic diseases. Autoimmun Rev. 2023;22(4):103276. [49] SHAH RJ, BANERJEE S, RAYCHAUDHURI S, et al. JAK-STAT inhibitors in Immune mediated diseases: An Overview. Indian J Dermatol Venereol Leprol. 2023;89(5): 691-699. [50] WEN J, HU H, CHEN M, et al. Role of Janus Kinase (JAK) Inhibitor in Autoimmune Ocular Inflammation: A Systematic Review. J Immunol Res. 2021;2021:2324400. [51] CALVO-RÍO V, SÁNCHEZ-BILBAO L, ÁLVAREZ-REGUERA C, et al. Baricitinib in severe and refractory peripheral ulcerative keratitis: a case report and literature review. Ther Adv Musculoskelet Dis. 2022;14:1759720x221137126. [52] LIU J, SHI W, LI S, et al. Modified lamellar keratoplasty and immunosuppressive therapy guided by in vivo confocal microscopy for perforated Mooren’s ulcer. Br J Ophthalmol. 2015;99(6):778-783. [53] AZIZI S, SUBHI Y, RASMUSSEN MLR. Surgical Treatment of Corneal Shield Ulcer in Vernal Keratoconjunctivitis: A Systematic Review. J Pers Med. 2023;13(7):1092. [54] BULUT O, MUSAYEVA G, SELVER OB. Impact of adjuvant amniotic membrane transplantation in infectious ulcerative keratitis. Int Ophthalmol. 2023;43(3): 915-923. [55] SABHAPANDIT S, MURTHY SI, SHARMA N, et al. Surgical Management of Peripheral Ulcerative Keratitis: Update on Surgical Techniques and Their Outcome. Clinical Ophthalmology. 2022;16:3547-3557. [56] KUSUMESH R, AMBASTHA A, SINGH A, et al. Clinical outcome and course of Tenon’s patch graft in corneal perforation and descemetocele. Indian J Ophthalmol. 2022;70(12):4257-4262. [57] JHANJI V, YOUNG AL, MEHTA JS, et al. Management of corneal perforation. Surv Ophthalmol. 2011;56(6):522-538. [58] HEATHER M. SKEENS MAEJH, MD. Large-diameter penetrating keratoplasty indications and outcomes. Cornea. 2010;29(3):296-301. [59] LOHCHAB M, PRAKASH G, ARORA T, et al. Surgical management of peripheral corneal thinning disorders. Surv Ophthalmol. 2019;64(1): 67-78. [60] LIANG T, WANG X, WU J, et al. Small-diameter acellular porcine corneal stroma for peripheral corneal ulceration treatment. Int J Ophthalmol. 2024;17(5):831-837. [61] YOKOYAMA K, NAKAMURA R, OTSUKA T, et al. Deep Anterior Lamellar Keratoplasty and Peripheral Lamellar Keratoplasty for a Case of Severe Peripheral Ulcerative Keratitis. Case Rep Ophthalmol. 2022;13(1):9-16. [62] ARTAECHEVARRIA ARTIEDA J, ESTéBANEZ-CORRALES N, SÁNCHEZ-PERNAUTE O, et al. Peripheral Ulcerative Keratitis in a Patient with Bilateral Scleritis: Medical and Surgical Management. Case Rep Ophthalmol. 2020;11(3):500-506. [63] ARUN K, GEORGOUDIS P. Pseudomonas Keratitis: From Diagnosis to Successful Deep Anterior Lamellar Keratoplasty. Cureus. 2024;16(3):e56154. [64] SHARMA A, SHARMA R. Customized therapeutic deep anterior lamellar keratoplasty in perforated Mooren’s ulcer: A novel technique. Indian J Ophthalmol. 2024;72(1):130-133. [65] LI J, YU L, DENG Z, et al. Deep anterior lamellar keratoplasty using acellular corneal tissue for prevention of allograft rejection in high-risk corneas. Am J Ophthalmol. 2011;152(5):762-70.e3. [66] 刘景晨,李明军,孙曙光.眼科领域应用的脱细胞组织材料[J].中国组织工程研究,2021,25(34):5530-5536. [67] CHEN Y, ZHANG L, LIU Z, et al. Efficacy of Lamellar Keratoplasty with Acellular Porcine Corneal Stroma in Treatment for Infectious Central and Peripheral Corneal Ulcers. Ther Clin Risk Manag. 2021;17:623-634. [68] WANG Y, XU L, ZHAO J, et al. Reconstructing auto tissue engineering lamellar cornea with aspartic acid modified acellular porcine corneal stroma and preconditioned limbal stem cell for corneal regeneration. Biomaterials. 2022; 289:121745. |
| [1] | Jing Ruyi, Chen Yingxin, Cao Lei . Prognosis of deep lamellar keratoplasty versus penetrating keratoplasty in the treatment of stromal corneal dystrophy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1626-1633. |
| [2] | Ba Yanhong, Gao Minghong, Chen Yingxin. Impact of graft thickness on corneal endothelial decompensation following simple Descemet’s stripping endothelial keratoplasty [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1199-1207. |
| [3] | Lu Xiuli, Xu Huazhen, Chen Yuxing, Yao Nan, Hu Zixuan, Huang Dane. Mechanism of Jiangu Formula in treating osteoporosis based on osteoclast-osteoblast coupling [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6828-6835. |
| [4] | Yan Laijun, Ge Haiya, Wang Zhengming, Yang Zongrui, Niu Lifeng, Zhan Hongsheng. Mechanism by which Tongdu Huoxue Decoction inhibits macrophage inflammation to delay intervertebral disc degeneration in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6851-6857. |
| [5] | Nigeayi · Aihemaiti, Yilidanna · Dilixiati, An Wei, Maimaitituxun · Tuerdi. Expression of mitochondrial creatine kinase 2 in a rat model of temporomandibular joint osteoarthritis and its role in inflammation progression [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6877-6884. |
| [6] | Wang Ziheng, Wu Shuang. Oxidative stress-related genes and molecular mechanisms after spinal cord injury: data analysis and verification based on GEO database [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6893-6904. |
| [7] | Zhang Pulian, Liu Baoru, Yang Min . Mesenchymal stem cells for treatment of aplastic anemia: inhibiting or activating relevant targets in its pathological evolution [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(31): 6800-6810. |
| [8] | Yu Qinghe, Cai Ziming, Wu Jintao, Ma Pengfei, Zhang Xin, Zhou Longqian, Wang Yakun, Lin Xiaoqin, Lin Wenping. Vanillic acid inhibits inflammatory response and extracellular matrix degradation of endplate chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6391-9397. |
| [9] | Fan Jiaxin, Jia Xiang, Xu Tianjie, Liu Kainan, Guo Xiaoling, Zhang Hui, Wang Qian . Metformin inhibits ferroptosis and improves cartilage damage in osteoarthritis model rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6398-6408. |
| [10] | Zhou Ying, Tian Yong, Zhong Zhimei, Gu Yongxiang, Fang Hao. Inhibition of tumor necrosis factor receptor associated factor 6 regulates mTORC1/ULK1 signaling and promotes autophagy to improve myocardial injury in sepsis mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6434-6440. |
| [11] | Wang Wanchun, , Yi Jun, Yan Zhangren, Yang Yue, Dong Degang, Li Yumei. 717 Jiedu Decoction remodels homeostasis of extracellular matrix and promotes repair of local injured tissues in rats after Agkistrodon halys bite [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6457-6465. |
| [12] | Zhang Xin, Guo Baojuan, Xu Huixin, Shen Yuzhen, Yang Xiaofan, Yang Xufang, Chen Pei. Protective effects and mechanisms of 3-N-butylphthalide in Parkinson’s disease cell models [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6466-6473. |
| [13] | Zhang Songjiang, Li Longyang, Zhou Chunguang, Gao Jianfeng. Central anti-inflammatory effect and mechanism of tea polyphenols in exercise fatigue model mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6474-6481. |
| [14] | Hu Shujuan, Liu Dang, Ding Yiting, Liu Xuan, Xia Ruohan, Wang Xianwang. Ameliorative effect of walnut oil and peanut oil on atherosclerosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6482-6488. |
| [15] | Zhang Jian, Cai Feng, Li Tingwen, Ren Pengbo. Fatigue gait recognition of athletes based on fish swarm algorithm [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6489-6498. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||