Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (6): 1499-1507.doi: 10.12307/2026.570
Previous Articles Next Articles
Potential target values of low temperature and cold receptor transient receptor potential M8 and glutamate receptor-3/glutamate receptor ionotropic, kainate 2 in the treatment of hypertension
Wang Jingfeng, Xia Fan, Mao Sujie, Li Xiaolin
- Harbin Sports University, Harbin 150008, Heilongjiang Province, China
-
Received:2024-12-25Accepted:2025-03-14Online:2026-02-28Published:2025-07-17 -
Contact:Li Xiaolin, PhD, Harbin Sports University, Harbin 150008, Heilongjiang Province, China -
About author:Wang Jingfeng, PhD candidate, Harbin Sports University, Harbin 150008, Heilongjiang Province, China -
Supported by:Harbin Sport University Laboratory Platform Special Project, No. LAB2021-06 (to LXL); the Natural Science Foundation of Heilongjiang Province, No. LH2022C051 (to LXL [project participant]
CLC Number:
Cite this article
Wang Jingfeng, Xia Fan, Mao Sujie, Li Xiaolin. Potential target values of low temperature and cold receptor transient receptor potential M8 and glutamate receptor-3/glutamate receptor ionotropic, kainate 2 in the treatment of hypertension[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1499-1507.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
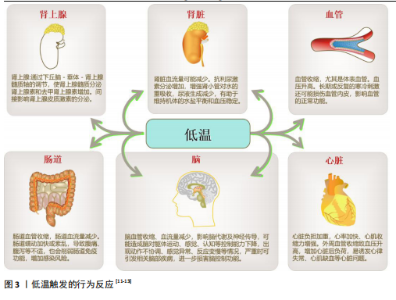
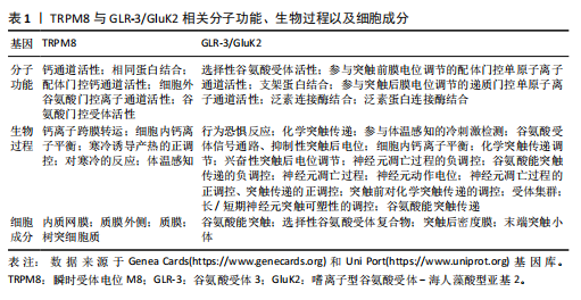
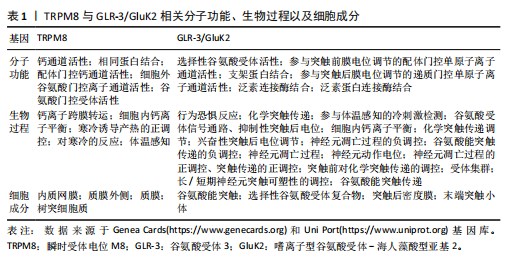
2.1 TRPM8、GLR-3/GluK2与低温 寒冷刺激触发适当行为反应的能力对动物的生存和健康至关重要[10-13](图3)。动物已经进化出复杂的、多方面的感觉系统来应对冷刺激[10]。在哺乳动物等恒温动物中已经发现了一些冷传感器,如瞬时受体电位(transient receptor potential,TRP)离子通道TRPM8以及谷氨酸受体GLR-3/GluK2[9](表1)。 2.1.1 TRPM8与低温 TRP阳离子通道家族在温度感知、疼痛传导、血管舒张和肿瘤发生等多种过程中起着关键作用。TRPM8是研究较多的TRPM通道之一,被认为是环境寒冷的生理传感器[14]。TRPM8通道最初是在小鼠感觉背根神经节神经元中发现的,最初因它与TRP家族成员的同源性而被命名为TRP-p8[15],并且现在许多TRPM8亚型已经在各种哺乳动物组织中得到描述,如前列腺、心血管系统、支气管肺组织、膀胱和泌尿生殖道等[16]。 该通道在小尺寸的外周感觉神经元(无髓鞘纤维)中表达,以传导环境冷刺激[17]。TRPM8已被确定为Ca2+渗透性阳离子通道,并以电压通道依赖的方式参与体温的调节[18]。薄荷中的“降温”成分薄荷醇是最著名的TRPM8通道化学激动剂[19]。薄荷醇可以提高该通道的温度阈值,还可以调节通道的开放概率和离子电导率,并将电压敏感性转移[20]。目前有许多其他化合物也可以激活TRPM8,例如,桉树醇和薄荷醇衍生物[14]。 为了更好地适应环境温度,TRPM8感知寒冷的能力在不同物种中是精细调节的[21]。甚至有研究提出TRPM8与TRPA1、TRPV1通道共同作用是小鼠所有热感觉的基础[22]。事实上,敲除小鼠TRPM8的基因操作会导致环境冷感觉的丧失,甚至是对温暖感知能力的丧失[23]。在人类中,TRPM8表达的降低导致寒冷和疼痛感觉的减弱[24]。相反,通道的过度激活在疾病疼痛状态中起着核心作用,如炎症或神经损伤后的冷性异常疼痛[17]。TRPM8调节的另一种模式是通道在寒冷或激动剂刺激下的快速钙依赖性适应[17]。像许多感觉系统一样,冷感受器适应长时间的冷刺激,这一过程对于识别温觉信号至关重要[16],尤其是在不断变化的环境中。在体外,重组TRPM8通道也以Ca2+依赖的方式适应或脱敏于长时间的冷刺激[25]。 Ca2+依赖性TRPM8的调控提供了"
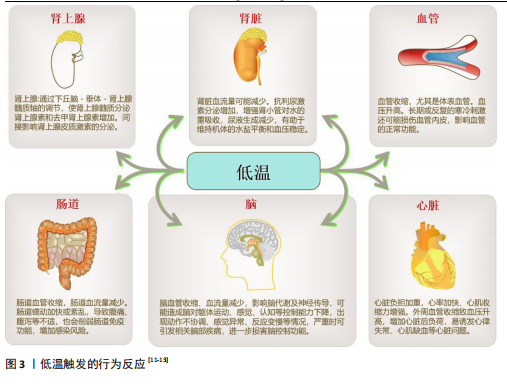
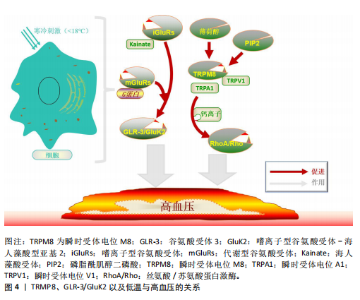
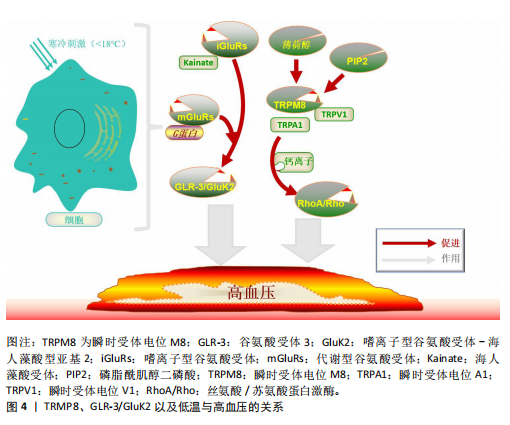
一个简单的反馈机制,通过冷却打开TRPM8导致Ca2+内流,这降低了TRPM8的冷敏感性并导致其关闭,更强的寒冷刺激可以再次打开它。基于Ca2+内流的反馈可以解释冷适应如何使TRPM8的阈值刚好低于适应温度[26]。 TRPM8不仅在感觉神经元子集(皮肤)中表达,而且对寒冷和模拟寒冷的化学物质(如薄荷醇)均有反应[27]。与其他分子不同的是,在冷刺激下,阳离子通过TRPM8通道流入导致去极化反应大到足以产生神经冲动[28]。TRPM8受钙基适应的影响,同时也受同一神经元中表达的其他离子通道的调节,从而可以调节神经元对特定温度范围的反应[29]。TRPM8在敏感的初级传入神经元亚群中表达[30],并传导信号支配高度冷敏感的组织,包括皮肤、口腔上皮、牙齿、鼻黏膜、舌头和角膜[31]。 2.1.2 GLR-3/GluK2与低温 GLR-3是一种谷氨酸受体,其在感觉神经元中感知低温并触发冷回避行为。GLR-3在哺乳动物细胞系中的异源表达同样具有冷敏感性,其同系物GluK2在体内外均可作为冷受体[32]。例如,小鼠GluK2在体内冷感中可以在功能上替代GLR-3[33]。并且,有研究发现GluK2在背根神经节中的敲减降低了初级感觉神经元对寒冷温度的敏感性,验证了GluK2在哺乳动物背根神经节中作为冷受体发挥作用的可能性[34]。GLR-3/GluK2作为冷受体的作用可能从蠕虫到人类在进化上是保守的,为进一步探究其在哺乳动物的作用提供了理论依据[5]。另外,GLR-3在无脊椎动物体内不需要谷氨酸来感知寒冷,因为缺乏谷氨酸信号的突变蠕虫在感觉神经元中表现出正常的冷敏感性。GLR-3和小鼠GluK2在异源系统中缺乏谷氨酸的情况下也能感知寒冷[35]。这表明GLR-3/GluK2的冷感活性独立于其谷氨酸受体功能。GluK2的N端氨基末端结构域的突变破坏了小鼠GluK2的冷敏感性,使其谷氨酸门控通道活性得以保留,这表明GluK2的冷感知和谷氨酸感知功能可能被解离,可能需要不同的结构域[36]。 此外,GluK2似乎既是一种嗜离子型谷氨酸受体,又是一种代谢型冷传感器[35]。GLR-3的激活阈值低于20 ℃,这表明它主要感知有害的寒冷而不是凉爽的温度[5]。与其他温度门控离子通道的冷受体不同,GLR-3通过独立于谷氨酸门控通道功能的G蛋白信号传递冷信号,提示GLR-3作为一种代谢型冷受体参与机体调节[6]。处于通道失活的GLR-3蠕虫和GluK2特异性敲除小鼠表现出正常的离子转移特性(冷激活Ca2+内流被证明与GluK2本身的离子化功能无关[35]),这一观察结果支持了这一观点。并且虽然蠕虫GLR-3对冷敏感,但同样没有显示任何可检测的通道活性[9]。另外,GLR-3作为一种代谢型冷受体,这可能会导致下游转导通道的激活,从而导致冷诱发的钙反应[5]。GLR-3介导的冷却激活钙反应主要是由钙内流引起的,表明存在下游转导通道。然而作用于GLR-3和G蛋白下游传导通道的具体机制目前尚不清楚,未来的研究需要解决这一问题[5]。值得注意的是,除了通道之外,G蛋白还可以调节许多其他类型的效应物,如酶、转运体、转录机制、移动/收缩机制、分泌机制等[37]。在这一方面,代谢型谷氨酸受体功能更广泛,可能调节更多的细胞过程。因此, GLR-3/GluK2代表了一种以前未知的冷受体类型。 2.1.3 TRPM8与GLR-3/GluK2在低温领域的比较 嗜离子型谷氨酸受体组成了一个古老的基因家族,存在于包括细菌在内的几乎所有生物体中[38]。大多数热敏TRP通道(如TRPVl、TRPAl和TRPM8)只存在于脊椎动物中,而无脊椎动物中却不存在[39]。此外,对于那些同时存在于脊椎动物和无脊椎动物基因组中的热敏 TRPs,它们的温度感应功能在不同的系统中往往是不同的[40],例如,TRPA1在昆虫和蛇类中是热传感器,但在线虫中则是冷传感器[41]。与热敏TRP通道不同,GLR-3/GluK2的同源物存在于脊椎动物和无脊椎动物中,并且重要的是,它们至少都能在体外发挥冷传感器的功能[5]。 温度感知是神经系统的一个重要特征,它使生物体能够避免身体危险并选择最佳生存环境。TRPM8以26 ℃的激活阈值感知环境温度[42]。虽然TRPM8作为凉爽温度传感器的生理作用被广泛接受,但它在健康组织中对急性有害冷感知的参与仍存在争议。由于哺乳动物显然能够感知26 ℃以下的温度,TRPM8敲除小鼠对有害寒冷表现出强烈的反应[28],由此,未知的冷感受器,特别是那些感知有害冷的感受器一定存在,但仍有待鉴定。GLR-3的激活阈值低于TRPM8(18-26 ℃),接近有害寒冷范围,这表明它主要感知有害的寒冷而不是凉爽的温度。另外,GLR-3在哺乳动物细胞系中的异源表达(GluK2)具有冷敏感性,这表明它足以作为一种冷受体发挥作用[5]。例如,GluK2在小鼠背根神经节的感觉神经元中表达,神经元中GluK2的敲低会抑制这些感觉神经元对寒冷而不是凉爽温度的敏感性[43]。 尽管如此,GluK2和TRPM8仍有可能在一小部分背根神经节中共同发挥作用,因为有研究表明低比例的背根神经节神经元同时表达 GluK2和TRPM8[44]。虽然 TRPM8被归类为适宜凉爽温度传感器,但它也能被低温激活,并与GluK2一起参与冷感。GluK2是否以及如何在细胞和/或通路水平与TRPM8相互作用以介导冷感,还需要进一步研究。 2.2 TRPM8、GLR-3/GluK2与高血压 2.2.1 TRPM8与高血压 TRPM8的激活/失活过程受遗传修饰和结构修饰[45],以及重要的内源性因子如磷脂酰肌醇-4,5-二磷酸[46]、相互作用蛋白、G蛋白偶联受体信号级联和核受体的调控[47]。这些复杂的TRPM8分子网络参与的生理过程,包括冷感觉、核心体温调节、基底泪液分泌、细胞分化以及胰岛素稳态[48]。与此一致的是,TRPM8表达和功能的改变可能导致病理过程的紊乱或维持[31]。在各种炎症和神经性疼痛状态下,包括干眼病和偏头痛、癌性周围神经病变或脊髓损伤,可观察到功能性TRPM8改变[49]。这些状态的特征是冷敏感,由TRPM8过表达或TRPM8基因变异引起[50]。TRPM8还与其他疼痛类型或不适状态有关,如肠易激综合征、口咽吞咽困难和慢性咳嗽[51],以及呼吸道炎症过程和高血压[52]。 血压冬季升高夏季降低的季节性变化可归因于几个因素,包括自主神经系统、抗利尿激素和内皮型一氧化氮合酶表达的变化[53]。多项研究表明,炎症事件参与高血压的病理生物学,许多抗炎和/或免疫调节药物(特别是非类固醇抗炎药和环孢素)可诱导高血压的发生。适应性免疫反应似乎在高血压和血管疾病的病理生物学中起作用[54]。TRPM8激活可诱导肾素-血管紧张素-醛固酮系统介导的高血压[55],随后诱导小分子和液体外渗,增加血浆免疫球蛋白水平,并引发免疫抑制[56]。TRPM8对蛋白激酶C和磷脂酰肌醇-4,5-二磷酸敏感,表明TRPM8受到磷脂酶C偶联受体的刺激。活化的磷脂酶C通过降低细胞PI(4,5)P2水平和通过二酰基甘油激活蛋白激酶C来抑制TRPM8[53]。缓激肽和前列腺素E2是促炎分子,可降低机体对寒冷的反应,提示磷脂酶A2可从细胞膜脂质池中释放多种类的前体多不饱和脂肪酸,从而调节TRPM8的功能。TRPM8作为伤害感受器并调节免疫反应[53],这种TRPM8诱导的免疫抑制类似于静脉注射免疫球蛋白对各种炎症性疾病的免疫抑制治疗[53]。此外,TRPM8+黏膜纤维在人和小鼠结肠中表达降钙素基因相关肽[57]。降钙素基因相关肽导致肿瘤生长增加,而减少肿瘤神经支配伤害感受器释放的降钙素基因相关肽可增强抗肿瘤免疫,这又为TRPM8在调节免疫反应中的作用及其在包括高血压等几种疾病和冷反应中的作用提供了另一层证据[53]。另外,TRPM8可被薄荷醇激活[53]。膳食薄荷醇可以通过激活TRPM8来保护心肌梗死后的炎症和心脏重构[58]。薄荷醇对TRPM8的激活抑制了血管活性氧的产生,并通过以TRPM8依赖的方式减弱过多的线粒体活性氧介导丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,RhoA/Rho)的激活来降低血压。这些研究均表明,冷诱导TRPM8的激活在高血压以及炎症和免疫调节中发挥着重要作用。然而,TRPM8在代谢中的潜在益处、与生物活性脂质的潜在关系以及在各种疾病中的作用,仍需要更详细的实验研究。 2.2.2 GLR-3/GluK2与高血压 谷氨酸是哺乳动物大脑中主要的兴奋性递质,可通过与特定膜受体的相互作用调控机体功能[59]。谷氨酸受体根据其激活产生突触后电流的机制可分为2大类[60]:嗜离子型谷氨酸受体(当谷氨酸与受体结合时激活,其形成离子通道孔);代谢型谷氨酸受体(通过涉及G蛋白的信号级联间接激活离子通道) [61]。从大脑发出的血管紧张性升高是高血压发生的一个主要机制。在各种高血压动物模型中,下丘脑室旁核交感前神经元的谷氨酸能使兴奋性输入增加[62]。同样,最近的研究也揭示了高血压患者下丘脑室旁核交感前神经元的谷氨酸能引起突触输入增强的分子和细胞机制[63]。 谷氨酸作用于G蛋白偶联的代谢型谷氨酸受体,Ⅰ组代谢型谷氨酸受体(代谢型谷氨酸受体1和代谢型谷氨酸受体5)和Ⅱ组代谢型谷氨酸受体(代谢型谷氨酸受体2和代谢型谷氨酸受体3)均在下丘脑室旁核中表达[61]。例如,高血压患者血管紧张性是通过下丘脑室旁核Ⅰ组代谢型谷氨酸受体的强直性激活来维持的[64]。下丘脑室旁核中Ⅱ组代谢性谷氨酸受体的激活通过抑制自发性高血压大鼠中增加的谷氨酸能输入和神经元亢进来抑制血管紧张性[65]。同时阻断代谢型谷氨酸受体5和激活下丘脑室旁核 Ⅲ组代谢型谷氨酸受体可有效减少高血压交感神经流出[63]。此外,缺乏谷氨酸受体2的α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(alpha-Amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor,AMPAR,Ca2+渗透性AMPAR由亚基谷氨酸受体1-4决定)活性在自发性高血压大鼠的下丘脑室旁核中增加,并导致该大鼠高血压模型中的下丘脑室旁核神经元过度活跃[66]。有研究表明,靶向Ⅰ组和Ⅱ组代谢型谷氨酸受体以及下丘脑室旁核中负责增强N-甲基-D-天冬氨酸受体活性的特定蛋白激酶或N-甲基-D-天冬氨酸受体相互作用蛋白可能为治疗耐药、神经源性高血压提供新的机会[61]。 越来越多的证据表明,孤束核、延髓吻侧和尾侧腹侧核以及脊髓内兴奋性谷氨酸受体的突触激活在中枢神经系统心血管信息的神经传递中起着关键作用[67]。孤束核神经元接收和投射谷氨酸能输入,随后调节血压,而G蛋白偶联代谢型谷氨酸受体在调压反射通路中对谷氨酸能传递起调节作用。代谢型谷氨酸受体2/3信号可能与自发性高血压大鼠高血压的发生有关[68],并且调节代谢型谷氨酸受体2/3在脑干背侧的表达/刺激可能是一种通过增加副交感神经活动来治疗高血压的新策略[68]。另外,在孤束核中,AMPA受体的谷氨酸受体1亚基主要存在于树突棘中,谷氨酸受体1和树突棘密度在自发性高血压大鼠的孤束核中均增加,高血压改变了孤束核内含有AMPA型谷氨酸受体的树突棘,表明孤束核内谷氨酸受体1表达的调整是突触适应高血压状态的一部分[69]。此外,在自发性高血压大鼠模型中,刺激吻侧腹外侧的代谢性和嗜离子性谷氨酸受体可引起心血管反应增强,这可能与高血压有关。中枢血管紧张素Ⅱ诱导谷氨酸的释放,谷氨酸通过中枢血管紧张素Ⅱ型1受体与增强的嗜离子性N-甲基-D-天冬氨酸受体和AMPA受体结合,导致吻侧腹部延髓中谷氨酸能神经元的激活,增加应激性高血压中的交感兴奋[70]。 嗜离子型谷氨酸受体包括N-甲基-D-天冬氨酸受体、AMPA受体和海人藻酸受体,它们是配体门控的离子通道,通过结合谷氨酸从而调控通道的开闭状态[71]。海人藻酸受体作为3大离子型谷氨酸受体之一,不仅与学习、记忆以及感觉信号转导等过程相联系,也与许多神经性系统疾病的产生相关[72]。与AMPA受体和N-甲基-D-天冬氨酸受体不同,海人藻酸受体在突触前和突触后膜均存在,在控制神经递质释放和神经递质信号传导中都发挥着重要作用[73]。 尽管GluK2在高血压中的研究还比较少,但是其在神经性疾病中的作用仍值得探究。例如,GluK2 Q/R编辑影响海人藻酸受体信号的嗜离子/代谢平衡,从而调节AMPARs的突触表达和可塑性[74]。有研究发现,(RS)-2-氨基-3-(3-羟基-5-叔丁基异恶唑-4-基)丙酸 [(RS)-2-Amino-3-(3-hydroxy-5-tert-butylisoxazol-4-yl)propanoic acid,ATPA]在特定剂量下激活GluK1可能促进γ氨基丁酸的释放,进而通过γ氨基丁酸(A)R抑制突触后GluK2-JNK3信号介导的脑缺血损伤[75]。含有GluK2的海人藻酸受体可以通过与神经调节胆碱能系统的相互作用来控制海马回路的兴奋性[76]。Parkin与GluK2亚基相互作用,调节海人藻酸受体功能[77]。另外,异常的含有GluK2的海人藻酸受体在颞叶癫痫的慢性癫痫发作中起主要作用,提示其可能是癫痫的潜在治疗靶点[78]。抗抑郁药/抗双相治疗使星形胶质细胞GluK2活性失活,通过抑制星形胶质细胞谷氨酸释放来改善抑郁症[79]。由上述可知高血压与谷氨酸受体参与的调节有着密切的关联,尤其是在代谢型谷氨酸受体以及嗜离子谷氨酸受体(AMPA和N-甲基-D-天冬氨酸受体)之中,而在海人藻酸受体与高血压的研究尤其是涉及冷受体GluK2仍有空白。 2.3 低温与高血压 长期暴露于寒冷环境会伴随着静息血压(收缩压、舒张压和平均血压)升高、心动过速和心脏肥厚[80]。低温使高血压加重,并引发心血管并发症(脑卒中、心肌梗死、心力衰竭等)。慢性或间歇性暴露于寒冷会使动物血压升高,并导致心脏和肾脏肥大,即冷致高血压[2]。与低温相关的血流动力学变化可能都是心血管风险和死亡率增加的原因[81]。血压升高是心血管对冷暴露的重要反应,它通过增加非寒颤产热和代谢率来增强循环功能,以维持体温[82]。从某种意义上讲,血压升高是对寒冷暴露的适应性反应。然而,持续升高的血压会导致暴露在寒冷环境中的动物出现心血管和肾脏损害(如心脏和肾脏肥大)[83]。迄今为止,冷致高血压的发病机制尚不完全清楚。最近的研究表明,冷致高血压的机制可能涉及交感神经系统、肾素-血管紧张素系统、一氧化氮和内皮素1[2]。低温会增加交感神经系统和肾素-血管紧张素系统的活动,交感神经系统通过肾素-血管紧张素系统启动冷致高血压。冷暴露抑制内皮型一氧化氮合酶的表达和一氧化氮的形成,增加内皮素1的产生[2]。然而,冷诱导心肌肥厚可能是由于细胞生长相关转录因子的上调所致[82]。随着年龄的增加,皮肤反射血管收缩反应可变得过度敏感或迟钝。健康老年人的反射性血管收缩功能受损,这可能导致在某些情况下保护体温的能力受损[84]。冷应激可能通过线粒体损伤、细胞凋亡、自噬、代谢、氧化应激和神经内分泌等途径对心肌造成损伤[85]。虽然冷应激诱导的心血管功能障碍的确切性质尚不清楚,但内皮素受体、内质网应激、谷氨酸受体、瞬时受体电位、线粒体相关蛋白、活性氧、核因子E2相关因子2-Kelch样环氧氯丙烷相关蛋白1(Nuclear factor E2-related factor 2-Kelch-like epichlorohydrin-related protein 1,Nrf2-Keap1)信号通路、Bcl-2和脂蛋白脂肪酶信号通路都可能发挥关键作用。对于冷应激引起的心血管损伤,需要更全面和深入的研究来更好地确定潜在的治疗机制[86]。 2.4 低温相关TRPM8及GLR-3/GluK2与高血压 高血压的发病机制涉及交感神经系统的激活、肾素-血管紧张素-醛固酮系统和炎症过程[4],并且线粒体、Ca2+和活性氧均参与血管功能的调节,被认为与高血压的发生有关[4]。TRPM8可参与心血管系统的调节,例如,TRPM8可调节血管平滑肌细胞中线粒体Ca2+浓度和线粒体呼吸功能[87];薄荷醇激活TRPM8可减弱血管紧张素Ⅱ诱导的Ca2+内流和线粒体功能障碍诱导的活性氧生成[55]。另外,从大脑发出的血管紧张性升高是高血压发生的一个主要机制。在各种高血压动物模型中,下丘脑室旁核交感前神经元的谷氨酸能兴奋性输入增加导致交感神经流出增加[61]。谷氨酸受体在神经元之间传递化学信号,并介导中枢神经系统中大部分兴奋性化学突触传递[5],这些共同突出了谷氨酸受体在中枢神经系统的功能和组织中的基础作用。最近的研究揭示了高血压患者下丘脑室旁核前交感神经元谷氨酸能突触输入增强的分子和细胞机制[61];下丘脑室旁核谷氨酸能输入增加在高血压的发生中起重要作用[88];谷氨酸与代谢型谷氨酸受体结合可刺激许多细胞内通路,从而增强突触传递[89]。由此谷氨酸受体GLR-3/GluK2可能是区别于TRPM8通道的另一种参与高血压调节的方式,尤其是在冷致高血压的探究中(图4)。"
| [1] DIETRICHS E, HÅHEIM B, KONDRATIEV T, et al. Effects of hypothermia and rewarming on cardiovascular autonomic control in vivo. J Appl Phys. 2018;124:850-859. [2] CHEN PGF, SUN Z. AAV Delivery of Endothelin-1 shRNA Attenuates Cold-Induced Hypertension. Human Gene Ther. 2017;28(2):190-199. [3] GOEL H, SHAH K, KUMAR A, et al. Temperature, cardiovascular mortality, and the role of hypertension and renin-angiotensin-aldosterone axis in seasonal adversity: a narrative review. J Human Hypertens. 2022;36(12):1035-1047. [4] XIONG S, WANG B, LIN S, et al. Activation of Transient Receptor Potential Melastatin Subtype 8 Attenuates Cold-Induced Hypertension Through Ameliorating Vascular Mitochondrial Dysfunction. J Am Heart Assoc. 2017;6(8):e005495. [5] GONG J, LIU J, RONAN EA, et al. A Cold-Sensing Receptor Encoded by a Glutamate Receptor Gene. Cell. 2019;178(6):1375-1386.e11. [6] CASTILLO K, DIAZ-FRANULIC I, CANAN J, et al. Thermally activated TRP channels: molecular sensors for temperature detection. Phys Biol. 2018;15(2):021001. [7] YAMAKI S, CHAU A, GONZALES L, et al. Nociceptive afferent phenotyping reveals that transient receptor potential ankyrin 1 promotes cold pain through neurogenic inflammation upstream of the neurotrophic factor receptor GFRα3 and the menthol receptor transient receptor potential melastatin 8. Pain. 2021;162(2):609-618. [8] LIU L, ROHACS T. Regulation of the cold-sensing TRPM8 channels by phosphoinositides and Gq-coupled receptors. Channels (Austin). 2020;14(1):79-86. [9] LIN C, SHAN Y, WANG Z, et al. Molecular and circuit mechanisms underlying avoidance of rapid cooling stimuli in C. elegans. Nat Commun. 2024;15(1):297. [10] MCKEMY D. The Molecular and Cellular Basis of Cold Sensation. ACS Chem Neurosci. 2013;4(2):238-47. [11] WALTHER L, VON KÄNEL R, HEIMGARTNER N, et al. Altered Cardiovascular Reactivity to and Recovery from Cold Face Test-Induced Parasympathetic Stimulation in Essential Hypertension. J Clin Med. 2021; 10(12):2714. [12] KANAYAMA N, KHATUN S, BELAYET H, et al. Chronic local cold stress to the soles induces hypertension in rats. Am J Hypertens. 1999; 12(11 Pt 1):1124-9. [13] ROXANE B, CHANDROU K, ALEXANDRE C, et al. Gastrointestinal thermal homogeneity and effect of cold water ingestion. J Therm Biol. 2018;78:204-208. [14] LIU Z, WU H, WEI Z, et al. TRPM8: a potential target for cancer treatment. J Cancer Res Clin Oncol. 2016;142(9):1871-1881. [15] LUU D, RAMESH N, KAZAN I, et al. Evidence that the cold- and menthol-sensing functions of the human TRPM8 channel evolved separately. Sci Adv. 2024; 10(25):eadm9228. [16] BLANQUART S, BOROWIEC A, DELCOURT P, et al. Evolution of the human cold/menthol receptor, TRPM8. Mol Phylogenet Evol. 2019;136:104-118. [17] IFTINCA M, ALTIER C. The cool things to know about TRPM8! Channels (Austin). 2020;14(1):413-420. [18] RADDATZ N, CASTILLO J, GONZALEZ C, et al. Temperature and Voltage Coupling to Channel Opening in Transient Receptor Potential Melastatin 8 (TRPM8). J Biol Chem. 2014;289(51):35438-35454. [19] LIU B, FAN L, BALAKRISHNA S, et al. TRPM8 is the principal mediator of menthol-induced analgesia of acute and inflammatory pain. Pain. 2013;154(10):2169-2177. [20] 李名伟,张淼,许玮华,等.瞬时受体电位8型的功能结构及其化学调节剂的研究进展[J].中国现代应用药学,2022, 39(19):2557-2566. [21] YANG S, LU X, WANG Y, et al. A paradigm of thermal adaptation in penguins and elephants by tuning cold activation in TRPM8. Proc Natl Acad Sci U S A. 2020; 117(15):8633-8638. [22] YARMOLINSKY DA, PENG Y, POGORZALA LA, et al. Coding and Plasticity in the Mammalian Thermosensory System. Neuron. 2016;92(5):1079-1092. [23] PARICIO-MONTESINOS R, SCHWALLER F, UDHAYACHANDRAN A, et al. The Sensory Coding of Warm Perception. Neuron. 2020; 106(5):830-841.e3. [24] GAVVA NR, SANDROCK R, ARNOLD GE, et al. Reduced TRPM8 expression underpins reduced migraine risk and attenuated cold pain sensation in humans. Sci Rep. 2019;9(1):19655. [25] THAPA D, BARRETT B, ARGUNHAN F, et al. Influence of Cold-TRP Receptors on Cold-Influenced Behaviour. Pharmaceuticals(Basel). 2021;15(1):42. [26] MELANAPHY D, JOHNSON C, KUSTOV M, et al. Ion channel mechanisms of rat tail artery contraction-relaxation by menthol involving, respectively, TRPM8 activation and L-type Ca2+ channel inhibition. Am J Physiol Heart Circ Physiol. 2016;311(6):H1416-H1430. [27] CHEN X, XU L, ZHANG H, et al. Differential Activation of TRPM8 by the Stereoisomers of Menthol. Front Pharmacol. 2022;13: 898670. [28] ORDAS P, HERNANDEZ-ORTEGO P, VARA H, et al. Expression of the cold thermoreceptor TRPM8 in rodent brain thermoregulatory circuits. J Comp Neurol. 2021;529(1):234-256. [29] 袁源, 叶鹏, Wang Q, 等.食用薄荷醇通过瞬时受体电位M8缓解心肌梗死后炎症及心肌重塑[J].中华高血压杂志,2021, 29(1):98. [30] RIVERA B, CAMPOS M, ORIO P, et al. Negative Modulation of TRPM8 Channel Function by Protein Kinase C in Trigeminal Cold Thermoreceptor Neurons. Int J Mol Sci. 2020;21(12):4420. [31] IZQUIERDO C, MARTIN-MARTINEZ M, GOMEZ-MONTERREY I, et al. TRPM8 Channels: Advances in Structural Studies and Pharmacological Modulation. Int J Mol Sci. 2021;22(16):8502. [32] CAI W, ZHANG W, ZHENG Q, et al. The kainate receptor GluK2 mediates cold sensing in mice. Nat Neurosci. 2024;27(4): 679-688. [33] IIDA I, KONNO K, NATSUME R, et al. A comparative analysis of kainate receptor GluK2 and GluK5 knockout mice in a pure genetic background. Behav Brain Res. 2021; 405:113194. [34] JOSEPH DJ, WILLIAMS DJ, MACDERMOTT AB. Modulation of Neurite Outgrowth by Activation of Calcium-Permeable Kainate Receptors Expressed by Rat Nociceptive-Like Dorsal Root Ganglion Neurons. Dev Neurobiol. 2011;71(10):818-835. [35] BUIJS TJ, MCNAUGHTON PA. The Role of Cold-Sensitive Ion Channels in Peripheral Thermosensation. Front Cell Neurosci. 2020;14:262. [36] LI YJ, DUAN GF, SUN JH, et al. Neto proteins regulate gating of the kainate-type glutamate receptor GluK2 through two binding sites. J Biol Chem. 2019;294(47):17889-17902. [37] WANG Y, QIN J, SHARMA A, et al. Exploring the promise of regulator of G Protein Signaling 20: insights into potential mechanisms and prospects across solid cancers and hematological malignancies. Cancer Cell Int. 2024;24(1):305. [38] TRAYNELIS S, WOLLMUTH L, MCBAIN C, et al. Glutamate Receptor Ion Channels: Structure, Regulation, and Function. Pharmacol Rev. 2010;62(3):405-496. [39] TAKAYAMA Y, TOMINAGA M. Interaction between TRP channels and anoctamins. Cell Calcium. 2024;121:102912. [40] DHAKAL S, LEE Y. Transient Receptor Potential Channels and Metabolism. Mol Cells. 2019;42(8):569-578. [41] SINICA V, ZIMOVA L, BARVIKOVA K, et al. Human and Mouse TRPA1 Are Heat and Cold Sensors Differentially Tuned by Voltage. Cells. 2019;9(1):57. [42] BABES A, CIOBANU AC, NEACSU C, et al. TRPM8, a Sensor for Mild Cooling in Mammalian Sensory Nerve Endings. Curr Pharm Biotechnol. 2011;12(1):78-88. [43] CAI W, DUAN B, XU XZS. Identification of a cold sensor in peripheral somatosensory neurons. Nat Neurosci. 2024;27(4):613-614. [44] SHARMA N, FLAHERTY K, LEZGIYEVA K, et al. The emergence of transcriptional identity in somatosensory neurons. Nature. 2020;577(7790):392-398. [45] PERTUSA M, GONZALEZ A, HARDY P, et al. Bidirectional Modulation of Thermal and Chemical Sensitivity of TRPM8 Channels by the Initial Region of the N-terminal Domain. J Biol Chem. 2014;289(32):21828-21843. [46] DE CARO C, CRISTIANO C, AVAGLIANO C, et al. Characterization of New TRPM8 Modulators in Pain Perception. Int J Mol Sci. 2019;20(22):5544. [47] GKIKA D, LOLIGNIER S, GROLEZ GP, et al. Testosterone-androgen receptor: The steroid link inhibiting TRPM8-mediated cold sensitivity. FASEB J. 2020;34(6):7483-7499. [48] KASUGA R, SHIRAKI C, HORIKAWA R, et al. Role of TRPM8 in cold avoidance behaviors and brain activation during innocuous and nocuous cold stimuli. Physiol Behav. 2022;248:113729. [49] PIÑA R, UGARTE G, CAMPOS M, et al. Role of TRPM8 Channels in Altered Cold Sensitivity of Corneal Primary Sensory Neurons Induced by Axonal Damage. J Neurosci. 2019;39(41):8177-8192. [50] LING Y, CHEN S, FANN C, et al. TRPM8 genetic variant is associated with chronic migraine and allodynia. J Headache Pain. 2019;20(1):115. [51] KOBAYASHI M, ZOCHODNE D. Diabetic neuropathy and the sensory neuron: New aspects of pathogenesis and their treatment implications. J Diabetes Investig. 2018;9(6):1239-1254. [52] HOSSAIN M, ANDO H, UNNO S, et al. Activation of TRPV1 and TRPM8 Channels in the Larynx and Associated Laryngopharyngeal Regions Facilitates the Swallowing Reflex. Int J Mol Sci. 2018; 19(12):4113. [53] DAS UN. Potential Role of TRPM8 in Cold-Induced Hypertension and Its Clinical Implications. Discov Med. 2023; 35(177):451-457. [54] ZHANG Z, ZHAO L, ZHOU X, et al. Role of inflammation, immunity, and oxidative stress in hypertension: New insights and potential therapeutic targets. Front Immunol. 2023;13:1098725. [55] HUANG F, NI M, ZHANG JM, et al. TRPM8 downregulation by angiotensin II in vascular smooth muscle cells is involved in hypertension. Mol Med Rep. 2017;15(4): 1900-1908. [56] CHAN H, HUANG HS, SUN DS, et al. TRPM8 and RAAS-mediated hypertension is critical for cold-induced immunosuppression in mice. Oncotarget. 2018;9(16):12781-12795. [57] DE JONG PR, TAKAHASHI N, PEIRIS M, et al. TRPM8 on mucosal sensory nerves regulates colitogenic responses by innate immune cells via CGRP. Mucosal Immunol. 2015;8(3):491-504. [58] WANG Q, YANG Y, CHEN K, et al. Dietary Menthol Attenuates Inflammation and Cardiac Remodeling After Myocardial Infarction via the Transient Receptor Potential Melastatin 8. Am J Hypertens. 2020;33(3):223-233. [59] EGBENYA D, AIDOO E, KYEI G. Glutamate receptors in brain development. Childs Nerv Syst. 2021;37(9):2753-2758. [60] RAMOS-VICENTE D, GRANT S, BAYÉS A. Metazoan evolution and diversity of glutamate receptors and their auxiliary subunits. Neuropharmacology. 2021;195: 108640. [61] LI DP, PAN HL. Glutamatergic Regulation of Hypothalamic Presympathetic Neurons in Hypertension. Curr Hypertens Rep. 2017; 19(10):78. [62] 尹桂东,崔桂玉,邴艳华,等.下丘脑室旁核的I组促代谢型谷氨酸受体在压力感受性反射调节中的作用[J].中国现代医学杂志,2010,20(10):1477-1481. [63] ZHOU JJ, PACHUAU J, LI DP, et al. Group III metabotropic glutamate receptors regulate hypothalamic presympathetic neurons through opposing presynaptic and postsynaptic actions in hypertension. Neuropharmacology. 2020;174:108159. [64] LI DP, PAN HL. Increased group I metabotropic glutamate receptor activity in paraventricular nucleus supports elevated sympathetic vasomotor tone in hypertension. Am J Physiol Regul Integr Comp Physiol. 2010;299(2):R552-R561. [65] HSU J, SEKIZAWA S, TOCHINAI R, et al. Loss of Group II Metabotropic Glutamate Receptor Signaling Exacerbates Hypertension in Spontaneously Hypertensive Rats. Life (Basel). 2021;11(7):720. [66] LI DP, BYAN HS, PAN HL. Switch to Glutamate Receptor 2-Lacking AMPA Receptors Increases Neuronal Excitability in Hypothalamus and Sympathetic Drive in Hypertension. J Neurosci. 2012;32(1):372-380. [67] 谢金燕,洪葵. NMDA受体及其与心血管疾病关系的研究进展[J].中南大学学报(医学版),2017,42(11):1316-1320. [68] HSU JCN, SEKIZAWA SI, TOCHINAI R, et al. Chronic stimulation of group II metabotropic glutamate receptors in the medulla oblongata attenuates hypertension development in spontaneously hypertensive rats. PLoS One. 2021;16(5):e0251495. [69] HERMES SM, MITCHELL JL, SILVERMAN MB, et al. Sustained hypertension increases the density of AMPA receptor subunit, GluR1, in baroreceptive regions of the nucleus tractus solitarii of the rat. Brain Res. 2008;1187:125-136. [70] ZHOU X, YANG H, SONG X, et al. Central blockade of the AT1 receptor attenuates pressor effects via reduction of glutamate release and downregulation of NMDA/AMPA receptors in the rostral ventrolateral medulla of rats with stress-induced hypertension. Hypertens Res. 2019;42(8): 1142-1151. [71] BURADA A, VINNAKOTA R, BHARTI P, et al. Emerging insights into the structure and function of ionotropic glutamate delta receptors. Br J Pharmacol. 2022;179(14): 3612-3627. [72] GANGWAR SP, YELSHANSKAYA MV, NADEZHDIN KD, et al. Kainate receptor channel opening and gating mechanism. Nature. 2024;630(8017):762-768. [73] HE L, SUN J, GAO Y, et al. Kainate receptor modulation by NETO2. Nature. 2021;599(7884):325-329. [74] NAIR JD, WILKINSON KA, YUCEL BP, et al. GluK2 Q/R editing regulates kainate receptor signaling and long-term potentiation of AMPA receptors. iScience. 2023;26(10):107708. [75] THOMPSON K, WATSON S, ZANATO C, et al. The atypical hippocampal’ glutamate receptor coupled to phospholipase D that controls stretch-sensitivity in primary mechanosensory nerve endings is homomeric purely metabotropic GluK2. Exp Physiol. 2024;109(1):81-99. [76] GORLEWICZ A, BARTHET G, ZUCCA S, et al. The Deletion of GluK2 Alters Cholinergic Control of Neuronal Excitability. Cereb Cortex. 2022;32(14):2907-2923. [77] REGONI M, CATTANEO S, MERCATELLI D, et al. Pharmacological antagonism of kainate receptor rescues dysfunction and loss of dopamine neurons in a mouse model of human parkin-induced toxicity. Cell Death Dis. 2020;11(11):963. [78] WANG L, LIU Y, LU R, et al. The role of S-nitrosylation of kainate-type of ionotropic glutamate receptor 2 in epilepsy induced by kainic acid. J Neurochem. 2018;144(3):255-270. [79] PENG L, LI B, DU T, et al. Does conventional anti-bipolar and antidepressant drug therapy reduce NMDA-mediated neuronal excitation by downregulating astrocytic GluK2 function? Pharmacol Biochem Behav. 2012;100(4):712-725. [80] DE VITA A, BELMUSTO A, DI PERNA F, et al. The Impact of Climate Change and Extreme Weather Conditions on Cardiovascular Health and Acute Cardiovascular Diseases. J Clin Med. 2024;13(3):759. [81] POLDERMAN KH, VARON J. Cool hemodynamics - The intricate interplay between therapeutic hypothermia and the post-cardiac arrest syndrome. Resuscitation. 2014;85(8):975-976. [82] 顾恺, 何红.高血压患者夏季和冬季动态血压监测值的差异[J].中华高血压杂志, 2016, 24(6):578-580. [83] SUN Z. Cardiovascular responses to cold exposure. Front Biosci (Elite Ed). 2010;2(2): 495-503. [84] ALBA BK, CASTELLANI JW, CHARKOUDIAN N. Cold-induced cutaneous vasoconstriction in humans: Function, dysfunction and the distinctly counterproductive. Exp Physiol. 2019;104(8):1202-1214. [85] TARAPACKI P, JORGENSEN LB, SORENSEN JG, et al. Acclimation, duration and intensity of cold exposure determine the rate of cold stress accumulation and mortality in Drosophila suzukii. J Insect Physiol. 2021; 135:104323. [86] KONG X, LIU H, HE X, et al. Unraveling the Mystery of Cold Stress-Induced Myocardial Injury. Front Physiol. 2020;11:580811. [87] DRYN DO, MELNYK MI, MELANAPHY D, et al. Bidirectional TRP/L Type Ca2+ Channel/RyR/BKCa Molecular and Functional Signaloplex in Vascular Smooth Muscles. Biomolecules. 2023;13(5):759. [88] YE ZY, LI DP, PAN HL. Regulation of Hypothalamic Presympathetic Neurons and Sympathetic Outflow by Group II Metabotropic Glutamate Receptors in Spontaneously Hypertensive Rats. Hypertension. 2013;62(2):255-262. [89] BURADA A, VINNAKOTA R, LAMBOLEZ B, et al. Structural biology of ionotropic glutamate delta receptors and their crosstalk with metabotropic glutamate receptors. Neuropharmacology. 2021;196:108683. |
| No related articles found! |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||