Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (26): 5673-5679.doi: 10.12307/2025.741
Previous Articles Next Articles
Mechanism of Notch signaling pathway regulating condylar cartilage development and temporomandibular joint inflammation
An Xingqi, Li Wenjin
- School of Stomatology, Shanxi Medical University, Taiyuan 030000, Shanxi Province, China
-
Received:2024-08-28Accepted:2024-11-02Online:2025-09-18Published:2025-02-28 -
Contact:Li Wenjin, MD, Chief physician, School of Stomatology, Shanxi Medical University, Taiyuan 030000, Shanxi Province, China -
About author:An Xingqi, MS, Physician, School of Stomatology, Shanxi Medical University, Taiyuan 030000, Shanxi Province, China -
Supported by:Shanxi Province Overseas Educated Scholars Science and Technology Activities Merit-Supported Project, No. 20240048 (to LWJ); Shanxi Province Natural Science Research General Project, No. 202303021211214 (to LWJ)
CLC Number:
Cite this article
An Xingqi, Li Wenjin. Mechanism of Notch signaling pathway regulating condylar cartilage development and temporomandibular joint inflammation[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(26): 5673-5679.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
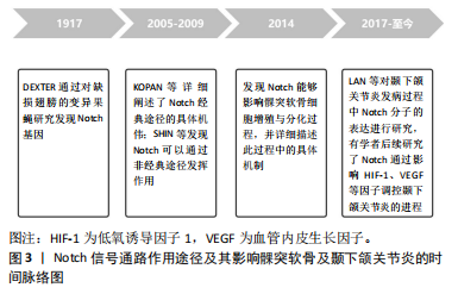
2.1 髁突软骨的发育 髁突软骨是颞下颌关节的重要组成部分,是下颌骨髁突表面覆盖的一层结缔组织,主要由纤维软骨组成,其发育过程与四肢骨相同,均通过软骨内成骨这种较为独特的方式来调控髁突的生长[4]。在髁突软骨发育初期,软骨膜内层的间充质干细胞分泌Ⅰ型胶原蛋白,同时分化为软骨细胞,大量的软骨细胞附着于髁突表面,逐渐形成次级软骨样特征[5]。随着时间的推移,这些软骨细胞进行软骨内成骨,包裹在颞骨的膜内骨基质中,最终形成软骨样骨[6]。髁突软骨的结构特征显著,其内部分化为4个界限清晰的层次,这些层次的形成源于软骨细胞在组织中的差异化排列、细胞大小和形态的多样性,以及基质钙化程度的逐层变化。髁突软骨从表层至深层递进依次为:浅层、多态性层、扁平软骨细胞层和肥大软骨细胞层,其中多态性层中存在软骨前体细胞,这些细胞会在更深层分化为肥大软骨细胞,因此软骨前体细胞的增殖对肥大软骨细胞层的形成有着决定性作用[6]。这种细胞分化过程意味着多态性层对髁突软骨的生长至关重要,并且赋予髁突软骨极强的功能适应性。 临床中髁突软骨被称为继发性软骨,其生长方式与原发性软骨差异较大。在继发性软骨形成的进程中,软骨膜下方的生发层细胞经历了一个体积扩增的阶段,随着这些细胞逐渐成熟,其内部会释放出软骨基质成分,这一过程被广泛称为添加性生长。髁突软骨细胞的增生主要发生于软骨组织表面未分化的间充质干细胞,而相关软骨基质的合成发生于深层已分化的成软骨细胞,这就导致软骨基质无法包绕正在分裂的髁突软骨细胞,因此在生长发育过程中常受到局部生长因素的影响[7]。与原发性软骨不同的是,髁突软骨的增殖层细胞表现出两种分化趋势:髁突软骨若处于低氧或高强度机械刺激时会分化成软骨,而当刺激条件不存在时软骨则会发生萎缩或转变为骨组织的现象,这可能是与SRY相关高迁移率族蛋白9(SRY-related high mobility group-box 9,Sox9)和Runt相关转录因子(Runt related gene 2,Runx2)2种基因促进成骨的调控有关。在个体出生时,髁突软骨的绝大部分区域会经历一个显著的转变过程,即软骨内成骨作用,导致这些区域逐渐被新生的骨组织所取代,剩余的继发性软骨会一直保留至成年。 2.2 Notch信号通路 Notch基因最初是1917年由DEXTER等从遗传学的角度出发,通过对缺损翅膀的变异果蝇品系研究而发现[8]。Notch信号通路参与决定细胞命运、胚胎发育、器官形成和组织修复等不同的生物过程,在整个结构与功能上高度保守。Notch受体和配体是含有表皮生长因子样重复序列的跨膜蛋白,通常需要相邻细胞上的跨膜配体激活,通过受体-配体相互作用来启动经典的Notch信号转导,其核心机制是将信号从细胞外侧的配体传递到细胞核内,与核内结合蛋白相接触,改变核内的基因,启动下游靶基因的转录[9]。而近年以来越来越多的证据表明,Notch可以通过独立于配体或CSL的非经典途径来发挥作用。经典的Notch信号通路在细胞间互相作用和基因转录调控中发挥着重要的生理功能,而非经典的Notch信号通路涉及各种信号通路之间的相互作用来实现下游靶基因的激活。研究Notch信号通路的具体机制均能为调节髁突软骨生长发育及TMJOA发病过程提供新的观念,见图3。 2.2.1 Notch信号通路的组成 哺乳动物的Notch信号通路主要由4种Notch受体(Notch 1-4)、5种Notch配体(JAG 1/2,DLL 1/3/4)、细胞内转录因子(CSL结合蛋白)、多个靶基因Hes、Hey等组成[10-11]。Notch受体是一种跨膜蛋白,主要有3个组成部分:Notch细胞外区域(NECD)、跨膜区域、Notch细胞内区域(NICD)。NECD由数个表皮生长因子和一个负调节区构成;Notch 1-4受体NECD中表皮生长因子的数量也存在区别,用于区别不同Notch受体对不同配体的亲和力;Notch配体是细胞膜蛋白,结构上与Notch受体相似,根据是否存在半胱氨酸区,Notch配体可分为Serrate样配体-JAG1/2,Delta样配体-DLL1/3/4[12]。JAG1/2胞外区由DSL区(Delta、Serrate和Lag-2)、表皮生"
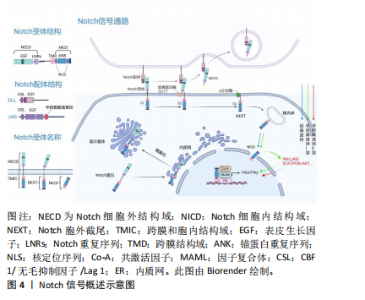
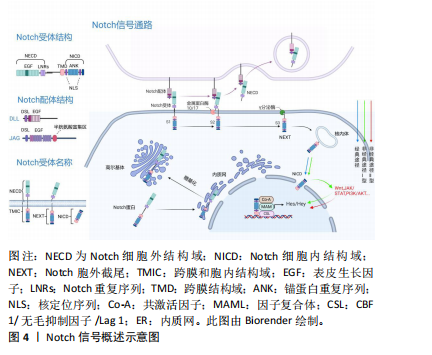
长因子重复序列和半胱氨酸富集区组成[13]。DLL 1/3/4的胞外区与JAG1/2相似,但缺少半胱氨酸富集区。 有研究发现Notch受体3/4以及Notch配体JAG1/2和DLL1会在髁突软骨膜表面表达,其中Notch受体能够控制髁突软骨细胞的增殖、分化和成熟[14-15]。Notch1也是祖细胞的标志物[16],有维持人类关节软骨细胞处于未分化状态以及细胞自我更新的能力。RUTKOWSKI等[17]发现Hes1和Hes5会抑制软骨形成并促进软骨细胞肥大,Hes5还可以直接调节Sox9的转录来协调软骨的发育。 2.2.2 Notch信号通路的作用机制 Notch信号通路中多种蛋白的激活构成了通路中一系列复杂机制。起初,胞内的单链跨膜蛋白即Notch蛋白进入内质网,在内质网内Notch蛋白经历糖基化过程[18],随后转移到高尔基体。在高尔基体内部,一种类似呋喃的转化酶在S1位点裂解Notch蛋白,这也是Notch蛋白整体裂解过程的第一步,裂解后形成2个不同的片段:NECD和跨膜区域[19]。随后NECD与跨膜区域借助非共价键结合,成熟的异二聚体形式的Notch受体最终形成并附着于胞膜。随后位于胞膜表面的Notch受体与临近细胞表面的配体相结合。此过程受体中的表皮生长因子与配体中的DSL发挥作用[20],在受体上产生拉力,使得表皮生长因子与胞膜之间的负调节区结构发生改变,被金属蛋白酶(ADAM10/17)水解加工,完成S2裂解过程,形成一种由NICD和跨膜区域组成的瞬时中间肽(NEXT)。当NEXT到达S3位点后,γ分泌酶发挥作用,释放Notch受体的c末端部分,彻底将NICD与跨膜区域分开,通过核内体途径NICD进入细胞核内。在细胞核中,NICD上的RAM结构与被称为CSL的结合蛋白相互作用,并且募集共激活因子复合体(MAML)来稳定此过程,最终激活下游Hes/Hey等因子的表达[21]。 上述是Notch信号通路常见的作用途径,被称为经典途径。然而当Notch信号通路不与核内CSL结合,表达下游靶基因时,该途径被称为非经典途径[22]。通过对脊椎动物研究发现,非经典途径能够激活下游因子的方法主要分为2型:Ⅰ型(非经典Notch信号传导)和Ⅱ型(非经典Notch靶基因激活)[23]。Ⅰ型中Notch受体同经典途径一样需要释放NICD,NICD裂解后与核内的组织特异性共激活因子(Co-A)相互作用,激活下游的目标因子,并不需要同CBF1结合发挥作用。裂解后的NICD还可以直接与其他信号通路中的因子相互结合,激活Notch通路下游的靶基因。Ⅱ型与Ⅰ型不同点在于Ⅱ型不需要切割Notch受体释放NICD去激活下游的目标因子,下游目标因子的表达主要靠相关信号通路中的因子去激活[24]。有研究表明,Notch可以调节Wnt/β-catenin通路、JAK/STAT通路、磷脂酰肌醇3激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)通路[25],从而发挥非经典途径的功能,其中Wnt/β-catenin通路及PI3K/Akt通路在髁突软骨生长发育过程中起到关键性的作用[26-27]。因此推测非典型途径也是Notch通路影响髁突软骨细胞生长发育的重要方式。见图4。"
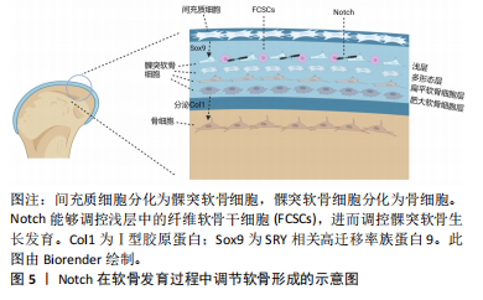
2.3 Notch信号通路在髁突生长发育过程中的作用 2.3.1 体内因素导致Notch信号通路中因子的异常表达 髁突软骨为继发性软骨,在胚胎第12周时开始发育。软骨内成骨是髁突典型生长发育的方式,最初的间充质细胞大量聚集,在转录因子Sox9的作用下逐渐分化为髁突软骨细胞,再经历增殖、肥大等过程最终形成髁突软骨[28]。 在成熟的髁突软骨下部开始,软骨细胞直接转化为骨细胞,此过程中开始分泌富含Ⅰ型胶原蛋白的基质(并非软骨细胞特有的Ⅱ型胶原蛋白基质),随之产生矿化程度更高的骨组织[29],即髁突头,最终形成髁突软骨覆盖于髁突头表面的组织结构[6]。采用免疫组织化学染色技术得以验证Notch信号分子特异性地定位于下颌髁突软骨的前成骨细胞层,这一位置正对应于髁突软骨的浅层区域,而作为可以分化为髁突软骨细胞的纤维软骨干细胞也位于其中,由此可以推测在髁突软骨发育过程中Notch能够调控纤维软骨干细胞的命运。通过实验研究表明Notch的高表达会促进纤维软骨干细胞成骨和成软骨的分化[30],这也验证了Notch在软骨发育过程中调节软骨形成的关键作用。见图5。 SERRANO等[14]发现Notch1主要在软骨形成的早期表达,表达于髁突软骨膜中的软骨祖母细胞中,在细胞分化的过程中发挥作用。有研究表明,在颌面部软骨分化过程中,NICD主要表达于前肥大区和肥大软骨区,当"
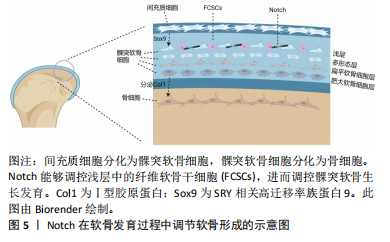

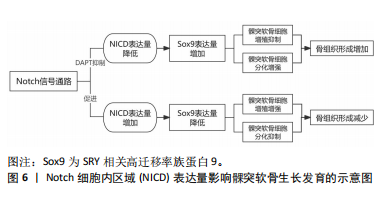
γ分泌酶抑制剂抑制Notch信号通路传导,NICD表达量降低时,髁突软骨细胞增殖被抑制,Sox9表达量明显增加,髁突软骨细胞分化能力增强,骨组织形成增加;相反,高表达Notch1-NICD会促进软骨细胞增殖,软骨量增加,抑制细胞分化,骨组织形成减少[31-32]。由此可见Notch信号通路能够促进髁突软骨细胞的增殖,但会影响细胞的分化程度。因此当下颌髁突软骨中的Notch信号遭到破坏后,软骨细胞的增殖能力会减弱,分化能力会增强。有学者发现除了Notch1受体在髁突软骨上高表达外,Notch3/4受体及配体JAG1/2、DLL也能够检测到表达,并且基因的表达与位置也有关:与髁突软骨的软骨部分相比,软骨膜中Notch信号传导的基因表达差异性更高[14]。见图6。"
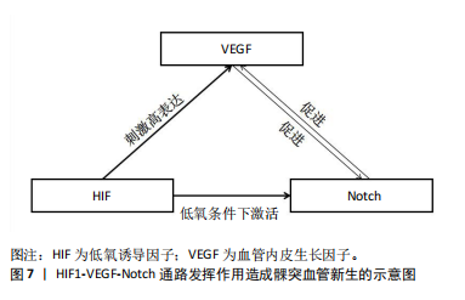
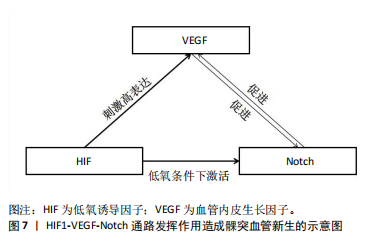
在机体生长发育过程中,Notch信号通路的传导作用决定了众多机制的走向,而仍有部分机制是由Notch信号通路与其他通路或蛋白相互作用而决定的。骨形态发生蛋白信号通路具有精密调控机制的功能,其组成主要包括细胞外配体、跨膜受体和细胞内调节因子[33]。骨形态发生蛋白与其特异性受体相结合后,会触发一系列的胞内反应,首要的是下游Smad蛋白的磷酸化过程被激活,这一过程进而激活了细胞内部一系列相互关联的信号级联反应。髁突软骨细胞周期的调节对于软骨细胞的分化及肥大过程至关重要。当NICD的表达水平显著升高时,它会诱导细胞周期调控因子p57的表达增强,这一变化直接导致细胞周期进程受阻,进入停滞状态。随后通过骨形态发生蛋白/Smad这一信号调控网络的作用,p57的表达水平得以提升,最终促进了髁突软骨细胞向肥大方向发育。当使用γ分泌酶抑制剂作用于髁突软骨细胞时,可减少内源性骨形态发生蛋白2诱导的Smad1/5/8磷酸化,使得Smad1/5/8表达量降低,NICD诱导的髁突软骨细胞分化作用及p57的表达水平均减弱[34]。 甲状旁腺激素相关蛋白以其独特的生理作用参与软骨细胞增殖、分化、肥大和凋亡等过程[35]。有研究表明在下颌髁突软骨生长发育过程中,甲状旁腺激素相关蛋白和Notch可能存在协同效应。同Notch信号功能相似,甲状旁腺激素相关蛋白也具有促进软骨细胞增殖、抑制分化的作用。并且有实验发现,在兔胫骨骨折模型中,甲状旁腺激素1-34可以使Notch信号通路中JAG1配体因子高表达,进而达到促进兔胫骨骨折愈合的目的[36],最终实验结果可以得出结论:在四肢骨中Notch信号通路的表达受到甲状旁腺激素相关蛋白的调控。而前文中提到髁突软骨与四肢骨的发育方式相同,均为软骨内成骨。而下一步研究的重心应放在下颌骨髁突软骨中这两种信号的协同效应。 成纤维细胞因子2是一种已知的髁突软骨细胞有丝分裂原,它可以导致Notch基因表达的剂量依赖性增加[37]。有实验研究证明成纤维细胞因子2能够增加Notch的表达,成纤维细胞因子2诱导的髁突软骨细胞增殖可通过激活Notch信号传导实现[38]。 2.3.2 体外因素导致Notch信号通路中因子的异常表达 在下颌骨发育过程中Notch信号通路不仅能通过体内众多因子来影响下颌骨髁突软骨的发育,体外因素也会影响Notch信号通路从而间接影响髁突软骨的发育。长期异常的咀嚼应力将导致髁突软骨的厚度减少、延缓软骨细胞的成熟、降低软骨形态调控因子的表达以及减弱Notch信号传导的阳性反应。当髁突长期处于较低的咀嚼应力时,Notch信号通路中Notch1/3受体、JAG1和DLL1配体的表达量减少,使通路传导受阻,不利于髁突软骨早期的生长发育,出现发育迟缓或受阻等现象[39-40]。YAN等[15]通过给兔的颞下颌关节施加不同力量的机械负载后,发现弱负载组的Notch1受体表达量偏低。以上实验提示不论是外界施加的机械力还是自身产生的咀嚼应力,异常的力量均会影响Notch信号通路的正常传导,进而影响髁突软骨的生长发育。 2.4 Notch信号通路影响TMJOA的作用机制 TMJOA是一种以疼痛、活动受限、软骨退变以及关节功能障碍为主要症状的颞下颌关节紊乱疾病,是颞下颌关节紊乱疾病中的一个重要类型。当髁突软骨、滑膜及软骨下骨中的关节软骨和软骨下骨质发生异常的退行性改变时容易造成TMJOA,该疾病的病变过程涉及炎症因子、信号通路、细胞外基质以及基质蛋白酶。当代人群在生活压力以及不良习惯的影响下,发病率逐渐上升,长期的炎症还会影响髁突以及下颌骨的正常发育,最终导致下颌骨发育不全甚至颅颌面畸形等现象[41]。TMJOA的主要发病机制较为复杂,主要包括炎症、外力负荷以及软骨退化等。 Notch信号作用的异常对关节炎症产生过程有重要影响。Notch分子在健康成人髁突软骨中几乎消失,然而当髁突软骨出现不同程度的损伤时,可检测到Notch分子水平大幅度提高。有研究表明对调控Notch信号作用过程会影响TMJOA的病程[42]。TMJOA软骨中的Notch1受体及JAG-1配体的活性远高于正常髁突软骨[43],Notch受体及配体在TMJOA中高度表达。通过使用肿瘤坏死因子α诱导的TMJOA小鼠模型,发现Notch受体和配体的表达量均上调[30]。有研究发现Notch信号通路可能是通过Notch1/Jagged1/Hes5途径来调控TMJOA的进程[44]。当Notch信号抑制剂γ分泌酶抑制剂发挥作用阻断通路后,TMJOA的进展有所延缓[42]。 关节盘新生血管是诱发及加重TMJOA症状的重要原因,而Notch是一个与新生血管密切相关的重要通路。有研究发现,血管内皮生长因子(vascular endothelial growth factor,VEGF)与血管新生密切相关,并且Notch1受体是参与血管新生的重要因子,二者存在一定的关联:VEGF可以促进Notch受体表达激活通路,Notch信号通路也可以影响VEGF的表达[45]。因此在血管新生的过程中,VEGF与Notch信号通路之间的相互作用起到了重要作用。低氧诱导因子1(hypoxia inducible factor-1,HIF-1)是一种由α和β两个亚基构成的异二聚体,在低氧环境下与低氧反应原件相互作用,发挥调节血管生成的作用,能够介导低氧条件下的血管新生[46]。有研究指出在TMJOA状态下,低氧诱导的血管新生是通过HIF-1/Notch通路相互作用而产生[47],并且HIF-1/Notch通路是低氧环境下血管新生及内皮细胞侵袭的关键因素。HIF-1在低氧条件下可以激活Notch通路,使通路中的Notch1受体与Delta4配体表达量增高,最终引起通路下游因子Hes1的高表达,而HIF-1也会刺激VEGF高表达,由此推测HIF1-VEGF-Notch通路会参与髁突血管新生,在一定程度上参与TMJOA的发生发展,这也为治疗TMJOA提供了新的思路[48]。见图7。"

TMJOA的发生发展与众多炎性因子的作用有关,白细胞介素1作为其中最重要的炎症启动因子,由白细胞介素1α蛋白和白细胞介素1β蛋白组成,在软骨细胞炎症反应过程中起到关键性的作用[49]。有研究表明,在不正常压力、创伤、自由基等刺激作用下会诱导髁突软骨细胞合成并分泌大量的白细胞介素1β,而白细胞介素1β会导致髁突软骨中Notch1和NICD的表达量增高,增强软骨细胞的炎症反应,进而加重TMJOA病情[50]。相反,当抑制Notch1信号通路后,由白细胞介素1β造成的软骨细胞中基质金属蛋白酶表达失衡的现象有所缓解,因此可以减轻由白细胞介素1β调控造成的颞下颌关节软骨细胞的炎症反应。核因子κB是一种真核细胞转录因子Rel家族的和蛋白因子,它可以调节细胞的生长、分化、凋亡及炎性反应,在细胞生长分化周期中发挥着重要作用[51]。 有研究表明,核因子κB可介导由白细胞介素1β引起的软骨细胞的炎症反应,并且Notch信号通路能够调节核因子κB的活性,抑制Notch1信号就可以实现抑制核因子κB信号通路正常传导的目的,从而抑制其下游基因血管内皮生长因子、基质金属蛋白酶9的活性与表达,最终实现缓解甚至抑制TMJOA的症状[52]。 纤维软骨干细胞不仅在髁突软骨正常的生长发育过程中发挥作用,在研究Notch与TMJOA之间的关系中也具有重要意义。纤维软骨干细胞具有修复关节损伤的功能,可用于治疗TMJOA[53]。上文中提到Notch基因在纤维软骨干细胞分化为软骨细胞过程中起到重要作用[30],纤维软骨干细胞在小鼠颞下颌关节形态发育过程中Notch基因存在高表达的现象;在TMJOA期间,激活Notch信号可以诱导纤维软骨干细胞向骨分化,促进软骨向骨的转化。相反,当Notch信号传导被抑制后会造成纤维软骨干细胞成骨分化能力的减弱,阻断了软骨向骨的转化,因此在使用Notch通路抑制剂γ分泌酶抑制剂后,纤维软骨干细胞的成骨和成软骨能力均有所下降,阻断了TMJOA中软骨细胞的增殖以及软骨细胞向骨形态的转化,进而达到缓解TMJOA症状的目的。"

| [1] 王兵, 熊一静, 罗倩, 等. 儿童及青少年不同骨面型颞下颌关节的研究进展[J]. 口腔医学,2024,44(6):475-480. [2] MCKIMPSON WM, SPIEGEL S, MUKHANOVA M, et al. Calorie restriction activates a gastric Notch-FOXO1 pathway to expand ghrelin cells. J Cell Biol. 2024;223(10): e202305093. [3] 彭慧敏, 裴婷婷, 刘畅. 下颌髁突软骨生长发育相关信号通路的研究进展[J]. 口腔生物医学,2018,9(1):53-57. [4] BENDER ME, LIPIN RB, GOUDY SL. Development of the Pediatric Temporomandibular Joint. Oral Maxillofac Surg Clin North Am. 2018;30(1):1-9. [5] BECHTOLD TE, SAUNDERS C, DECKER RS, et al. Osteophyte formation and matrix mineralization in a TMJ osteoarthritis mouse model are associated with ectopic hedgehog signaling. Matrix Biol. 2016;52-54:339-354. [6] BECHTOLD TE, KURIO N, NAH HD, et al. The Roles of Indian Hedgehog Signaling in TMJ Formation. Int J Mol Sci. 2019;20(24):6300. [7] 李松. 下颌髁状突软骨与生长板软骨生长发育的比较研究[J]. 昆明医科大学学报,2014,35(2):1-4. [8] METZ CW, BRIDGES CB. Incompatibility of Mutant Races in Drosophila. Proc Natl Acad Sci U S A. 1917;3(12):673-678. [9] ANDERSSON ER, SANDBERG R, LENDAHL U. Notch signaling: simplicity in design, versatility in function. Development. 2011;138(17):3593-3612. [10] 王雪淞, 周林, 李林材, 等. Notch信号通路调控间充质干细胞的增殖与分化[J]. 中国组织工程研究,2024,28(19):3076-3083. [11] 李婷, 程亚楠, 周小平. 阻断Notch信号通路后补益营卫方对衰老皮肤表皮干细胞Notch1、Jagged1、RBP-Jκ和Hes1表达的影响[J]. 中国老年学杂志, 2023,43(4):876-880. [12] ZACK SR, MEYER A, ZANOTTI B, et al. Notch ligands are biomarkers of anti-TNF response in RA patients. Angiogenesis. 2024;27(2):273-283. [13] KRISHNA BM, JANA S, SINGHAL J, et al. Notch signaling in breast cancer: From pathway analysis to therapy. Cancer Lett. 2019;461:123-131. [14] SERRANO MJ, SO S, HINTON RJ. Roles of notch signalling in mandibular condylar cartilage. Arch Oral Biol. 2014;59(7):735-740. [15] YAN F, FENG J, YANG L, et al. The effect induced by alternated mechanical loading on Notch-1 in mandibular condylar cartilage of growing rabbits. Bone Joint Res. 2021;10(7):437-444. [16] DOWTHWAITE GP, BISHOP JC, REDMAN SN, et al. The surface of articular cartilage contains a progenitor cell population. J Cell Sci. 2004;117(Pt 6):889-897. [17] RUTKOWSKI TP, KOHN A, SHARMA D, et al. HES factors regulate specific aspects of chondrogenesis and chondrocyte hypertrophy during cartilage development. J Cell Sci. 2016;129(11):2145-2155. [18] MATSUMOTO K, LUTHER KB, HALTIWANGER RS. Diseases related to Notch glycosylation. Mol Aspects Med. 2021;79:100938. [19] LOGEAT F, BESSIA C, BROU C, et al. The Notch1 receptor is cleaved constitutively by a furin-like convertase. Proc Natl Acad Sci U S A. 1998;95(14):8108-8112. [20] LUCA VC, JUDE KM, PIERCE NW, et al. Structural biology. Structural basis for Notch1 engagement of Delta-like 4. Science. 2015;347(6224): 847-853. [21] KIM GS, PARK HS, LEE YC. OPTHiS Identifies the Molecular Basis of the Direct Interaction between CSL and SMRT Corepressor. Mol Cells. 2018; 41(9):842-852. [22] SHI Q, XUE C, ZENG Y, et al. Notch signaling pathway in cancer: from mechanistic insights to targeted therapies. Signal Transduct Target Ther. 2024;9(1):128. [23] SANALKUMAR R, DHANESH SB, JAMES J. Non-canonical activation of Notch signaling/target genes in vertebrates. Cell Mol Life Sci. 2010;67(17):2957-2968. [24] JENSEN CH, JOHNSEN RH, ESKILDSEN T, et al. Pericardial delta like non-canonical NOTCH ligand 1 (Dlk1) augments fibrosis in the heart through epithelial to mesenchymal transition. Clin Transl Med. 2024;14(2):e1565. [25] LIU L, ZHANG L, ZHAO S, et al. Non-canonical Notch Signaling Regulates Actin Remodeling in Cell Migration by Activating PI3K/AKT/Cdc42 Pathway. Front Pharmacol. 2019;10:370. [26] CHEN S, LAN L, LEI J, et al. Gli1+ Osteogenic Progenitors Contribute to Condylar Development and Fracture Repair. Front Cell Dev Biol. 2022;10:819689. [27] DENG Z, LIU Y, WANG C, et al. Involvement of PI3K/Akt pathway in rat condylar chondrocytes regulated by PTHrP treatment. Arch Oral Biol. 2014;59(10):1032-1041. [28] 徐谣, 李文晋. Hedgehog信号通路在下颌骨发育过程中作用机制的研究进展[J]. 口腔疾病防治,2024,32(9):709-714. [29] JING Y, ZHOU X, HAN X, et al. Chondrocytes Directly Transform into Bone Cells in Mandibular Condyle Growth. J Dent Res. 2015;94(12):1668-1675. [30] RUSCITTO A, SCARPA V, MOREL M, et al. Notch Regulates Fibrocartilage Stem Cell Fate and Is Upregulated in Inflammatory TMJ Arthritis. J Dental Res. 2020; 99(10):1174-1181. [31] DONG Y, JESSE AM, KOHN A, et al. RBPjkappa-dependent Notch signaling regulates mesenchymal progenitor cell proliferation and differentiation during skeletal development. Development. 2010;137(9):1461-1471. [32] MEAD TJ, YUTZEY KE. Notch pathway regulation of chondrocyte differentiation and proliferation during appendicular and axial skeleton development. Proc Natl Acad Sci U S A. 2009;106(34):14420-14425. [33] TAKABAYASHI H, JI T, PENG L, et al. Regulation of Parietal Cell Homeostasis by Bone Morphogenetic Protein Signaling. Gastro Hep Adv. 2023;2(2):221-231. [34] SHANG X, WANG J, LUO Z, et al. Notch signaling indirectly promotes chondrocyte hypertrophy via regulation of BMP signaling and cell cycle arrest. Sci Rep. 2016; 6:25594. [35] 庄欠志, 武秀萍. 甲状旁腺激素相关蛋白在下颌骨髁突软骨生长发育中的作用机制[J]. 口腔医学研究,2021,37(9):791-793. [36] DELGADO-CALLE J, MCANDREWS K, WU G, et al. The Notch pathway regulates the bone gain induced by PTH anabolic signaling. Faseb J. 2022;36(3):e22196. [37] FUENTES MA, OPPERMAN LA, BELLINGER LL, et al. Regulation of cell proliferation in rat mandibular condylar cartilage in explant culture by insulin-like growth factor-1 and fibroblast growth factor-2. Arch Oral Biol. 2002;47(9):643-654. [38] SERRANO MJ, SO S, SVOBODA KK, et al. Cell fate mediators Notch and Twist in mouse mandibular condylar cartilage. Arch Oral Biol. 2011;56(6):607-613. [39] ISHIDA T, YABUSHITA T, SOMA K. Effects of a liquid diet on temporomandibular joint mechano-receptors. Journal of dental research, 2009;88(2):187-191. [40] 刘晨燕, 冯剑颖, 谷志远. 咀嚼负荷对幼兔髁突软骨细胞BrdU标记影响的研究[J]. 口腔医学,2015,35(4):250-253+286. [41] WEI J, WANG Y, TU S, et al. Circadian rhythm disruption upregulating Per1 in mandibular condylar chondrocytes mediating temporomandibular joint osteoarthritis via GSK3β/β-CATENIN pathway. J Transl Med. 2024;22(1):662. [42] LU K, MA F, YI D, et al. Molecular signaling in temporomandibular joint osteoarthritis. J Orthop Translat. 2022;32:21-27. [43] MAHJOUB M, SASSI N, DRISS M, et al. Expression patterns of Notch receptors and their ligands in human osteoarthritic and healthy articular cartilage. Tissue Cell. 2012;44(3):182-194. [44] 兰玲莉, 张伟娜, 蒋扬眉, 等. Notch信号通路在颞下颌骨关节炎中的表达[J]. 口腔疾病防治,2017,25(3):143-152. [45] CHEN Y, ZHAO B, ZHU Y, et al. HIF-1-VEGF-Notch mediates angiogenesis in temporomandibular joint osteoarthritis. Am J Transl Res. 2019;11(5):2969-2982. [46] MORENO-DOMíNGUEZ A, COLINAS O, ARIAS-MAYENCO I, et al. Hif1α-dependent mitochondrial acute O(2) sensing and signaling to myocyte Ca(2+) channels mediate arterial hypoxic vasodilation. Nat Commun. 2024;15(1):6649. [47] RIBATTI D, D’AMATI A. Bone angiocrine factors. Front Cell Dev Biol. 2023;11:1244372. [48] SHIRAKURA M, TANIMOTO K, EGUCHI H, et al. Activation of the hypoxia-inducible factor-1 in overloaded temporomandibular joint, and induction of osteoclastogenesis. Biochem Biophys Res Commun. 2010;393(4):800-805. [49] YANG H, ZHOU Y, YING B, et al. Effects of human umbilical cord mesenchymal stem cell-derived exosomes in the rat osteoarthritis models. Stem Cells Transl Med. 2024;13(8):803-811. [50] AIDA Y, MAENO M, SUZUKI N, et al. The effect of IL-1beta on the expression of matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases in human chondrocytes. Life Sci. 2005;77(25):3210-3221. [51] LIU L, CHEN Y, HAN Y, et al. Qing Hua Chang Yin ameliorates chronic colitis in mice by inhibiting PERK-ATF4-CHOP pathway of ER stress and the NF-κB signalling pathway. Pharm Biol. 2024;62(1):607-620. [52] Retraction: Down-regulation of Notch-1 Inhibits Invasion by Inactivation of Nuclear Factor-κB, Vascular Endothelial Growth Factor, and Matrix Metalloproteinase-9 in Pancreatic Cancer Cells. Cancer Res. 2018;78(18):5476. [53] QIU J, HUA B, YE X, et al. Intra-articular injection of kartogenin promotes fibrocartilage stem cell chondrogenesis and attenuates temporomandibular joint osteoarthritis progression. Front Pharmacol. 2023;14:1159139. |
| [1] | Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [2] | Lu Xiuli, Xu Huazhen, Chen Yuxing, Yao Nan, Hu Zixuan, Huang Dane. Mechanism of Jiangu Formula in treating osteoporosis based on osteoclast-osteoblast coupling [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6828-6835. |
| [3] | Yan Laijun, Ge Haiya, Wang Zhengming, Yang Zongrui, Niu Lifeng, Zhan Hongsheng. Mechanism by which Tongdu Huoxue Decoction inhibits macrophage inflammation to delay intervertebral disc degeneration in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6851-6857. |
| [4] | Nigeayi · Aihemaiti, Yilidanna · Dilixiati, An Wei, Maimaitituxun · Tuerdi. Expression of mitochondrial creatine kinase 2 in a rat model of temporomandibular joint osteoarthritis and its role in inflammation progression [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6877-6884. |
| [5] | Wang Ziheng, Wu Shuang. Oxidative stress-related genes and molecular mechanisms after spinal cord injury: data analysis and verification based on GEO database [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6893-6904. |
| [6] | Yu Qinghe, Cai Ziming, Wu Jintao, Ma Pengfei, Zhang Xin, Zhou Longqian, Wang Yakun, Lin Xiaoqin, Lin Wenping. Vanillic acid inhibits inflammatory response and extracellular matrix degradation of endplate chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6391-9397. |
| [7] | Fan Jiaxin, Jia Xiang, Xu Tianjie, Liu Kainan, Guo Xiaoling, Zhang Hui, Wang Qian . Metformin inhibits ferroptosis and improves cartilage damage in osteoarthritis model rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6398-6408. |
| [8] | Zhou Ying, Tian Yong, Zhong Zhimei, Gu Yongxiang, Fang Hao. Inhibition of tumor necrosis factor receptor associated factor 6 regulates mTORC1/ULK1 signaling and promotes autophagy to improve myocardial injury in sepsis mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6434-6440. |
| [9] | Wang Wanchun, , Yi Jun, Yan Zhangren, Yang Yue, Dong Degang, Li Yumei. 717 Jiedu Decoction remodels homeostasis of extracellular matrix and promotes repair of local injured tissues in rats after Agkistrodon halys bite [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6457-6465. |
| [10] | Zhang Xin, Guo Baojuan, Xu Huixin, Shen Yuzhen, Yang Xiaofan, Yang Xufang, Chen Pei. Protective effects and mechanisms of 3-N-butylphthalide in Parkinson’s disease cell models [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6466-6473. |
| [11] | Zhang Songjiang, Li Longyang, Zhou Chunguang, Gao Jianfeng. Central anti-inflammatory effect and mechanism of tea polyphenols in exercise fatigue model mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6474-6481. |
| [12] | Hu Shujuan, Liu Dang, Ding Yiting, Liu Xuan, Xia Ruohan, Wang Xianwang. Ameliorative effect of walnut oil and peanut oil on atherosclerosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6482-6488. |
| [13] | Zhang Jian, Cai Feng, Li Tingwen, Ren Pengbo. Fatigue gait recognition of athletes based on fish swarm algorithm [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6489-6498. |
| [14] | Zhang Zihan¹, Wang Jiaxin¹, Yang Wenyi², Zhu Lei¹. Regulatory mechanism of exercise promoting mitochondrial biogenesis in skeletal muscle [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6499-6508. |
| [15] | Wang Jianxu, Dong Zihao, Huang Zishuai, Li Siying, Yang Guang. Interaction between immune microenvironment and bone aging and treatment strategies [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6509-6519. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||