Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (10): 2105-2112.doi: 10.12307/2025.262
Previous Articles Next Articles
Antibacterial piezoelectric materials: no selective killing of bacteria and no bacterial resistance
Feng Nan, Li Yunfeng
- Department of Oral and Maxillofacial Surgery, State Key Laboratory of Oral Diseases & National Center for Stomatology & National Clinical Research Center for Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China
-
Received:2024-01-04Accepted:2024-02-26Online:2025-04-08Published:2024-08-23 -
Contact:李运峰,副教授,硕士生导师,口腔疾病防治全国重点实验室,国家口腔医学中心,国家口腔疾病临床医学研究中心,四川大学华西口腔医院口腔颌面外科,四川省成都市 610041 -
About author:Feng Nan, Master candidate, Department of Oral and Maxillofacial Surgery, State Key Laboratory of Oral Diseases & National Center for Stomatology & National Clinical Research Center for Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China -
Supported by:Sichuan Provincial Science and Technology Plan Funding Project, No. 2023NSFSC0570 (to LYF); National Key Research & Development Plan Project, No. 2022YFB3804500 (to LYF); Technology Innovation Research and Development Project of Chengdu Science and Technology Bureau, No. 2022-YF05-01838-SN (to LYF)
CLC Number:
Cite this article
Feng Nan, Li Yunfeng. Antibacterial piezoelectric materials: no selective killing of bacteria and no bacterial resistance[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2105-2112.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
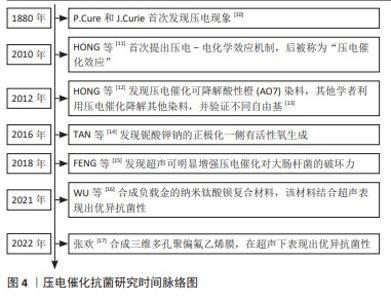
自1880年压电现象被发现以来,压电材料这种可以实现力与电相互转化的特性受到了众多学者的关注和研究[10],如机电传感器、纳米发电机、声学设备和致动器等。在2010年,HONG等[11]学者于首次提出了将电化学能转化为化学能的压电-电化学效应机制。他们通过对ZnO微纤维和BaTiO3施加超声波在材料表面上产生了感应电势,使电荷与水分子反应产生H2和O2,后来也被称为“压电催化效应”。随后在2012年HONG等[12]发现BaTiO3压电催化可以降解酸性橙7染料,首次将压电催化用于降解污染物的环境治理领域,随后也有学者利用压电催化降解如罗丹明B、亚甲基蓝及甲基橙等有机污染物的相关研究,并使用不同的自由基清除剂证明有不同的活性氧自由基产生[13]。在2016年,TAN等[14]学者在铌酸钾钠(Na0.5K0.5NbO3)材料的正极化一侧表面观察到有大量活性氧生成,催化生成活性氧的发现极大地推动了压电材料在环境污染物处理和生物医学等领域的研究和发展。在2018年,FENG等[15]通过研究纳米/微米BaTiO3在超声作用下对大肠杆菌的抗菌性能,发现超声与压电催化相结合具有较大的抗菌潜力,且压电催化与超声机械作用之间存在协同抗菌效应。在2021年,WU等[16]用立方相钛酸钡负载金纳米颗粒形成一种纳米复合材料(简称为Au@BTO),使用低频超声波作用于材料后生成大量活性氧,该材料不仅在体外和动物体内表现出优异的抗菌效果,而且还能促进小鼠感染伤口的愈合,进一步拓展了压电材料在抗菌领域的应用场景。在2022年,张欢[17]改进了合成方法制备了均匀孔径的三维多孔聚偏氟乙烯膜,有效提高了有机压电材料聚偏氟乙烯的力学敏感性以及压电性,并对金黄色葡萄球菌和大肠杆菌表现出优异的抗菌性,提高了有机压电材料的抗菌性能,见图4。"
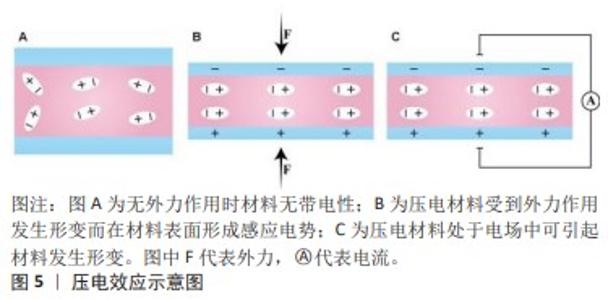
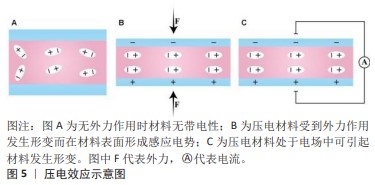
2.1 压电材料的特性 2.1.1 压电效应 压电性(Piezoelectricity)最早是由P. Cure和J. Curie于1880年发现,因他们观察到材料在受到机械力时有电荷产生的现象而来。“压”代表施加压力,“电”则对应电子的移动,故具有压电性的材料被称为压电材料。压电性与材料晶胞中正负电荷的非中心对称分布有关,当沿某方向对材料施加外力时,会发生拉伸、挤压或弯曲等变形,晶胞偶极矩发生变化,引起带电粒子的移动而产生净电荷,从而在材料上产生电势差形成电场[10]。当压电材料对施加的外力进行响应后可产生电荷,这种将机械能转化为电能的现象称为正压电效应;而将压电材料置于特定电场中可使材料产生形变,这种将电能转化为机械能的现象称为逆压电效应[6-18],见图5。"
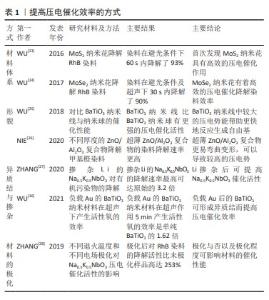
压电材料包括无机压电材料、有机压电材料、复合压电材料和生物压电材料,常见的无机压电材料有BaTiO3,SrTiO3,ZnO,MoS2和羟基磷灰石等;有机压电材料有聚偏氟乙烯等;复合材料可有不同无机材料之间以及无机材料与有机材料的复合材料,如掺杂Li的Na0.5K0.5NbO3、掺杂BaTiO3的水凝胶等;生物压电材料骨骼、牙本质、肌肉和神经等[19]。非极性晶体的压电材料在无应力作用状态下不会产生电偶极子,在应力作用下使电荷中心分离产生电偶极子,从而产生感应压电势,典型例子为石英。也有部分压电材料属于极性晶体,由于正负电荷的分离,在无应力作用和无电场状态下也可表现出自发极化,典型例子为氧化锌[20]。有研究发现,生物体内的骨组织也存在压电现象,产生的负电荷具有促进骨细胞功能和新骨形成的作用,这种生物压电现象在骨发育和骨折愈合中发挥着重要作用[21]。 2.1.2 压电催化 压电效应过程中产生的带电粒子,可在材料的表面与周围介质发生化学反应,这种特性称为压电催化。目前关于压电催化发生的机制和理论仍存在争议,但能带理论和屏蔽电荷效应两种观点得到了众多学者的认可。受光催化启发的能带理论认为压电催化反应的能力主要取决于能带水平(价带和导带),在该理论中,压电势在很大程度上充当了“闸门”的角色,通过调整能带结构和控制内部载流子流向材料表面,使得反应得以进行。另一种理论,即屏蔽电荷效应,强调了压电势和相关外部屏蔽电荷(即来自表面带电的吸附物)的关键作用。更具体地说,压电势作为驱动力,应完全达到或超过特定反应所需的吉布斯自由能变化被认为是压电催化的先决条件。此外,不同于能带理论的另一个特点是,屏蔽电荷效应认为参与氧化还原反应的电荷是来自表面带电吸附物的屏蔽电荷,而非材料内部的电荷[22]。 压电材料的抗菌性能在一定程度与其催化效率有着紧密联系,催化效率越高代表在相同时间内催化生成的产物越多,而影响压电催化效率的因素有很多,如材料体系、形貌、异质结与掺杂、材料极化以及外部条件等[23-28],见表1。近年来,压电催化除了在环境修复领域被广泛研究,也在固氮合成氨、还原二氧化碳及合成过氧化氢等方面引起人们的关注,使得压电催化及相关技术在能源转化和环境治理等领域的应用逐渐被人们关注[8-18],为解决环境污染和能源危机问题提供了新视角,但目前对于压电催化的具体机制也尚未明确。 "
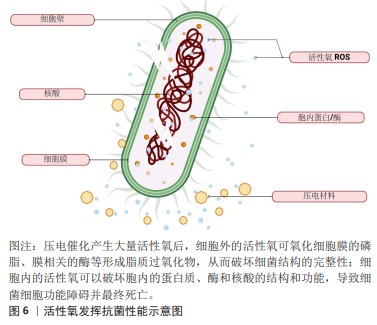
2.1.3 活性氧 活性氧是一类氧不完全还原所形成的化学物质的总称,主要包括超氧阴离子(O2??)、过氧化氢(H2O2)、单线态氧(1O2)和羟基自由基(·OH)等[29-30]。活性氧在正常生理代谢活动中有着广泛参与,在调节生物的各种生理功能方面起着重要作用,活性氧还是生物发育所必需的基础,然而产生过量的活性氧可导致氧化应激,涉及许多如癌症、神经退行性疾病及炎症等疾病的发生和发展过程[31-33]。由于纳米材料和技术的飞速发展,人们发现了多种具有调控活性氧的纳米材料,可在生物环境中调控活性氧的时空分布,从而形成了一种新一代的治疗方法,即纳米材料引导的体内活性氧治疗[34]。 事实上,与其他真核细胞类似,细菌也具有内源性的抗氧化防御系统来中和外来的异常氧化剂,并将其转化为无害的产物[35]。因此,纳米材料想要获得理想的抗菌效果,高活性氧生成效率是保证氧化应激显著高于细菌耐受阈值的前提,从而发挥抗菌效果。大多数学者认为,催化产生大量的活性氧在压电材料的抗菌作用中发挥了重要作用。活性氧的抗菌效应可分为细胞外氧化和细胞内氧化,细胞外氧化即脂质过氧化,是指活性氧可与生物膜的磷脂、膜相关的酶、膜的侧链多不饱和脂肪反应,形成脂质过氧化产物,因此,细胞膜的流动性和通透性改变,细胞内容物发生泄露,最终导致细菌功能和结构变化,甚至死亡;细胞内氧化及氧化应激,是指细胞的氧化和抗氧化失衡并趋向过氧化,破坏细胞内的蛋白质和核酸结构和功能,导致细菌细胞功能障碍并最终死亡[36-37],见图6。"

此外,真核细胞中的活性氧可以刺激线粒体释放casepase第二激活物进入细胞质,抑制抗凋亡因子,同时释放细胞色素C,参与构成凋亡小体,形成内源性诱导细胞凋亡途径[38]。活性氧的细胞毒性以及对DNA的损伤均会激活RIP激酶,将坏死信号转达到线粒体,线粒体破坏激活多种蛋白酶和磷脂酶,导致细胞膜破裂,导致细胞坏死[39]。活性氧不仅可以诱导细胞凋亡,还可以通过促进Mec1形成、促进Snf1对Mec1磷酸化诱导细胞自噬,从而导致细胞内蛋白质或细胞器发生降解[40]。过量活性氧与多不饱和脂肪酸及其衍生物相作用导致大量脂质过氧化,随后引起的细胞膜损伤从而导致细胞铁死亡[41]。 2.1.4 声动力治疗 超声波作为一种外源性机械力源,具有可控性强、非侵入性、非电离性和组织穿透性强的特点,已被广泛应用于许多生物医学应用,如超声检查、高强度聚焦超声 、低强度聚焦超声及声动力疗法[42]。声动力疗法作为一种低强度超声与压电材料(声敏剂)的结合,被认为是一种很有前景的癌症治疗替代方案,作为一种新兴的癌症治疗方式,其抗肿瘤机制复杂,活性氧被认为是主要机制。目前关于声动力疗法产生活性氧的途径主要有两种说法:一种是“声致发光”,即用超声波作用于溶液时可产生光,声致发光可以进一步激发声敏剂产生电子-空穴对(e--h+),然后产生活性氧,但声致发光确切机制尚不清楚;第二种是“高温分解”,在超声作用下形成许多气泡,气泡的形成、生长和破裂可使微环境的温度升高,声敏剂分解水产生自由基,自由基与其他内源性底物反应产生活性氧[36]。除了催化产生活性氧之外,超声还具有空化效应与机械力效应。空化效应是指在超声下气泡半径和压力呈不均匀状态,气泡可能在坍塌时出现反弹,或表现为膨胀或完全内爆的过程,主要分为惯性空化和稳定空化。超声的机械作用产生的剪切应力还可导致如增加细胞膜孔隙、激活机械敏感离子通道和促进胞吞作用等生物学效应[43]。超声波不仅可以作为外界机械力激发压电材料的压电效应,而且还可以极大提高压电催化的效率,因此利用超声波结合压电材料的相关研究得到了广泛关注。 2.2 压电材料的抗菌研究与应用 2.2.1 细菌感染 是指由细菌在宿主体内繁殖及侵袭,在生物因子与宿主相互作用下导致机体产生以防御为主的一系列全身及局部组织反应的疾患。当致病菌突破了机体的皮肤、黏膜等屏障后,宿主的免疫系统可快速响应,吞噬细胞群如巨噬细胞、粒细胞和单核细胞等可对入侵细菌进行吞噬,同时释放大量炎症因子,促进更多免疫细胞的趋化、聚集、分化和激活下游信号通路,以控制感染防止感染进一步扩散[44-45]。一方面,细菌可合成包括脂多糖、外毒素及特殊水解酶等大量毒素可诱导细胞凋亡和破坏组织结构,如铜绿假单胞菌T3可合成Exo U等具有强细胞毒性的蛋白酶,这类蛋白酶可以抑制细胞的吞噬作用并促进细胞凋亡;另一方面,机体对感染的过度免疫可增加自身抗原识别并产生自身抗体,从而破坏宿主自身细胞和组织,可能会引起急性风湿热和风湿性心脏病等疾病。长期慢性感染甚至可能引发败血症、器官衰竭、弥散性血管内凝血、血栓形成和水肿,甚至诱发死亡[46-49]。 2.2.2 细菌生物膜 细菌生物膜是由细菌及胞外聚合物组成的复杂结构。胞外聚合物主要由细胞外多糖、核酸、蛋白质、脂质以及其他生物分子共同组成,在生物膜的结构和功能中起到关键的作用[50-51]。一方面,胞外聚合物可以促进微生物细胞黏附于物体表面,可将不同细菌包裹在一起,为其提供一个复杂且稳定的微环境,不同细菌之间可以在生物膜空间内进行相互作用[52];另一方面,生物膜起到了屏障和保护作用,可以阻碍和延缓抗菌药物的进入,抵抗来自宿主免疫系统的攻击,从而增强细菌对抗生素和抗菌剂的抵抗性和耐受性[53-55]。除此之外,部分生物膜内的细菌还将进入休眠状态,从而躲避抗菌药物的作用,当外部条件适宜时再复苏进行生长繁殖[56]。临床上的感染通常是伴有生物膜形式的多种细菌混合感染,这极大地增加了抗菌治疗的难度。 2.2.3 抗菌相关研究 自从压电催化被发现以来,压电材便在抗菌领域得到了广泛关注和研究。在2016年,TAN等[14]在铌酸钾钠材料的正极化一侧表面观察到有大量活性氧生成,随后测试抗金黄色葡萄球菌的性能。在2020年,VERMA等[57]将不同浓度的铌酸钾钠(10%-30%)添加到1393生物活性玻璃(1393BG)中以改善其性能,并表现出不错的抗菌性。在2021年,吴聪[58]在钛金属表面合成了一种TiO2@BaTiO3纳米管涂层,该涂层还可负载盐酸万古霉素和纳米银,对药物进行控释,对金黄色葡萄球菌的表现出长效抗菌性。在2021年,WU等[40]用立方相钛酸钡负载金纳米颗粒形成一种具有异质结的纳米复合材料(简称为Au@BTO),在体外和体内抗菌实验中均表现出优异的抗菌性能,细胞划痕实验结果表明可促进成纤维细胞和巨噬细胞迁,提示声动力生成的活性氧在体外和体内都具有显著的抗菌活性和促进组织修复的作用。在2021年,MONTOYA等[59]将纳米钛酸钡颗粒作为口腔树脂的填料,该复合材料可以抑制生物膜生长和促进再矿化作用。2022年,SHARMA等[60]通过合成NaNbO3/ZnO二元纳米复合材料并在超声波下研究该材料对牙齿美白和抗菌效果。 ZnO因具备良好的生物相容性受到广泛关注,研究发现ZnO不仅具有良好的抗菌性,还具备促进多种细胞系的黏附、生长、分化、成骨和成血管作用[61-62]。2022年,邓伟成等[63]利用3-氨丙基三乙氧基硅烷对ZnO进行改性,并与甲基丙烯酸酐化明胶、N,N-二甲基丙烯酰胺和α-甲基丙烯酸水凝胶进行掺杂得到ZnO掺杂水凝胶(简称为ZnO@GDM),并用大肠杆菌来测试ZnO@GDM的抗菌性。 2022年,张欢[17]改进了合成方法合成均匀孔径的三维多孔聚偏氟乙烯膜,有效提高了PVDF的力学敏感性以及压电性,并显示出该优异的抗菌性。在2022年,LIU等[64]研制了一种压电材料复合可注射水凝胶,将四方相钛酸钡掺杂到由N-三羟甲基甲基丙烯酰胺、N-(3-氨基丙基)甲基丙烯酰胺盐酸盐和氧化透明质酸的水凝胶中,该复合材料在体外和体内都表现出了优异的抗菌性能。 表2以表格的形式分别从研究作者、研究年份、研究所用的材料、材料的生物相容性、体外与体内的抗菌效果以及用于抗菌研究的细菌种类来对上述研究进行汇总。在抗菌相关研究中,研究者们常以金黄色葡萄球菌和大肠杆菌分别作为革兰阳性菌和革兰阴性菌的代表来研究材料的抗菌性能。"

| [1] GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2022; 400(10369):2221-2248. [2] KUMAR S, SHARMA M, FRÖMLING T, et al. Antibacterial ferroelectric materials: advancements and future directions. J Ind Eng Chem. 2021; 97:95-110. [3] MEHTA AC, MUSCARELLA LF. Bronchoscope-related “superbug” infections. Chest. 2020;157(2):454-469. [4] MCCULLOCH TR, WELLS TJ, SOUZA-FONSECA-GUIMARAES F. Towards efficient immunotherapy for bacterial infection. Trends Microbiol. 2022;30(2):158-169. [5] LARSSON DGJ, FLACH CF. Antibiotic resistance in the environment. Nat Rev Microbiol. 2022;20(5):257-269. [6] HUEMER M, MAIRPADY SHAMBAT S, BRUGGER SD, et al. Antibiotic resistance and persistence-Implications for human health and treatment perspectives. EMBO Rep. 2020;21(12):e51034. [7] KAPAT K, SHUBHRA QTH, ZHOU M, et al. Piezoelectric nano-biomaterials for biomedicine and tissue regeneration. Adv Funct Mater. 2020. doi: 10.1002/adfm.201909045. [8] 孙奇薇,薛国梁,周学凡,等.压电催化降解有机污染物的研究进展[J].中国有色金属学报,2021,31(8):1997-2013. [9] YANG B, CHEN Y, SHI J. Reactive oxygen species (ROS)-based nanomedicine. Chem Rev. 2019;119(8):4881-4985. [10] QIAN W, YANG W, ZHANG Y, et al. Piezoelectric materials for controlling electro-chemical processes. Nanomicro Lett. 2020;12(1):149. [11] HONG KS, XU HF, KONISHI H, et al. Direct water splitting through vibrating piezoelectric microfibers in water. J Phys Chem Lett. 2010; 1(6):997-1002. [12] HONG KS, XU HF, KONISHI H, et al. Piezoelectrochemical effect: a new mechanism for azo dye decolorization in aqueous solution through vibrating piezoelectric microfibers. J Phys Chem Lett. 2012; 116(24):13045-13051. [13] 战立慧,宁雪儿,郝平玉,等.压电催化技术在能源与环境领域中的研究进展[J].中国科学:化学,2023,53(8):1336-1354. [14] TAN G, WANG S, ZHU Y, et al. Surface-selective preferential production of reactive oxygen species on piezoelectric ceramics for bacterial killing. ACS Appl Mater Interfaces. 2016;8(37):24306-24309. [15] FENG JX, FU Y, LIU XS, et al. Significant improvement and mechanism of ultrasonic inactivation to escherichia coli with piezoelectric effect of hydrothermally synthesized t-BaTiO3. ACS Sustainable Chem Eng. 2018;6(5):6032-6041. [16] WU MQ, ZHANG ZY, LIU ZR, et al. Piezoelectric nanocomposites for sonodynamic bacterial elimination and wound healing. Nano Today. 2021;37:101104. [17] 张欢.三维多孔压电聚偏氟乙烯膜的制备及其抗菌研究[D].广州:华南理工大学,2022. [18] GAZVODA L, PERIŠIĆ NANUT M, SPREITZER M, et al. Antimicrobial activity of piezoelectric polymer: piezoelectricity as the reason for damaging bacterial membrane. Biomater Sci. 2022;10(17):4933-4948. [19] WANG W, LI J, LIU H, et al. Advancing versatile ferroelectric materials toward biomedical applications. Adv Sci (Weinh). 2020;3;8(1):2003074. [20] MANDAL D, BANERJEE S. Surface acoustic wave (SAW) sensors: physics, materials, and applications. Sensors (Basel). 2022;22(3):820. [21] KHARE D, BASU B, DUBEY AK. Electrical stimulation and piezoelectric biomaterials for bone tissue engineering applications. Biomaterials. 2020;258:120280. [22] WANG K, HAN C, LI J, et al. The mechanism of piezocatalysis: energy band theory or screening charge effect? Angew Chem Int Ed Engl. 2022;1;61(6):e202110429. [23] WU JM, CHANG WE, CHANG YT, et al. Piezo-catalytic effect on the enhancement of the ultra-high degradation activity in the dark by single- and few-layers MoS2 nanoflowers. Adv Mater. 2016;28(19):3718-3725. [24] WU MH, LEE J T, CHUNG YJ, et al. Ultrahigh efficient degradation activity of single- and few-layered MoSe2 nanoflowers in dark by piezo-catalyst effect. Nano Energy. 2017;40:369-375. [25] WU J, QIN N, BAO DH. Effective enhancement of piezocatalytic activity of BaTiO3 nanowires under ultrasonic vibration. Nano Energy. 2018;45:44−51. [26] NIE Q, XIE YF, MA JM, et al. High piezo-catalytic activity of ZnO/Al2O3 nanosheets utilizing ultrasonic energy for wastewater treatment. J. Cleaner Prod. 2020;242:118532. [27] ZHANG A, LIU ZY, XIE B, et al. Vibration catalysis of eco-friendly Na0.5K0.5NbO3-based piezoelectric: an efficient phase boundary catalyst. Appl Catal B. 2020;279:119353. [28] ZHANG A, LIU ZY, GENG XH, et al. Ultrasonic vibration driven piezocatalytic activity of lead-free K0.5Na0.5NbO3 materials. Ceramics Int. 2019;45(17):22486-22492. [29] D’AUTRÉAUX B, TOLEDANO MB. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis. Nat Rev Mol Cell Biol. 2007;8:813-824. [30] MITTLER R. ROS are good. Trends Plant Sci. 2017;22(1):11-19. [31] NATHAN C, CUNNINGHAM-BUSSEL A. Beyond oxidative stress: an immunologist’s guide to reactive oxygen species. Nat Rev Immunol. 2013;13(5):349-61. [32] CHEUNG EC, VOUSDEN KH. The role of ROS in tumour development and progression. Nat Rev Cancer. 2022;22(5):280-297. [33] HERB M, SCHRAMM M. Functions of ROS in macrophages and antimicrobial immunity. Antioxidants (Basel). 2021;10(2):313. [34] 卢璐,张坤.可调控活性氧的纳米声敏剂在声动力疗法的应用进展[J].临床与病理杂志,2022,42(4):995-1001. [35] EZRATY B, GENNARIS A, BARRAS F, et al. Oxidative stress, protein damage and repair in bacteria. Nat Rev Microbiol. 2017;15(7):385-396. [36] SON S, KIM JH, WANG X, et al. Multifunctional sonosensitizers in sonodynamic cancer therapy. Chem Soc Rev. 2020;49(11):3244-3261. [37] WANG G, WU W, ZHU JJ, et al. The promise of low-intensity ultrasound: a review on sonosensitizers and sonocatalysts by ultrasonic activation for bacterial killing. Ultrason Sonochem. 2021;79:105781. [38] CARNEIRO BA, EL-DEIRY WS. Targeting apoptosis in cancer therapy. Nat Rev Clin Oncol. 2020;17(7):395-417. [39] 王晓东,程文.声动力疗法介导肿瘤细胞死亡模式的研究进展[J].医学影像学杂志,2023,33(6):1108-1111. [40] WU CF, LI YX, ZHONG S, et al. ROS is essential for initiation of energy deprivation-induced autophagy. J Genet Genomics. 2021;48(6):512-515. [41] JIANG X, STOCKWELL BR, CONRAD M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol. 2021;22(4):266-282. [42] YANG Y, HUANG J, LIU M, et al. Emerging sonodynamic therapy-based nanomedicines for cancer immunotherapy. Adv Sci (Weinh). 2023; 10(2):e2204365. [43] 蒋恩琰,王丹,张照霞,等.声动力疗法的机制研究进展[J].临床超声医学杂志,2023,25(8):677-680. [44] ABDULLAH Z, KNOLLE PA. Scaling of immune responses against intracellular bacterial infection. EMBO J. 2014;33(20):2283-2294. [45] NATHAN C. Nonresolving inflammation redux. Immunity. 2022;55(4): 592-605. [46] HARDY KS, TESSMER MH, FRANK DW, et al. Perspectives on the pseudomonas aeruginosa type III secretion system effector ExoU and its subversion of the host innate immune response to infection. Toxins (Basel). 2021;13(12):880. [47] WILDE S, JOHNSON AF, LAROCK CN. Playing with fire: proinflammatory virulence mechanisms of group a streptococcus. Front Cell Infect Microbiol. 2021;11:704099. [48] COHEN J, VINCENT JL, ADHIKARI NK, et al. Sepsis: a roadmap for future research. Lancet Infect Dis. 2015;15(5):581-614. [49] KELLER N, ANDREONI F, REIBER C, et al. Human streptococcal necrotizing fasciitis histopathology mirrored in a murine model. Am J Pathol. 2018;188(7):1517-1523. [50] FLEMMING HC, WINGENDER J, SZEWZYK U, et al. Biofilms: an emergent form of bacterial life. Nat Rev Microbiol. 2016;14(9):563-575. [51] KARYGIANNI L, REN Z, KOO H. et al. Biofilm matrixome: extracellular components in structured microbial communities. Trends Microbiol. 2020;28(8):668-681. [52] KOO H, YAMADA KM. Dynamic cell-matrix interactions modulate microbial biofilm and tissue 3D microenvironments. Curr Opin Cell Biol. 2016;42:102-112. [53] DRAGOŠ A, KOVÁCS ÁT. The peculiar functions of the bacterial extracellular matrix. Trends Microbiol. 2017;25(4):257-266. [54] KOO H, ALLAN RN, HOWLIN RP, et al. Targeting microbial biofilms: current and prospective therapeutic strategies. Nat Rev Microbiol. 2017;15(12):740-755. [55] HUGHES G, WEBBER MA. Novel approaches to the treatment of bacterial biofilm infections. Br J Pharmacol. 2017;174(14):2237-2246. [56] SHARMA D, MISBA L, KHAN AU. Antibiotics versus biofilm: an emerging battleground in microbial communities. Antimicrob Resist Infect Control. 2019;8:76. [57] VERMA AS, KUMAR D, DUBEY AK. Antibacterial and cellular response of piezoelectric Na0.5K0.5NbO3 modified 1393 bioactive glass. Mater Sci Eng C Mater Biol Appl. 2020;116:111138. [58] 吴聪.钛表面生物压电涂层的构建及其骨修复促进机制研究[D].西安:西安理工大学,2021. [59] MONTOYA C, JAIN A, LONDOÑO JJ, et al. Multifunctional dental composite with piezoelectric nanofillers for combined antibacterial and mineralization effects. ACS Appl Mater Interfaces. 2021;13(37): 43868-43879. [60] SHARMA A, BHARDWAJ U, JAIN D, et al. NaNbO3/ZnO piezocatalyst for non-destructive tooth cleaning and antibacterial activity. iScience. 2022;25(9):104915. [61] LAURENTI M, CAUDA V. ZnO Nanostructures for tissue engineering applications. Nanomaterials (Basel). 2017;7(11):374. [62] KHADER A, ARINZEH TL. Biodegradable zinc oxide composite scaffolds promote osteochondral differentiation of mesenchymal stem cells. Biotechnol Bioeng. 2020;117(1):194-209. [63] 邓伟成,谭帼馨,田雨,等.氧化锌掺杂压电水凝胶的制备及其抗菌机理[J].中国表面工程,2022,35(3):254-261. [64] LIU D, LI L, SHI BL, et al. Ultrasound-triggered piezocatalytic composite hydrogels for promoting bacterial-infected wound healing. Bioact Mater. 2022;24:96-111. [65] 宋刚,王新,柳江枫,等.环磷酰胺免疫抑制大鼠的皮肤感染模型建立[J].中华微生物学和免疫学杂志,2013,33(6):458-461. [66] 王永芳,李新宇,宋莎莎,等.单纯性浅表皮肤感染小鼠模型的建立及有效性验证[J].中国药科大学学报,2013,44(6):573-576. [67] GOLDUFSKY J, WOOD SJ, JAYARAMAN V, et al. Pseudomonas aeruginosa uses T3SS to inhibit diabetic wound healing. Wound Repair Regen. 2015;23(4):557-564. [68] MA M, ZHONG Y, JIANG X. Thermosensitive and pH-responsive tannin-containing hydroxypropyl chitin hydrogel with long-lasting antibacterial activity for wound healing. Carbohydr Polym. 2020;15;236:116096. |
| [1] | Zhu Weiwei, Fan Zhengchao, Xu Ying, Xia Jizhu, Zhao Xiangzhi. Dual-modality imaging bionic nanoparticles for sonodynamic therapy on medullary thyroid carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3410-3419. |
| [2] | Feng Shuqi, Zhang Shiyong, Yao Keyi, Tang Yufei, Wang Kai, Zhou Xuemei, Xiang Lin. Application of photoresponsive nanomaterials in bone tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3469-3475. |
| [3] | hang Zining, Deng Ronghui, Yu Jiakuo. Alleviation of oxidative stress damage in chondrocytes by a new Mn-containing bioceramic powder [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3335-3342. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||

