Chinese Journal of Tissue Engineering Research ›› 2019, Vol. 23 ›› Issue (14): 2261-2268.doi: 10.3969/j.issn.2095-4344.1649
Previous Articles Next Articles
Allogeneic and xenogeneic tissue repair materials: how to choose a suitable virus inactivation process
Bai Yulong1, 2, Gao Yufeng1, 2, Zhong Hongbin1, 2, Zhao Yantao1, 2, Guo Ruizhou1, 2, Li Li1, 2
- 1 Department of Orthopedics, First Affiliated Hospital of the General Hospital of PLA, Beijing 100048, China; 2Beijing Engineering Research Center of Orthopedics Implants, Beijing 100048, China
-
Received:2018-12-17Online:2019-05-18Published:2021-04-28 -
Contact:Zhao Yantao, Associate researcher, Department of Orthopedics, First Affiliated Hospital of the General Hospital of PLA, Beijing 100048, China; Beijing Engineering Research Center of Orthopedics Implants, Beijing 100048, China -
About author:Bai Yulong, Department of Orthopedics, First Affiliated Hospital of the General Hospital of PLA, Beijing 100048, China; Beijing Engineering Research Center of Orthopedics Implants, Beijing 100048, China -
Supported by:the National Natural Science Foundation of China, No. 81672130 (to ZYT [principal investigator] and BYL [participant]); Beijing Municipal Science and Technology Plan Program, No. Z171100002217013 (to ZHB [principal investigator] and BYL [participant]); and Military Medical Project, No. AWS14C007 (to ZHB [participant], ZYT [participant] and LL [participant])
CLC Number:
Cite this article
Bai Yulong, Gao Yufeng, Zhong Hongbin, Zhao Yantao, Guo Ruizhou, Li Li. Allogeneic and xenogeneic tissue repair materials: how to choose a suitable virus inactivation process[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(14): 2261-2268.
share this article
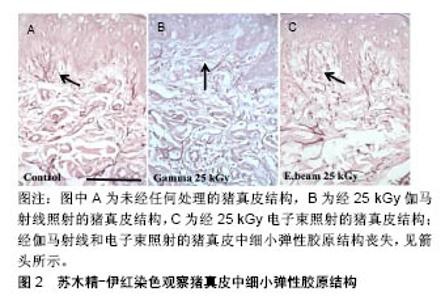
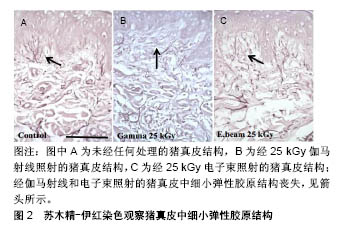
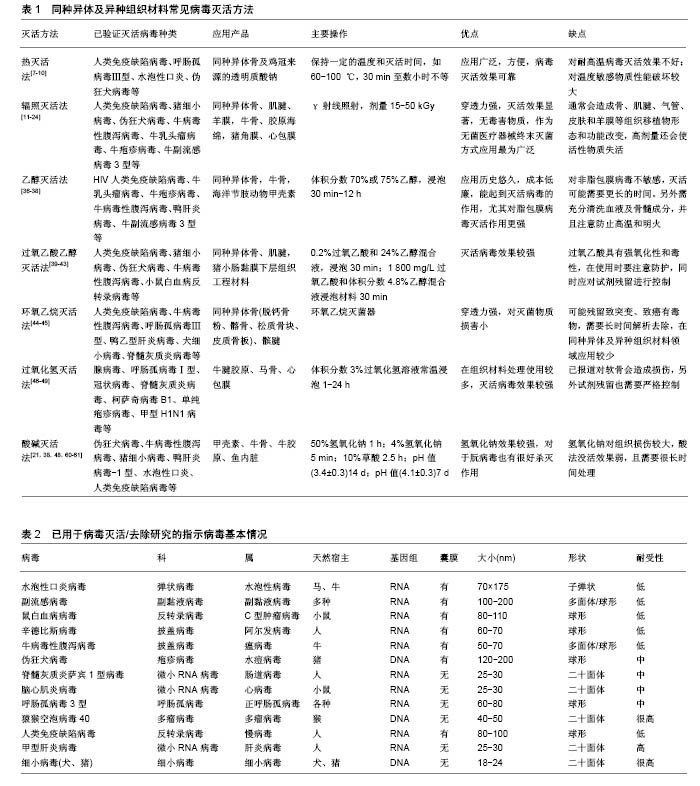
2.1 病毒灭活方法 2.1.1 热灭活法 热灭活法主要包括湿热灭活法和干热灭活法,该方法不引入任何的化学试剂,仅需控制温度和时间,使病毒结构组成发生变化即可达到灭活病毒的目的。具有代表性的如巴氏消毒法,其在牛奶消毒和血液制品病毒灭活中得到了广泛引用,近年来也有研究者将该方法应用于同种异体及动物源性组织的病毒灭活。朱加亮等[7]将染人类免疫缺陷病毒Ⅰ型病毒的同种异体骨于60 ℃恒温水浴锅中浸泡10 h,发现人类免疫缺陷病毒Ⅰ型病毒滴度下降了5.67 log。Kode等[8]应用巴氏消毒法(60-65 ℃,40 min)处理术中切取得的骨肉瘤标本,通过体内外实验证明了该方法能够有效杀死肿瘤细胞,可用于治疗大段骨缺损。任彩霞等[9]采用80- 90 ℃蒸汽对鸡冠来源的透明质酸钠进行了病毒灭活处理,发现处理2 h后,呼肠孤病毒Ⅲ型、伪狂犬病毒、水泡性口炎病毒和猴空泡病毒40滴度下降均超过5 log,可作为医用透明质酸钠制备过程中的有效病毒灭活工艺。需要注意的是在应用该方法进行病毒灭活时,需要充分清洗去除原材料中的血液成分,同时对于温度敏感型生物材料应尽量避免使用该方法。 干热灭活法主要针对一些冻干产品进行热处理,从而达到灭活病毒效果,常用的温度为65,80,90,100 ℃,时间为30 min到数小时不等[10]。这种方法对生物源性组织修复材料会造成一定热损伤破坏材料性能,故未见在同种异体和动物源性组织修复材料病毒灭活应用的报道。 2.1.2 辐照灭活法 γ射线辐照是目前应用最为广泛的终末灭菌法,其穿透力强,能够破坏微生物核酸分子结构,最终导致微生物死亡[11-12]。γ射线辐照灭活病毒的效果与照射剂量密切相关。早期研究表明,低温下(-60 ℃)经过低剂量(11.6-12.9 kGy)γ射线辐照后,同种异体肌腱材料上负载的人类免疫缺陷病毒Ⅰ型、猪细小病毒、伪狂犬病毒和牛病毒性腹泻病毒滴度下降log值分别为2.90,1.90,3.80,2.57;同种异体骨材料负载的人类免疫缺陷病毒Ⅰ型、猪细小病毒、伪狂犬病毒和牛病毒性腹泻病毒滴度下降log值分别为3.20,1.58,3.79,4.56[13]。表明11.6-12.9 kGy病毒灭活效果较差,只能有效灭活同种异体骨牛病毒性腹泻病毒。Knaepler 等[14]报道15 kGy即可杀灭同种异体松质骨人类免疫缺陷病毒Ⅰ型病毒,但该剂量显然存在诸多争议。Fideler等[15]对同种异体髌腱-骨移植物人类免疫缺陷病毒Ⅰ型灭活研究结果发现,辐照剂量为20-25 kGy时不能破坏人类免疫缺陷病毒Ⅰ型的基因,而当辐照剂量上升为30-40 kGy时病毒被彻底灭活。Campbell等[16]研究结果与Fideler等的报道相同,在-70 ℃条件下,35 kGy照射能够灭活同种异体骨人类免疫缺陷病毒Ⅰ型。刘思扬等[17]报道了常温状态下25 kGy辐照能够使人羊膜材料中污染的人类免疫缺陷病毒Ⅰ型病毒滴度下降6.5log以上,可完全灭活人类免疫缺陷病毒Ⅰ型。赵彦涛等[18]利用γ射线对同种异体肌腱进行病毒灭活,发现25 kGy照射后人类免疫缺陷病毒Ⅰ型病毒滴度下降超过4 log值。γ射线能够彻底灭活人类免疫缺陷病毒Ⅰ型的剂量存在一些争议,可能与原材料自身性质如组成、厚度、尺寸大小等相关,另外照射时样本所处的温度环境也会对病毒灭活效果产生重要影响[12,19-20]。 对于人类免疫缺陷病毒Ⅰ型以外的其他病毒,γ射线辐照灭活的作用则比较明确,一般25 kGy即可彻底灭活病毒。Lee等[21]利用25 kGy照射染毒的牛骨,发现经辐照后牛乳头瘤病毒、牛疱疹病毒、牛病毒性腹泻病毒、牛副流感3型病毒的病毒滴度下降均超过5 log值,能够彻底灭活病毒。王建锋[22]采用γ射线辐照法对染毒的猪来源板层角膜进行病毒灭活,发现辐照剂量为10 kGy时已检测不到病毒,将辐照剂量为10,15,20,25 kGy的样本盲传3代后均未检出病毒。张伟[23]、蒋丽霞等[24]分别采用25 kGy剂量对染毒的脱细胞猪心包膜、牛跟腱来源的胶原海绵及猪来源的板层角膜进行辐照,也彻底灭活了所负载的病毒。 辐照灭菌技术通常会对生物组织修复材料的性能造成损失。大量证据表明,γ射线灭菌会导致骨、肌腱、气管、皮肤和羊膜等组织移植物的形态和功能改变,这种影响通常与照射剂量正相关[25-35]。Allaveisi等[26]研究发现,50 kGy照射剂量能够导致同种异体皮质骨极限拉伸强度下降28%左右,并且通过扫描电镜观察到在该照射剂量下皮质骨胶原基质表面发生了断裂。除了会导致同种异体骨的力学性能降低,高剂量辐照还会导致骨中生物活性物质骨形态发生蛋白和转化生长因子β等失活,进而影响材料的骨重塑能力[27-28]。25 kGy及更高剂量辐照同样对同种异体肌腱刚度和极限拉伸载荷带来不利影响[29-31],这种不利影响反应在临床上则表现为同种异体肌腱移植物松动、旋转、断裂等[32-34]。辐照灭菌同样对皮肤和羊膜组织有不同程度的损伤,主要表现为基底膜和胶原纤维结构被破坏。Mrázová等[35]对比研究了不同剂量伽马射线和电子束辐照对同种异体及异种皮肤和羊膜的影响,发现伽马射线辐照剂量为25 kGy时,通过苏木精-伊红染色发现皮肤中细小纤维结构丧失,35 kGy时皮肤和羊膜结构损伤较为显著,在电子束辐照剂量为50 kGy组也观察到了同样的结果,见图2。"
2.1.3 乙醇灭活法 乙醇是医疗领域应用最为广泛的一种消毒剂,在同种异体及动物源性组织材料生产制备及保存中也有着悠久的应用历史,其作用机制主要是使蛋白变性沉淀。刘思扬等[36]报道利用体积分数75%乙醇完全浸泡30 min,可彻底灭活同种异体骨污染的人类免疫缺陷病毒Ⅰ型。衷鸿宾等[37]进一步证实了该方法对同种异体骨活性无不利影响。Lee等[21]利用体积分数70%乙醇浸泡染毒的牛骨30 min,发现牛乳头瘤病毒、牛疱疹病毒、牛病毒性腹泻病毒、人3型副流感病毒滴度下降均超过5 log值,表明该方法能够彻底灭活上述病毒。也有研究者结合实际生产工序验证了在海洋节肢动物甲壳素提取过程中,利用体积分数70%乙醇长时间(12,24 h)搅拌清洗对病毒灭活的效果,结果显示醇洗12 h后,伪狂犬病毒、猪细小病毒、牛病毒性腹泻病毒、鸭肝炎病毒-1型病毒滴度下降均超过了4 log[38]。 在应用乙醇对组织材料进行病毒灭活时,应该着重考虑乙醇对蛋白的变性作用,胶原类产品在经乙醇处理后性状改变可能较大。另外应该关注试剂管控问题,避免高温和明火。 2.1.4 过氧乙酸-乙醇法 过氧乙酸是一种广谱、高效杀菌剂,其强氧化性,可使细菌和病毒的蛋白质成分失活;加入乙醇后可降低溶液的表面张力,使消毒剂完全进入材料内部及孔隙中。Zhou等[39]利用0.2%过氧乙酸和24%乙醇混合液对染毒的同种异体肌腱进行病毒灭活,发现过氧乙酸乙醇浸泡5 min后,人类免疫缺陷病毒Ⅰ型即被彻底灭活,浸泡30 min后猪细小病毒、伪狂犬病毒、牛病毒性腹泻病毒病毒滴度下降超过6log,且该工序处理对肌腱力学性能无显著影响。刘明等[40]采用细胞感染法利用过氧乙酸-乙醇灭活同种骨植入材料中的病毒,结果表明10 g/L过氧乙酸与体积分数24%乙醇组成的消毒液常温下浸泡材料4 h,可将伪狂犬病毒、牛病毒性腹泻病毒、猪细小病毒滴度降低4个log值以上。过氧乙酸-乙醇也被用于同种异体骨病毒灭活,且研究表明该方法对同种异体骨的骨诱导活性、结构均没有显著影响[41-42]。过氧乙酸-乙醇灭活法在动物源性材料中也有应用。Hodde等[43]在猪小肠黏膜下层组织工程材料制备中应用过氧乙酸-乙醇进行病毒灭活,发现 1 800 mg/L过氧乙酸和体积分数4.8%乙醇混合液浸泡材料30 min即可彻底灭活猪细小病毒、小鼠白血病反转录病毒、伪狂犬病毒病毒,达到病毒灭活国际标准的要求。 过氧乙酸具有强氧化性,性状不稳定,易发生爆炸,在应用中应对其严格管控。除此之外,微量过氧乙酸仍具有一定细胞毒性,对于材料中的残留量应有严格的控制,以确保同种/异种组织移植的安全有效性。 2.1.5 环氧乙烷灭活法 环氧乙烷作为一种具有代表性的烷基化剂,能够作用于蛋白质、核酸分子中的巯基、氨基、羟基等,使上述基团发生烷基化反应,致生物大分子失活,最终杀灭微生物。环氧乙烷具有广谱杀菌性,是同种异体/异种移植物灭菌处理的常用方法之一。Moore等[44]利用环氧乙烷对同种异体脱钙骨粉、皮质骨、髂骨、松质骨块、髌腱进行病毒灭活处理,发现环氧乙烷处理7 h后能有效杀灭人类免疫缺陷病毒Ⅰ型、牛病毒性腹泻病毒、呼肠孤病毒Ⅲ型、鸭乙肝病毒、脊髓灰质炎病毒和犬细小病毒。周宗科等[45]研究了环氧乙烷处理对同种异体皮质骨板移植的影响,发现48 ℃环氧乙烷灭菌处理对山羊同种异体皮质骨板的生物活性没有影响。 环氧乙烷灭菌后可能残留致突变、致癌的有毒物质,因此需要长时间解析去除。随着辐照技术的发展,在同种异体及动物源性组织材料领域已很少使用该方法。 2.1.6 过氧化氢法 过氧化氢杀灭病毒的作用与过氧乙酸类似,均是由于其强氧化作用破坏了细菌细胞壁、蛋白质、核酸等的结构,从而杀灭细菌/病毒。报道称过氧乙酸溶液/蒸汽可杀灭腺病毒、鼻病毒1A、1B型、NEO-1、冠状病毒、脊髓灰质炎病毒等[46-47]。方哲翔等[48]在牛腱来源的医用胶原膜制备过程中采用体积分数3%过氧化氢24 ℃浸泡1 h进行病毒灭活,发现该法对脂包膜病毒有较强的灭活效果,水泡性口炎和伪狂犬病毒滴度下降均达到4log以上。Cusinato等[49]利用体积分数3%过氧化氢24 ℃条件下浸泡24 h,对马来源的骨和心包膜材料进行病毒灭活,发现单疱疹病毒滴度下降4.6log,甲型H1N1病毒滴度下降6log,柯萨奇病毒B1滴度下降6.4log,表明该方法可有效杀灭动物源性组织材料污染的上述病毒。 在应用该方法对组织材料进行病毒灭活时的注意事项,与应用过氧乙酸-乙醇法基本相同。另外,已报道过氧化氢通过生产氧自由基造成软骨细胞降解,同时还会抑制蛋白聚糖的合成,导致软骨损伤[50-53]。而过氧化氢通常对皮肤和肌腱等软组织不会造成显著的性能下降[54-55]。因此在应用该方法对同种异体骨/软骨材料进行病毒灭活时,应慎重考虑试剂浓度和作用时间。 2.1.7 酸碱法 酸法或碱法灭活病毒的原理是通过溶液的酸碱性破坏病毒分子的蛋白或核酸使之变性,使病毒失去侵染能力直至死亡。通常碱病毒灭活作用较强,世界卫生组织(WHO)推荐采用1 mol/L氢氧化钠溶液处理动物组织废料,以灭活疯牛病病毒,该方法可杀灭所有病原体[56]。杨倩等[38]将3批染毒的甲壳素经50%氢氧化钠80 ℃水浴1 h后检测病毒滴度,伪狂犬病毒、牛病毒性腹泻病毒、猪细小病毒、鸭肝炎病毒-1型平均灭活对数值分别为≥6.736 log、≥6.138 log、≥6.597 log和≥5.806 log,表明氢氧化钠处理是灭活病毒的有效方法。Lee等[21]利用4%氢氧化钠处理染毒的牛骨,5 min后便使得病毒滴度下降超过了4 log。在同种及异种组织清洗处理中,氢氧化钠清洗过程不但能够降低杀灭常规病毒,对于朊病毒的杀灭效果也非常彻底,同时该过程还能增强组织的生物相容性及血管重塑能力[57-59]。与碱法相比,酸法灭活病毒效果稍弱且通常需要更长的时间。王春雨等[60]采用10%草酸对染毒的鱼内脏组织处理 1.5 h,检测到病毒滴度有所下降,但并没有彻底灭活,在此基础上将样本继续用10%盐酸处理1 h后,病毒完全灭活。在另一项牛源胶原制品病毒灭活研究中,采用低pH值(3.4±0.3)孵放14 d后才将病毒彻底杀灭[48]。梁婧等[61]在对低pH孵放病毒灭活效果回顾性验证评价中报道,pH值为4.1±0.3、常温孵放7 d以上才能彻底灭活水泡性口炎、辛德毕斯病毒、伪狂犬病毒及HIV。 在同种及异种组织材料生产过程中,经常会用到碱性或者酸性试剂,一方面能够对组织进行抗原清除和脱钙,同时还能起到病毒灭活的作用,可根据实际情况选择适宜的浓度及处理时间。 2.1.8 其他方法 其他已见报道的病毒灭活方法还包括:S/D法、膜过滤法、亚甲基蓝光照射法等,在血液/生物制品领域得到了广泛应用[10,12,25,62-63]。但目前在生物组织材料领域应用较少,主要原因是血液、蛋白制品与生物组织材料存在本质差异,上述病毒灭活工序并不完全适用于固体材料。 另外,一些新型的灭菌技术,如超临界CO2萃取灭菌、低温等离子技术近年来在医疗领用应用较多,也见用于同种异体骨、肌腱和半月板清洗和灭菌,灭菌效果理想且对组织修复材料的损害较小[64-65],但该方法对病毒的杀灭效果未见报道。其他冷灭菌技术,如磁力灭菌技术、高压电产脉冲杀菌技术、脉冲强光杀菌技术在食品领域应用较广泛,在杀菌过程中不会产热或产热较少,有利于保留对温度敏感的活性成分,但是否可用于杀灭病毒还有待进一步研究。同种异体及异种组织修复材料常见病毒灭活方法,见表1。 2.2 病毒灭活工艺验证应注意的问题 2.2.1 指示病毒的选择 在选择指示病毒时应遵循以下几个原则:应首选实际使用同种异体或异种原材料中可能含有的病毒进行验证,如条件限制无法实现,也应该选择理化性质与之相近的病毒;选择的指示病毒需具有代表性(病毒大小、核酸类型及有无包膜),且至少需包括一种对生产工艺所涉及的物理和/或化学处理有明显抗性的病毒;指示病毒初始滴度需尽可能高(一般需≥109 L-1)[66]。表2为已用于病毒灭活/去除研究的指示病毒基本情况[64]。 2.2.2 病毒滴度降低系数要求 关于病毒灭活/去除效果的评价最早是在卫生部《消毒技术规范》(2002版)和《血液制品去除/灭活病毒技术方法及验证指导原则》(2002版)给出了评判标准:在对血液制品进行病毒灭活工艺验证时,当病毒滴度降低系数≥4 log值时,表明该病毒灭活工艺有效;如因实际检测方法限制导致病毒降低系数<4 log值时,应继续盲传3代,如无病毒检出,则也可认为病毒灭活工艺有效。 对于同种异体及异种组织修复材料病毒灭活效果评价,最初也是沿用该要求,后来在国家食品药品监督管理总局发布的《动物源性医疗器械注册技术审查指导原则(2017年修订版)》(2017年第224号)中进一步提出:一般来说,同种异体及异种医疗器械的生产过程中去除/灭活病毒的总降低系数宜达到6 log以上,并且原则上需至少有一个病毒去除/灭活步骤的降低系数达到4 log以上。但是,如果采用总降低系数达6 log的病毒灭活/去除工艺,将导致医疗器械产生不可接受的性能改变,则需要根据动物源性材料的来源、采集及处理过程控制情况及对患者的风险/受益分析来判断其可接受性,但其单一去除/灭活病毒步骤的降低系数仍需达到4 log以上。同时,还应该考虑病毒灭活动力学,优选能够快速灭活病毒的方法。"
| [1] Wubneh A,Tsekoura EK,Ayranci C,et al. Current state of fabrication technologies and materials for bone tissue engineering.Acta Biomater.2018;80:1-30.[2] Eagle MJ,Rooney P,Kearney JN.Production of an osteoinductive demineralised bone matrix powder without the use of organic solvents.Cell Tissue Bank.2015;16(3):433-441.[3] Su FY,Pang S,Ling Y,et al.Deproteinization of Cortical Bone: Effects of Different Treatments. Calcif Tissue Int. 2018;103(5): 554-566.[4] de Girolamo L,Ragni E,Cucchiarini M,et al.Cells, soluble factors and matrix harmonically play the concert of allograft integration.Knee Surg Sports Traumatol Arthrosc.2018. doi: 10.1007/s00167-018-5182-1.[Epub ahead of print] [5] Chaudhuri R,Ramachandran M,Moharil P,et al.Biomaterials and cells for cardiac tissue engineering: Current choices.Mater Sci Eng C Mater Biol Appl.2017;79:950-957.[6] Dasgupta A,Orgill D,Galiano RD,et al.A Novel Reticular Dermal Graft Leverages Architectural and Biological Properties to Support Wound Repair.Plast Reconstr Surg Glob Open.2016;4(10):e1065.[7] 朱加亮,刘思扬,衷鸿宾,等.巴氏法对异体骨中HIV病毒灭活效果的研究[J].中国骨肿瘤骨病,2011,10(3):249-251.[8] Kode J,Taur P,Gulia A,et al.Pasteurization of bone for tumour eradication prior to reimplantation - an in vitro & pre-clinical efficacy study.Indian J Med Res.2014;139(4): 585-597.[9] 任彩霞,范素俊,侯永泰.透明质酸钠原料病毒灭活/去除工艺的研究[J].安徽医药,2010,14 (10):1126-1128.[10] 陈柯君.浅析血液制品病毒灭活的研究进展[A].广东省药学会. 2016年广东省药师周大会论文集[C].广东省药学会:广东省药学会,2015:7.[11] 青莉芳,魏敏,杨平华,等.γ辐照食品灭菌的机理及微生物检测[J].食品研究与开发,2016,37(5):218-220.[12] Singh R,Singh D,Singh A.Radiation sterilization of tissue allografts: A review.World J Radiol. 2016;8(4):355-369.[13] Moore MA.Inactivation of enveloped and non-enveloped viruses on seeded human tissues by gamma irradiation.Cell Tissue Bank.2012;13(3):401-407.[14] Knaepler H,Koch F,Bugany H.Studies on HIV inactivation in allogeneic bone transplants using chemical disinfection and radioactive irradiation.Unfallchirurgie.1992;18(1):1-6.[15] Fideler BM,Vangsness CJ,Moore T,et al.Effects of gamma irradiation on the human immunodeficiency virus. A study in frozen human bone-patellar ligament-bone grafts obtained from infected cadavera.J Bone Joint Surg Am. 1994;76(7): 1032-1035.[16] Campbell DG, Li P. Sterilization of HIV with irradiation: relevance to infected bone allografts. Aust N Z J Surg. 1999; 69(7):517-521. [17] 刘思扬,庄道民,董如华,等.钴(60)辐照法对生物羊膜中人类免疫缺陷病毒灭活效果的研究[J].中国消毒学杂志, 2015,32(3): 217-218,221.[18] 赵彦涛,刘思扬,尹惠琼,等.γ射线终末辐照对同种异体肌腱病毒灭活效果及生物力学性能影响的研究[J].中国骨与关节杂志, 2018,7(5):389-393.[19] Hernigou P,Gras G,Marinello G,et al.Inactivation of HIV by application of heat and radiation: implication in bone banking with irradiated allograft bone.Acta Orthop Scand. 2000;71(5): 508-512.[20] Andriola Silva Brun-Graeppi AK, Richard C,Bessodes M,et al. The effect of sterilization methods on the thermo-gelation properties of xyloglucan hydrogels.Polym Degrad Stab. 2010; 95(2):254-259.[21] Lee KI,Lee JS,Jung HH,et al.Inactivation of enveloped and non-enveloped viruses in the process of chemical treatment and gamma irradiation of bovine-derived grafting materials. Xenotransplantation.2012;19(6):365-369.[22] 王剑锋,英志芳,徐康维,等.板层人工角膜辐照法病毒灭活验证方法的建立及灭活效果验证[J].微生物学免疫学进展, 2018,46(4): 40-43.[23] 张伟,潘洁丽,钱垂文,等.钴60-γ射线辐照对动物源性膜材指示病毒灭活效果的验证[J].中国卫生检验杂志, 2015,25(16): 2666-2668.[24] 蒋丽霞.胶原蛋白海绵病毒灭活/去除工艺的研究[J].中国修复重建外科杂志,2013,27(7):885-888.[25] Harrell CR,Djonov V,Fellabaum C,et al.Risks of Using Sterilization by Gamma Radiation: The Other Side of the Coin.Int J Med Sci.2018;15(3):274-279.[26] Allaveisi F,Mirzaei M.Effects of high-dose gamma irradiation on tensile properties of human cortical bone: Comparison of different radioprotective treatment methods.J Mech Behav Biomed Mater. 2016;61:475-483.[27] Qiu QQ,Connor J.Effects of gamma-irradiation,storage and hydration on osteoinductivity of DBM and DBM/AM composite. J Biomed Mater Res A.2008;87(2):373-379.[28] Alanay A,Wang JC,Shamie AN,et al.A novel application of high-dose (50kGy) gamma irradiation for demineralized bone matrix: effects on fusion rate in a rat spinal fusion model.Spine J. 2008;8(5):789-795.[29] Hoburg A,Keshlaf S,Schmidt T,et al.High-dose electron beam sterilization of soft-tissue grafts maintains significantly improved biomechanical properties compared to standard gamma treatment. Cell Tissue Bank.2015;16(2):219-226.[30] Baldini T,Caperton K,Hawkins M,et al.Effect of a novel sterilization method on biomechanical properties of soft tissue allografts.Knee Surg Sports Traumatol Arthrosc. 2016;24(12): 3971-3975.[31] Hangody G,Szebenyi G,Abonyi B,et al.Does a different dose of gamma irradiation have the same effect on five different types of tendon allografts? - a biomechanical study.Int Orthop. 2017;41(2):357-365.[32] Tian S,Ha C,Wang B,et al.Arthroscopic anatomic double-bundle ACL reconstruction using irradiated versus non-irradiated hamstring tendon allograft.Knee Surg Sports Traumatol Arthrosc. 2017;25(1):251-259.[33] Sun K,Zhang J,Wang Y,et al.Arthroscopic anterior cruciate ligament reconstruction with at least 2.5 years' follow-up comparing hamstring tendon autograft and irradiated allograft.Arthroscopy. 2011;27(9):1195-1202.[34] DiBartola AC,Everhart JS,Kaeding CC,et al.Maximum load to failure of high dose versus low dose gamma irradiation of anterior cruciate ligament allografts:A meta-analysis. Knee. 2016;23(5):755-762.[35] Mrázová H,Koller J,Kubisova K,et al.Comparison of structural changes in skin and amnion tissue grafts for transplantation induced by gamma and electron beam irradiation for sterilization.Cell Tissue Bank.2016;17(2):255-260.[36] 刘思扬,庄道民,董如华,等.酒精对同种骨植入材料中人类免疫缺陷病毒灭活效果的研究[J].中国消毒学杂志,2009,26(6): 615-617.[37] 衷鸿宾,白玉龙,赵彦涛,等.75%酒精超声清洗工艺对同种脱钙骨基质性能的影响[J].中国骨与关节损伤杂志, 2015,30(12): 1296-1298.[38] 杨倩,宋战昀,张旭光,等.羧甲基壳聚糖病毒灭活/去除工艺验证[J].中国生物制品学杂志,2016,29(5):533-537.[39] Zhou M,Zhang N,Liu X,et al.Tendon allograft sterilized by peracetic acid/ethanol combined with gamma irradiation.J Orthop Sci.2014;19(4):627-636. [40] 刘明,张旗,王蕊.过氧乙酸-乙醇对同种骨植入材料中病毒的灭活效果研究[J].中国消毒学杂志,2010,27(3):241-243.[41] 李雄涛,余国荣,余黎,等.过氧乙酸-乙醇联合辐照灭菌对脱钙骨基质成骨诱导活性的影响[J].生物骨科材料与临床研究, 2018, 15(1):1-4.[42] Rauh J,Despang F,Baas J,et al.Comparative biomechanical and microstructural analysis of native versus peracetic acid-ethanol treated cancellous bone graft.Biomed Res Int. 2014;2014:784702.[43] Hodde J,Hiles M.Virus safety of a porcine-derived medical device: evaluation of a viral inactivation method.Biotechnol Bioeng.2002;79(2):211-216.[44] Moore TM,Gendler E,Gendler E.Viruses adsorbed on musculoskeletal allografts are inactivated by terminal ethylene oxide disinfection.J Orthop Res. 2004;22(6): 1358-1361.[45] 周宗科,裴福兴,屠重棋,等.环氧乙烷处理同种异体皮质骨板移植组织学研究[J].生物骨科材料与临床研究,2004,1(4):1-4.[46] 施坚.双氧水灭活病毒[J].国外医学.生物制品分册, 1979,2(1): 45-46.[47] 陆烨,陆龙喜,李晔,等.汽化过氧化氢对不同空间消毒效果观察[J].中华医院感染学杂志,2015,25(11):2626-2628.[48] 方哲翔,王建华,袁平,等.医用胶原修复膜病毒灭活/去除工艺的验证和评价[J].中国生物制品学杂志,2016,29(12):1341-1345.[49] Cusinato R,Pacenti M,Martello T,et al.Effectiveness of hydrogen peroxide and electron-beam irradiation treatment for removal and inactivation of viruses in equine-derived xenografts. J Virol Methods.2016;232:39-46.[50] 杨朋,胡晓青,傅欣,等.过氧化氢体外诱导人关节软骨细胞外基质降解研究[J].中国运动医学杂志,2017,36(4):306-311.[51] 王超.双氧水对关节软骨损害的实验研究[D].长春:吉林大学, 2012.[52] Cicek E.Hydrogen peroxide induced oxidative damage on mechanical properties of the articular cartilage.Acta Biol Hung. 2017;68(4):368-375.[53] Ouyang X,Wei B,Hong SD,et al.Study on the Mechanisms of Cartilage Tissue Damage Caused by Hydrogen Peroxide.Cell Biochem Biophys.2015;72(2):343-348.[54] Gardner EM,VonderHeide N,Fisher R,et al.Effect of hydrogen peroxide on human tendon allograft.Cell Tissue Bank.2013; 14(4):667-671.[55] Leow-Dyke SF,Rooney P,Kearney JN.The efficacy and sterilisation of human decellularised dermal allografts with combinations of cupric ions and hydrogen peroxide.Cell Tissue Bank. 2017;18(4):561-572.[56] WHO.Decontamination methods for transmissible spongiform encephalopathies. Report of a WHO consultation, Geneva,Switzerland,23-26 march 1999.In: WHO infection control guidelines for transmissible spongiform encephalopathies.WHO/CDS/CSR/APH/2000.3;2009:29-32.[57] van Steenberghe M,Schubert T,Guiot Y,et al.Enhanced vascular biocompatibility of decellularized xeno-/allogeneic matrices in a rodent model.Cell Tissue Bank. 2017;18(2): 249-262.[58] van Steenberghe M,Schubert T,Xhema D,et al.Enhanced vascular regeneration with chemically/physically treated bovine/human pericardium in rodents.J Surg Res. 2018;222: 167-179.[59] Fawzi-Grancher S,Goebbels RM,Bigare E,et al.Human tissue allograft processing: impact on in vitro and in vivo biocompatibility.J Mater Sci Mater Med. 2009;20(8): 1709-1720.[60] 王春雨,徐琳凯,李超,等.工艺处理过程中病毒的灭活效果研究[J].实验动物科学,2015,32(2):15-17.[61] 梁婧,张潇文,李策生,等.低pH孵放病毒灭活效果回顾性验证评价[J].中国输血杂志,2016,29(9):915-917.[62] Squillace DM,Zhao Z,Call GM,et al.Viral Inactivation of Human Osteochondral Grafts with Methylene Blue and Light. Cartilage.2014;5(1):28-36.[63] Shirasaki N,Matsushita T,Matsui Y,et al.Assessment of the efficacy of membrane filtration processes to remove human enteric viruses and the suitability of bacteriophages and a plant virus as surrogates for those viruses.Water Res. 2017; 115:29-39.[64] Huang Q,Ingham E,Rooney P,et al.Production of a sterilised decellularised tendon allograft for clinical use.Cell Tissue Bank.2013;14(4):645-654.[65] Bui D,Lovric V,Oliver R,et al.Meniscal allograft sterilisation: effect on biomechanical and histological properties.Cell Tissue Bank.2015;16(3):467-475.[66] 国家食品药品监督管理总局.动物源性医疗器械注册技术审查指导原则(2017年修订版)[S],2017年第224号. |
| [1] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [2] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [3] | Xu Dongzi, Zhang Ting, Ouyang Zhaolian. The global competitive situation of cardiac tissue engineering based on patent analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 807-812. |
| [4] | Wu Zijian, Hu Zhaoduan, Xie Youqiong, Wang Feng, Li Jia, Li Bocun, Cai Guowei, Peng Rui. Three-dimensional printing technology and bone tissue engineering research: literature metrology and visual analysis of research hotspots [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 564-569. |
| [5] | Chang Wenliao, Zhao Jie, Sun Xiaoliang, Wang Kun, Wu Guofeng, Zhou Jian, Li Shuxiang, Sun Han. Material selection, theoretical design and biomimetic function of artificial periosteum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 600-606. |
| [6] | Liu Fei, Cui Yutao, Liu He. Advantages and problems of local antibiotic delivery system in the treatment of osteomyelitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 614-620. |
| [7] | Li Xiaozhuang, Duan Hao, Wang Weizhou, Tang Zhihong, Wang Yanghao, He Fei. Application of bone tissue engineering materials in the treatment of bone defect diseases in vivo [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 626-631. |
| [8] | Zhang Zhenkun, Li Zhe, Li Ya, Wang Yingying, Wang Yaping, Zhou Xinkui, Ma Shanshan, Guan Fangxia. Application of alginate based hydrogels/dressings in wound healing: sustained, dynamic and sequential release [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 638-643. |
| [9] | Chen Jiana, Qiu Yanling, Nie Minhai, Liu Xuqian. Tissue engineering scaffolds in repairing oral and maxillofacial soft tissue defects [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 644-650. |
| [10] | Li Jun, Zuo Xinhui, Liu Xiaoyuan, Zhang Kai, Han Xiangzhen, He Huiyu, . Effect of over expression of miR-378a on osteogenic and vascular differentiation of bone marrow mesenchymal stem cell sheet [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(31): 4939-4944. |
| [11] | Xing Hao, Zhang Yonghong, Wang Dong. Advantages and disadvantages of repairing large-segment bone defect [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(3): 426-430. |
| [12] | Chen Siqi, Xian Debin, Xu Rongsheng, Qin Zhongjie, Zhang Lei, Xia Delin. Effects of bone marrow mesenchymal stem cells and human umbilical vein endothelial cells combined with hydroxyapatite-tricalcium phosphate scaffolds on early angiogenesis in skull defect repair in rats [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3458-3465. |
| [13] | Wang Hao, Chen Mingxue, Li Junkang, Luo Xujiang, Peng Liqing, Li Huo, Huang Bo, Tian Guangzhao, Liu Shuyun, Sui Xiang, Huang Jingxiang, Guo Quanyi, Lu Xiaobo. Decellularized porcine skin matrix for tissue-engineered meniscus scaffold [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3473-3478. |
| [14] | Mo Jianling, He Shaoru, Feng Bowen, Jian Minqiao, Zhang Xiaohui, Liu Caisheng, Liang Yijing, Liu Yumei, Chen Liang, Zhou Haiyu, Liu Yanhui. Forming prevascularized cell sheets and the expression of angiogenesis-related factors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3479-3486. |
| [15] | Liu Chang, Li Datong, Liu Yuan, Kong Lingbo, Guo Rui, Yang Lixue, Hao Dingjun, He Baorong. Poor efficacy after vertebral augmentation surgery of acute symptomatic thoracolumbar osteoporotic compression fracture: relationship with bone cement, bone mineral density, and adjacent fractures [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3510-3516. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||