Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (28): 6118-6126.doi: 10.12307/2025.482
Previous Articles Next Articles
Application of graphene oxide in field of oral implant restoration
Shi Chunrong, He Jiaxu, Deng Lishan, Wang Hailan, Zhao Aimin, Yu Yiling, Geng Haixia, Song Weijun
- School of Stomatology, Jining Medical University, Jining 272000, Shandong Province, China
-
Received:2024-06-22Accepted:2024-08-27Online:2025-10-08Published:2024-12-09 -
Contact:Song Weijun, MS, School of Stomatology, Jining Medical University, Jining 272000, Shandong Province, China -
About author:Shi Chunrong, School of Stomatology, Jining Medical University, Jining 272000, Shandong Province, China -
Supported by:Jining City Key Research and Development Project, No. 2023YXNS214 (to GHX)
CLC Number:
Cite this article
Shi Chunrong, He Jiaxu, Deng Lishan, Wang Hailan, Zhao Aimin, Yu Yiling, Geng Haixia, Song Weijun. Application of graphene oxide in field of oral implant restoration[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6118-6126.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
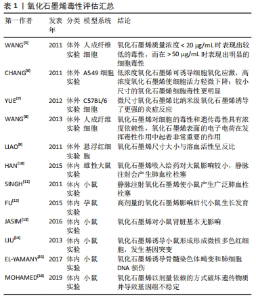
2.1 氧化石墨烯的生物相容性 生物相容性是指生物材料应用于人体后可以耐受宿主各系统的作用而保持相对稳定,不被排斥和破坏的生物学特性。氧化石墨烯作为种植体材料应用于人体要求具有良好的生物相容性,能够与人体组织相互作用而产生平衡且稳定的影响。该文将从组织相容性(包括毒性、免疫炎症反应和细胞黏附作用)和血液相容性两方面评估氧化石墨烯的生物相容性。 2.1.1 氧化石墨烯的组织相容性 (1)氧化石墨烯毒性评估:种植体植入后将与口腔软硬组织长期接触,因此,在新型材料进一步应用于口腔种植修复之前必须对其毒性进行评估,探究其在应用于人体后是否会对人体造成短期或长期损害。该文总结氧化石墨烯在体内和体外的毒性作用以及产生毒性的机制,为其在种植领域的进一步发展提供了参考,见表1。"

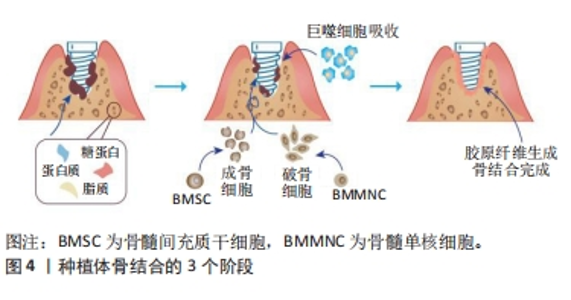
氧化石墨烯体外毒性评估:①氧化石墨烯对细胞的毒性作用具有剂量依赖性:WANG等[5]实验研究表明,氧化石墨烯在质量浓度< 20 μg/mL时对人成纤维细胞表现出较低的毒性,细胞存活率在80%以上;在质量浓度大于50 μg/mL时表现出明显的细胞毒性,具体表现为降低细胞黏附、诱导细胞凋亡及进入溶酶体、线粒体、内质网和细胞核等。CHANG等[6]研究结果表明,氧化石墨烯几乎不进入细胞,对A549细胞无明显毒性,但氧化石墨烯可呈剂量依赖性诱导细胞氧化应激,高浓度氧化石墨烯可诱导细胞活力轻微下降。因此,低浓度氧化石墨烯具有良好的生物相容性,具有作为细胞生长基质的潜力。②氧化石墨烯横向尺寸对细胞毒性反应具有显著的调节作用。YUE等[7]实验研究表明,与纳米级氧化石墨烯相比,微尺寸氧化石墨烯在细胞内诱导的炎症反应更强,而纳米尺寸的石墨烯片表现出更好的生物相容性。CHANG等[6]研究表明,与较大尺寸的氧化石墨烯相比,较小尺寸的氧化石墨烯在A549细胞中引起的氧化应激更严重,并且诱导的细胞毒性更明显。③氧化石墨烯表面的电子电荷在对细胞毒性反应中起着非常重要的作用。WANG等[8]实验研究表明,氧化石墨烯以浓度依赖的方式诱导了活性氧生成,活性氧的积累抵抗了细胞抗氧化酶(如超氧化物歧化酶)的防御作用,多余的自由基会与蛋白质和膜脂相互作用,从而破坏蛋白质和膜脂,而抗氧化剂可以逆转氧化石墨烯对人成纤维细胞的毒性作用,表明氧化应激可能是氧化石墨烯造成毒性反应的重要原因。LIAO等[9]通过测量悬浮红细胞的血红蛋白流出量来衡量细胞毒性大小,结果表明,在最小尺寸下氧化石墨烯表现出最大的溶血活性,而聚集的石墨烯薄片表现出最低的溶血活性,壳聚糖包覆的氧化石墨烯几乎消除了溶血活性,氧化石墨烯的细胞毒性反应是由于其表面带负电的氧基团与红细胞外膜上带正电的磷脂酰胆碱之间的强静电相互作用。由以上研究结论可以得出,氧化石墨烯虽然存在一定的毒性,但可通过控制剂量、横向尺寸及对表面电荷的修饰来降低材料毒性,使氧化石墨烯有望作为一种新型种植材料应用于口腔种植修复领域。 氧化石墨烯体内毒性评估:①对呼吸系统的毒性与给药途径有关。通过单次吸入氧化石墨烯的给药方式对实验模型的影响十分有限,而通过静脉注射氧化石墨烯可诱导实验模型产生广泛的肺血栓栓塞。HAN等[10]使用雄性大鼠和单次6 h的纯鼻吸入技术来检测氧化石墨烯对肺部的影响,发现在14 d的恢复期后对大鼠几乎无影响,仅在高浓度组肺组织病理学检查中观察到肺泡巨噬细胞摄取氧化石墨烯。SINGH等[11]实验研究表明,静脉注射氧化石墨烯使小鼠产生了广泛的肺血栓栓塞。②对消化系统的毒性与给药剂量有关。FU等[12]给孕鼠口服2种不同剂量的氧化石墨烯,观察氧化石墨烯对孕鼠体内胎儿发育的潜在毒性,结果表明,高剂量组子代发育迟缓,子鼠的体质量、体长和尾长增长受到明显抑制作用,同时子鼠肠绒毛长度明显减少。③氧化石墨烯对泌尿系统基本无毒性,不会诱导任何急性肾毒性或肾小球屏障功能障碍。JASIM等[13]研究发现,注射高剂量氧化石墨烯于小鼠体内,1个月后血清和尿液分析显示肾脏功能没有损害,组织学检查未见肾小球及肾小管区损伤,透射电镜超微结构分析显示无损伤,足细胞狭缝大小、内皮细胞窗、肾小球基底膜宽度均无变化。④氧化石墨烯毒性具有致突变性和遗传毒性。LIU等[14]以4 mg/kg剂量连续5 d向小鼠静脉注射氧化石墨烯后,发现可以明显诱导形成微核多色红细胞,在体外实验中发现氧化石墨烯可在分子水平上干扰DNA复制并诱导其发生改变。EL-YAMANY等[15]研究发现,氧化石墨烯可诱导小鼠骨髓染色体畸变和肺细胞DNA损伤。MOHAMED等[16]研究发现,以10,20或40 mg/kg的剂量注射纳米氧化石墨烯颗粒1 d或连续5 d显著增加DNA断裂,以剂量依赖的方式破坏遗传物质并导致基因组不稳定;还可诱导p53(外显子6和7)和早老素(外显子5)基因突变,增加p53蛋白的表达;肝(肝实质)和脑(大脑、小脑和海马)切片p53反应阳性,p53免疫染色显著升高。 氧化石墨烯的毒性产生可能机制:培养基中的氧化石墨烯附着在人体细胞表面,向细胞提供刺激信号,该信号在细胞和细胞核内转导,引发黏附相关基因及相应黏附蛋白下调,致使细胞黏附降低,导致细胞脱落、浮起、体积缩小。同时,氧化石墨烯通过内吞途径进入细胞质,主要位于溶酶体、线粒体、内质和细胞核,可能干扰细胞能量代谢和基因转录翻译过程,最终导致细胞凋亡或死亡[5,17-18]。 氧化石墨烯对细胞和个体的毒性作用是限制其在医疗领域使用的一个重要因素,如何降低或消除氧化石墨烯的毒性仍然是一个具有挑战性的任务。目前普遍认为氧化石墨烯具有较低的细胞毒性,但对细胞毒性产生的机制尚无共识。 (2)氧化石墨烯的炎症反应:生物材料应用于人体前需对其在人体内发生的炎症反应或异物反应程度进行评估。研究发现,氧化石墨烯横向尺寸在细胞和动物实验中对激活巨噬细胞和促进炎症反应发挥着关键作用。MA等[19]分别从细胞和动物层面展开研究,发现20 μg/mL氧化石墨烯作用于J774.A1巨噬细胞24 h后促炎性因子mRNA表达量与氧化石墨烯横向尺寸呈一定的相关性,促炎因子表达量由低到高的顺序为最小尺寸的氧化石墨烯<中间尺寸的氧化石墨烯<最大尺寸的氧化石墨烯;在动物实验中发现,最大尺寸氧化石墨烯诱导的炎症反应明显高于最小尺寸氧化石墨烯,同时不同尺寸氧化石墨烯促炎作用具有显著差异:最大尺寸的氧化石墨烯容易被质膜吸附并激活核因子κB通路,而最小尺寸的氧化石墨烯则主要被巨噬细胞吸收。YUE等[7]研究发现,虽然微尺寸氧化石墨烯与纳米级氧化石墨烯被巨噬细胞摄取量相同,但微尺寸氧化石墨烯引发的炎症反应更强。由此说明,调整氧化石墨烯的横向尺寸可以降低抗原性、减弱炎症反应强度,增加其在生物体内的相容性,使氧化石墨烯未来作为新型口腔材料应用于种植修复领域更加安全。 (3)氧化石墨烯促进细胞黏附作用:当生物材料与细胞接触后具有细胞黏附多、悬浮死亡细胞少的特点时,说明材料具有良好的生物相容性。细胞黏附指单个细胞黏附到另一个细胞或其他一些无生命体表面的能力,是一个细胞最基本的生命活动,在细胞增殖、维持活性、分化和迁移中具有关键作用,一旦细胞黏附发生异常就会出现严重的病理变化,包括肿瘤的增殖、转移和抵抗凋亡等。氧化石墨烯可以促进细胞的黏附与增殖。魏常博等[20]分别以0.1,0.5,2.5,12.5和62.5 μg/mL氧化石墨烯通过序贯培养和联合培养2种方法来培养牙髓干细胞,发现在序贯培养中,一定质量浓度范围内的氧化石墨烯能够以浓度依赖的方式提高牙髓干细胞的黏附和增殖能力,并且低质量浓度氧化石墨烯可以促进成骨相关蛋白表达。冯曦等[21]将大鼠施万细胞分别接种于未经处理的光滑钛片、喷砂酸蚀后的钛片和不同浓度氧化石墨烯溶液制备后的钛片上,发现氧化石墨烯修饰的钛表面可以促进施万细胞的黏附与增殖,其中以0.25 mg/mL氧化石墨烯溶液涂层组最为显著。细胞黏附性是确保组织结构完整性的核心前提,在调控细胞迁移和功能表现方面起着决定性作用。氧化石墨烯能够促进细胞的黏附与增殖,具有良好的生物相容性。 2.1.2 血液相容性 材料与血液长期接触时是否发生反应是血液接触性生物材料所面临的主要问题。氧化石墨烯进入血液时可能会直接或间接接触到血液中的血浆和血细胞,检测氧化石墨烯的血液相容性对评价其生物安全性具有重要意义。LIAO等[9]研究表明,较小尺寸氧化石墨烯比较大尺寸氧化石墨烯表现出更高的溶血活性,而壳聚糖覆盖氧化石墨烯薄片后消除了溶血活性,具有更优的血液相容性。血液与材料相互作用后血浆蛋白吸附是阻塞性凝血的主要原因,其中白蛋白和蛋白原是调节血液-材料相互作用的2种重要蛋白。KENRY等[22]通过评估血浆蛋白吸附作用来测定氧化石墨烯的血液相容性,研究发现氧化石墨烯对白蛋白和蛋白原均具有较高的负载能力,同时不会破坏白蛋白的整体二级结构和构象稳定性,证明了白蛋白功能化氧化石墨烯具有减少血凝块和血栓形成的作用。 2.2 氧化石墨烯与种植区周围软硬组织形成良好结合 种植体与缺牙区牙槽骨及周围牙龈组织形成良好的骨结合和龈结合,是口腔种植的生物学基础。 2.2.1 与骨组织结合 埋植在活骨内的种植体与牙槽骨之间直接接触,形成良好的骨结合是种植手术成功的关键。种植体与骨实现骨结合分为3个阶段(图4):①第一阶段(适应层形成期):种植体植入后表面首先被血块包绕,对骨髓内的营养物质(蛋白质、脂质、糖蛋白等)进行吸附,形成适应层,此时骨髓内细胞散在外侧分部;②第二阶段(修复期):种植体植入1个月后,种植区的组织破坏和增生同时进行,由于钻骨切削引起的骨损伤及植入时对骨组织的压力,部分骨组织可能会被吸收,但同时也是骨形成的过程;以巨噬细胞为主的吞噬细胞吞噬吸收适应层,使骨髓内细胞可以聚集在种植体表面,形成有机结合,以成骨细胞为主的活动开始进行,骨吸收与骨增生同时发生,成骨细胞和破骨细胞协同作用调控骨形成;③第三阶段(完成期):种植体植入后3个月,胶原纤维形成,逐渐完成骨结合。在此过程中,成骨细胞和破骨细胞分别由骨髓间充质干细胞和骨髓单核细胞分化产生。通过对以上3个阶段的分析可以得出,骨结合是由微环境中各种细胞彼此相互作用而产生的,因此,评价氧化石墨烯对骨结合的影响重点需要研究其对骨髓间充质干细胞、成骨细胞、破骨细胞、血管内皮细胞及巨噬细胞在迁移和矿化方面的影响。"

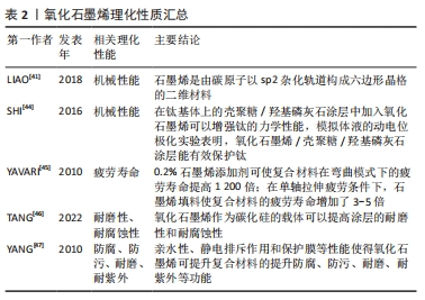
氧化石墨烯能够通过调节间充质干细胞的迁移和成骨分化来促进成骨。氧化石墨烯尺寸大小对间充质干细胞增殖和分化方面有着重要影响。KANG等[23]观察微尺寸氧化石墨烯和纳米尺寸氧化石墨烯对人脂肪间充质干细胞分化的影响,发现在微尺寸氧化石墨烯包被基质上生长的人脂肪间充质干细胞具有更高的细胞扩散和增殖率,人脂肪间充质干细胞的成骨能力更高。因此,强调在氧化石墨烯成为种植材料之前需要对其尺寸进行严格分析和精确调整。QI等[24]设计了光交联丝胶甲基丙烯酰/氧化石墨烯水凝胶骨功能修复的仿生支架,研究证实该支架诱导自体骨髓间充质干细胞分化、促进新骨再生,有效修复骨缺损。JIAO等[25]制备了明胶还原氧化石墨烯,并将明胶还原氧化石墨烯与光交联明胶水凝胶结合构建复合材料,发现该复合材料可诱导骨髓间充质干细胞双分化,促进成骨和血管生成作用,实现骨快速修复。ZHOU等[26]将不同质量浓度氧化石墨烯加入胶原蛋白支架中,发现加入1 g/L氧化石墨烯的胶原蛋白多孔支架在修复大鼠颅骨缺损中表现出良好的治疗效果,说明添加氧化石墨烯可以提高胶原蛋白的生物矿化效率,原因是氧化石墨烯富含羰基和羟基等官能团可为仿生矿化提供更多活性位点,促进大鼠骨髓基质细胞的增殖。 氧化石墨烯通过抑制破骨细胞的生成和促进巨噬细胞的增殖来达到抗破骨作用,从而促进成骨。ZENG等[27]研究了一种由胶原蛋白-氧化石墨烯负载阿仑膦酸钠的载药系统,结果发现胶原蛋白-0.05%氧化石墨烯负载阿仑膦酸钠载药系统中阿仑膦酸钠的释放速度比胶原蛋白-0.2%氧化石墨烯负载阿仑膦酸钠载药系统更快,胶原蛋白-氧化石墨烯负载阿仑膦酸钠海绵有效抑制破骨细胞生成,减少骨吸收。WANG等[28]构建的一个氧化石墨烯修饰的仿骨同心微槽底物,发现同心微槽改变了细胞骨架形态,改性后的表面具有良好的生物相容性,有利于钙的沉积,并限制了破骨细胞融合和密封区的形成,可促进RAW264.7巨噬细胞的增殖、抑制RAW264.7细胞的破骨分化。YANG等[29]发现氧化石墨烯/镓纳米复合材料具有明显的成骨潜能,可通过调节骨形态发生蛋白/Smad、丝裂原活化蛋白激酶和核因子κB信号通路抑制破骨细胞分化。 血管内皮细胞为骨骼的形成提供营养物质。氧化石墨烯可促进血管内皮细胞的增殖和分化,有效维持细胞活性[30]。王伟宇等[31]研究发现,1 g/L氧化石墨烯可促进人脐静脉内皮细胞的迁移和细胞形态伸展。FANG等[32]在小鼠体内通过血管穿越构建血管化的氧化石墨烯胶原腔室模型,通过血管灌注分析证实氧化石墨烯胶原腔可改善血管生成过程,促进体内成骨。 钛作为一种种植材料在口腔种植修复领域被广泛使用,氧化石墨烯在骨结合过程中可促进骨髓间充质干细胞的增殖与成骨分化,利用氧化石墨烯对钛表面进行修饰可以增强种植体的骨结合。WANG等[33]制备了带有氧化石墨烯涂层的表面微槽钛合金,发现其可促进骨髓间充质干细胞的黏附、增殖和分化,说明微槽结构和氧化石墨烯涂层的结合在增强材料表面生物活性方面具有相当大的潜力,并且这种组合改性有望用于钛种植体表面,以增强口腔种植修复领域中的骨结合。SUO等[34]在钛基体上利用电泳技术制备了氧化石墨烯/壳聚糖/羟基磷灰石复合涂层,结果表明该复合涂层可增强钛的骨结合作用。膜具有多孔结构,因此也可考虑将氧化石墨烯与其他材料结合形成复合膜,用于种植体材料表面。LIU等[35]采用一步真空过滤和仿生矿化法制备了壳聚糖和羟基磷灰石复合膜,结果表明该复合膜具有独特的仿生多孔结构、优越的力学性能和优异的骨再生能力。 2.2.2 与龈结合作用 龈结合是牙龈软组织与种植体表面形成连接,该过程为:牙龈上皮细胞通过表面特殊的蛋白多糖与种植体表面血清蛋白的吸附层相互黏附,之后上皮细胞分泌细胞外基质,在细胞膜和种植体氧化膜之间形成半桥粒附着结构,良好地封闭了种植体软硬组织交界处,形成袖口结构。因此,种植体与软组织之间的连接主要依靠牙龈上皮细胞的作用。伴放线聚集杆菌是牙周炎的主要致病菌之一,会损害牙龈上皮细胞结构,而氧化石墨烯对伴放线聚集杆菌具有显著的抑制作用,能够促进牙龈上皮细胞与种植体形成龈结合,减少炎症反应,提高种植体成功率[36-37]。 2.3 氧化石墨烯的理化性质 优良的理化性能是种植体能够长期稳定存在于口腔当中的重要基础,是影响种植长期成功率的重要因素。咬合力过大会导致种植体的过度负载,引发种植材料的应力疲劳,是种植修复体发生折断的主要原因之一[38]。种植体断裂虽然罕见,但仍存在发生的可能性。氧化石墨烯优良的理化性能可以降低传统种植体折断的可能[39]:①在微观结构上,石墨烯是由排列在六角晶格中的碳原子组成的二维原子晶体,具有层状结构[40-41],这种排列结构使氧化石墨烯具有卓越的机械性能,是一种十分坚固的材料。氧化石墨烯能够表现出约1 TPa的极高弹性模量和130 GPa的固有强度,引入氧化石墨烯作为界面增强剂可以改善材料之间的界面结合,优化复合材料的模量、强度和断裂韧性[42-43]。②研究发现,氧化石墨烯与其他材料结合后可提高复合材料的机械性能。SHI等[44]采用电泳沉积技术在钛基体上的壳聚糖/羟基磷灰石涂层中加入氧化石墨烯,以增强钛的力学性能,模拟体液的动电位极化实验表明,氧化石墨烯/壳聚糖/羟基磷灰石涂层能有效保护钛。YAVARI等[45]将不同质量分数的石墨烯薄片渗透到环氧树脂中并直接喷涂到玻璃纤维/环氧复合材料的玻璃微纤维上,发现添加0.2%的石墨烯可使复合材料在弯曲模式下的疲劳寿命提高1 200倍;在单轴拉伸疲劳条件下,石墨烯填料使复合材料的疲劳寿命增加了3-5倍。③氧化石墨烯可以改善涂层的耐磨性和耐腐蚀性。TANG等[46]发现在环氧涂层中使用氧化石墨烯作为碳化硅的载体,可以将涂层中碳化硅的磨料摩擦转化为氧化石墨烯表面碳化硅的摩擦,从而提高涂层的耐磨性;1%氧化石墨烯改性碳化硅/环氧树脂涂层具有优异的耐磨性和耐腐蚀性。YANG等[47]发现亲水性、静电排斥作用和保护膜等性能促进了氧化石墨烯在水和质子溶剂中的分布,可提升氧化石墨烯基材料的防腐性能。 综上所述,氧化石墨烯优良的理化性能在口腔种植修复领域具有良好的应用前景,见表2。"

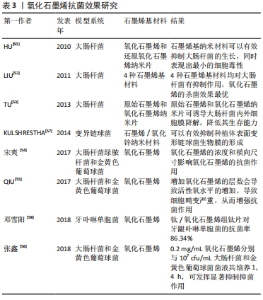
2.4 氧化石墨烯的抗菌性能 由于种植手术后需要相对较长的恢复时间,在此期间食物残渣、唾液都为口腔菌群提供了合适的繁殖环境,种植体周围容易暴露于口腔微环境中,可能会发生感染问题。当感染发生后,患者表现出牙周软组织胀痛、红肿等症状,进而引起种植体松动、脱落,最终会导致手术失败[48-49]。因此,改善种植体材料的抗菌性能可以减少术后感染的发生,提高种植手术成功率。 2.4.1 抗菌原理 石墨烯基材料的抗菌机制目前尚无定论。研究发现,与石墨烯基材料混合培养的细菌在很大程度上失去了细胞完整性,细胞膜被严重破坏,细胞质流出,这是石墨烯能够杀菌的原因[50-51]。对此,目前主要存在2种观点解释其机制:一种观点认为抗菌可能与石墨烯基材料的锐度有关,细菌与石墨烯之间存在直接接触切割,切割作用损伤细菌的细胞膜,继而介导氧化应激,最终导致细菌死亡[50,52];另一种观点认为石墨烯基材料通过大量抽取细胞膜上的磷脂分子来破坏细胞膜,导致细菌膜的降解,降低细菌生存能力,从而杀死细菌[53]。总之,有关石墨烯基材料的抗菌机制还有待更加深入的研究。 2.4.2 影响氧化石墨烯抗菌效率的因素 影响氧化石墨烯的抗菌因素主要有以下5个方面:①氧化石墨烯的抗菌活性与其横向尺寸呈正相关关系,随着横向尺寸的增大,抗菌活性也显著增高。宋爽等[54]选取了横向尺寸依次减小的氧化石墨烯-0、氧化石墨烯-2、氧化石墨烯-3、氧化石墨烯-4和氧化石墨烯-5与大肠杆菌混合培养,发现横向尺寸最大的氧化石墨烯-0组抗菌活性最高,而氧化石墨烯-5组抗菌活性显著降低。②抗菌活性与氧化石墨烯的层数有关。QIU等[55]研究结果表明,氧化石墨烯在钛表面具有良好的抗菌性能,增加氧化石墨烯的层数会导致活性氧水平的增加,导致细菌细胞畸变严重,从而增强抗菌作用。③抗菌活性与氧化石墨烯接触时间和浓度有关。LIU等[52]将一定浓度的氧化石墨烯与大肠杆菌共培养,发现很大一部分细胞死亡发生在第一个小时,随时间的延长,大肠杆菌活力的逐渐丧失;将不同浓度的氧化石墨烯和还原氧化石墨烯与大肠杆菌共培养,发现随浓度的增加,大肠杆菌的活力逐渐丧失。④抗菌活性与细菌种类有关。多个研究表明,氧化石墨烯对革兰阴性菌的抑制作用强于对革兰阳性菌的抑制作用[54-56]。⑤氧化石墨烯材料的金属丰度也在其抗菌活性中起一定作用。LIU等[52]研究发现,导电氧化石墨烯比绝缘氧化石墨烯具有更高的氧化能力,杀菌作用更高效。 氧化石墨烯在抗菌方面的积极作用已被大量实验证实,见表3,优越的抗菌性能使氧化石墨烯在预防口腔种植体周围炎方面有着巨大潜能,在口腔种植修复领域拥有广泛的应用前景。"

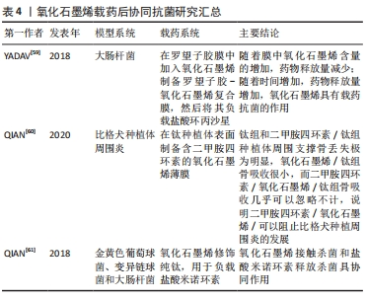
2.4.3 载药抗菌 氧化石墨烯还可以负载药物,多个研究表明,氧化石墨烯在负载药物后可以协同抗菌,比单纯氧化石墨烯的抗菌效果更强。YADAV等[59]制备了罗望子胶-氧化石墨烯复合膜,在负载盐酸环丙沙星后具有显著的抗菌作用。QIAN等[60]研究在钛种植体表面制备含二甲胺四环素的氧化石墨烯薄膜,在应用于比格犬种植体周围炎后发现,钛组和二甲胺四环素/钛组种植体周围支撑骨丢失极为明显,氧化石墨烯/钛组骨吸收很小,而二甲胺四环素/氧化石墨烯/钛组骨吸收几乎可以忽略不计。QIAN等[61]用氧化石墨烯修饰纯钛并负载盐酸米诺环素,结果显示氧化石墨烯接触杀菌和盐酸米诺环素释放杀菌具协同作用。氧化石墨烯载药后协同抗菌研究汇总,见表4。"

| [1] 林国芬,许杨波,王思源,等. 种植失败原因分析[J].口腔医学, 2023,43(1):18-23. [2] 任文燕,刘雪,王一宇.石墨烯及衍生物治疗牙周病:有利于成骨分化及牙周支持组织的重建[J].中国组织工程研究,2023,27(12): 1954-1960. [3] PARK S, AN J, JUNG I, et al. Colloidal suspensions of highly reduced graphene oxide in a wide variety of organic solvents. Nano Lett. 2009; 9(4):1593-1597. [4] BARUAH A, NEWAR R, DAS S, et al. Biomedical applications of graphene-based nanomaterials: recent progress, challenges, and prospects in highly sensitive biosensors. Discov Nano. 2024;19(1):103. [5] WANG K, RUAN J, SONG H, et al. Biocompatibility of Graphene Oxide. Nanoscale Res Lett. 2011;6(1):8. [6] CHANG Y, YANG ST, LIU JH, et al. In vitro toxicity evaluation of graphene oxide on A549 cells. Toxicol Lett. 2011;200(3):201-210. [7] YUE H, WEI W, YUE Z, et al. The role of the lateral dimension of graphene oxide in the regulation of cellular responses. Biomaterials. 2012;33(16):4013-4021. [8] WANG A, PU K, DONG B, et al. Role of surface charge and oxidative stress in cytotoxicity and genotoxicity of graphene oxide towards human lung fibroblast cells. J Appl Toxicol. 2013;33(10):1156-1164. [9] LIAO KH, LIN YS, MACOSKO CW, et al. Cytotoxicity of graphene oxide and graphene in human erythrocytes and skin fibroblasts. ACS Appl Mater Interfaces. 2011;3(7):2607-2615. [10] HAN SG, KIM JK, SHIN JH, et al. Pulmonary Responses of Sprague-Dawley Rats in Single Inhalation Exposure to Graphene Oxide Nanomaterials. Biomed Res Int. 2015;2015:376756. [11] SINGH SK, SINGH MK, NAYAK MK, et al. Thrombus inducing property of atomically thin graphene oxide sheets. ACS Nano. 2011;5(6):4987-4996. [12] FU C, LIU T, LI L, et al. Effects of graphene oxide on the development of offspring mice in lactation period. Biomaterials. 2015;40:23-31. [13] JASIM D A, MURPHY S, NEWMAN L, et al. The Effects of Extensive Glomerular Filtration of Thin Graphene Oxide Sheets on Kidney Physiology. ACS Nano. 2016;10(12):10753-10767. [14] LIU Y, LUO Y, WU J, et al. Graphene oxide can induce in vitro and in vivo mutagenesis. Sci Rep. 2013;3:3469. [15] EL-YAMANY NA, MOHAMED FF, SALAHELDIN TA, et al. Graphene oxide nanosheets induced genotoxicity and pulmonary injury in mice. Exp Toxicol Pathol. 2017;69(6):383-392. [16] MOHAMED HRH, WELSON M, YASEEN AE, et al. Estimation of genomic instability and mutation induction by graphene oxide nanoparticles in mice liver and brain tissues. Environ Sci Pollut Res Int. 2019;27(1): 264-278. [17] RODRÍGUEZ-GARRAUS A, PASSERINO C, VALES G, et al. Impact of physico-chemical properties on the toxicological potential of reduced graphene oxide in human bronchial epithelial cells. Nanotoxicology. 2023;17(5):471-495. [18] GHAZIMORADI MM, GHORBANI MH, EBADIAN E, et al. Epigenetic effects of graphene oxide and its derivatives: A mini-review. Mutat Res Genet Toxicol Environ Mutagen. 2022;878:503483. [19] MA J, LIU R, WANG X, et al. Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-inflammatory Responses in Cells and Animals. ACS Nano. 2015;9(10):10498-10515. [20] 魏常博,余智超,李晔,等.氧化石墨烯片对人乳牙牙髓干细胞黏附、增殖及成骨早期相关蛋白表达的影响[J].临床口腔医学杂志,2018,34(7):387-391. [21] 冯曦,王佐林.钛表面氧化石墨烯涂层对施旺氏细胞黏附与增殖的影响[J].口腔颌面外科杂志,2019,29(2):61-68. [22] KENRY, LOH KP, LIM CT. Molecular Hemocompatibility of Graphene Oxide and Its Implication for Antithrombotic Applications. Small. 2015; 11(38):5105-5117. [23] KANG ES, SONG I, KIM DS, et al. Size-dependent effects of graphene oxide on the osteogenesis of human adipose-derived mesenchymal stem cells. Colloids Surf B Biointerfaces. 2018;169:20-29. [24] QI C, DENG Y, XU L, et al. A sericin/ graphene oxide composite scaffold as a biomimetic extracellular matrix for structural and functional repair of calvarial bone. Theranostics. 2020;10(2):741-756. [25] JIAO D, ZHENG A, LIU Y, et al. Bidirectional differentiation of BMSCs induced by a biomimetic procallus based on a gelatin-reduced graphene oxide reinforced hydrogel for rapid bone regeneration. Bioact Mater. 2020;6(7):2011-2028. [26] ZHOU C, LIU S, LI J, et al. Collagen Functionalized With Graphene Oxide Enhanced Biomimetic Mineralization and in Situ Bone Defect Repair. ACS Appl Mater Interfaces. 2018;10(50):44080-44091. [27] ZENG Y, ZHOU M, CHEN L, et al. Alendronate loaded graphene oxide functionalized collagen sponge for the dual effects of osteogenesis and anti-osteoclastogenesis in osteoporotic rats. Bioact Mater. 2020;5(4):859-870. [28] WANG H, LAI Y, XIE Z, et al. Graphene Oxide-Modified Concentric Microgrooved Titanium Surfaces for the Dual Effects of Osteogenesis and Antiosteoclastogenesis. ACS Appl Mater Interfaces. 2022;14(49):54500-54516. [29] YANG Y, LI M, ZHOU B, et al. Graphene oxide/gallium nanoderivative as a multifunctional modulator of osteoblastogenesis and osteoclastogenesis for the synergistic therapy of implant-related bone infection. Bioact Mater. 2022;25:594-614. [30] 高丽,刘浏,任文燕,等.石墨烯及其衍生物对血管生成和血管化骨的影响机制[J].中国组织工程研究,2024,28(17):2716-2722. [31] 王伟宇,刘鋆,杨勇,等.静电纺丝蛋清/聚乙烯醇/氧化石墨烯复合纤维支架的制备及体外生物相容性[J].中国组织工程研究, 2021,25(28):4497-4503. [32] FANG H, LUO C, LIU S, et al. A biocompatible vascularized graphene oxide (GO)-collagen chamber with osteoinductive and anti-fibrosis effects promotes bone regeneration in vivo. Theranostics. 2020;10(6): 2759-2772. [33] WANG C, HU H, LI Z, et al. Enhanced Osseointegration of Titanium Alloy Implants with Laser Microgrooved Surfaces and Graphene Oxide Coating. ACS Appl Mater Interfaces. 2019;11(43):39470-39483. [34] SUO L, JIANG N, WANG Y, et al. The enhancement of osseointegration using a graphene oxide/chitosan/hydroxyapatite composite coating on titanium fabricated by electrophoretic deposition. J Biomed Mater Res B Appl Biomater. 2019;107(3):635-645. [35] LIU S, LI Z, WANG Q, et al. Graphene Oxide/Chitosan/Hydroxyapatite Composite Membranes Enhance Osteoblast Adhesion and Guided Bone Regeneration. ACS Appl Bio Mater. 2021;4(11):8049-8059. [36] 吴志富,王佐林.氧化石墨烯对牙周致病菌影响的实验研究[J].口腔颌面外科杂志,2019,29(1):23-29. [37] 马晓琳,于烁,曲珊琳,等.伴放线聚集杆菌与人牙龈上皮细胞相互作用的研究进展[J].口腔生物医学,2023,14(3):192-196+201. [38] 陈恩,李守宏.种植修复后基台或中央螺丝折断的原因及预防[J].临床口腔医学杂志,2022,38(6):375-378. [39] SAILER I, KARASAN D, TODOROVIC A, et al. Prosthetic failures in dental implant therapy. Periodontol 2000. 2022;88(1):130-144. [40] LEI Y, ZHANG T, LIN YC, et al. Graphene and Beyond: Recent Advances in Two-Dimensional Materials Synthesis, Properties, and Devices. ACS Nanosci Au. 2022;2(6):450-485. [41] LIAO C, LI Y, TJONG SC. Graphene Nanomaterials: Synthesis, Biocompatibility, and Cytotoxicity. Int J Mol Sci. 2018;19(11):3564. [42] CHUMAKOVA N, KOKORIN A. Graphene Oxide Membranes-Synthesis, Properties, and Applications. Membranes (Basel). 2023;13(9):771. [43] DAS P, IBRAHIM S, CHAKRABORTY K, et al. Stepwise reduction of graphene oxide and studies on defect-controlled physical properties. Sci Rep. 2024;14(1):294. [44] SHI YY, LI M, LIU Q, et al. Electrophoretic deposition of graphene oxide reinforced chitosan-hydroxyapatite nanocomposite coatings on Ti substrate. J Mater Sci Mater Med. 2016;27(3):48. [45] YAVARI F, RAFIEE MA, RAFIEE J, et al. Dramatic increase in fatigue life in hierarchical graphene composites. ACS Appl Mater Interfaces. 2010;2(10):2738-2743. [46] TANG J, TAN Y, QI F, et al. A Micro-Nano Structure Formed by SiC/Graphene Oxide Self-Assembly Improves the Wear Resistance and Corrosion Resistance of an Epoxy-Based Composite Coating. Polymers (Basel). 2022;14(21):4704. [47] YANG X, TU Y, LI L, et al. Well-dispersed chitosan/graphene oxide nanocomposites. ACS Appl Mater Interfaces. 2010;2(6):1707-1713. [48] 赵珺, 莉蓉,马文杰,等.口腔种植体周围细菌感染病原菌分布特点及细菌感染的危险因素分析 [J]. 现代生物医学进展,2022, 22(5):895-899. [49] 刘中林,彭澜,王晖,等.种植体周围细菌感染患者病原菌分布及耐药性分析[J].中华医院感染学杂志,2017,27(2):399-401,13. [50] HU W, PENG C, LUO W, et al. Graphene-based antibacterial paper. ACS Nano. 2010;4(7):4317-4323. [51] DEEPAK T, BHARAT BS, R BABU A. Evaluation of physicochemical properties of graphene oxide-decellularized pericardium biohybrid scaffold. J Biomed Mater Res B Appl Biomater. 2024;112(1):e35353. [52] LIU S, ZENG TH, HOFMANN M, et al. Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: membrane and oxidative stress. ACS Nano. 2011;5(9):6971-6980. [53] TU Y, LV M, XIU P, et al. Destructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheets. Nat Nanotechnol. 2013;8(8):594-601. [54] 宋爽,储林芳,吕中,等.氧化石墨烯选择性抗菌性能研究[J].武汉大学学报(理学版),2017,63(4):283-288. [55] QIU J, GENG H, WANG D, et al. Layer-Number Dependent Antibacterial and Osteogenic Behaviors of Graphene Oxide Electrophoretic Deposited on Titanium. ACS Appl Mater Interfaces. 2017;9(14):12253-12263. [56] 张鑫,施欢贤,任映坤.氧化石墨烯的制备、表征及其抗菌性能研究[J].西北药学杂志,2018,33(6):796-800. [57] KULSHRESTHA S, KHAN S, MEENA R, et al. A graphene/zinc oxide nanocomposite film protects dental implant surfaces against cariogenic Streptococcus mutans. Biofouling. 2014;30(10):1281-1294. [58] 邓雪阳,潘兰兰,胡婷,等.钛合金表面氧化石墨烯涂层的制备[J].国际口腔医学杂志,2018,45(5):539-545. [59] YADAV I, NAYAK SK, RATHNAM VSS, et al. Reinforcing effect of graphene oxide reinforcement on the properties of poly (vinyl alcohol) and carboxymethyl tamarind gum based phase-separated film. J Mech Behav Biomed Mater. 2018;81:61-71. [60] QIAN W, QIU J, LIU X. Minocycline hydrochloride-loaded graphene oxide films on implant abutments for peri-implantitis treatment in beagle dogs. J Periodontol. 2020;91(6):792-799. [61] QIAN W, QIU J, SU J, et al. Minocycline hydrochloride loaded on titanium by graphene oxide: an excellent antibacterial platform with the synergistic effect of contact-killing and release-killing. Biomater Sci. 2018;6(2):304-313. [62] LI Q, WANG Z. Involvement of FAK/P38 Signaling Pathways in Mediating the Enhanced Osteogenesis Induced by Nano-Graphene Oxide Modification on Titanium Implant Surface. Int J Nanomedicine. 2020;15:4659-4676. [63] AGARWALLA SV, ELLEPOLA K, SILIKAS N, et al. Persistent inhibition of Candida albicans biofilm and hyphae growth on titanium by graphene nanocoating. Dent Mater. 2021;37(2):370-377. [64] JANG W, KIM HS, ALAM K, et al. Direct-Deposited Graphene Oxide on Dental Implants for Antimicrobial Activities and Osteogenesis. Int J Nanomedicine. 2021;16:5745-5754. [65] 吕尚毅,何惠宇,吾凡别克·巴合提,等.氧化石墨烯-羟基磷灰石复合涂层材料的理化性质及生物相容性[J].中国组织工程研究, 2024,28(10):1477-1483. |
| [1] | Yu Shuai, Liu Jiawei, Zhu Bin, Pan Tan, Li Xinglong, Sun Guangfeng, Yu Haiyang, Ding Ya, Wang Hongliang. Hot issues and application prospects of small molecule drugs in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1913-1922. |
| [2] | Yu Jingbang, Wu Yayun. Regulatory effect of non-coding RNA in pulmonary fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1659-1666. |
| [3] | Wang Qiuyue, Jin Pan, Pu Rui . Exercise intervention and the role of pyroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1667-1675. |
| [4] | Yuan Weibo, Liu Chan, Yu Limei. Potential application of liver organoids in liver disease models and transplantation therapy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1684-1692. |
| [5] | Peng Hongcheng, Peng Guoxuan, Lei Anyi, Lin Yuan, Sun Hong, Ning Xu, Shang Xianwen, Deng Jin, Huang Mingzhi . Role and mechanism of platelet-derived growth factor BB in repair of growth plate injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1497-1503. |
| [6] | Yu Shuangqi, Ding Fan, Wan Song, Chen Wei, Zhang Xuejun, Chen Dong, Li Qiang, Lin Zuoli. Effects of polylactic acid-glycolic acid copolymer/lysine-grafted graphene oxide nanoparticle composite scaffolds on osteogenic differentiation of MC3T3 cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 707-712. |
| [7] | Liu Haoyang, Xie Qiang, Shen Mengran, Ren Yansong, Ma Jinhui, Wang Bailiang, Yue Debo, Wang Weiguo . Application, research hotspots, and shortcomings of degradable zinc-based alloys in bone defect repair and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 839-845. |
| [8] | Huang Haina, Yu Yanrong, Bi Jian, Huang Miao, Peng Weijie. Epigenetic characteristics of hepatogenic differentiation of mesenchymal stem cells in three-dimensional culture [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7848-7855. |
| [9] | Liu Lu, Zhong Chang, Yu Xin, Ren Chenyuan, Gong Yangyang, Zhou Ping, Wang Yingbin. Academic progress and clinical application of in vitro synthetic microenvironment to promote maturation of human pluripotent stem cell-derived cardiomyocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7856-7862. |
| [10] | Guo Zhao, Zhuang Haoyan, Shi Xuewen. Role of exosomes derived from mesenchymal stem cells in treatment of colorectal cancer [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7872-7879. |
| [11] | Li Ruotong, Wu Yuening, Deng Yunyi, Chen Shichao, Lan Xiaorong, Li Shiting, Li Guangwen. Preparation and antibacterial evaluation of nanosilver-reduced graphene oxide/polydopamine/methacrylated gelatin@Gap19 hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7333-7343. |
| [12] | Su Yongkun, Sun Hong, Liu Miao, Yang Hua, Li Qingsong. Development of novel antioxidants and antioxidant combination carried by nano-hydrogel systems in treatment of intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7376-7384. |
| [13] | Yi Xiaoding, Zhang Di, Guo Hong, Qing Liang, Zhao Tianyu. Decellularized tendon scaffold: a biomedical material for tendon injury repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7385-7392. |
| [14] | Wu Ziwei, Luo Yicai, Wei Yinge, Liao Hongbing. Application of poly(lactic-co-glycolic acid) copolymer in stomatology [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7393-7404. |
| [15] | Li Zhongzheng, Chen Zhenghao, Tang Ziyou, Lou Kaiyang, Zhang Rui, Liu Qi, Zhao Na, Yang Kun. Effects of scaffold materials combined with biological factors on biological characteristics of dental follicle cell proliferation and osteogenic differentiation [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7405-7414. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||