Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (1): 185-192.doi: 10.12307/2025.002
Previous Articles Next Articles
Regulating ferroptosis of osteoblasts by traditional Chinese medicine in treatment of steroid-induced avascular necrosis of femoral head
Zhang Mianyu1, Han Jie2, Zeng Hao1, Chen Xiangshan1, Gao Zhengang1
- 1Graduate College, Guangxi University of Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China; 2Ruikang Hospital, Guangxi University of Chinese Medicine, Nanning 530011, Guangxi Zhuang Autonomous Region, China
-
Received:2023-11-07Accepted:2023-12-28Online:2025-01-08Published:2024-05-20 -
Contact:Han Jie, Master, Chief physician, Ruikang Hospital, Guangxi University of Chinese Medicine, Nanning 530011, Guangxi Zhuang Autonomous Region, China -
About author:Zhang Mianyu, Master candidate, Graduate College, Guangxi University of Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China -
Supported by:National Natural Science Foundation of China, No. 82260858 (to HJ); Guangxi Education Department Youth Teacher Research Ability Enhancement Project, No. 2021KY0290; Three-Year Action Plan for Construction of High-Level Talent Team at Guangxi University of Chinese Medicine: Construction Project of Research Center for Academic Thought and Clinical Diagnosis and Treatment Inheritance and Development of Chinese Medicine Master Wei Guikang, No. 2022V001; Training Project for Young Qihuang Scholars in Guangxi in 2022, No. [2022]13 (to HJ)
CLC Number:
Cite this article
Zhang Mianyu, Han Jie, Zeng Hao, Chen Xiangshan, Gao Zhengang. Regulating ferroptosis of osteoblasts by traditional Chinese medicine in treatment of steroid-induced avascular necrosis of femoral head[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(1): 185-192.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
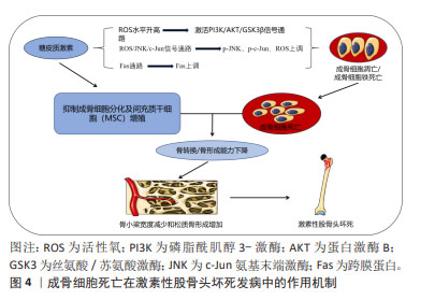
在2003年,DOLMA等[6]发现一种名为erastin的化合物引发非凋亡细胞死亡。在2008年,YANG等[7]发现该化合物erastin引发的细胞死亡后铁含量增加,证实该非凋亡细胞死亡具有铁依赖性。2012年,DIXON等[8]首次提出细胞铁死亡概念,其发生依赖于细胞内铁。在2014年,YANG等[9]发现谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是重要调节因子,参与脂质过氧化引起细胞铁死亡。2015年,JIANG等[10]发现调控胱氨酸/谷氨酸逆向转运蛋白抑制胱氨酸摄取,从而限制细胞内谷胱甘肽的产生,引发铁死亡。在2015年,XIAO等[11]证实铁超载抑制了成骨细胞的活性。在2016年,BALOGH等[12]证实铁和铁蛋白在体外和体内特异性抑制骨髓间充质干细胞的成骨保护和分化。在2022年,LIU等[13]发现成骨细胞与铁死亡关系密切。 2.2 成骨细胞铁死亡在激素性股骨头坏死发病中的作用 2.2.1 激素性股骨头坏死的发病机制 目前激素性股骨头坏死的发病机制尚未达成共识,但近年来骨细胞凋亡学说受到国内外学者的广泛关注,有研究表明激素性股骨头坏死的主要病理组织病变和细胞学病变与骨细胞的凋亡有关[14]。此外,其他证据同样证实骨细胞凋亡在激素性股骨头坏死的发病机制中起关键作用[15]。骨组织形成、修复及重建均依赖成骨细胞及破骨细胞精确协调,其中成骨细胞释放骨基质蛋白,而破骨细胞负责吸收清除。破骨细胞和成骨细胞凋亡增加会影响骨转换和骨形成,导致骨小梁宽度减小和松质骨形成增加,容易导致股骨头坏死的发生[16]。研究发现,Fas通路对骨细胞凋亡产生影响[17]。而糖皮质激素可通过上调Fas表达,从而刺激细胞凋亡,发生糖皮质激素相关性骨病患者的骨细胞大多发生凋亡[18]。CUI等[14]发现经地塞米松诱导处理后的小鼠股骨头骨密度降低,组织病理学改变异常,空腔隙率增加,股骨头骨细胞凋亡率显著提高。MUTIJIMA等[19]对所有髋关节疾病置换所得的标本进行研究后,发现激素性股骨头坏死患者股骨头中骨细胞的凋亡率明显高于其他,这充分表明骨细胞凋亡可以导致激素性股骨头坏死。另有研究表明,激素可以增加成骨细胞活性氧水平,活性氧可通过激活三磷酸磷脂酰肌醇/蛋白激酶B/糖原合酶激酶3β (phosphoinositide-3-kinase/Protein kinase B/glycogen synthase kinase-3,PI3K/AKT/GSK3β)信号通路,从而导致成骨细胞铁死亡,最终导致激素性股骨头坏死[20]。PENG等[21]通过地塞米松处理大鼠后发现,地塞米松可通过活性氧/ c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK) /c-Jun信号通路发挥作用,导致大鼠体内成骨细胞内p-JNK,p-c-Jun,活性氧水平显著增加,诱导成骨细胞铁死亡的发生。 综上所述,糖皮质激素通过诱导骨细胞死亡促进激素性股骨头坏死的发生发展,其中成骨细胞的死亡起到了重要作用,详见图4。所以如何抑制成骨细胞铁死亡,促进成骨细胞存活并发挥功能是未来治疗激素性股骨头坏死的重要研究方向。 "
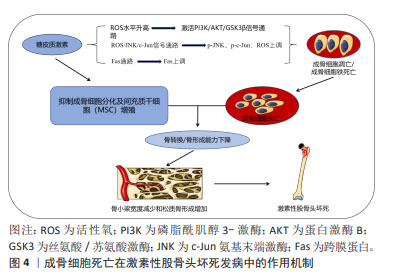
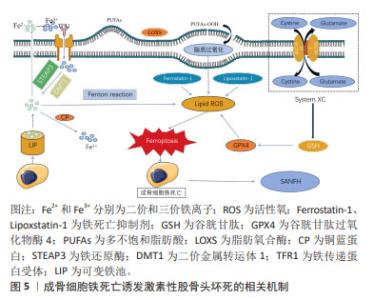
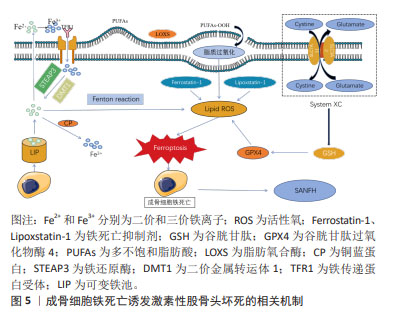
2.2.2 成骨细胞铁死亡诱导激素性股骨头坏死发生发展 成骨细胞主要由骨髓间充质干细胞而来,在骨基质合成、分泌和矿化过程中发挥着重要作用,是骨修复的关键细胞。在骨形成过程中,成骨细胞经细胞内信号传导,大量增殖、分化并迁移到骨修复部位,并分泌骨基质,引起基质矿化,达到骨修复的目的。糖皮质激素可抑制成骨细胞分化并抑制间充质干细胞增殖[22],从而影响成骨细胞生成,引起激素性股骨头坏死的发生。XING等[23]研究发现,地塞米松可通过PI3K/Akt途径抑制Sema3A表达来抑制成骨细胞分化。综上,糖皮质激素可作用于成骨细胞,并导致成骨细胞死亡或功能失常,继而诱导发生激素性股骨头坏死。铁死亡(Ferroptosis)是2012年首次提出的一种新型细胞死亡模式[8],其形态特征在于线粒体膜密度的增加和线粒体的收缩,表现为线粒体体积减小、线粒体膜密度增加、线粒体外膜完整性被破坏、线粒体嵴溶解消失[24]。发生成骨细胞铁死亡的主要特征包括成骨细胞内铁超载、活性氧的大量堆积以及脂质过氧化。 在细胞铁超载情况下,铁蛋白外的多余亚铁离子参与芬顿反应并产生羟基自由基诱导铁死亡,或通过激活含有铁的酶(例如脂氧合酶)来诱导铁死亡[25]。有研究证据显示去铁胺和铁死亡抑制剂1 (Ferrostatin-1)通过抑制细胞铁超载逆转细胞铁死亡[26]。可以说,成骨细胞内铁超载是诱导成骨细胞铁死亡发生的重要原因。有研究表明,通过调节细胞内可变铁池可避免成骨细胞内铁超载的发生,调节可变铁池的主要参与者是铁蛋白,铁蛋白可将铁氧化成反应性较低的三价铁并储存在24亚基复合物中,从而防止铁死亡[27]。其他证据也表明铁蛋白可以维持成骨细胞内铁稳态,减少芬顿反应引起的氧化应激,减少成骨细胞铁死亡的发生[28]。此外,在铁还原酶(STEAP3)作用下,三价铁还原成亚铁并储存在铁蛋白中,这同样可避免细胞铁超载的发生。除了这些机制之外,铜蓝蛋白作为一种亚铁氧化酶,也可通过将亚铁转化成反应性较低的三价铁来保护细胞免受铁死亡的侵害[29]。同样新型铁死亡抑制剂9a也通过减少细胞内亚铁的数量,从而阻断铁死亡[30]。综上,作者认为抑制成骨细胞内亚铁离子数量过多,从而避免成骨细胞铁超载,是阻止成骨细胞铁死亡的重要途径之一。 另外,成骨细胞内发生芬顿反应可生成大量的活性氧。活性氧是指部分还原的含氧分子,是自由基和/或氧衍生物,大多数来源于超氧自由基[31]。芬顿反应是铁和过氧化氢之间的反应并产生羟基自由基,羟基自由基对活细胞具有高反应性和剧毒性[32]。活性氧可激活相关信号通路启动铁死亡[33]。研究发现活性氧积聚抑制成骨细胞活性[25,34],对成骨细胞的产生和存活及其分化有重大影响[35]。由于细胞膜或细胞器膜存在高多不饱和脂肪酸,特别容易受到活性氧的损伤,脂质过氧化便通过影响膜上的多不饱和脂肪酸,从而导致细胞铁死亡[36]。某些脂氧合酶能直接氧化生物膜上的多不饱和脂肪酸和含多不饱和脂肪酸的脂质,这可减少细胞脂质过氧化发生,这也说明脂氧合酶也可作为调控成骨细胞铁死亡的通路之一。在成骨细胞铁死亡中还有一个重要的XC系统,其作为胱氨酸-谷氨酸反向转运蛋白,用于转移谷氨酸细胞外和胱氨酸(Cystine)细胞内用于谷胱甘肽合成。谷胱甘肽可降低脂质过氧化物的毒性,以保护生物膜系统免受铁死亡损伤。若XC系统出现问题,会导致高浓度谷氨酸从而抑制胱氨酸摄取和谷胱甘肽合成,从而影响GPX4的活性并导致铁死亡[37]。GPX4是一种中枢调节因子,是人体的脂质抗氧化系统。体内谷胱甘肽消耗会影响GPX4的活性,在此之后,细胞内的亚铁氧化脂质产生活性氧,导致铁死亡[38]。因此,作者认为成骨细胞铁死亡是一种多因素参与,并受到多种机制调节的细胞死亡方式,主要涉及:①铁代谢失常引起的细胞内铁超载;②细胞内芬顿反应产生大量的活性氧;③脂质过氧化损伤细胞导致铁死亡;④XC系统通过影响谷胱甘肽水平和GPX4活性,从而诱导铁死亡等。 随着研究的不断深入,对于成骨细胞铁死亡诱发激素性股骨头坏死的机制已有了充分的认识,详见图5。成骨细胞凋亡作为激素性股骨头坏死的重要发病机制之一,各种因素导致的成骨细胞铁死亡会使骨稳态失衡和骨质流失,诱发激素性股骨头坏死。MA等[39]使用柠檬酸铁铵处理MLO-Y4骨样细胞和小鼠骨细胞模拟铁过载环境,发现柠檬酸铁铵增加了MLO-Y4细胞内活性氧水平并增加小鼠骨细胞氧化应激,导致细胞铁死亡,破坏骨细胞形态,造成骨破坏。同样,JIANG等[40]用柠檬酸铁铵模拟铁过载条件,而去铁胺和铁抑素1用于体外抑制MC3T3-E1细胞的铁死亡,结果表明细胞铁死亡的发生抑制了体外成骨分化和矿化,而抑制铁死亡逆转了上述变化。上述研究证实成骨细胞铁死亡会抑制成骨分化,影响骨的发育、修复及重建以及骨转换和骨形成,促进激素性股骨头坏死的发生发展。综上,抑制成骨细胞铁死亡可作为防治激素性股骨头坏死的方向,而如何调控成骨细胞铁死亡成了治疗的新思路。"
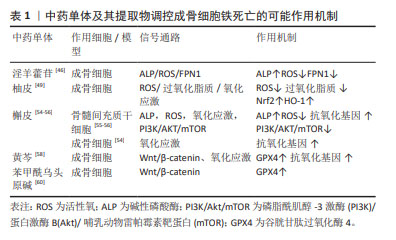
2.3 中草药调控成骨细胞铁死亡 目前已有大量研究表明中草药可通过调控细胞铁死亡治疗相应疾病,且都取得不错的进展[41]。作者发现其中一些研究证实部分中草药与成骨细胞铁死亡密切相关。成骨细胞铁死亡是激素性股骨头坏死的重要发病机制,作者将这部分中草药归纳总结,阐述其调控成骨细胞铁死亡的作用机制,以期在临床应用这部分中草药防治激素性股骨头坏死提供新的思路。激素性股骨头坏死在祖国医学属于“骨蚀”和“骨痹”范畴,根据诊疗指南以及中医辨证标准分为早期:气滞血瘀证、痰瘀阻络证;中期:经脉痹阻证;晚期:肝肾不足证等4个证型[42]。通过中医辨证论治,运用上述中草药治疗,调控成骨细胞铁死亡产生积极的作用,抑制骨破坏,促进成骨及骨修复,进而对抗激素性股骨头坏死的发生及发展。文章从中药单体、中医复方及中成药三个方面阐述中草药调控成骨细胞铁死亡治疗激素性股骨头坏死的可能作用机制。 2.3.1 中药单体 淫羊藿苷:有研究表明,淫羊藿苷可诱导成骨基因表达、成骨细胞矿化以及碱性磷酸酶活性,促进成骨分 化[43]。淫羊藿苷是一种来源于淫羊藿的黄酮类化合物,它以抗炎和抗氧化作用最为突出。研究证实淫羊藿苷可以通过Wnt信号通路、PI3K/AKT信号通路、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路和雌激素信号通路等促进成骨干细胞增殖、分化和矿化,从而促进成骨并起到防治激素性股骨头坏死的作用[44]。此外,付殷等[45]研究发现淫羊藿苷可显著提高大鼠成骨细胞的碱性磷酸酶活性及钙化能力,明显降低细胞内活性氧的水平,并抑制铁转运蛋白(FPN1)过表达,显著提高了成骨细胞活性及矿化能力。铁转运蛋白过表达可显著降低成骨细胞的碱性磷酸酶活性及钙化能力,引起成骨细胞细胞内活性氧水平增加,引发成骨细胞铁死亡,这表明淫羊藿可以抑制成骨细胞铁死亡从而有效防治激素性股骨头坏死。 柚皮素和槲皮素:柚皮素和槲皮素是治疗激素性股骨头坏死的关键活性成分[46]。柚皮素是一种天然存在的二氢黄酮类化合物,是枳壳、枳实、骨碎补及化橘红等中药的主要有效成分之一,有抗氧化与清除自由基的作用。研究表明柚皮素可促进成骨细胞的分化和表达,并且可促进间充质干细胞骨髓间充质干细胞成骨分化和成骨相关基因表达[47]。PAN等[48]发现柚皮素可缓解铁过载状态下成骨细胞活力的下降,减少活性氧和过氧化脂质(LPO)的积累,并上调抗氧化基因Nrf2和HO-1表达。此外,XU等[49]研究发现柚皮素促使Nrf2,SLC7A11,GPX4,FTH1和FPN1在细胞组织中的表达呈剂量依赖性增加,而NOX1的表达下降,这表明了柚皮素可通过Nrf2/HO-1通路以及Nrf2/System XC-/GPX4通路调控成骨细胞铁死亡,在防治激素性股骨头坏死中起积极作用。槲皮素是一种天然黄酮类化合物,是杜仲、山楂及三七等多味中草药有效成分之一,具有很强的抗氧化、抗炎作用以及促成骨作用。研究显示槲皮素与激素性股骨头坏死发病核心基因相互作用指数较高,这提示槲皮素可在治疗激素性股骨头坏死上发挥重要作用[50]。另有研究表明槲皮素可显著提高鸡成骨细胞碱性磷酸酶活性,并促进成骨矿化[51]。MESSER等[52]发现槲皮素代谢物上调成骨细胞的抗氧化反应。另外有研究同样证实了槲皮素可通过抗氧化途径抑制骨髓间充质干细胞铁死亡[53]。LAN等[54]研究发现,槲皮素能显著维持大鼠骨髓间充质干细胞的活力,明显上调碱性磷酸酶,降低活性氧水平,激活抗氧化基因,并能下调PI3K,AKT和mTOR的磷酸化水平,这表明在氧化应激环境下槲皮素可能通过PI3K/AKT/mTOR信号通路调控铁死亡,以保持骨髓间充质干细胞活性和成骨细胞分化。上述研究表明,槲皮素可能通过抗氧化途径抑制成骨细胞以及骨髓间充质干细胞铁死亡的发生,有利于对抗激素性股骨头坏死的发生发展。 黄芩素:是中药黄芩的有效成分之一,具有抗氧化及抗炎等作用[55]。有研究发现黄芩素能够促进小鼠MC3T3-E1成骨细胞的增殖,可能通过Wnt/β-catenin信号传导通路上调GPX4来抑制成骨细胞铁死亡[56]。黄芩素因具有强大的抗氧化功效,可清除自由基并终止自由基反应,有研究发现黄芩素可通过减轻氧化应激损伤对激素性股骨头坏死产生保护作用[57]。这些证据表明,黄芩素可能通过Wnt/β-catenin信号通路以及抗氧化应激方面调控成骨细胞铁死亡,从而对激素性股骨头坏死产生治疗作用。 苯甲酰乌头原碱:是来源于乌头、附子等乌头类药物的活性单体,具有抗炎镇痛、促进代谢、增加糖蛋白转运活性等作用。研究表明,低浓度的苯甲酰乌头原碱能够增加 Erastin 诱导铁死亡的成骨细胞的GPX4和β-catenin蛋白表达,有效抑制成骨细胞铁死亡的发生,但高浓度的苯甲酰乌头原碱则表现出细胞毒性[58],这表明苯甲酰乌头原碱可能通过Wnt/β-catenin信号通路增强GPX4表达抑制铁死亡,且其疗效与药物浓度相关。成骨细胞铁死亡在激素性股骨头坏死发病中有重要作用,有确切证据证实苯甲酰乌头原碱与成骨细胞铁死亡关系密切,见表1,但遗憾的是苯甲酰乌头原碱与激素性股骨头坏死的研究较少,未能阐明两者之间的作用关系,这有待进一步研究。"
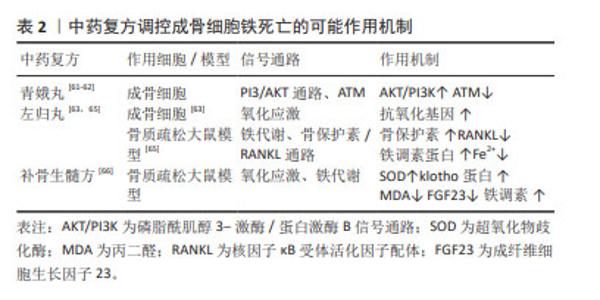
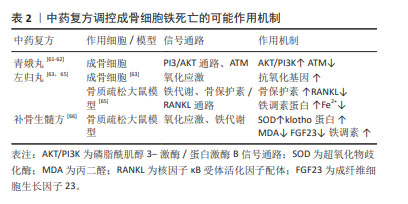
因此,中药治疗激素性股骨头坏死具有很大的潜力,淫羊藿苷增强碱性磷酸酶活性及钙化能力,降低活性氧的水平,并抑制铁转运蛋白(FPN1)过表达,抑制成骨细胞铁死亡,显著提高了成骨细胞活性及矿化能力;柚皮素可缓解铁过载状态下的细胞损伤,减少活性氧和过氧化脂质的积累,上调抗氧化基因Nrf2及HO-1表达,以及调控Nrf2/System xc-/GPX4通路抑制成骨细胞铁死亡;槲皮素可上调细胞碱性磷酸酶,降低活性氧水平,激活抗氧化基因,并能下调PI3K,AKT和mTOR的磷酸化水平,通过PI3K/AKT/mTOR信号通路以及抗氧化途径抑制成骨细胞以及骨髓间充质干细胞细胞铁死亡的发生;黄芩素通过Wnt/β-catenin信号传导通路上调GPX4,减轻氧化应激抵抗细胞损伤,发挥抗氧化作用抑制成骨细胞铁死亡;苯甲酰乌头原碱可能通过Wnt/β-catenin信号通路增强GPX4表达抑制成骨细胞铁死亡。中草药具有效果良好、不良反应小和费用低的优势,未来随着更多研究的深入,更多可调控成骨细胞铁死亡的中草药被发现,以期为治疗激素性股骨头坏死提供更多的选择。 2.3.2 中药复方 青娥丸:由杜仲、补骨脂、胡桃和葱组成,具有补肾强腰膝之功。帅波等[59]运用青娥丸加味治疗激素性股骨头坏死小鼠模型,与模型组相比,青娥丸加味组股骨头颈局部骨小梁数量明显减少,空间间隙增加,骨小梁之间的连接遭到破坏等情况明显改善,表明青娥丸加味在对抗激素性股骨头坏死上有一定的疗效。研究表明,青娥丸含药血清具有促进成骨细胞增殖、分化和矿化的作用,提高成骨细胞活力,从而刺激骨形成[60]。另外,青娥丸可通过PI3/AKT通路和ATM调节抑制成骨细胞铁死亡发生[61-62]。ATM是铁死亡的关键因素,PI3K途径与铁死亡、细胞增殖有关,激活PI3K可以保护细胞免受铁死亡。综上,青娥丸可通过抑制成骨细胞铁死亡,同时促进成骨细胞增殖、分化和矿化,在治疗激素性股骨头坏死上起到了作用。 左归丸:是由熟地、山药、山茱萸、枸杞、菟丝子、川牛膝、龟板胶和鹿角胶等组成的补肾代表方剂,具有滋阴补肾、填精益髓之功效,可运用于激素性股骨头坏死的肝肾不足证。研究显示,左归丸对成骨细胞氧化损伤具有保护作用[63],这提示左归丸可能通过调节氧化应激抑制成骨细胞铁死亡发生。此外,左归丸可调节骨髓间充质干细胞相关的成骨分化因子的表达,促进成骨分化,减少骨丢失,还可激活相关成骨相关因子,调控成骨相关蛋白表达,促成骨增殖[64]。刘梅洁等[65]发现左归丸能降低细胞Fe2+含量,增加铁调素蛋白表达,并上调骨保护素蛋白,下调RANKL蛋白表达,这表明左归丸可能通过铁调素蛋白、骨保护素/RANKL信号通路缓解铁过载以及氧化应激,抑制成骨细胞铁死亡的发生。 补骨生髓方:由补骨脂、狗脊、骨碎补、三七、人参等药物组成,具有补益肝肾、益气活血的作用,同样可运用于肝肾不足型激素性股骨头坏死。章轶立等[66]发现补骨生髓方可增加大鼠血清超氧化物歧化酶活性和klotho蛋白含量,降低丙二醛和成纤维细胞生长因子23含量,提示补骨生髓方可提高大鼠抗氧化能力,抑制体内氧化应激水平,抑制细胞铁死亡。氧化应激可导致骨重建过程中骨髓间充质干细胞成骨分化减弱、成骨细胞生成减少、骨细胞凋亡增加等[67]。此外,在补骨生髓方干预后,大鼠血清铁调素含量增加,提示补骨生髓方可在一定程度上纠正铁过载状态,抑制细胞铁死亡。综上,补骨生髓方通过调控氧化应激以及铁代谢相关通路抑制细胞铁死亡,但是否作用于成骨细胞还有待研究证实。 综上,中药复方在治疗激素性股骨头坏死中发挥重要的作用,青娥丸通过PI3/AKT通路和ATM调节抑制成骨细胞铁死亡发生,并发挥促进成骨细胞增殖、分化和矿化的作用;左归丸可能通过铁调素蛋白、骨保护素/RANKL信号通路调节铁代谢以及氧化应激,抑制成骨细胞铁死亡的发生;补骨生髓方可提高大鼠抗氧化能力,抑制体内氧化应激水平,还可纠正细胞铁过载,抑制细胞铁死亡,见表2。遗憾的是,目前对于中药复方与成骨细胞铁死亡的相关研究较少,具体作用细胞机制有待阐明,这对于中草药如何发挥作用有重要意义。 "
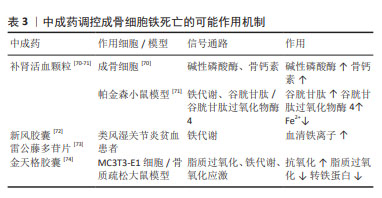
2.3.3 中成药 补肾活血颗粒:原方来源于《伤科大成》,该处方是以补肾活血法为基本治则。有研究发现复方补肾活血颗粒含药血清促进人骨髓间充质干细胞成骨分化[68-69]。刘慧等[70]发现应用补肾活血颗粒后大鼠血生化的成骨细胞分泌的骨形成指标碱性磷酸酶、骨钙素升高,推测补肾活血颗粒对增强成骨细胞分化增殖及活性功能作用明显。从结果上看,补肾活血颗粒可能对激素性股骨头坏死有一定的治疗作用,但仍需进一步研究明确两者的关系。李晨等[71]通过实验发现补肾活血颗粒可以通过调节细胞内铁浓度、谷胱甘肽含量和GPX4抑制细胞铁死亡。综上,作者推测补肾活血颗粒可能通过成骨细胞铁死亡在对抗激素性股骨头坏死上有一定的作用。 雷公藤:是可用于治疗激素性股骨头坏死的中药,具有活血通络、消肿止痛的功效。雷公藤制剂有雷公藤多苷片和新风胶囊等。有研究发现,新风胶囊能够升高骨保护素水平,增强成骨细胞活性,降低RANKL水平,增加骨形成,减少骨流失[72]。在铁代谢相关信号传导通路的变化发现,雷公藤多苷片、新风胶囊两种不同雷公藤制剂均能够调节铁代谢,影响铁调素相关信号通路[73],说明这两种不同雷公藤制可参与细胞铁死亡的作用通路。综上,雷公藤多苷片和新风胶囊可增强成骨细胞活性,并能调节铁代谢及影响铁调素等细胞铁死亡通路,因此作者推测这两种雷公藤制剂可能调控成骨细胞铁死亡,但具体机制需进一步研究证实。 金天格胶囊:人工虎骨粉,具有健骨作用,且还具有一定的促进骨生长的作用,临床已有将其应用于股骨头坏死治疗的报道。研究发现金天格胶囊对H2O2 诱导的 MC3T3-E1 细胞氧化应激损伤具有保护作用,并显著促进小鼠MC3T3-E1正常成骨细胞增殖,增强成骨细胞活性[74]。因此,金天格胶囊可能调控成骨细胞铁死亡,但仍需进一步研究解释。 综上,补肾活血颗粒可能通过细胞内铁浓度、谷胱甘肽含量和GPX4调控成骨细胞铁死亡;雷公藤多苷片、新风胶囊两种不同雷公藤制剂可能通过调节铁代谢,并降低铁调素,调控成骨细胞铁死亡;金天格胶囊可能通过调控脂质过氧化和铁蓄积等通路调控成骨细胞铁死亡,见表3。遗憾的是,并没有明确的研究验证补肾活血颗粒雷公藤多苷片、新风胶囊以及金天格胶囊等中成药与成骨细胞铁死亡之间的关系,这有待未来学者的深入研究,这对防治激素性股骨头坏死有重大意义。 "
| [1] ZHANG S, WANG C, SHI L, et al. Beware of steroid-induced avascular necrosis of the femoral head in the treatment of COVID-19-experience and lessons from the SARS epidemic. Drug Des Devel Ther. 2021;15:983-995. [2] LIU Q, WU Y, LI S, et al. Ursolic acid alleviates steroid-induced avascular necrosis of the femoral head in mouse by inhibiting apoptosis and rescuing osteogenic differentiation. Toxicol Appl Pharmacol. 2023;475:116649. [3] XI H, TAO W, JIAN Z, et al. Levodopa attenuates cellular apoptosis in steroid-associated necrosis of the femoral head. Exp Ther Med. 2017;13(1):69-74. [4] 王小龙,韩超前,赵晓娜,等.普伐他汀能否降低早期兔激素诱导性股骨头坏死发生的风险[J].中国组织工程研究,2018,22(32):5097-5103. [5] 尚征亚,曹林忠,张翼,等.中药单体调控成骨相关信号通路治疗激素性股骨头坏死的研究进展[J].中国实验方剂学杂志,2023,29(18):229-240. [6] DOLMA S, LESSNICK SL, HAHN WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells. Cancer Cell. 2003;3(3):285-296. [7] YANG WS, STOCKWELL BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells. Chem Biol. 2008;15(3):234-245. [8] DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 2012;149(5):1060-1072. [9] YANG WS, SRIRAMARATNAM R, WELSCH M E, et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 2014;156(1-2):317-331. [10] JIANG L, KON N, LI T, et al. Ferroptosis as a p53-mediated activity during tumour suppression. Nature. 2015;520(7545):57-62. [11] XIAO W, BEIBEI F, GUANGSI S, et al. Iron overload increases osteoclastogenesis and aggravates the effects of ovariectomy on bone mass. J Endocrinol. 2015;226(3):121-134. [12] BALOGH E, TOLNAI E, NAGY BJ, et al. Iron overload inhibits osteogenic commitment and differentiation of mesenchymal stem cells via the induction of ferritin. Biochim Biophys Acta. 2016;1862(9):1640-1649. [13] LIU P, WANG W, LI Z, et al. Ferroptosis: a new regulatory mechanism in osteoporosis. Oxid Med Cell Longev. 2022;2022:2634431. [14] CUI D, ZHAO D, HUANG S. Beneficial contribution of a safflower (Carthamus tinctorius L.) polysaccharide on steroid-induced avascular necrosis of the femoral head in rats. Int J Biol Macromol. 2019;123:581-586. [15] WANG B, GONG S, SHAO W, et al. Comprehensive analysis of pivotal biomarkers, immune cell infiltration and therapeutic drugs for steroid-induced osteonecrosis of the femoral head. Bioengineered. 2021;12(1):5971-5984. [16] 孙懿,赵海燕,成杰,等.激素性股骨头坏死发生机制的研究进展[J].中国矫形外科杂志,2023,31(1):58-62. [17] KRATOCHVILOVA A, RAMESOVA A, VESELA B, et al. Impact of fasl stimulation on sclerostin expression and osteogenic profile in IDG-SW3 osteocytes. Biology (Basel). 2021;10(8):757. [18] 丁香莹,梁敏.凋亡在糖皮质激素性骨质疏松症中的研究进展[J].中国骨质疏松杂志,2017,23(12):1660-1663. [19] MUTIJIMA E, DE MAERTELAER V, DEPREZ M, et al. The apoptosis of osteoblasts and osteocytes in femoral head osteonecrosis: its specificity and its distribution. Clin Rheumatol. 2014;33(12):1791-1795. [20] 万超超,曹林忠,王多贤,等.成骨细胞铁代谢异常的研究进展[J].中国骨质疏松杂志,2023,29(5):691-694. [21] PENG P, NIE Z, SUN F, et al. Glucocorticoids induce femoral head necrosis in rats through the ROS/JNK/c-Jun pathway. FEBS Open Bio. 2021;11(1):312-321. [22] XIE B, ZENG Z, LIAO S, et al. Kaempferol ameliorates the inhibitory activity of dexamethasone in the osteogenesis of MC3T3-E1 cells by JNK and p38-MAPK pathways. Front Pharmacol. 2021;12:739326. [23] XING Q, FENG J, ZHANG X. Glucocorticoids suppressed osteoblast differentiation by decreasing Sema3A expression via the PIK3/Akt pathway.Exp Cell Res. 2021;403(1):112595. [24] LI J, CAO F, YIN H L, et al. Ferroptosis: past, present and future. Cell Death Dis. 2020;11(2):88. [25] YANG WS, KIM KJ, GASCHLER MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci USA. 2016;113(34):E4966-E4975. [26] LUO C, XU W, TANG X, et al. Canonical Wnt signaling works downstream of iron overload to prevent ferroptosis from damaging osteoblast differentiation. Free Radic Biol Med. 2022;188:337-350. [27] HU W, ZHOU C, JING Q, et al. FTH promotes the proliferation and renders the HCC cells specifically resist to ferroptosis by maintaining iron homeostasis. Cancer Cell Int. 2021;21(1):709. [28] 谢恒,顾叶,顾赢楚,等.骨骼疾病中的铁死亡:骨质疏松治疗靶点[J].中国组织工程研究,2024,28(16):2613-2618. [29] SHANG Y, LUO M, YAO F, et al. Ceruloplasmin suppresses ferroptosis by regulating iron homeostasis in hepatocellular carcinoma cells. Cell Signal. 2020;72:109633. [30] FANG Y, CHEN X, TAN Q, et al. Inhibiting ferroptosis through disrupting the NCOA4-FTH1 interaction: a new mechanism of action. ACS Cent Sci. 2021;7(6):980-989. [31] SU L J, ZHANG J H, GOMEZ H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis. Oxid Med Cell Longev. 2019;2019:5080843. [32] ABE C, MIYAZAWA T. Current use of fenton reaction in drugs and food. Molecules. 2022;27(17):5451. [33] LIU J, KANG R, TANG D. Signaling pathways and defense mechanisms of ferroptosis. FEBS J. 2022;289(22):7038-7050. [34] TAO H, GEe G, LIANG X, et al. ROS signaling cascades: dual regulations for osteoclast and osteoblast. Acta Biochim Biophys Sin (Shanghai). 2020; 52(10):1055-1062. [35] BAO J, YAN Y, ZUO D, et al. Iron metabolism and ferroptosis in diabetic bone loss: from mechanism to therapy. Front Nutr. 2023;10:1178573. [36] YANG WS, KIM KJ, GASCHLER MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci USA. 2016; 113(34):E4966-E4975. [37] YAN C, ZHANG J, AN F, et al. Research progress of ferroptosis regulatory network and bone remodeling in osteoporosis. Front Public Health. 2022;10:910675. [38] XIONG Y, CHEN L, LIN Z, et al. The regulatory role of ferroptosis in bone homeostasis. Stem Cells Int. 2022;2022:3568597. [39] MA J, WANG A, ZHANG H, et al. Iron overload induced osteocytes apoptosis and led to bone loss in Hepcidin (-/-) mice through increasing sclerostin and RANKL/OPG. Bone. 2022;164:116511. [40] JIANG Z, WANG H, QI G, et al. Iron overload-induced ferroptosis of osteoblasts inhibits osteogenesis and promotes osteoporosis: an in vitro and in vivo study. IUBMB Life. 2022;74(11):1052-1069. [41] LIU J, JIANG G, HE P, et al. Mechanism of ferroptosis in traditional chinese medicine for clinical treatment: a review. Front Pharmacol. 2022;13:1108836. [42] 陈卫衡,何伟,童培建,等.股骨头坏死中医辨证标准(2019年版)[J].中医正骨,2019,31(6):1-2. [43] XIE D, XU Y, CAIW, et al. Icariin promotes osteogenic differentiation by upregulating alpha-enolase expression. Biochem Biophys Rep. 2023;34:101471. [44] 李嘉骏,夏天,刘佳敏,等.淫羊藿苷调控成骨信号相关通路治疗激素性股骨头缺血性坏死的分子机制[J].中国组织工程研究,2022,26(5):780-785. [45] 付殷,刘宇洲,胡晓阳,等.基于铁死亡通路研究淫羊藿苷对大鼠成骨细胞增殖分化的影响[J].时珍国医国药,2022,33(9):2100-2103. [46] REN GW, WEN SB, HAN J, et al. Network-based pharmacology and bioinformatics study on the mechanism of action of gujiansan in the treatment of steroid-induced avascular necrosis of the femoral head. Biomed Res Int. 2022;2022:8080679. [47] 李泽林,孙海飚.柚皮素治疗骨质疏松的作用机制研究[J].中国骨质疏松杂志,2023,29(6):932-936. [48] PAN Z, HE Q, ZENG J, et al. Naringenin protects against iron overload-induced osteoarthritis by suppressing oxidative stress. Phytomedicine. 2022;105:154330. [49] XU S, WU B, ZHONG B, et al. Naringenin alleviates myocardial ischemia/reperfusion injury by regulating the nuclear factor-erythroid factor 2-related factor 2 (Nrf2)/System xc-/glutathione peroxidase 4 (GPX4) axis to inhibit ferroptosis. Bioengineered. 2021;12(2):10924-10934. [50] 肖振,李盛华.激素性股骨头坏死血管新生相关基因的鉴定及其靶向中药成分筛选验证[J].中草药,2023,54(5):1526-1539. [51] 刘洪柱,李垚,陈鑫,等.沙棘总黄酮、槲皮素对鸡成骨细胞碱性磷酸酶活性作用机制的体外研究[J].动物营养学报,2011,23(8):1378-1385. [52] MESSER JG, HOPKINS RG, KIPP DE. Quercetin metabolites up-regulate the antioxidant response in osteoblasts isolated from fetal rat calvaria. J Cell Biochem. 2015;116(9):1857-1866. [53] LI X, ZENG J, LIU Y, et al. Inhibitory effect and mechanism of action of quercetin and quercetin diels-alder anti-dimer on erastin-induced ferroptosis in bone marrow-derived mesenchymal stem cells. Antioxidants (Basel). 2020;9(3):205. [54] LAN D, QI S, YAO C, et al. Quercetin protects rat BMSCs from oxidative stress via ferroptosis. J Mol Endocrinol. 2022;69(3):401-413. [55] 王雅芳,李婷,唐正海,等.中药黄芩的化学成分及药理研究进展[J].中华中医药学刊,2015,33(1):206-211. [56] 庄文德,郭浩华,陈振,等.铁死亡调控在骨质疏松症中的作用机制及中药干预研究[J].中国骨质疏松杂志,2023,29(6):890-896. [57] 段丽颖,王绍宁,那铎,等.双黄岑素氧钒配合物的抗氧化性和抑菌活性[J].沈阳药科大学学报,2018,35(7):581-586. [58] 徐晶.苯甲酰乌头原碱对Erastin诱导成骨细胞铁死亡的影响及潜在机制[D].南京:南京中医药大学,2022. [59] 帅波,杨功旭,沈霖,等.加味青娥丸对激素性股骨头坏死小鼠局部1,25(OH)2D3/VDR mRNA/RAS信号转导通路的影响[J].中国中医骨伤科杂志,2017,25(7):1-5. [60] 翁泽斌,颜翠萍,张志杰,等.不同炮制品入药的青娥丸含药血清对人成骨细胞增殖、分化及矿化的影响[J].中国实验方剂学杂志,2015, 21(6):165-168. [61] 邸学士,陈昭,贾育松,等.基于网络药理学探讨青娥丸治疗绝经后骨质疏松症的作用机制[J].中国骨质疏松杂志,2021,27(3):364-371. [62] HAO J, BEI J, LI Z, et al. Qing’e pill inhibits osteoblast ferroptosis via ATM serine/threonine kinase (ATM) and the PI3K/AKT pathway in primary osteoporosis. Front Pharmacol. 2022;13:902102. [63] 乔久涛,关德宏,王冬艳,等.左归丸对成骨细胞氧化应激损伤的保护作用[J].中国组织工程研究,2020,24(7):1052-1056. [64] 胡阳,宋敏,李凯等.左归丸及其组方治疗绝经后骨质疏松症的基础研究进展[J].中华中医药学刊,41(12):86-89. [65] 刘梅洁,吴佳莹,李艳,等.左归丸对骨质疏松症模型大鼠铁过载的影响[J].中医杂志,2018,59(9):777-780. [66] 章轶立,方圣杰,李秋月,等.补骨生髓方对骨质疏松症模型大鼠氧化应激及铁死亡相关指标的影响[J].中国中医药信息杂志,2022,29(4):75-79. [67] 程韶,舒冰,赵永见,等.氧化应激对骨重建的影响[J].中国骨质疏松杂志,2019,25(10):1478-1482. [68] 乔明珠,吕浩,胡芷苜,等.基于Wnt/β-catenin信号通路的复方补肾活血颗粒对骨髓间充质干细胞成骨、成脂分化的影响[J].中国中医药信息杂志,2023,30(11):107-113. [69] 王子文,王久香,吕浩,等.复方补肾活血颗粒含药血清通过Trb3调控hBMSCs成骨成脂分化[J].中国骨质疏松杂志,2023,29(4):544-549. [70] 刘慧,许兵,方剑利,等.补肾活血颗粒对去势大鼠血生化的影响[J].中华中医药杂志,2012,27(5):1435-1438. [71] 李晨,王鹏,王亮,等.补肾活血颗粒对亚急性帕金森病模型小鼠脑黑质多巴胺神经元铁死亡的影响[J].中医杂志,2022,63(15):1463-1469. [72] 徐慧敏.基于OPG/RANKL/RANK系统探讨新风胶囊对RA患者骨代谢影响及其作用机制[D].合肥:安徽中医药大学,2018. [73] 孙艳秋,刘健,黄旦,等.不同雷公藤制剂对类风湿关节炎贫血患者的疗效及其机制[J].中国免疫学杂志,2020,36(3):360-364. [74] 李超,赵剑波,陈俊雅,等.金天格胶囊对H2O2诱导的小鼠成骨细胞MC3T3-E1氧化应激损伤及炎症因子的作用[J].中国骨质疏松杂志, 2022,28(10):1448-1452. |
| [1] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [2] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [3] | Zhou Panpan, Cui Yinglin, Zhang Wentao, Wang Shurui, Chen Jiahui, Yang Tong . Role of cellular autophagy in cerebral ischemic injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1650-1658. |
| [4] | Zhu Hanmin, Wang Song, Xiao Wenlin, Zhang Wenjing, Zhou Xi, He Ye, Li Wei, . Mitophagy regulates bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1676-1683. |
| [5] | Aikepaer · Aierken, Chen Xiaotao, Wufanbieke · Baheti. Osteogenesis-induced exosomes derived from human periodontal ligament stem cells promote osteogenic differentiation of human periodontal ligament stem cells in an inflammatory microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1388-1394. |
| [6] | Zhao Nannan, Li Yanjie, Qin Hewei, Zhu Bochao, Ding Huimin, Xu Zhenhua. Changes in ferroptosis in hippocampal neurons of vascular dementia model rats treated with Tongmai Kaiqiao Pill [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1401-1407. |
| [7] | Zhang Mingyang, Yang Xinling. Verbascoside inhibits Erastin-induced ferroptosis of dopaminergic nerve cell line MN9D cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1408-1413. |
| [8] | Wang Mi, Ma Shujie, Liu Yang, Qi Rui. Identification and validation of characterized gene NFE2L2 for ferroptosis in ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1466-1474. |
| [9] | Chi Wenxin, Zhang Cunxin, Gao Kai, Lyu Chaoliang, Zhang Kefeng. Mechanism by which nobiletin inhibits inflammatory response of BV2 microglia [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1321-1327. |
| [10] | Gao Yang, Qin Hewei, Liu Dandan. ACSL4 mediates ferroptosis and its potential role in atherosclerotic cardiovascular disease [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1239-1247. |
| [11] | Liu Lingyun, He Guixin, Qin Weibin, Song Hui, Zhang Liwen, Tang Weizhi, Yang Feifei, Zhu Ziyi, Ou Yangbin . Improvement of myocardial injury by traditional Chinese medicine: mitochondrial calcium homeostasis mediates macrophage autophagy and pyroptosis pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1276-1284. |
| [12] | Lan Shuangli, Xiang Feifan, Deng Guanghui, Xiao Yukun, Yang Yunkang, Liang Jie. Naringin inhibits iron deposition and cell apoptosis in bone tissue of osteoporotic rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 888-898. |
| [13] | Lang Mecuo, Zhang Yilin, Wang Li. MiR-338-3p affects proliferation and apoptosis of alveolar bone osteoblasts by targeting receptor activator of nuclear factor-kappaB ligand [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 899-907. |
| [14] | Xiao Fang, Huang Lei, Wang Lin. Magnetic nanomaterials and magnetic field effects accelerate bone injury repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 827-838. |
| [15] | Jiang Qiyu, Zeng Huiyan. A novel analysis and prediction method for potential mechanisms of traditional Chinese medicine based on artificial intelligence and omics data-driven approach [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7552-7561. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||