Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (29): 4697-4702.doi: 10.12307/2024.568
Previous Articles Next Articles
Minipigs used in hydrogel wound repair research
Mei Rigeng1, Geng Shaohui2, Lin Zhimin3, Wu Jiapeng1, Liu Xin4, Lan Xinyi2, Gao Yuruo2, Huang Guangrui2
- 1School of Traditional Chinese Medicine, 2School of Life Sciences, 4School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102446, China; 3Third Affiliated Hospital, Beijing University of Chinese Medicine, Beijing 102446, China
-
Received:2023-10-25Accepted:2023-12-06Online:2024-10-18Published:2024-03-23 -
Contact:Huang Guangrui, Professor, School of Life Sciences, Beijing University of Chinese Medicine, Beijing 102446, China -
About author:Mei Rigeng, School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 102446, China Geng Shaohui, MD, School of Life Sciences, Beijing University of Chinese Medicine, Beijing 102446, China -
Supported by:National Defense Science and Technology Innovation Special Zone H863 Project, No. 20-163-02-ZT-008-003-01 (to HGR); Innovation and Entrepreneurship Training Program for College Students from Beijing University of Chinese Medicine, No. s202310026032 (to LZM); Innovation and Entrepreneurship Training Program for College Students from Beijing University of Chinese Medicine, No. X202310026070 (to LZM); Innovation and Entrepreneurship Training Program for College Students from Beijing University of Chinese Medicine, No. X202310026158 (to LX)
CLC Number:
Cite this article
Mei Rigeng, Geng Shaohui, Lin Zhimin, Wu Jiapeng, Liu Xin, Lan Xinyi, Gao Yuruo, Huang Guangrui. Minipigs used in hydrogel wound repair research[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4697-4702.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

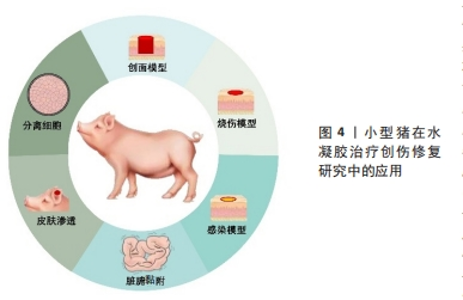
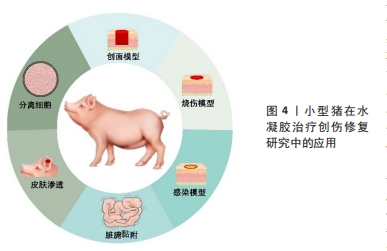
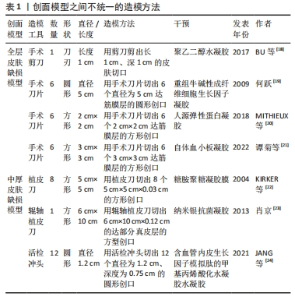
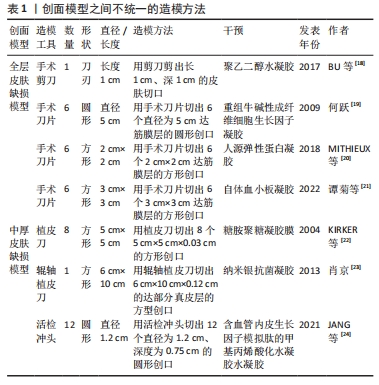
2.3.1 全层皮肤缺损模型 全层皮肤缺损模型即切除全层的皮肤组织露出筋膜层的一种创伤模型,该模型具有易于质控、重复性好的优势,应用最为广泛。BU等[18]通过无机疏水性多面体笼型低聚硅倍半氧烷单元对聚乙二醇水凝胶进行优化,去除了膨胀度过高等缺点,通过实验验证此胶黏剂不仅能够粘黏伤口,并且还可以促进猪皮肤伤口愈合。何跃[19]选择2月龄雄性家猪制作全层皮肤缺损模型,使用较成人20倍用量重组牛碱性成纤维细胞生长因子外用凝胶治疗伤口,实验发现该凝胶组小猪新生血管、汗腺、脂腺和纤维增多。小型猪皮肤缺损模型很好地验证了水凝胶促进伤口愈合的治疗效果。除了高分子水凝胶外,也有学者使用人源弹性蛋白等自体成分水凝胶使用小型猪模型来评价治疗效果。MITHIEUX等[20]使用人源弹性蛋白水凝胶材料治疗伤口,发现伤口内皮标志物血小板-内皮细胞黏附分子水平降低和血管性血友病因子染色减少,实验证实猪伤口模型作为人源弹性蛋白水凝胶治疗模型具有较好的稳定性,并且人源弹性蛋白水凝胶在健康猪伤口愈合方面优于对比治疗组。谭菊等[21]使用自体血小板凝胶治疗巴马香猪全层皮损模型,实验发现水凝胶组创面愈合速度更快,其修复机制为自体血小板凝胶通过降低白细胞数和血清白细胞介素8水平、提高血清白细胞介素10和组织羟脯氨酸含量促进伤口愈合。 2.3.2 中厚皮肤缺损模型 不同于全层皮肤缺损模型,中厚皮肤缺损模型保留了大部分真皮层,模拟了程度较轻的浅表皮肤缺损。啮齿类动物皮肤缺损模型制作难度系数大,主要原因是啮齿类动物的皮肤较小型猪皮肤薄,不能够准确剥离真皮层及筋膜层,因此小型猪在此模型中有较独特的优势。KIRKER等[22]使用化学交联糖胺聚糖水凝胶膜治疗中厚皮肤缺损模型,分析发现相较于缝合伤口,黏合剂处理的皮肤受伤面积更小且无纤维化组织,研究人员认为该模型能够模拟供区自体移植创面愈合场景,研究水凝胶促进伤口上皮化的效果。断层皮创面模型同属于中厚皮损模型,但其保留的真皮层厚度要更少。肖京[23]、JANG等[24]都制作了断层皮创面模型,前者发现斯丽凯纳米银抗菌凝胶能够促进创面愈合,后者使用3D生物打印机打印含血管内皮生长因子模拟肽的甲基丙烯酸化水凝胶治疗断层皮创面模型,该模型可以通过组织学、免疫组化和荧光分析等方法评价水凝胶促进伤口愈合的效果,体现了水凝胶在伤口愈合中的优势。 2.3.3 糖尿病慢性伤口模型 糖尿病慢性伤口模型是慢性伤口中的重要研究模型。慢性创面在临床伤口疾病中具有愈合时间较长的特点,严重影响患者生活,而糖尿病是导致慢性创面的主要的病因[25]。目前造成慢性创口难以愈合的理论原因是炎症、增殖和重塑阶段生物信号失调,大部分研究人员通过调节如肿瘤坏死因子α、血管内皮生长因子、C-反应蛋白等大分子来促进愈合,也有人员通过调节微小核糖核酸小分子来促进愈合。 对比啮齿类动物,小型猪在血糖规律、血液生化指标、脂质代谢方面与人类较为相似[26],因此研究多采用小型猪动物模型来研究药物调节大分子促进伤口愈合的机制。ABADIR等[27]在糖尿病尤卡坦小型猪背部制作全层皮损模型,于伤口施加缬沙坦凝胶,实验发现伤口肉芽组织面积、毛细血管数量和再上皮化率均增加,验证了抗血管紧张素1能够上调转化生长因子β信号传导和线粒体数量,从而促进胶原蛋白沉淀、伤口血液流量增加和再上皮化。在调节小分子促进糖尿病伤口愈合方面,梁渝捷等[28]用芦荟凝胶治疗巴马小型猪糖尿病慢性皮肤伤口,发现愈合时间明显缩短,组织切片显示创面愈合初期胶原纤维生成增多,愈合后1年观察胶原排列整齐且有较多血管分布,通过微小核糖核酸检测得出该凝胶愈合机制可能与其上调创面肉芽组织微小核糖核酸有关。 2.3.4 临床疾病模型 小型猪除可构建单纯皮肤缺损模型以外,利用其食管及周围结构与人类高度相似的优势,也可应用于水凝胶促进皮瓣移植模型以及食管环周内镜黏膜下剥离术伤口模型中。ZELLNER等[29]报道了此小型猪皮瓣模型能够评价水凝胶敷料改善缺血坏死组织的血运以及降低皮瓣移植术后皮瓣坏死率和提高伤口愈合率的效果,其在猪每侧抬起了2个4 cm×16 cm的皮瓣,并且在皮瓣最远端的皮肤下隧道缝合并连接封闭的抽吸引流球,分别使用聚丙烯酰胺聚合物制成的封闭泡沫水凝胶敷料和聚丙烯酰胺基质吸收性水凝胶敷料治疗猪皮瓣,发现两组伤口均被明显改善,但前者临床失败率更低、组织学形态改善更明显。猪食管环周内镜黏膜下剥离术伤口模型需要经历标记、黏膜下注射凝胶、周切开黏膜及剥离、处理创面4个步骤。王华[30]在猪食管环周创面注射胸腺素β4凝胶,发现用药组狭窄愈合时间较短、扩张次数减少,并且最狭窄程度更轻,实验表明胸腺素β4凝胶能减少创面炎症和管壁纤维化、促进创面新生上皮细胞的迁移和增殖,从而减少术后食管狭窄。 2.4 烧伤模型 烧伤模型是创伤修复模型中的一个重要研究内容,烧伤会导致周围的毛细血管通透性增加,体液渗出形成组织水肿,伴发缺氧和缺血[31]。水凝胶敷料可以减轻传统敷料伤口粘连对组织的刺激,并且提供的湿润环境促进组织再生。猪皮肤具有类似人类皮肤的生理结构[32],目前多采用热金属烫伤法制备皮肤烧伤模型。 无论是装有调节弹簧和铜锭的热金属探针还是YLS-5Q台式烫伤仪,都具有压力、温度可控而且更安全的特点。在水凝胶的治疗研究中,通常在烧伤1-4 d后手术切除造模坏死皮肤,直到有出血的区域进行水凝胶贴敷治疗。BOUCARD等[33]用该模型来评价壳聚糖水凝胶的治疗效果,发现壳聚糖水凝胶具有良好的机械性能和气体交换性能,能够降低伤口回缩并实现快速恢复的效果。BURMEISTER等[34]用原位输送纤维蛋白水凝胶治疗猪皮肤烫伤模型,发现原位输送纤维蛋白水凝胶具有防止伤口机械收缩的特性,还能够调节实验动物小型猪自身免疫的能力。刘有华[35]施以猪脂肪干细胞超表达脂肪含量和肥胖相关蛋白并复合3D水凝胶,结果显示猪脂肪干细胞超表达脂肪含量和肥胖相关蛋白并复合3D水凝胶可促进烧伤表皮再生。 2.5 感染伤口模型 细菌感染是创伤修复最关键的问题,细菌在创伤部位积累并生长会造成创面感染延缓伤口愈合。水凝胶敷料能够提供湿润环境并吸收伤口渗出液,其次能够搭载药物隔绝并抑制细菌生长。在感染伤口模型的研究中,研究者多选用体外猪皮肤作为研究对象,因其能够在一定时间内与体内皮肤的渗透率和新鲜程度保持一致,并且便于研究水凝胶药物的抑菌程度和药物渗透率。体外猪皮模型具有易保存、易操作、易控制变量等优势。 体外感染伤口模型多在体外猪皮肤伤口模型的基础上直接接种致病菌,如 CUI等[36]在体外猪皮上接种金黄色葡萄球菌和大肠杆菌,取榴莲皮基纤维素和类黄酮生产酵母产生的酚类代谢物质以研发天然水凝胶敷贴,发现菌群增殖受到抑制,证明其具有很强的抗菌活性。感染伤口的耐药性问题日渐突出,部分学者在体外猪皮肤伤口模型的基础上接种耐药菌群进行研究。YAN等[37]和LI等[38]均采用鲍曼不动杆菌接种在体外猪皮上,前者施加一种对鲍曼不动杆菌有活性的裂解性肌病毒科噬菌体IME-AB2结合温敏水凝胶治疗,实验结果显示噬菌体IME-AB2结合温敏水凝胶治疗组细菌数得到明显抑制;后者施加噬菌体溶菌素LysP53温敏水凝胶进行治疗,在猪体外感染伤口中也验证了噬菌体溶菌素LysP53温敏水凝胶的抗菌效果。 相较于体外皮肤,体内皮肤仅在机制探索中有更全面的认识。包括免疫反应、毛细血管的作用和促进伤口愈合等。吴志谷等[39]使用水凝胶敷料治疗金葡菌接种的全层皮损模型,发现创面细菌数量得到一定的抑制。所以既使用体内皮肤深层探索水凝胶在小型猪感染伤口的机制,又使用体外皮肤探索水凝胶药物渗透率和抑菌程度会得到更全面的实验结果。 2.6 组织脏器黏附 当人体皮肤或脏器遭受较大的创伤时需要缝合创伤部位以促进愈合,而常规的手术缝合线可能对组织造成二次伤害。与常规的手术缝合线相比,水凝胶不仅具有较好的形状适应性,能够减轻外力干扰,还能形成隔绝细菌的物理屏障[40],因此很多研究者选择水凝胶来研制新型的组织脏器创伤修复与黏合材料。小型猪皮肤、脏器创伤模型的结构及组成与人体十分接近,常被用于测试黏合水凝胶的组织脏器黏附性,常用的测试模型有3种:一是定量反应凝胶与体外猪组织的黏附性,二是黏附愈合后期猪体外皮肤创伤,三是密封愈合前期猪组织器官创伤模型。 在体外组织器官中,皮肤模型易于操作实验,可较精准地测试黏附水凝胶的黏附性。PAGANO等[41]将水凝胶膜贴在猪皮肤样品上,并使用体外黏附力测力仪测量薄膜从皮肤脱离所需的力,证明了3种羧甲基纤维素钠水凝胶膜良好的黏附能力。DENG等[42]通过检测双动态硼酸酯键交联水凝胶与猪皮肤的黏附强度,证明该凝胶具有较强的组织黏附性。 此外,体外皮肤创伤模型还能测验水凝胶的伤口黏合与促修复效果,如SHEN等[43]在猪皮肤组织上进行了水凝胶贴片的黏附性能实验,结果表明该贴片有望在不缝合的情况下成为一种良好的组织创口愈合剂及生物相容性黏合剂。体外脏器主要用于测试水凝胶对特定组织的黏附性,如WANG等[44]利用猪皮肤和肝脏组织创建了全皮层缺损模型,通过比较凝胶在模型中的延展情况证实聚Ⅰ-谷氨酸基双网络水凝胶具有良好的组织黏附性。研究还为猪与人皮肤结构的相似性、猪组织黏附与内脏损伤实验模型的可行性提供有力支撑。 但体外组织器官无法模拟完整生物个体遭受创伤后的恢复过程与情况,也难以测试水凝胶在生物体内所表现出的性质,因此在需要测试水凝胶黏合剂对脏器组织的黏合修复效果时,实验模型往往选用脏器有创伤的小型猪个体。刘爽[45]制备了小香猪急性胃穿孔模型,验证了以二甲基丙烯酰胺和海藻酸钠为分子骨架、胱胺双丙烯酰胺和钙离子为交联剂的双交联水凝胶能够快速封堵伤口、促进愈合。相似地,小型猪也被用于测试水凝胶黏合剂对血管和出血伤口的修复促愈合效果。赵小林[46]选用小香猪股动脉造成损伤模型并植入水凝胶,14 d后凝胶未脱落且血流通畅,验证了负载炎症小体抑制剂的黏附性双层结构双网络水凝胶的组织相容性,发现该水凝胶能止血、促进伤口愈合和组织再生。周飞飞[47]制作了小型猪出血模型,将光响应型水凝胶粘贴在不同的创口处,检测其渗血量、血流量变化和血栓发生情况,实验结果显示术后血流量无明显减小,无渗血情况和血栓发生,这证明该光响应型水凝胶可以止血、促进组织修复再生,具有优越的组织黏附性。 2.7 皮肤渗透模型 透皮给药系统是经过皮肤给药,药物恒速渗透皮肤进入体循环从而产生全身或局部治疗的给药途径[48]。水凝胶敷料的高保水性能提高皮肤水合作用,进而提高药物渗透率。小型猪的药物代谢途径、药物消除速率、药物吸收和分布等方面与人类较为接近,在局限性创伤研究中通常选用血管更丰富、渗透率更近似人皮的猪耳模型,但创伤较深、较大时只能选用猪腹或猪背等周身皮肤系统。 相较于小型猪其他部位,小型猪耳部皮肤的厚度、脂质含量与形态结构等与人类皮肤更相似,能有效模拟载药水凝胶施用于人皮肤的情况,因此猪耳皮肤渗透模型常被用于研究载药水凝胶的渗透性,以及测试凝胶搭载的药物到达靶部位的浓度、作用时间与透皮吸收情况等[49]。RüTHER等[50]将5种盖仑制剂水凝胶应用于猪耳皮肤,比较失水性与渗透性,探究最适于治疗日常损伤的载药凝胶。BALESTRIN等[51]以猪耳皮肤模拟浅表和较深层的伤口,将菊科植物甲状腺素提取物制成纳米乳剂水凝胶进行渗透实验检测药物残留情况,评价水凝胶的皮肤渗透性与促伤愈合效果。TAZRART等[52]用锕系元素污染体外猪耳皮肤,再分别将水、特效胭脂清洗凝胶和二乙烯三胺五乙酸水凝胶作用于猪耳模型并比较,证明二乙烯三胺五乙酸水凝胶对放射性元素有较好的清洁效果。 在研究深部损伤和大面积创口时,小型猪耳部皮肤会受限于厚度面积与形态结构,并不能很好地用作实验模型以模拟真实情况,所以研究者也会选用小型猪新鲜体外皮肤作为皮肤渗透模型。UTTAYARAT等[53]将新鲜体外猪皮肤与电子束辐照交联洋葱皮水凝胶贴剂结合,用紫外可见分光光度计测定皮肤组织中的凝胶含量,验证该凝胶贴剂良好的渗透性。 2.8 其他应用 猪作为常用的实验动物,不仅能被用作创伤修复模型以研究不同药物的治疗机制与适合的用法,还可以将其细胞中促修复成分应用于皮肤创伤治疗。较大型猪来说,小型猪在组织成分体积及细胞排列密度与人类较为近似的优势,因此多使用小型猪作为成分提取模型。现阶段猪细胞的修复成分主要有猪细胞蛋白、猪皮细胞中的胶原和猪器官及组织提取物3种。 研究表明,小型猪细胞含有多种促皮肤创伤修复组分,小型猪细胞蛋白是其中较为常见的一种。刘有华[35]探索了脂肪量和肥胖相关蛋白的医学价值,该团队选取3 d龄小型猪脂肪组织,用Ⅱ型胶原酶消化分离得到猪脂肪干细胞,用瞬时超表达技术发现猪脂肪干细胞超表达的脂肪量和肥胖相关蛋白并复合3D水凝胶能促进烧伤皮肤修复、加速愈合。高垚垚[54]未用酶解法而是选用了组织冻融法提取小型猪胎盘蛋白制备凝胶剂,施用于动物模型,发现该蛋白能显著促进烫伤皮肤组织修复、缓解皮肤衰老。刘彤[55]以小型猪肌腱胶原蛋白为原料制备皮耐克代表人工真皮,作为微粒皮移植覆盖物修复大鼠全层皮肤缺损创面,证明了该人工真皮能加快创面细胞增殖、促进创面愈合、提高愈合质量、预防创面过度收缩和减轻瘢痕增生,验证了人工真皮耐克作为微粒皮覆盖物一步法修复全层皮肤缺损创面的可行性。 除了细胞蛋白,小型猪皮细胞中的胶原也常被提取应用于皮肤修复。刘长龙[56]分离纯化并鉴定不同工艺酶解猪皮制备的促创面愈合活性部位或单体,得出最佳酶解工艺,这种工艺获得的猪皮免疫原性低,皮中胶原及酶解后的寡肽在破损皮肤修复中尤其是前期起较大的作用。KIM等[57]以猪皮为材料,提取皮中胶原并以特定的理化方法纯化,去盐后冻干,冻干的胶原用缓冲溶液溶解,再和透明质酸混合搅拌,冷冻干燥后制得胶原透明质酸水凝胶样品,通过扫描量热计、热重分析、细胞培养和噻唑蓝检测等方式发现这种水凝胶的热稳定性、机械强度和溶胀行为等性能显著增强;而且凝胶表面培养的软骨细胞活力与胶原浓度呈正相关,表明胶原透明质酸水凝胶是一种优秀的伤口敷料,适用于细胞工程、组织重建等生物医学应用。 此外,也有研究者并未分离细胞或是纯化细胞组分,而是从器官和组织的层面研究猪细胞在皮肤创伤修复领域的应用。廖建贵[58]提取小型猪小肠黏膜制备脱细胞猪小肠黏膜下层膜,低温粉碎后将细胞粉末与海绵、水凝胶冷冻交联制得猪小肠黏膜下层冷冻凝胶,在电镜扫描和细胞接种后发现有形态记忆和弹性形变能力,并且生物相容性好、免疫原性低、富含生长因子;通过将绿色荧光蛋白转基因小鼠皮肤成纤维细胞与猪小肠黏膜下层冷冻凝胶体外复合培养,使用荧光显微镜及扫描电镜观察发现猪小肠黏膜下层冷冻凝胶有利于细胞的生长黏附,证实其作为细胞骨架的可行性,其机制与通过挤压排水后主动吸附细胞悬液有关。在心血管系统、消化系统与被皮系统等方面,猪小肠黏膜下层水凝胶的应用也十分广泛[59]。"

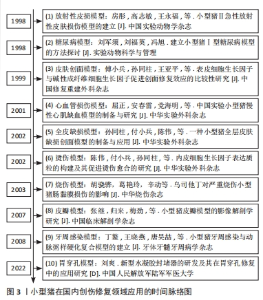
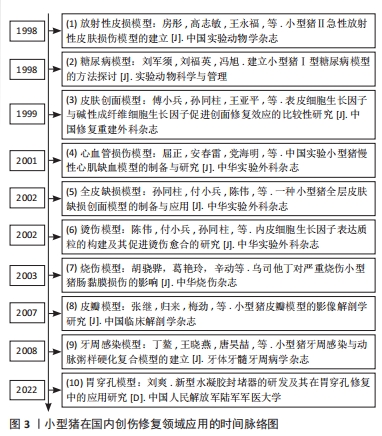
| [1] 傅小兵,孙同柱,王亚平,等.表皮细胞生长因子与碱性成纤维细胞生长因子促进创面修复效应的比较性研究[J].中国修复重建外科杂志, 1999,13(5):278-282. [2] 陈伟,付小兵,孙同柱,等.内皮细胞生长因子表达质粒的构建及其促进烫伤愈合的研究[J].中华实验外科杂志,2002,19(2):144-146. [3] 孙同柱,付小兵,陈伟,等.一种小型猪全层皮肤缺损创面模型的制备与应用[J].中华实验外科杂志,2002,19(5):466-467. [4] 胡骁骅,葛艳玲,辛动,等.乌司他丁对严重烧伤小型猪肠黏膜损伤的影响[J].中华烧伤杂志,2003,19(S1):18-21. [5] 张继,归来,梅劲,等.小型猪皮瓣模型的影像解剖学研究[J].中国临床解剖学杂志,2007,25(5):502-506. [6] 房彤,高志敏,王永福,等.小型猪Ⅱ°急性放射性皮肤损伤模型的建立[J].中国实验动物学杂志,1998(1):29-30. [7] 丁鳌,王晓燕,唐昊喆,等.小型猪牙周感染与动脉粥样硬化复合模型的建立[J].牙体牙髓牙周病学杂志,2008,18(4):190-194. [8] 刘爽.新型水凝胶封堵器的研发及其在胃穿孔修复中的应用研究[D].重庆:中国人民解放军陆军军医大学,2023. [9] 屈正,安春雷,党海明,等.中国实验小型猪慢性心肌缺血模型的制备与研究[J].中华实验外科杂志,2001,18(3):89. [10] 高富雷,王丹茹,张余光.创伤愈合动物模型的研究进展[J].中国美容医学,2007,16(2):278-281. [11] 陈雨荣,安星兰,汪正铸,等.猪作为人类疾病模型的研究进展[J].中国比较医学杂志,2020,30(7):110-119. [12] WEINSTEIN GD. Autoradiographic Studies on Turnover Time and Protein Synthesis in Pig Epidermis. J Invest Dermatol. 1965;44:413-419. [13] VARDAXIS NJ, BRANS TA, BOON ME, et al. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. J Anat. 1997;190(4):601-611. [14] WINTER GD. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young domestic pig. Nature. 1962;193: 293-294. [15] 侯萍,李铭,马军,等.天然高分子材料水凝胶的制备及其应用进展[J].高分子通报,2022(8):29-36. [16] 刘羽霄.蛋白水凝胶微载体的制备及其生物医学应用[D].南京:东南大学,2022. [17] SEVINç-ÖZAKAR R, SEYRET E, ÖZAKAR E, et al. Nanoemulsion-Based Hydrogels and Organogels Containing Propolis and Dexpanthenol: Preparation, Characterization, and Comparative Evaluation of Stability, Antimicrobial, and Cytotoxic Properties. Gels. 2022;8(9):578. [18] BU YZ, SUN GF, ZHANG LC, et al. POSS-modified PEG adhesives for wound closure. Chin J Polym Sci. 2017;35(10):1231-1242. [19] 何跃.PCD/PCBR复合植物多糖修复家猪皮肤缺损的疗效观察研究[D].成都:成都中医药大学,2009. [20] MITHIEUX SM, AGHAEI-GHAREH-BOLAGH B, YAN LP, et al. Tropoelastin Implants That Accelerate Wound Repair. Adv Healthc Mater. 2018;7(10): e1701206. [21] 谭菊,李巨银,赵天赐,等.自体血小板凝胶对猪皮肤创伤愈合的影响[J].畜牧与兽医,2022,54(10):142-146. [22] KIRKER KR, LUO Y, MORRIS SE, et al. Glycosaminoglycan hydrogels as supplemental wound dressings for donor sites. J Burn Care Rehabil. 2004; 25(3):276-286. [23] 肖京.复方中药软膏在猪断层皮创面愈合中作用的实验研究[D].郑州:郑州大学,2013. [24] JANG MJ, BAE SK, JUNG YS, et al. Enhanced wound healing using a 3D printed VEGF-mimicking peptide incorporated hydrogel patch in a pig model. Biomed Mater. 2021;16(4). doi: 10.1088/1748-605X/abf1a8. [25] XU ZR, RAN XW. Diabetic foot care in China: challenges and strategy. Lancet Diabetes Endo. 2016;4(4):297-298. [26] 姚爽.巴马小型猪糖尿病心肌病模型的建立及鉴定[D].桂林:桂林医学院,2019. [27] ABADIR P, HOSSEINI S, FAGHIH M, et al. Topical Reformulation of Valsartan for Treatment of Chronic Diabetic Wounds. J Invest Dermatol. 2018;138(2): 434-443. [28] 梁渝捷,李艳,高芸艺,等.芦荟凝胶治疗巴马小型猪糖尿病慢性皮肤溃疡的实验研究[J].四川大学学报(医学版),2022,53(6):953-960. [29] ZELLNER S, MANABAT R, ROE DF. A dissolved oxygen dressing: A pilot study in an ischemic skin flap model. J Int Med Res. 2015;43(1):93-103. [30] 王华.局部注射胸腺素β4凝胶预防食管环周内镜黏膜下剥离术后狭窄的有效性及其初步机制[D].上海:第二军医大学,2016. [31] NISCHWITZ SP, FINK J, SCHELLNEGGER M, et al. The Role of Local Inflammation and Hypoxia in the Formation of Hypertrophic Scars-A New Model in the Duroc Pig. Int J Mol Sci. 2023;24(1):316. [32] ORTEGA-SáNCHEZ C, PéREZ-DíAZ M, MELGAREJO-RAMíREZ Y, et al. Radiosterilized Pig Skin, Silver Nanoparticles and Skin Cells as an Integral Dressing Treatment for Burns: Development, Pre-Clinical and Clinical Pilot Study. Pharmaceutics. 2023;15(8):2105. [33] BOUCARD N, VITON C, AGAY D, et al. The use of physical hydrogels of chitosan for skin regeneration following third-degree burns. Biomaterials. 2007;28(24):3478-3488. [34] BURMEISTER DM, ROY DC, BECERRA SC, et al. In Situ Delivery of Fibrin-Based Hydrogels Prevents Contraction and Reduces Inflammation. J Burn Care Res. 2018;39(1):40-53. [35] 刘有华.猪脂肪干细胞超表达FTO在皮肤创伤修复中的作用研究[D].杭州:浙江大学,2020. [36] CUI X, LEE J, NG KR, et al. Food Waste Durian Rind-Derived Cellulose Organohydrogels: Toward Anti-Freezing and Antimicrobial Wound Dressing. Acs Sustain Chem Eng. 2021;9(3):1304-1312. [37] YAN W, BANERJEE P, LIU YN, et al. Development of thermosensitive hydrogel wound dressing containing phage against wound infections. Int J Pharm. 2021;602:120508. [38] LI CC, NYARUABA R, ZHAO XW, et al. Thermosensitive Hydrogel Wound Dressing Loaded with Bacteriophage Lysin LysP53. Viruses. 2022;14(9):1956. [39] 吴志谷,付小兵,黎君友,等.速愈乐TM敷料促进小型猪感染创面愈合和抑菌作用的实验研究[J]. 感染、炎症、修复,2011,12(4):217-203,封3. [40] 李静菲.治疗皮肤创伤感染的聚赖氨酸原位水凝胶[D].北京:军事科学院,2023. [41] PAGANO C, CECCARINI MR, CALARCO P, et al. Bioadhesive polymeric films based on usnic acid for burn wound treatment: Antibacterial and cytotoxicity studies. Colloid Surface B. 2019;178:488-499. [42] DENG PP, LIANG X, CHEN FX, et al. Novel multifunctional dual-dynamic-bonds crosslinked hydrogels for multi-strategy therapy of MRSA-infected wounds. Appl Mater Today. 2022;26:101362. [43] SHEN C, LI YJ, MENG Q. Adhesive polyethylene glycol-based hydrogel patch for tissue repair. Colloids Surf B Biointerfaces. 2022;218:112751. [44] WANG YS, XIONG XR, LIN CH, et al. Natural Dual-Crosslinked Self-Healing Hydrogels for In Situ Wound Healing. Macromol Mater Eng. 2022;307(9).doi:10.1002/mame.202200101 [45] 刘爽.新型水凝胶封堵器的研发及其在胃穿孔修复中的应用研究[D].重庆:中国人民解放军陆军军医大学,2022. [46] 赵小林.负载MCC950的粘附型双网络水凝胶用于动脉损伤的止血修复[D].重庆:中国人民解放军陆军军医大学,2021. [47] 周飞飞.光响应型组织黏附性水凝胶用于软组织修复再生的研究[D].杭州:浙江大学,2020. [48] 汪静.卡泊三醇软膏皮肤渗透性研究[D].长春:吉林大学,2013. [49] 柳亚锋,刘岱拯,谢珍茗.6种常用防晒剂的透皮吸收和安全评估[J].日用化学工业,2021,51(11):1088-1094. [50] RÜTHER L, VOSS W. Hydrogel or ointment? Comparison of five different galenics regarding tissue breathability and transepidermal water loss. Heliyon. 2021;7(1):e06071. [51] BALESTRIN LA, BACK PI, MARQUES MD, et al. Effect of Hydrogel Containing (Asteraceae) Extract-Loaded Nanoemulsions on Wound Healing Activity. Pharmaceutics. 2022;14(12):2726. [52] TAZRART A, BOLZINGER MA, LAMART S, et al. Actinide-contaminated Skin: Comparing Decontamination Efficacy of Water, Cleansing Gels, and DTPA Gels. Health Phys. 2018;115(1):12-20. [53] UTTAYARAT P, CHIANGNOON R, THONGNOPKOON T, et al. Electron Beam Irradiation Cross-Linked Hydrogel Patches Loaded with Red Onion Peel Extract for Transdermal Drug Delivery: Formulation, Characterization, Cytocompatibility, and Skin Permeation. Gels. 2023;9(1):52. [54] 高垚垚.猪胎盘抗衰老药效物质基础及相关作用机制研究[D].扬州:扬州大学,2018. [55] 刘彤.重组人胶原蛋白水凝胶和人工真皮分别作为微粒皮移植覆盖物修复全层皮肤缺损的实验研究[D].上海:中国人民解放军海军军医大学,2019. [56] 刘长龙.猪皮促创面愈合活性肽的制备分离及鉴定研究[D].济南:山东中医药大学,2013. [57] KIM JK, LEE JS, JUNG HJ, et al. Preparation and properties of Collagen/Modified hyaluronic acid hydrogel for biomedical application. J Nanosci Nanotechno. 2007;7(11):3852-3856. [58] 廖建贵.小肠粘膜下层冷冻凝胶用于细胞移植支架的研究[D].重庆:第三军医大学,2016. [59] 粟香,葛良鹏,李前勇.猪小肠黏膜下层作为组织修复材料的研究进展[J].中国比较医学杂志,2019,29(8):122-1228. |
| [1] | Yu Weijie, Liu Aifeng, Chen Jixin, Guo Tianci, Jia Yizhen, Feng Huichuan, Yang Jialin. Advantages and application strategies of machine learning in diagnosis and treatment of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1426-1435. |
| [2] | Lin Zeyu, Xu Lin. Research progress in gout-induced bone destruction mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1295-1300. |
| [3] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [4] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [5] | Xu Rong, Wang Haojie, Geng Mengxiang, Meng Kai, Wang Hui, Zhang Keqin, Zhao Huijing. Research advance in preparation and functional modification of porous polytetrafluoroethylene artificial blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 759-765. |
| [6] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [7] | Liu Chuang, Shan Shuo, Yu Tengbo, Zhou Huan, Yang Lei. Advantages, discomfort and challenges of clinical application of orthopedic hemostatic materials [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 795-803. |
| [8] | Wang Wu, Fan Xiaolei, Xie Jie, Hu Yihe, Zeng Min. Hydroxyapatite-polyvinyl alcohol/collagen-chitosan-gelatin composite hydrogel for repairing rabbit osteochondral defect [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 682-689. |
| [9] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [10] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [11] | Li Jiaqi, Huang Yuanli, Li Yan, Wang Chunren, Han Qianqian. Mechanism and influencing factors in molecular weight degradation of non-cross-linked hyaluronic acid [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 747-752. |
| [12] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [13] | Zhang Ming, Wang Bin, Jia Fan, Chen Jie, Tang Wei. Application of brain-computer interface technology based on electroencephalogram in upper limb motor function rehabilitation of stroke patients [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 581-586. |
| [14] | He Yuanjie, Chen Yuheng, Zhao Yongchao, Wang Zhenglong. Progress in epigenetic regulation of vascular smooth muscle cell remodeling in the occurrence and development of aortic aneurysms [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 602-608. |
| [15] | Ma Sicong, Chen Jing, Li Yunqing. Functions and roles of connective tissue growth factor in nervous systems [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 615-620. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||