Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (17): 2716-2722.doi: 10.12307/2024.483
Previous Articles Next Articles
Influential mechanism of graphene and its derivatives on angiogenesis and vascularized bone
Gao Li1, Liu Liu2, Ren Wenyan1, Liu Xue1, Wang Yiyu1
- 1School of Stomatology, Jining Medical University, Jining 272067, Shandong Province, China; 2Jiangsu Provincial Key Laboratory of Oral Diseases Research, Nanjing Medical University, Department of Radiology, School of Stomatology, Nanjing Medical University, Nanjing 210029, Jiangsu Province, China
-
Received:2023-08-24Accepted:2023-10-07Online:2024-06-18Published:2023-12-15 -
Contact:Wang Yiyu, Master, Lecturer, School of Stomatology, Jining Medical University, Jining 272067, Shandong Province, China -
About author:Gao Li, School of Stomatology, Jining Medical University, Jining 272067, Shandong Province, China -
Supported by:Key Research and Development Plan Project of Jining City, No. 2021YXNS032 (to LX); Jining Medical University Students Innovation Training Program Project, No. cx2021131 (to RWY)
CLC Number:
Cite this article
Gao Li, Liu Liu, Ren Wenyan, Liu Xue, Wang Yiyu. Influential mechanism of graphene and its derivatives on angiogenesis and vascularized bone[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(17): 2716-2722.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
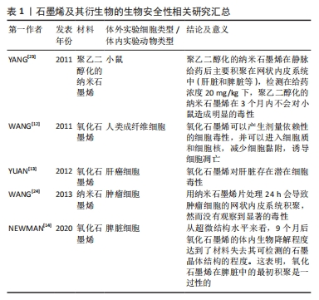
2.1 石墨烯及其衍生物的生物性能 近年来石墨烯及其衍生物材料被广泛应用于组织工程和再生医学,由于其优异的理化性能和生物学性能,在应用于生物医学中显示出巨大的优势和潜能,例如生物成像、生物传感、药物输送和癌症治疗等[6]。良好的生物性能是组织修复材料安全有效地应用于临床的重要保障。目前已有研究证实,石墨烯及其衍生物具有优越的生物相容性,特别是氧化石墨烯,具有大的表面积、疏水的六元芳香环结构和易修饰的氧官能团,使抗癌药物、基因和蛋白质等可以通过π-π堆积、静电相互作用或共价键有效地与之结合,使其在生物医学领域中的应用更为广泛[7]。 石墨烯及其衍生物可通过减小与不同材料的接触角而提高亲水性能,进而提高其生物相容性[8]。例如氧化石墨烯具有两亲性,这可能是由于含有氧官能团氧化石墨烯使疏水的石墨烯具有了亲水性,同时亲水基团与蛋白质分子的官能团可通过静电力或范德华力紧密联系[9],从而实现了氧化石墨烯对蛋白质分子的吸附,更有利于细胞的增殖。不同的制备方法、实验条件的差异以及不同的石墨来源等对氧化石墨烯的结构都有一定的影响,因此氧化石墨烯的精确结构还无法得到确定。目前普遍被接受的结构模型是在氧化石墨烯单片上随机分布着羟基和环氧基,边缘处则分布少量羧基、羰基、苯酚、内酯和醌基,其中的氧化物和羟基促进多能干细胞和胚胎干细胞等干细胞的分化和生长[10]。氧化石墨烯具有可用的官能团、两亲性、更好的表面增强拉曼散射、荧光以及比石墨烯更好的猝灭能力,在水溶液中易于加工和功能化,使其成为各种生物应用中十分有前途的生物材料[11]。 虽然石墨烯及其衍生物拥有出色的生物相容性,但是其生物安全性问题仍不该被忽视[12-14]。研究发现,氧化石墨烯的生物安全性与其浓度、尺寸、形状和暴露时间有关[15]。WANG等[12]研究发现当氧化石墨烯质量浓度低于20 μg/mL时,表现出较低的细胞毒性,而高于50 μg/mL时则表现出明显的细胞毒性,如降低细胞黏附及诱导细胞凋亡等。小尺寸的石墨烯纳米片比大尺寸的更容易表现出细胞毒性[16]。有研究表明,小于100 nm的纳米颗粒可以进入细胞,直径为40 nm的纳米颗粒可以穿过核膜并损伤细胞的DNA。WYCHOWANIEC等[17]分别使用4.9 μm和151.6 nm的氧化石墨烯片材制作氧化石墨烯纸,结果也表明较小尺寸的氧化石墨烯片材制备的氧化石墨烯纸的细胞毒性更高。即使在低质量浓度(1 μg/mL)下,小横向尺寸的还原氧化石墨烯也足以在短时间暴露后诱导产生细胞毒性,而大尺寸的还原氧化石墨烯只有在高浓度(≥100 μg/mL)和长时间暴露时,才会产生细胞毒性。由此可见,石墨烯及其衍生物一般是在高浓度、小尺寸表现出毒性作用。此外,不同的摄入途径会影响其体内的分布情况。YANG等[16]研究发现小鼠口服不同类型的聚乙二醇功能化氧化石墨烯几乎不能被吸收,并被快速排出体外;而将其腹膜内注射后在小鼠网状内皮系统显示出高积累,尽管腹膜内注射的氧化石墨烯在小鼠体内可长期滞留,但在系统血清生物化学、完整的血型测试和组织学分析中没有发现显著的毒性;向小鼠体内静脉注射聚4-苯乙烯磺酸钠功能化的纳米氧化石墨烯,在第1天观察到血清生化结果的异常,并可导致急性肝毒性;在1个月和3个月时,在小鼠的肝脏和肺部检测到中度慢性炎症[18]。这提示研究者们在应用时要注意其浓度、尺寸和给药途径等,尽可能减少石墨烯及其衍生物对生物体的损伤。 关于石墨烯及其衍生物产生细胞毒性的机制目前尚不十分明确,但已有的研究表明其自身的理化性质、产生氧化应激和炎症反应是导致细胞死亡的主要机制。有研究证明通过不同氧化方法制备的氧化石墨烯纳米材料的不同细胞毒性,是碳/氧比例和含氧基团(例如羰基)的比例不同造成的(碳/氧的比例越小,含氧基团的比例越大,毒性越小)[19]。ZHANG等[20]研究表明,氧化程度较低的氧化石墨烯对小鼠胚胎成纤维细胞表现出较强的毒性,刺激细胞产生活性氧,这些活性氧进一步导致DNA断裂、细胞膜损伤以及线粒体功能失调[21]。QU等[22]也研究发现,氧化石墨烯进入细胞内部并积累到一定的程度会使细胞内活性氧增加,同时氧化石墨烯还能与细胞膜表面的Toll样受体4发生作用并激活其信号通路,从而发生炎症反应并导致细胞程序性死亡[21]。 文章总结了石墨烯及其衍生物的生物安全性相关研究进展[12-14,23-24],见表1。"
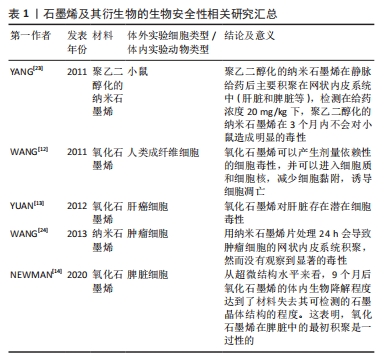
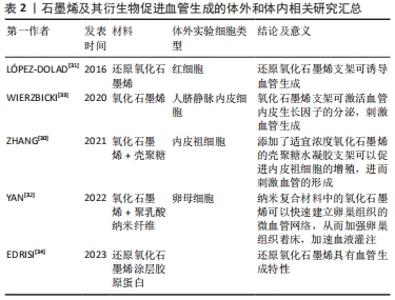
2.2 石墨烯及其衍生物的促血管生成活性 2.2.1 石墨烯及其衍生物促血管化的体外和体内研究 尽管石墨烯及其衍生物被广泛应用,但是血管化不足仍是体内组织工程失败的重要原因。血管化是组织工程移植物成功融入宿主体内的关键因素[25],血管生成被认为是组织修复的生物学基础。研究证实氧化石墨烯及还原氧化石墨烯均具有血管生成特性[26]。KAWAMOTO等[27]将氧化石墨烯添加至3D打印胶原支架中,并将其植入比格犬Ⅱ度根分叉病变的缺损处,术后4周即在氧化石墨烯胶原支架中检测到表达RECA-1阳性内皮细胞形成的血管样结构。REHMAN等[28]为了评价还原氧化石墨烯的诱导血管生成潜力,采用鸡胚血管生成法作为标准检测方法,结果显示,经空白甲基丙烯酸酐化明胶水凝胶处理的样品没有显示出任何显著的血管生成活性,而含有质量分数0.002%还原氧化石墨烯的甲基丙烯酸酐化明胶水凝胶可在鸡胚模型中诱导生成大量具有高度分枝毛细血管网络的血管,这可能与还原氧化石墨烯促进细胞内的活性氧浓度增加有关。JIAO等[29]研究发现,在与明胶还原氧化石墨烯刺激的骨髓间充质干细胞共培养3 d后,脐静脉内皮细胞的毛细血管形成能力增加,石墨烯类材料可在适当剂量的应用下诱导局部缺氧微环境,促进间充质干细胞的血管生成及分化。通过多项体外和体内实验可见,在一定浓度范围内,石墨烯及其衍生物可诱导血管生成[30-34],且细胞毒性不显著,见表2。"
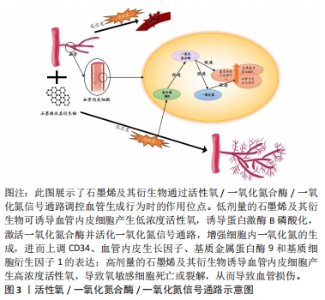
2.2.2 石墨烯及其衍生物对血管化相关细胞的影响 石墨烯及其衍生物可以促进细胞迁移:血管生成起源于内皮细胞(分化为尖端细胞的茎细胞)的分化,其过程包括内皮细胞的激活、增殖和向血管生成刺激物迁移[35],细胞迁移是血管生成过程中的重要步骤。在血管生成因子的刺激下,活化的内皮尖端细胞延伸丝状伪足并迁移以诱导新血管的发芽,在最终形成的血管形态中起决定性作用。LIU等[36]研究发现纳米级氧化石墨烯可提高内皮细胞中血管内皮细胞表面受体、δ样蛋白4和CD34蛋白的表达水平,这可在血管生成的早期阶段促进内皮尖端细胞表型,从而促进细胞迁移和血管新生。 石墨烯及其衍生物可促进间充质干细胞的黏附和增殖:间充质干细胞分泌的因子,如血管内皮生长因子、表皮生长因子等在新血管形成中可发挥重要作用[37]。间充质干细胞与血管稳定、平滑肌细胞迁移和基质重塑相关的因子密切相关,如转化生长因子β、血小板衍生生长因子β和基质金属蛋白酶9,以及高水平的基质细胞衍生因子1α趋化因子,后者可参与促血管生成的巨噬细胞和骨髓间充质干细胞自身的募集和保留[38]。SHIN等[39]报道,随着石墨烯浓度的增加(复合物中的石墨烯浓度为0.25%-1%),间充质干细胞中血管生成蛋白的表达水平提高。由此可见,石墨烯及其衍生物可通过促进间充质干细胞的表达来激活血管生长因子,从而提高其促血管生成活性。 石墨烯及其衍生物可促进血管平滑肌细胞的生长:血管平滑肌细胞是构成血管中膜的主要细胞成分,在血管发育的各个阶段起着至关重要的作用。SHIN等[40]对原代培养的血管平滑肌细胞在RGD-氧化石墨烯-聚乳酸-羟基乙酸共聚物纳米纤维垫上的初始附着和增殖进行了评估,发现其可为血管平滑肌细胞的生长提供所需的微环境,氧化石墨烯的加入能够有效促进血管平滑肌细胞的附着和增殖。 以上研究表明,石墨烯及其衍生物可通过促进尖端内皮细胞表型、促进间充质干细胞的黏附和增殖以及促进血管平滑肌细胞的生长,对血管生成起到促进和稳定的作用。以往关于石墨烯及其衍生物的血管生成作用的研究大多局限于其相对生长因子的递送和对新形成血管的观察,而忽视了其与内皮细胞等的相互作用。研究者们可以通过研究石墨烯及其衍生物诱导血管内皮细胞等分泌的细胞因子,剖析其对活化血管内皮细胞的细胞应激行为,为血管内皮细胞激活剂的设计提供一条新思路。 2.2.3 石墨烯及其衍生物促血管化的相关细胞因子和信号通路 对石墨烯及其衍生物促血管化相关分子和通路进行研究,可以明确在血管化过程中的促进和抑制因素,便于更好地调控血管化过程。石墨烯及其衍生物促血管化涉及多种细胞因子,主要有血管内皮生长因子、碱性成纤维细胞生长因子和肝细胞生长因子等,这些生长因子是诱导血管生成的主要生长因子[41]。血管内皮生长因子通过调节周围组织中内皮细胞的增殖、迁移,最终形成管状结构,从而激活内皮细胞的表达[42],特别是在低氧环境下,血管内皮生长因子可与内皮细胞膜上的血管内皮生长因子受体结合,引起受体的自身磷酸化,从而活化蛋白激酶,诱导内皮细胞增生。PARK等[41]研究发现,还原氧化石墨烯可增强细胞与细胞外基质的相互作用,从而通过介导纤连蛋白整合素的结合增加了血管内皮生长因子的数量,并增强了磷酸化局部黏着斑激酶、磷酸化细胞外调节蛋白激酶以及血管内皮生长因子的表达。碱性成纤维细胞生长因子是多种细胞类型的有丝分裂原,如成纤维细胞、内皮细胞和平滑肌细胞,其可在体外刺激以上细胞的增殖和分裂,从而促进血管生成。此外,石墨烯及其衍生物还可以调控其释放,装载碱性成纤维细胞生长因子的氧化石墨烯修饰的胶原-壳聚糖复合膜,可以持续释放碱性成纤维细胞生长因子至少28 d。添加氧化石墨烯并没有产生额外的细胞毒性作用,而是在细胞黏附和增殖方面表现出良好的体外生物相容性。肝细胞生长因子也是一类具有血管生成能力的因子,可通过其受体c-Met调控上皮细胞、内皮细胞和造血干细胞的生长,并可通过增加抗凋亡因子Bcl-2 的表达、减少凋亡因子caspase3的表达而促进血管形成。研究表明,石墨烯及其衍生物可以促进以上生长因子在间充质干细胞内的表达,从而在促进血管生成过程中起到重要作用[41]。 血管生成是原有血管发展成新血管的过程,受多种信号通路的控制[26]。目前被广泛证实的主要为活性氧/一氧化氮合酶/一氧化氮信号通路。石墨烯具有促血管生成活性,是一种基于细胞内活性氧和活性氮物种的形成以及磷酸化一氧化氮合酶和蛋白激酶B激活的机制。一氧化氮作为一种低分子气体信号分子,在生理性和病理性血管生成中起着关键作用[43],通过调控一氧化氮的表达来控制血压和血管张力,这可作为促血管生成的治疗策略[44]。有研究认为,还原氧化石墨烯和氧化石墨烯的促血管生成/抗血管生成活性取决于其纳米颗粒的浓度以及这些物质诱导的活性氧产生的数量[18,44]。在人脐静脉内皮细胞中,低剂量的氧化石墨烯或还原氧化石墨烯(1-100 ng/mL)诱导了人脐静脉内皮细胞中活性氧的细胞内形成,进而激活一氧化氮合酶,促使人脐静脉内皮细胞内形成一氧化氮和使血管皮生长因子表达增多[45],这介导了内皮细胞增殖和迁移,并调节体内血管生成。此外,还原氧化石墨烯和氧化石墨烯可以诱导蛋白激酶B磷酸化的激活,这进一步增强了一氧化氮合酶的磷酸化,导致细胞内一氧化氮水平升高,最终促进血管生成。与之相反,高浓度的还原氧化石墨烯和氧化石墨烯(100 ng/mL)会诱导机体产生过量活性氧,其具有抗血管生成的特性。 由此可见,石墨烯及其衍生物可增加生物系统中活性氧浓度,通过诱导一氧化氮合酶激活一氧化氮信号通路,增强细胞内一氧化氮的生成,进而上调血管生成相关因子CD34、血管内皮生长因子、基质金属蛋白酶9和基质细胞衍生因子1的表达[30],促进内皮细胞增殖和迁移,从而诱导新生血管形成,见图3。"
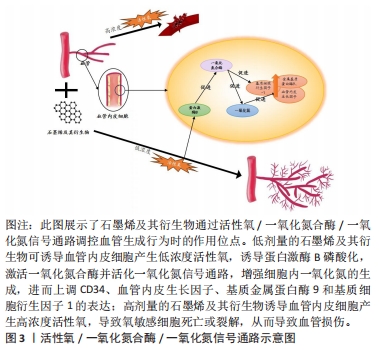
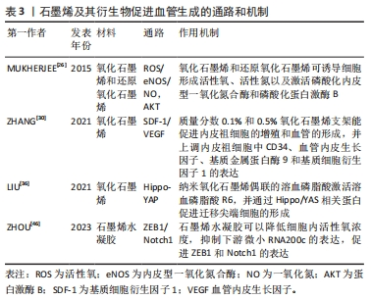
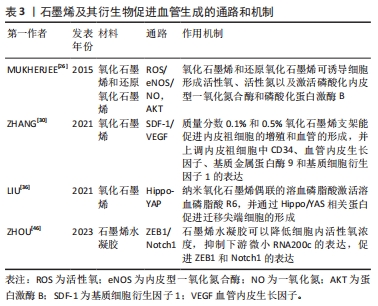
石墨烯及其衍生物除了通过调节活性氧、活性氮的浓度来参与血管生成,还可以通过其他多种信号通路促进血管生成。EDRISI等[34]通过整合素介导的细胞接触的黏着斑激酶激活途径描述了石墨烯的血管生成机制,黏着斑激酶的磷酸化激活细胞外信号调节激酶,从而增加血管内皮生长因子的产生。纤连蛋白可以吸附在纳米石墨烯上,这反过来又可以增强由纤连蛋白整合素结合介导的细胞间的相互作用,导致血管生成相关生长因子如血管内皮生长因子、肝细胞生长因子和成纤维细胞生长因子2的表达和分泌增强,从而促进血管生成。 此外,石墨烯及其衍生物可以通过Hippo-YAP信号通路激活内皮尖端细胞,进而促进血管生成。LIU等[36]对CD34和DLL4进行双免疫荧光染色,发现经纳米级氧化石墨烯复合溶血磷脂酸治疗后,大鼠内皮尖端细胞数量增加。溶血磷脂酸与纳米级氧化石墨烯的结合可能是通过改变溶血磷脂酸的亚型和生物学活性从而影响了溶血磷脂酸在特定环境下的分布,并激活了溶血磷脂酸R6,进而上调了人脐静脉内皮细胞中血管内皮生长因子受体2、DLL4和CD34的表达,并通过Hippo-YAP信号诱导内皮尖端细胞分化,从而促进体外和体内血管生成。 研究表明,石墨烯及其衍生物可诱导血管生成的活性氧/一氧化氮合酶/一氧化氮通路、溶血磷脂酸R6/Hippo-YAP通路、基质细胞衍生因子1/血管内皮生长因子通路、ZEB1/Notch1通路等多种信号通路[26,30,36,46],见表3。由此可见,石墨烯及其衍生物促进血管生成不是由单一的通路引起的,而是由多条信号通路共同作用,这些研究为石墨烯及其衍生物应用于临床提供了理论依据。 "
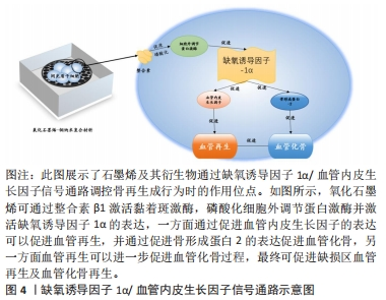
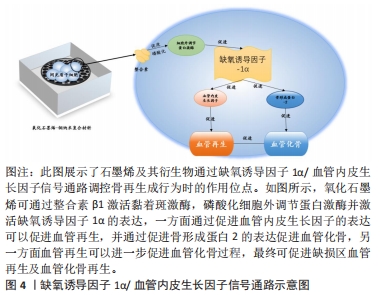
2.3 石墨烯及其衍生物的血管化骨活性 体外构建的组织工程化骨,植入体内后同样必须迅速建立充分的血供,为种子细胞功能活动提供充足的营养,只有这样才能保证组织工程化骨的活性和促进骨缺损的修复。血管生成与骨生成是高度耦合的过程,因此,在骨修复过程中促进机体血管生成对实现理想的骨再生至关重要[47]。石墨烯及其衍生物可以磷酸化细胞外调节蛋白激酶并激活缺氧诱导因子1,进而促进血管内皮生长因子和骨形态生成蛋白2的表达上调,血管内皮生长因可诱导血管生成,促进骨再生过程中营养物质的形成和运输[48],并且可以和骨形成蛋白2联合促进血管化骨再生。 2.3.1 石墨烯及其衍生物增强血管内皮生长因子和形成蛋白2的表达 为了进一步提高氧化石墨烯的生物活性、促进骨再生,骨形成蛋白和血管内皮生长因子等一些具有成骨或血管生成作用的细胞因子被加载到氧化石墨烯中[49]。BURGER等[50]在研究中发现血管内皮生长因子供应模式是血管化骨再生治疗的关键。通过纤维蛋白基质的修饰,血管内皮生长因子蛋白的均匀分布可以有效刺激成骨移植物中的血管形成和骨生成。血管形成和成骨的有效耦合转化可加速血管浸润,并在修复临界大小的颅骨缺损时显著改善骨生成能力。ZHANG等[51]在实验中观察到经氧化石墨烯-铜诱导3 d后,大鼠骨髓间充质干细胞中血管生成和成骨的两大主要调控因子——血管内皮生长因子和骨形成蛋白2的表达明显增强。血管内皮生长因子和骨形成蛋白2是成骨成血管诱导因子,二者联合使用可以显著促进血管化骨再生,这可能是通过募集自体干细胞并进一步促进成骨成血管分化而实现的。 2.3.2 石墨烯及其衍生物激活缺氧诱导因子1α,活化细胞外调节蛋白激酶通路 ZHANG等[51]发现将氧化石墨烯-铜纳米复合材料与大鼠间充质干细胞孵育可激活缺氧诱导因子1α,并通过细胞外调节蛋白激酶信号通路进一步增强血管内皮生长因子和骨形成蛋白2的表达。缺氧诱导因子处于氧感知通路的中心位置,与下游超过100种血管生成相关因子共同构成了复杂的血管生成调节网络。在骨骼发育和再生过程中,血管生成和骨生成是耦合的,缺氧诱导因子1α可能是通过调节血管生成和骨生成而加速骨再生的关键介质[52]。 为了进一步阐明氧化石墨烯-铜纳米复合材料促进血管生成和成骨的分子机制,ZHANG等[51]检测了缺氧诱导因子1及其抑制剂VHL的表达和细胞外调节蛋白激酶的磷酸化,结果显示氧化石墨烯和氧化石墨烯-铜促进了细胞外调节蛋白激酶的磷酸化、缺氧诱导因子1α的表达并抑制了VHL的表达,表明氧化石墨烯可通过整合素β1/局部黏着斑激酶信号通路,磷酸化细胞外调节蛋白激酶,进而促进血管内皮细胞在干细胞中的表达。JIAO等[53]证实,还原氧化石墨烯的添加可以促进细胞外调节蛋白激酶和蛋白激酶B途径的磷酸化、血管内皮生长因子和Runt相关转录因子对骨钙素和骨桥蛋白的表达,并证实了Runt相关转录因子2和血管内皮生长因子的表达上调是由细胞外调节蛋白激酶和蛋白激酶B信号通路的激活引起的。 综上,氧化石墨烯和氧化石墨烯-铜材料能够通过磷酸化细胞外调节蛋白激酶并激活缺氧诱导因子1α的表达,进而促进了成骨成血管诱导因子、血管内皮生长因子和骨形成蛋白2的表达上调,这可以进一步募集更多的宿主细胞进入组织缺损区并诱导其分化,最终可促进缺损区血管再生及血管化骨再生,见图4。但研究发现缺氧诱导因子1α可调控血管内皮生长因子编码基因,分泌型糖蛋白、丝裂原活化蛋白激酶及磷脂酰肌醇3激酶等通路也可影响血管内皮生长因子的表达,这些通路与缺氧诱导因子1α是否为级联关系尚未有研究阐明。"

2.3.3 石墨烯及其衍生物血管化骨的免疫途径 HOYLE等[54]在慢性脊髓半切大鼠模型中发现,未功能化或药物/细胞负载的还原氧化石墨烯支架可有效激活巨噬细胞向M2表型极化。M2巨噬细胞分泌血管内皮生长因子,可通过与血管内皮生长因子和精氨酸酶1结合,促进血管生成并提供成骨所需的氧气和营养物质[55]。GDFE(由多肽与聚多巴胺和氧化石墨烯的动态交联制备而成)刺激巨噬细胞向M2表型极化,其修复性分泌物通过旁分泌机制可显著改善人脐静脉内皮细胞在体外的迁移和血管生成[56]。王伟[57]在研究中发现氧化石墨烯刺激的巨噬细胞条件培养基不仅可以促进间充质干细胞的成骨分化,而且可以刺激人脐静脉细胞融合细胞迁移和小管生成,以上研究表明氧化石墨烯不仅能够调控巨噬细胞的分化,而且可以通过免疫途径促进干细胞的成骨分化和内皮细胞的血管形成。 2.4 石墨烯及其衍生物的应用 石墨烯及其衍生物促血管生成和血管化骨特性有助于在缺血组织中产生新血管,在应用于生物医学中显示出巨大的优势和潜能,特别是在心脏、神经、骨骼组织工程和创伤愈合中的应用。据报道,由于氧化石墨烯薄片表面的π键分布,添加低比例的氧化石墨烯/还原氧化石墨烯可以促进神经元迁移到多孔支架中,并促进血管生成;再生后的毛细血管可为神经元再生提供必要的营养,进一步引导神经细胞的增殖和迁移[58]。心肌内注射含有还原氧化石墨烯的藻酸盐水凝胶具有良好的生物相容性,KARIMI等[59]研究表明,心肌内注射还原氧化石墨烯/海藻酸盐对于增加心肌梗死后左心室功能、新生血管形成和调整电特性是安全的。氧化石墨烯也被认为是一种血管内皮生长因子系统,用于治疗缺血性疾病[60]。还原氧化石墨烯已被证明能有效提高间充质干细胞对缺血性心脏病的治疗效力[61]。常规使用的细胞因子(血管内皮生长因子及碱性成纤维细胞生长因子)作为治疗性血管生成剂与一些局限性有关,包括非特异性、纤维化和血栓形成。在这种情况下,基于石墨烯及其衍生物的纳米药物可能是一种更有前景的血管生成剂,用于治疗心血管相关疾病。血管化不足已成为骨修复中的一个严重问题,在骨修复的过程中,受损部位的血管新生情况决定了其损伤修复的程度。当骨缺损或骨折时,石墨烯及其衍生物支架材料可与成骨祖细胞结合起来,促进血管化骨,加快骨组织的愈合。尽管有几个关键问题和挑战尚不清楚,但石墨烯及其衍生物的结果表明了在未来潜在的生物医学应用。为了验证氧化石墨烯作为治疗多种疾病的潜在血管生成治疗纳米药物,迫切需要严格的临床前和临床研究。经过详细的临床前和临床研究,并对其生物安全性、潜在的长期毒性、药物动力学及生物利用度等进行适当评估,文章认为石墨烯及其衍生物可能是未来治疗心血管疾病、缺血性疾病最有前景的纳米药物之一。"

| [1] 任文燕,刘雪,王一宇.石墨烯及衍生物治疗牙周病:有利于成骨分化及牙周支持组织的重建[J].中国组织工程研究,2023,27(12):1954-1960. [2] LA WG, PARK S, YOON HH, et al. Delivery of a therapeutic protein for bone regeneration from a substrate coated with graphene oxide. Small. 2013;9(23): 4051-4060. [3] XU Z, WANG S, LI Y, et al. Covalent functionalization of graphene oxide with biocompatible poly(ethylene glycol) for delivery of paclitaxel. ACS Appl Mater Interfaces. 2014;6(19):17268-17276. [4] SUN X, LIU Z, WELSHER K, et al. Nano-graphene oxide for cellular imaging and drug delivery. Nano Res. 2008;1(3):203-212. [5] CHENG X, WAN Q, PEI X. Graphene family materials in bone tissue regeneration: perspectives and challenges. Nanoscale Res Lett. 2018;13:289. [6] 喻飞宇,吴惠霞.石墨烯量子点的制备及其在生物医学领域的应用[J].上海师范大学学报(自然科学版),2022,51(5):684-692. [7] 张园园,杨宁文,何星.氧化石墨烯的表面处理及其在生物医学领域的应用[J].有色金属材料与工程,2022,43(2):51-60. [8] GANESH BM, ISLOOR AM, ISMAIL AF. Enhanced hydrophilicity and salt rejection study of graphene oxide-polysulfone mixed matrix membrane. Desalination. 2013;313(7):199-207. [9] RHAZOUANI A, GAMRANI H, EL ACHABY M, et al. Synthesis and toxicity of graphene oxide nanoparticles: a literature review of in vitro and in vivo studies. Biomed Res Int. 202;2021:5518999. [10] KENRY, LEE WC, LOH KP, et al. When stem cells meet graphene: opportunities and challenges in regenerative medicine. Biomaterials. 2018;155:236-250. [11] SINGH DP, HERRERA CE, SINGH B, et al. Graphene oxide: an efficient material and recent approach for biotechnological and biomedical applications. Mater Sci Eng C Mater Biol Appl. 2018;86:173-197. [12] WANG K, RUAN J, SONG H, et al. Biocompatibility of graphene oxide. Nanoscale Res Lett. 2011;6(1):8. [13] YUAN J, GAO H, SUI J, et al. Cytotoxicity evaluation of oxidized single-walled carbon nanotubes and graphene oxide on human hepatoma HepG2 cells: an iTRAQ-coupled 2D LC-MS/MS proteome analysis. Toxicol Sci. 2012;126(1):149-161. [14] NEWMAN L, JASIM DA, PRESTAT E, et al. Splenic Capture and In Vivo Intracellular Biodegradation of Biological-Grade Graphene Oxide Sheets. ACS Nano. 2020; 14(8):10168-10186. [15] 王洁,刘加强,房兵,等.氧化石墨烯对大鼠骨髓间充质干细胞生物活性的影响[J].组织工程与重建外科杂志,2013,9(6):306-310, 314. [16] YANG K, GONG H, SHI X, et al. In vivo biodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administration. Biomaterials. 2013;34(11):2787-2795. [17] WYCHOWANIEC JK, LITOWCZENKO J, TADYSZAK K. Fabricating versatile cell supports from nano- and micro-sized graphene oxide flakes. J Mech Behav Biomed Mater. 2020;103:103594. [18] WEN KP, CHEN YC, CHUANG CH, et al. Accumulation and toxicity of intravenously-injected functionalized graphene oxide in mice. J Appl Toxicol. 2015;35(10): 1211-1218. [19] CHNG EL, PUMERA M. The toxicity of graphene oxides: dependence on the oxidative methods used. Chemistry. 2013;19(25):8227-8235. [20] ZHANG W, YAN L, LI M, et al. Deciphering the underlying mechanisms of oxidation-state dependent cytotoxicity of graphene oxide on mammalian cells. Toxicol Lett. 2015;237(2):61-71. [21] 马丽娟,张明兴,李斐,等.石墨烯纳米材料的生物安全性研究进展[J].鲁东大学学报(自然科版),2020,36(1):60-70. [22] QU G, LIU S, ZHANG S, et al. Graphene oxide induces toll-like receptor 4 (TLR4)-dependent necrosis in macrophages. ACS Nano. 2013;7(7):5732-5745. [23] YANG K, WAN J, ZHANG S, et al. In vivo pharmacokinetics, long-term biodistribution, and toxicology of PEGylated graphene in mice. ACS Nano. 2011;5(1):516-522. [24] WANG X, PODILA R, SHANNAHAN JH, et al. Intravenously delivered graphene nanosheets and multiwalled carbon nanotubes induce site-specific Th2 inflammatory responses via the IL-33/ST2 axis. Int J Nanomedicine. 2013;8:1733-1748. [25] ROSSI L, ATTANASIO C, VILARDI E, et al. Vasculogenic potential evaluation of bottom-up, PCL scaffolds guiding early angiogenesis in tissue regeneration. J Mater Sci Mater Med. 2016;27(6):107. [26] MUKHERJEE S, SRIRAM P, BARUI AK, et al. Graphene oxides show angiogenic properties. Adv Healthc Mater. 2015;4(11):1722-1732. [27] KAWAMOTO K, MIYAJI H, NISHIDA E, et al. Characterization and evaluation of graphene oxide scaffold for periodontal wound healing of class II furcation defects in dog. Int J Nanomedicine. 2018;13:2365-2376. [28] REHMAN SRU, AUGUSTINE R, ZAHID AA, et al. Reduced graphene oxide incorporated gelma hydrogel promotes angiogenesis for wound healing applications. Int J Nanomedicine. 2019;14:9603-9617. [29] JIAO D, WANG J, YU W, et al. Biocompatible reduced graphene oxide stimulated BMSCs induce acceleration of bone remodeling and orthodontic tooth movement through promotion on osteoclastogenesis and angiogenesis. Bioact Mater. 2022; 15:409-425. [30] ZHANG L, LI X, SHI C, et al. Biocompatibility and angiogenic effect of chitosan/graphene oxide hydrogel scaffolds on EPCs. Stem Cells Int. 2021;2021:5594370. [31] LÓPEZ-DOLADO E, GONZÁLEZ-MAYORGA A, GUTIÉRREZ MC, et al. Immunomodulatory and angiogenic responses induced by graphene oxide scaffolds in chronic spinal hemisected rats. Biomaterials. 2016;99:72-81. [32] YAN L, WANG L, WU J, et al. Multi-biofunctional graphene oxide-enhanced poly-L-lactic acid composite nanofiber scaffolds for ovarian function recovery of transplanted-tissue. NPJ Regen Med. 2022;7(1):52. [33] WIERZBICKI M, HOTOWY A, KUTWIN M, et al. Graphene oxide scaffold stimulates differentiation and proangiogenic activities of myogenic progenitor cells. Int J Mol Sci. 2020;21(11):4173. [34] EDRISI F, BAHEIRAEI N, RAZAVI M, et al. Potential of graphene-based nanomaterials for cardiac tissue engineering. J Mater Chem B. 2023;11(31):7280-7299. [35] 张逸,任思聪,皇甫慧敏,等.支架材料对成血管微环境的影响及作用机制[J].中国组织工程研究,2023,27(21):3391-3397. [36] LIU W, LUO H, WEI Q, et al. Electrochemically derived nanographene oxide activates endothelial tip cells and promotes angiogenesis by binding endogenous lysophosphatidic acid. Bioact Mater. 2021;9:92-104. [37] CHEN L, TREDGET EE, WU PY, et al. Paracrine factors of mesenchymal stem cells recruit macrophages and endothelial lineage cells and enhance wound healing. PLoS One. 2008;3(4):e1886. [38] LASOCKA I, JASTRZĘBSKA E, SZULC-DĄBROWSKA L, et al. The effects of graphene and mesenchymal stem cells in cutaneous wound healing and their putative action mechanism. Int J Nanomedicine. 2019;14:2281-2299. [39] SHIE MY, CHIANG WH, CHEN IP, et al. Synergistic acceleration in the osteogenic and angiogenic differentiation of human mesenchymal stem cells by calcium silicate-graphene composites. Mater Sci Eng C Mater Biol Appl. 2017;73:726-735. [40] SHIN YC, KIM J, KIM SE, et al. RGD peptide and graphene oxide co-functionalized PLGA nanofiber scaffolds for vascular tissue engineering. Regen Biomater. 2017; 4(3):159-166. [41] PARK J, KIM YS, RYU S, et al. Graphene potentiates the myocardial repair efficacy of mesenchymal stem cells by stimulating the expression of angiogenic growth factors and gap junction protein. Adv Funct Mater. 2015;25(17):2590-2600. [42] FUNOVICS P, BROSTJAN CNIGISCH A, et al. Effects of 15d-PGJ2 on VEGF-induced angiogenic activities and expression of VEGF receptors in endothelial cells. Vas Pharmacol. 2006;45(3):e20-e21. [43] 蔡维霞.Notch信号调控ROS产生对血管内皮细胞生物学行为的影响[D].西安:第四军医大学,2013. [44] D’AMORA U, DACRORY S, HASANIN MS, et al. Advances in the physico-chemical, antimicrobial and angiogenic properties of graphene-oxide/cellulose nanocomposites for wound healing. Pharmaceutics. 2023;15(2):338. [45] QIAN Y, SONG J, ZHAO X, et al. 3D Fabrication with integration molding of a graphene oxide/polycaprolactone nanoscaffold for neurite regeneration and angiogenesis. Adv Sci (Weinh). 2018;5(4):1700499. [46] ZHOU J, LI Y, HE J, et al. ROS scavenging graphene-based hydrogel enhances type H vessel formation and vascularized bone regeneration via ZEB1/Notch1 mediation. Macromol Biosci. 2023;23(4):e2200502. [47] ZHUANG Y, CHENG M, LI M, et al. Small extracellular vesicles derived from hypoxic mesenchymal stem cells promote vascularized bone regeneration through the miR-210-3p/EFNA3/PI3K pathway. Acta Biomater. 2022;150:413-426. [48] JAIDEV LR, KUMAR S, CHATTERJEE K. Multi-biofunctional polymer graphene composite for bone tissue regeneration that elutes copper ions to impart angiogenic, osteogenic and bactericidal properties. Colloids Surf B Biointerfaces. 2017;159:293-302. [49] WANG W, LIU Y, YANG C, et al. Delivery of salvianolic acid B for efficient osteogenesis and angiogenesis from silk fibroin combined with graphene oxide. ACS Biomater Sci Eng. 2020;6(6):3539-3549. [50] BURGER MG, GROSSO A, BRIQUEZ PS, Et al. Robust coupling of angiogenesis and osteogenesis by VEGF-decorated matrices for bone regeneration. Acta Biomater. 2022;149:111-125. [51] ZHANG W, CHANG Q, XU L, et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of Hif-1α. Adv Healthc Mater. 2016;5(11):1299-1309. [52] ZOU D, ZHANG Z, YE D, et al. Repair of critical-sized rat calvarial defects using genetically engineered bone marrow-derived mesenchymal stem cells overexpressing hypoxia-inducible factor-1α. Stem Cells. 2011;29(9):1380-1390. [53] JIAO D, ZHENG A, LIU Y, et al. Bidirectional differentiation of BMSCs induced by a biomimetic procallus based on a gelatin-reduced graphene oxide reinforced hydrogel for rapid bone regeneration. Bioact Mater. 2020;6(7):2011-2028. [54] HOYLE C, RIVERS-AUTY J, LEMARCHAND E, et al. Small, thin graphene oxide is anti-inflammatory activating nuclear factor erythroid 2-related factor 2 via metabolic reprogramming. ACS Nano. 2018;12(12):11949-11962. [55] GE YW, LIU XL, YU DG, et al. Graphene-modified CePO4 nanorods effectively treat breast cancer-induced bone metastases and regulate macrophage polarization to improve osteo-inductive ability. J Nanobiotechnol. 2021;19(1):11. [56] LUO Z, QI B, SUN Y, et al. Engineering bioactive M2 macrophage-polarized, anti-inflammatory, miRNA-based liposomes for functional muscle repair: from exosomal mechanisms to biomaterials. Small. 2022;18(34):e2201957. [57] 王伟.氧化石墨烯促进成骨分化及修复骨缺损的研究[D].上海:上海交通大学,2020. [58] YANG B, WANG PB, MU N, et al. Graphene oxide-composited chitosan scaffold contributes to functional recovery of injured spinal cord in rats. Neural Regen Res. 2021;16(9):1829-1835. [59] KARIMI HAJISHOREH N, BAHEIRAEI N, NADERI N, et al. Left ventricular geometry and angiogenesis improvement in rat chronic ischemic cardiomyopathy following injection of encapsulated mesenchymal stem cells. Cell J. 2022;24(12):741-747. [60] SUN Z, HUANG P, TONG G, et al. VEGF-loaded graphene oxide as theranostics for multi-modality imaging-monitored targeting therapeutic angiogenesis of ischemic muscle. Nanoscale. 2013;5(15):6857-6866. [61] NORAHAN MH, POURMOKHTARI M, SAEB MR, et al. Electroactive cardiac patch containing reduced graphene oxide with potential antibacterial properties. Mater Sci Eng C Mater Biol Appl. 2019;104:109921. [62] PAUL A, HASAN A, KINDI HA, et al. Injectable graphene oxide/hydrogel-based angiogenic gene delivery system for vasculogenesis and cardiac repair. ACS Nano. 2014;8(8):8050-8062. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [3] | Wei Juan, Li Ting, Huan Mengting, Xie Ying, Xie Zhouyu, Wei Qingbo, Wu Yunchuan. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1271-1276. |
| [4] | Yue Yun, Wang Peipei, Yuan Zhaohe, He Shengcun, Jia Xusheng, Liu Qian, Li Zhantao, Fu Huiling, Song Fei, Jia Menghui. Effects of croton cream on JNK/p38 MAPK signaling pathway and neuronal apoptosis in cerebral ischemia-reperfusion injury rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1186-1192. |
| [5] | Liu Xin, Hu Man, Zhao Wenjie, Zhang Yu, Meng Bo, Yang Sheng, Peng Qing, Zhang Liang, Wang Jingcheng. Cadmium promotes senescence of annulus fibrosus cells via activation of PI3K/Akt signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1217-1222. |
| [6] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [7] | Wang Yeyuan, Du Yilang, Yu Dehao, Ning Fengting, Bai Bing. Effect of micro-arc oxidation treatment on biological activity of medical metals [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 771-776. |
| [8] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [9] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [10] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [11] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [12] | Hu Guangzhi, Lu Hongyan. Changes in pulmonary pericytes and tube formation of pulmonary vascular endothelial cells in mouse models of broncho-pulmonary dysplasia [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 522-527. |
| [13] | Wei Yuanxun, Chen Feng, Lin Zonghan, Zhang Chi, Pan Chengzhen, Wei Zongbo. The mechanism of Notch signaling pathway in osteoporosis and its prevention and treatment with traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 587-593. |
| [14] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [15] | Qian Longjie, Su Wenli, Zhu Wenxian, Wang Yixin. SRT1720, an activator of silent information regulator 1, alleviates acute traumatic brain injury in a rat model [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(28): 4447-4454. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||