Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (10): 1620-1625.doi: 10.12307/2024.311
Previous Articles Next Articles
Regenerative endodontic therapy based on tissue engineering mediating by inflammatory microenvironment
Rao Jin, Jiang Shui, Shi Haishan
- School of Stomatology, Jinan University, Guangzhou 510632, Guangdong Province, China
-
Received:2023-04-08Accepted:2023-05-13Online:2024-04-08Published:2023-08-21 -
Contact:Shi Haishan, PhD, Associate professor, Master’s supervisor, School of Stomatology, Jinan University, Guangzhou 510632, Guangdong Province, China -
About author:Rao Jin, School of Stomatology, Jinan University, Guangzhou 510632, Guangdong Province, China -
Supported by:Basic and Applied Basic Research Project of Guangzhou Science and Technology Plan Program, No. 202102021127 (to SHS)
CLC Number:
Cite this article
Rao Jin, Jiang Shui, Shi Haishan. Regenerative endodontic therapy based on tissue engineering mediating by inflammatory microenvironment[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(10): 1620-1625.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
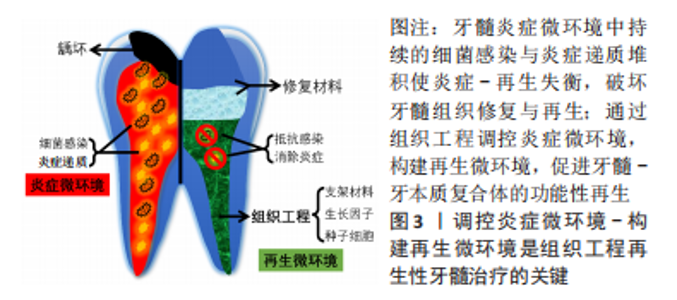
2.1 炎症牙髓微环境的变化 当牙髓发生炎症时,其微环境的变化与牙髓组织再生进程息息相关,了解炎症牙髓微环境的变化有利于制定更为适宜的临床干预手段以构建适宜的牙髓再生微环境。微环境是稳定维持正常细胞增殖、分化、代谢和功能活动的重要因素,其变化直接影响细胞功能和组织稳态。稳定的牙髓微环境维持着驻留干细胞的自我更新和分化能力,对干细胞在组织修复和体内平衡的调节至关重要。细菌感染及外源性刺激会直接导致牙髓微环境失衡,牙髓细胞会通过受体识别激活防御机制应对细菌侵袭,释放炎症因子和趋化因子,形成炎症微环境。这一系列复杂的细胞和分子反应旨在保护牙髓免受进一步的损害,加速牙髓组织损伤修复进程。 牙髓炎最早发生的症状之一是炎症区域的血流增加,这种血流的增加被称为炎性充血,是组织对损伤或炎症的一种正常反应。炎性充血有助于将免疫细胞及细胞因子输送到损伤或炎症部位。随着炎症的持续存在,牙髓产生和释放的炎症递质不断增加,如细胞因子、趋化因子和前列腺素等,其机制反应始于由Toll样受体(toll-like receptor,TLR)4/2阳性细胞介导的血管变化,帮助组织抵御感染并促进修复和愈合。一项系统回顾结果显示,各种TLR诱导的炎症递质参与牙髓炎症过程[6],包括可赋予牙髓免疫能力,调节牙髓细胞功能以抵抗炎症刺激。免疫细胞如中性粒细胞、巨噬细胞、淋巴细胞和肥大细胞被招募到炎症区域,这些细胞可以吞噬细菌,分泌炎症递质和调节适应性免疫。 当炎症长期存在或严重时,其对牙髓组织是弊大于利的。LIU等[7]研究发现,炎症产生的肿瘤坏死因子α和白细胞介素1β的短期作用可提高根尖乳头干细胞的增殖和矿化能力,但长期的炎症刺激对干细胞的矿化能力和成牙本质/成骨相关基因的表达有抑制作用,甚至引起细胞凋亡的发生。过多的炎症递质堆积会进一步增加炎症区域的血流量和血管通透性,加重组织损伤和导致脓肿的形成。炎症的牙髓还会产生高水平的活性氧,也会导致组织损伤和加重炎症。基质金属蛋白酶(matrix metalloproteinases,MMPs)在牙髓炎症期间也被激活,参与细胞外基质成分(如胶原蛋白、弹性蛋白和蛋白多糖等)的降解和重塑,产生促进炎症和牙髓坏死崩解的作用。免疫细胞过度地浸润和激活将进一步加速组织的损伤。破骨细胞同时被激活,造成牙齿结构的破坏。过度的炎症也使牙髓细胞如成纤维细胞及干细胞等的活力和功能下降,抑制牙髓-牙本质复合体(pulp-dentin complex)的形成与组织的再生愈合。 相对而言,正常牙髓微环境中炎症细胞保持稳定的平衡状态,炎症因子和趋化因子的表达水平并不高,组织能够保持其结构和功能,细胞外基质成分也保持完整。这是正常牙髓微环境与炎症牙髓微环境的重要区别,免疫平衡对维持牙齿健康至关重要。 总之,炎症牙髓微环境发生的变化是复杂且多方面的,涉及到免疫细胞、细胞因子和其他因素复杂的相互作用。尽管牙髓炎症受多因素影响的观点已被广泛认可,相关因素的独立性研究也日渐受到学者们的关注,但牙髓炎症发生发展后的微环境变化过程及具体机制至今仍不明确。从原理上探明并阐述这些变化对于确定牙髓炎症的病理机制并制定其再生性治疗策略至关重要,关键是如何通过调控牙髓的炎症微环境,营造适宜微环境,使其向有利于牙髓功能性再生的方向发展。基于此,关注与牙髓再生过程紧密相关的炎症问题是未来发展所趋与所需,尤其是要从临床牙髓炎症切入,通过更多的生物医学研究证据探明牙髓炎症微环境的动态演变。 2.2 牙髓炎症与再生 炎症常是组织再生前的必经过程和先决条件[8],在感染得到控制前,炎症的持续存在会严重影响组织修复与再生[9]。根据炎症的类型、强度和持续时间,炎症微环境可对组织再生产生积极或消极影响。一方面,炎症可以促进干细胞的募集、激活和分化为牙髓样组织,从而恢复牙髓活力和牙本质形成。例如:炎症反应中的一些活性分子(如肿瘤坏死因子α和活性氧等)可诱导牙髓干细胞成牙本质细胞样分化;成纤维细胞补体激活也能参与牙髓再生,通过提供补体活性片段、表达补体受体等促进干细胞募集、神经生长及牙本质形成[10-11]。另一方面,有报道指出在某些炎症条件下,牙髓干细胞失去了牙源性再生的潜力,其机制可能与炎症条件下的Wnt4下调有关[12]。炎症还可以通过免疫抑制来损害牙髓干细胞的功能[13]。炎症也会导致牙髓过度纤维化或钙化,从而损害牙髓再生过程[14]。因此,组织炎症与再生是相关联的,二者间存在动态平衡,如通过盖髓术可帮助机体清除感染,消除炎症,促使平衡向再生的方向倾斜[9]。盖髓材料也可调节炎症-再生的平衡状态,如GIRAUD等[15]发现TheraCal?盖髓材料会使平衡向炎症转移,表现为细胞活力下降、促炎细胞因子堆积和炎症细胞过度浸润;Biodentine?和MTA?盖髓材料则将平衡点转向再生,表现为促炎因子分泌受控、炎症细胞招募活动减弱、参与再生过程的因子如碱性成纤维细胞生长因子和转化生长因子β的表达增加,以及牙本质桥的诱导形成等。 当发生深龋等严重损害时,成牙本质细胞层被破坏,牙髓细胞、内皮细胞等可分泌生长因子如血管内皮生长因子、碱性成纤维细胞生长因子等,同时激活补体系统,诱导祖细胞募集,参与再生过程[16]。随后牙髓干细胞迁移至病灶并增殖、分化为成牙本质细胞样细胞,形成修复性牙本质,保护牙髓组织[15]。理想的牙髓再生还应包括血管生成和神经支配,即功能性牙髓再生[17]。牙髓干细胞可通过表达血管内皮生长因子、碱性成纤维细胞生长因子、血小板衍生生长因子及转化生长因子β等诱导血管生成[9,18]。牙髓细胞能持续释放神经营养因子如脑源性神经营养因子,促进神经的生长和支配[16]。基于炎症的有效调控,经历细胞迁移、增殖、牙源性分化、血管与神经生成等复杂过程,可实现牙髓-牙本质复合体结构与功能的完整再生。基于以上理解,炎症与再生是牙髓组织中始终共存和相互作用的状态,在生理学与病理学的角度上,成功的再生性牙髓治疗取决于炎症和再生之间的平衡,如何更好地把握并调控上述平衡或是提高再生性牙髓治疗策略的临床适用性的突破口之一,其中的关键问题之一是亟需明确炎症调控再生的具体机制,还需学者们在未来重视。 2.3 再生性牙髓治疗与组织工程的关系 组织工程应用工程学和生命科学的原理来修复、维持或替代生物功能,通过有目的地调控干细胞、生长因子及支架材料这3个因素的相互作用来促进组织再生。组织工程学的发展极大地推动了再生性牙髓治疗策略的进展。作为再生性牙髓治疗方法之一,牙髓血运重建(pulp revascularization)是目前临床传统根管治疗的最新替代手段,主要适用于牙髓坏死、根尖开放且不需桩核修复的未成熟恒牙[19]。其主要通过人为刺激根尖周组织出血形成血凝块,以之为支架并为组织再生提供足够的生长因子,同时干细胞也随之迁移入已消毒的根管内,最终完成牙髓、牙本质的再生[20]。虽然该血运重建过程部分契合组织工程理念,但与上述的组织工程概念仍存在差异,其更倾向于组织修复而非功能性再生,组织学研究也已证明,通过该方法在牙根末端新产生的硬组织为类似于牙周膜结缔组织的牙骨质样组织而并非牙本质样组织,管腔组织表现为牙骨质样、牙周韧带样、骨样而非髓样组织[1,19,21]。 近年来,基于组织工程学原则的干细胞归巢和移植两种再生性牙髓治疗策略逐渐引起研究者们的关注。与细胞、血管丰富的未成熟牙齿相比,成熟牙齿根尖发育已完成、根尖孔狭窄、血流量有限,牙髓组织的局部再生更加困难。对于牙髓坏死或摘除的恒牙,干细胞归巢和移植具备更大的潜能。细胞归巢策略是将含生长因子的支架注入根管,诱导内源性干细胞迁移、增殖、分化及血管、神经形成;而细胞移植策略则主要通过选用合适的支架材料装载外源性干细胞和生长因子后移植到患牙根管系统内,以实现组织再生[19]。干细胞移植疗程复杂,临床操作敏感性高,存在免疫排斥、成本高昂等问题,实际应用困难;相较之下,细胞归巢策略无需考虑干细胞的来源、分离和扩增问题,操作更简便,消除了免疫排斥问题,在临床上可能更易于实施[22]。目前这两种再生策略还存在诸多问题,尤其是在伦理和安全问题上需要大量的研究依据作为支持,这也是再生性牙髓治疗临床应用的最基本要求。更重要的是,在关注牙髓干细胞归巢与移植的实际应用场景时,炎症微环境在上述策略发挥作用过程中是不可忽略的条件因素,仍需受到足够重视。 2.4 基于炎症微环境的组织工程再生性牙髓治疗策略 干细胞、生长因子及支架材料是组织工程再生性牙髓治疗的三大关键要素。通过调控这些要素协同介导炎症反应以恢复炎症-再生平衡,即调控炎症微环境,构建再生微环境,使正常牙髓组织发育的生物过程得以再现,是成功的组织工程再生性牙髓治疗的核心要点,见图3。"

2.4.1 间充质干细胞 因其具有多向分化和免疫调节的潜能成为目前最具吸引力的骨和牙齿组织再生细胞来源。在干细胞疗法中,选择的供体和受体的微环境对移植的间充质干细胞的再生潜力起着至关重要的作用,表明细胞与其微环境的相互作用在间充质干细胞介导的骨和牙齿组织再生中是不可缺少的。从牙源性组织中可以获得不同类型的间充质干细胞群,牙源性间充质干细胞及其在组织工程再生性牙髓治疗方面的成就已成为近年来的研究热点。牙髓干细胞及其亚群具有高度营养和免疫调节作用以及组织特异性,有临床试验表明通过自体牙髓干细胞移植能够分化增殖形成富有血管、神经的牙髓样组织;牙髓干细胞易从第三磨牙的牙髓中分离、扩增和储存,现被广泛用于再生性牙髓治疗的研究 中[23]。牙髓干细胞包含多个生物活性和功能不同的亚群体,通过表面标记分离这些亚群,可为临床应用提供更合适的细胞源,提高牙髓再生成功率[24]。牙源性组织中还存在多种其他类型的干细胞,如脱落乳牙牙髓干细胞和根尖乳头干细胞来源于牙髓组织或其前体,可作为牙髓再生的潜在干细胞源[1];牙周膜干细胞也能分化为牙源性细胞并形成血管化牙髓样组织[25]。CHEN等[26]用从牙髓中分离出的外泌体诱导根尖乳头干细胞的迁移、增殖和分化,成功再生牙髓样结缔组织。 牙源性干细胞的再生潜力受其所处微环境介导,缺氧缺血的炎症微环境与长期、大量炎症因子的刺激会降低干细胞增殖和分化能力及成牙本质/成骨活性,创造适宜的再生微环境对牙髓的良好再生至关重要[5]。据报道,与常规培养细胞相比,细胞聚集体中含更多细胞因子、细胞外基质蛋白,具有更好的迁移和抗炎能力[27]。XUAN等[28]向牙髓坏死的年轻恒牙中植入脱落乳牙牙髓干细胞聚集体,成功诱导了功能性牙髓组织的再生。HONG等[29]利用牙囊干细胞条件培养基培养炎性牙髓细胞,发现其可将炎症微环境重塑为再生微环境,降低炎性牙髓细胞的促炎因子的表达,并通过免疫调节途径促进炎性牙髓细胞成牙本质分化。 探讨炎症微环境下间充质干细胞的再生潜力,对构建组织工程再生性牙髓治疗策略意义重大。牙髓干细胞作为最具有代表性的牙髓再生研究细胞类型,受到学者们的广泛关注,不少学者将其与炎症联系了起来,从不同方面探究牙髓干细胞在炎症微环境中的细胞行为与调节机制。 PARK等[30]观察到来自炎症组织的牙髓干细胞表现出更高的成骨能力(更强的矿化作用及更高的成骨标记物的表达),白细胞介素6的表达水平也较高。白细胞介素6作为一种强烈的炎症因子,对调节牙髓干细胞功能具有重要意义,对来自健康组织的牙髓干细胞进行白细胞介素6处理,可以刺激它们的成骨分化,减少神经源性分化,而对来自炎症组织的牙髓干细胞进行白细胞介素6阻断,则减弱了它们的成骨/神经源性能力。消退素E1是特异性促炎症消退介质之一,因其在各种炎症性疾病模型中具有出色的抗炎和促进消退作用而备受关注[31-33],围绕牙髓炎症的研究中也不乏消退素E1的身影[34-35]。CHEN等[36]研究发现消退素E1通过炎症微环境中的AKT、ERK和rS6相关信号传导增强了炎症微环境下的牙髓干细胞的增殖、趋化性和牙源性分化。因此,消退素E1可能具有作为促进牙髓炎症消退和组织再生的新治疗策略的潜力。最近研究发现,属于G蛋白偶联受体家族的苦味受体2型(taste 2 receptor,TAS2R)在炎症牙髓组织和脂多糖刺激的牙髓干细胞中显著上调;TAS2R通过G蛋白偶联受体常规信号通路在炎症微环境中介导细胞内Ca2+的增加来促进牙髓干细胞的牙源性分化,从而促进牙髓再生[37]。这些研究提示:通过调控干细胞所处炎症微环境,可促使干细胞向修复愈合的方向发展,提高组织工程再生性牙髓治疗的成功率。然而,损伤修复应当以软组织修复为主,牙髓再生中牙髓样组织和牙本质样组织同样应当保持平衡,避免过度矿化,上调牙髓干细胞的成牙本质分化能力也可能导致根管钙化,这一问题或是该研究领域亟需探明的难点。 文章总结了牙髓干细胞在炎症微环境中调节牙髓再生的细胞行为及相关因子,见表1。"

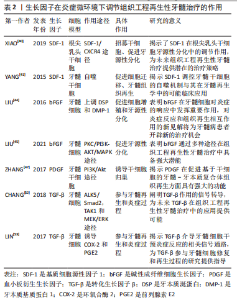
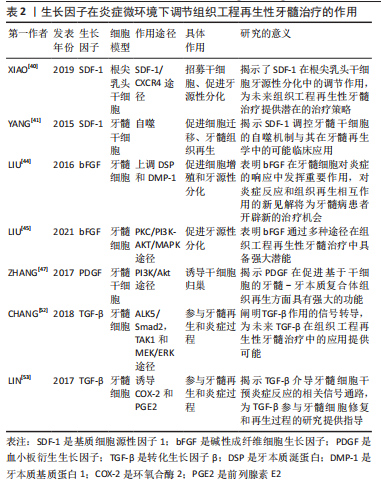
2.4.2 生长因子 组织工程再生性牙髓治疗离不开不同的生长因子和细胞因子高度协调地相互作用[38]。通过适当使用生长因子或细胞因子来刺激牙髓温和的炎症,以创造有利于组织修复和再生的炎症微环境,并充当调节细胞行为(包括细胞的迁移、增殖和分化)的信号分子,是组织工程再生性牙髓治疗可行的策略之一。例如CXC趋化因子亚家族的成员中,基质细胞源性因子1(stromal cell-derived factor-1,SDF-1)可以通过SDF-1/C-X-C趋化因子受体4型(C-X-C motif chemokine receptor 4,CXCR4)途径,诱导多种炎性细胞募集至炎症部位,构建炎症微环境,从而招募牙源性间充质干细胞[39-40]、通过自噬促进血管形成等方式来加快牙髓再生进程[41]。 碱性成纤维细胞生长因子、血小板衍生生长因子和转化生长因子β等也是目前组织工程再生性牙髓治疗中常用的生长因子。碱性成纤维细胞生长因子参与炎症、伤口愈合、细胞增殖与迁移、成骨分化、血管生成和细胞外基质形成等过程[42-43]。在基于炎症微环境的研究中,LIU等[44]发现碱性成纤维细胞生长因子与非编码RNA miR-146a在牙髓细胞的炎症反应中通过上调矿化相关基因牙本质涎蛋白(dentin sialoprotein,DSP)和牙本质基质蛋白1(dentin matrix protein-1,DMP-1)的表达、形成矿物结节促进细胞增殖和牙源性分化,表明二者可能在牙髓细胞炎症和再生的调节中发挥协同作用。碱性成纤维细胞生长因子被认为参与牙髓修复与再生的所有阶段,并通过不同的细胞信号通路来控制特定的生物过程,其中,碱性成纤维细胞生长因子通过PKC/PI3K-AKT/MAPK信号通路上调几种细胞因子(包括白细胞介素8、白细胞介素6、单核细胞趋化蛋白1、巨噬细胞炎症蛋白1α和趋化因子配体20等)的表达来介导牙髓炎症微环境以增强牙髓修复与再生[45]。 血小板衍生生长因子具有趋化性、促进细胞增殖和分化、血管生成等作用[46],已广泛用于组织再生。ZHANG等[47]发现其异构体血小板衍生生长因子BB可通过PI3K/Akt途径诱导内源性干细胞、祖细胞归巢促进牙髓-牙本质复合体的原位再生。LI等[48]收集已完成牙髓治疗的人牙齿,并将血小板衍生生长因子BB、神经生长因子、脑源性神经营养因子与Ⅰ型胶原共同注入其髓腔中,埋入大鼠背部皮下,结果显示移植后实验牙齿髓腔内有牙髓样组织新生,且血管和神经分布良好。目前缺乏关于在炎症微环境下血小板衍生生长因子促进牙髓再生的研究,近期报道血小板衍生生长因子BB可通过JAK2/STAT3,PI3K/AKT和p38信号通路,以及PKA介导的SOX9/RUNX2调节,来抑制炎症和增强细胞增殖[49]。这可能是炎症微环境下血小板衍生生长因子促进牙髓组织修复和再生的机制之一。 转化生长因子β在牙本质蛋白、蛋白酶的合成中发挥关键作用,参与牙髓干细胞矿化,成牙本质细胞也可受其信号刺激分泌基质[50-51]。CHANG等[52]发现转化生长因子β1可能通过调控纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)、尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)及其受体(urokinase-type plasminogen activator receptor,uPAR)的表达参与牙髓的炎症与再生过程。LIN等[53]的研究表明转化生长因子β1能够诱导牙髓细胞的环氧合酶2(cyclooxygenase-2,COX-2)和前列腺素E2表达,影响牙髓炎症,参与牙髓再生过程。 总之,生长因子在创造有利于牙髓再生的炎症微环境方面具有巨大的潜能,遗憾的是许多研究关注到其在组织修复与再生中的优势,见表2,却忽略了背后炎症微环境的重要调控作用,若能将生长因子对炎症调节的功能性和多样性联系到牙髓再生的过程及其机制,或许能有更大的突破。"
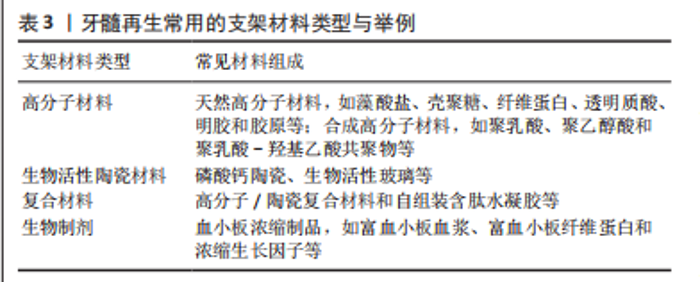
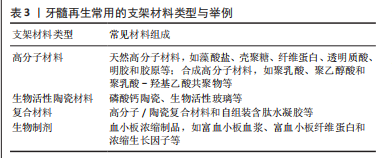
2.4.3 支架材料 生长因子的递送、干细胞的移植均需要具有适宜性能的生物材料作为支架,创造适合的局部微环境来支持细胞的附着、迁移、增殖与分化。适当的机械性能、生物相容性、孔隙率及降解性等是选择或制备再生支架材料需考虑的因素[54]。值得注意的是,为了在病理状态的牙髓组织中真正发挥效用,无论是通过递送抗菌抗炎分子或是依赖材料固有特性,理想牙髓组织工程支架还需具备控制感染、减轻炎症的功能,以刺激后续的修复反应并促进再生[55]。 牙髓再生常用的支架材料包括高分子材料、生物活性材料及各种复合支架等[1,54,56],见表3。如ZHANG等[57]制备的载牙髓干细胞外泌体的纤维蛋白凝胶能促进血管形成和胶原沉积。支架材料可用于载送多种抗炎药,如布洛芬和地塞米松等,以控制牙髓炎症,促进牙髓修复与再生。胶原和纤维蛋白支架已被用于多种抗炎分子传递,如白细胞介素10及脱硫肝素和神经营养素3等[55] 。由于富含可促进牙髓再生的生长因子,富血小板纤维蛋白或富血小板血浆也常被用作牙髓组织工程支架[19]。尽管如此,这些关于牙髓再生支架材料的研究大多基于健康的细胞或动物模型,缺少对感染及炎症等问题的关注,这与临床牙髓病理情况相去甚远,由此探讨的各种组织工程再生性牙髓治疗材料的机制具有较明显的局限性。"

近年来,有学者提出浓缩生长因子作为更理想的支架材料用于组织工程再生性牙髓治疗,并进行了大量的研究,其中,有一些研究者将关注点置于浓缩生长因子在炎症微环境下的作用与影响。据报道,浓缩生长因子可以促进体外暴露于脂多糖的牙髓干细胞的增殖、迁移和分化[58]。浓缩生长因子还通过抑制促炎症细胞因子白细胞介素8和肿瘤坏死因子α的表达来调节脂多糖诱导的牙髓干细胞的炎症反应,从而在组织修复中发挥作用。浓缩生长因子对被认为可以通过触发衰老细胞的重新编程来加速组织修复的白细胞介素6没有明显影响[59]。也有研究发现浓缩生长因子促进了M2巨噬细胞极化和调节众多炎症细胞因子的分泌,从而介导炎症微环境并促进愈合[60]。作为最新一代的血小板浓缩物,浓缩生长因子在成分和功效方面具有优势,特别是在炎症微环境中调节牙髓间充质干细胞的生物学行为上研究前景广阔[61]。尽管上述体外研究表明浓缩生长因子具有调控炎症微环境的潜能,促进间充质干细胞的分化,但实验条件仍不能完全模拟体内牙髓的炎症微环境,有待学者们进一步完善与探索。 综上,相对于传统根管治疗,组织工程策略在牙髓再生治疗中极具前景,通过种子细胞、生长因子及支架材料三要素的有机融合,或将实现牙髓的组织重建和功能结构。目前研究的关键是牙髓治疗始终面临炎症微环境的影响,所致炎症-再生失衡直接破坏了再生治疗的效果,但现有研究对炎症和感染问题缺乏足够重视,已有少数的研究也常偏重机制探索,尤其缺乏对组织工程策略调控炎症-再生平衡促进牙髓再生治疗的探讨,这或是组织工程再生性牙髓治疗研究的未来方向。"

| [1] MOROTOMI T, WASHIO A, KITAMURA C. Current and future options for dental pulp therapy. Jpn Dent Sci Rev. 2019;55(1):5-11. [2] 吴补领,罗奕菲,徐稳安,等.恒牙牙髓炎的活髓保存治疗[J].口腔疾病防治,2021, 29(7):433-441. [3] MERGONI G, GANIM M, LODI G, et al. Single versus multiple visits for endodontic treatment of permanent teeth. Cochrane Database Syst Rev. 2022;12(12):CD005296. [4] WEI X, YANG M, YUE L, et al. Expert consensus on regenerative endodontic procedures. Int J Oral Sci. 2022;14(1):55. [5] 王雪纯,毕静, 陈旭.微环境对牙髓再生影响的研究进展[J].中国实用口腔科杂志, 2021,14(3):347-350. [6] RECHENBERG DK, GALICIA JC, PETERS OA. Biological markers for pulpal inflammation: a systematic review. PLoS One. 2016;11(11):e0167289. [7] LIU C, XIONG H, CHEN K, et al. Long-term exposure to pro-inflammatory cytokines inhibits the osteogenic/dentinogenic differentiation of stem cells from the apical papilla. Int Endod J. 2016;49(10):950-959. [8] GOLDBERG M, NJEH A, UZUNOGLU E. Is pulp inflammation a prerequisite for pulp healing and regeneration? Mediators Inflamm. 2015;2015:347649. [9] ZAKY SH, SHEHABELDIN M, RAY H, et al. The role of inflammation modulation in dental pulp regeneration. Eur Cell Mater. 2021;41:184-193. [10] BERGMANN M, JEANNEAU C, GIRAUD T, et al. Complement activation links inflammation to dental tissue regeneration. Clin Oral Investig. 2020;24(12):4185-4196. [11] IRFAN M, KIM JH, MARZBAN H, et al. The role of complement C5a receptor in DPSC odontoblastic differentiation and in vivo reparative dentin formation. Int J Oral Sci. 2022;14(1):7. [12] ZHONG TY, ZHANG ZC, GAO YN, et al. Loss of Wnt4 expression inhibits the odontogenic potential of dental pulp stem cells through JNK signaling in pulpitis. Am J Transl Res. 2019;11(3):1819-1826. [13] INOSTROZA C, VEGA-LETTER AM, BRIZUELA C, et al. Mesenchymal stem cells derived from human inflamed dental pulp exhibit impaired immunomodulatory capacity in vitro. J Endod. 2020;46(8):1091-1098.e2. [14] HENDERSON NC, RIEDER F, WYNN TA. Fibrosis: from mechanisms to medicines. Nature. 2020;587(7835):555-566. [15] GIRAUD T, JEANNEAU C, ROMBOUTS C, et al. Pulp capping materials modulate the balance between inflammation and regeneration. Dent Mater Off Publ Acad Dent Mater. 2019;35(1):24-35. [16] LIANG C, LIAO L, TIAN W. Stem cell-based dental pulp regeneration: insights from signaling pathways. Stem Cell Rev Rep. 2021;17(4):1251-1263. [17] SUI B, CHEN C, KOU X, et al. Pulp stem cell-mediated functional pulp regeneration. J Dent Res. 2019;98(1):27-35. [18] SHEKATKAR MR, KHEUR SM, KHARAT AH, et al. Assessment of angiogenic potential of mesenchymal stem cells derived conditioned medium from various oral sources. J Clin Transl Res. 2022;8(4):323-338. [19] PULYODAN MK, PARAMEL MOHAN S, VALSAN D, et al. Regenerative endodontics: a paradigm shift in clinical endodontics. J Pharm Bioallied Sci. 2020;12(Suppl 1):S20-S26. [20] LIN LM, HUANG GTJ, SIGURDSSON A, et al. Clinical cell-based versus cell-free regenerative endodontics: clarification of concept and term. Int Endod J. 2021;54(6): 887-901. [21] ALTAII M, RICHARDS L, ROSSI-FEDELE G. Histological assessment of regenerative endodontic treatment in animal studies with different scaffolds: a systematic review. Dent Traumatol Off Publ Int Assoc Dent Traumatol. 2017;33(4):235-244. [22] AHMED GM, ABOUAUF EA, ABUBAKR N, et al. Cell-based transplantation versus cell homing approaches for pulp-dentin complex regeneration. Stem Cells Int. 2021;2021:1-23. [23] KIM SG. A cell-based approach to dental pulp regeneration using mesenchymal stem cells: a scoping review. Int J Mol Sci. 2021;22(9):4357. [24] XIE Z, SHEN Z, ZHAN P, et al. Functional dental pulp regeneration: basic research and clinical translation. Int J Mol Sci. 2021;22(16):8991. [25] RAVINDRAN S, HUANG CC, GEORGE A. Extracellular matrix of dental pulp stem cells: applications in pulp tissue engineering using somatic MSCs. Front Physiol. 2014;4:395. [26] CHEN Y, MA Y, YANG X, et al. The application of pulp tissue derived-exosomes in pulp regeneration: a novel cell-homing approach. Int J Nanomedicine. 2022;17:465-476. [27] HUANG X, LI Z, LIU A, et al. Microenvironment influences odontogenic mesenchymal stem cells mediated dental pulp regeneration. Front Physiol. 2021;12:656588. [28] XUAN K, LI B, GUO H, et al. Deciduous autologous tooth stem cells regenerate dental pulp after implantation into injured teeth. Sci Transl Med. 2018;10(455):eaaf3227. [29] HONG H, CHEN X, LI K, et al. Dental follicle stem cells rescue the regenerative capacity of inflamed rat dental pulp through a paracrine pathway. Stem Cell Res Ther. 2020; 11(1):333. [30] PARK YT, LEE SM, KOU X, et al. The role of interleukin 6 in osteogenic and neurogenic differentiation potentials of dental pulp stem cells. J Endod. 2019;45(11):1342-1348. [31] THANKAM FG, WILSON VED, RADWAN MM, et al. Involvement of ischemia-driven 5-lipoxygenase-resolvin-E1-chemokine like receptor-1 axis in the resolution of post-coronary artery bypass graft inflammation in coronary arteries. Mol Biol Rep. 2022;49(4):3123-3134. [32] STORNIOLO CE, PEQUERA M, VILARIÑO A, et al. Specialized pro-resolvin mediators induce cell growth and improve wound repair in intestinal epithelial caco-2 cell cultures. Prostaglandins Leukot Essent Fatty Acids. 2022;187:102520. [33] GRAZDA R, SEYFRIED AN, MADDIPATTI KR, et al. Impaired inflammation resolution in murine bone marrow failure is rescued by resolvin E1 treatment. Biorxiv. 2023. doi: 10.1101/2023.02.15.528688. [34] LIU X, WANG C, PANG L, et al. Combination of resolvin E1 and lipoxin A4 promotes the resolution of pulpitis by inhibiting NF-ΚB activation through upregulating sirtuin 7 in dental pulp fibroblasts. Cell Prolif. 2022;55(5):e13227. [35] 潘亮亮,张旗.消退素 E1 对牙髓炎中性粒细胞凋亡的影响[J].口腔医学研究, 2022,38(8):742-746. [36] CHEN J, XU H, XIA K, et al. Resolvin E1 accelerates pulp repair by regulating inflammation and stimulating dentin regeneration in dental pulp stem cells. Stem Cell Res Ther. 2021;12(1):75. [37] KANG W, WANG Y, LI J, et al. TAS2R supports odontoblastic differentiation of human dental pulp stem cells in the inflammatory microenvironment. Stem Cell Res Ther. 2022;13(1):374. [38] ORTI V, COLLART-DUTILLEUL PY, PIGLIONICO S, et al. Pulp regeneration concepts for nonvital teeth: from tissue engineering to cinical approaches. Tissue Eng Part B Rev. 2018;24(6):419-442. [39] YANG J, YUAN G, CHEN Z. Pulp regeneration: current approaches and future challenges. Front Physiol. 2016;7:58. [40] XIAO M, YAO B, BAI Y, et al. Stromal-derived factor-1α signaling is involved in bone morphogenetic protein-2-induced odontogenic differentiation of stem cells from apical papilla via the smad and Erk signaling pathways. Exp Cell Res. 2019;381(1):39-49. [41] YANG J, ZHANG Y, WAN C, et al. Autophagy in SDF-1α-mediated DPSC migration and pulp regeneration. Biomaterials. 2015;44:11-23. [42] HE B, ZHANG M, YIN L, et al. BFGF-incorporated composite biomaterial for bone regeneration. Mater Des. 2022;215:110469. [43] BIAN D, WU Y, SONG G. Basic fibroblast growth factor combined with extracellular matrix-inspired mimetic systems for effective skin regeneration and wound healing. Mater Today Commun. 2023;35:105876. [44] LIU L, SHU S, CHEUNG GS, et al. Effect of MiR-146a/BFGF/PEG-PEI nanoparticles on inflammation response and tissue regeneration of human dental pulp cells. BioMed Res Int. 2016;2016:3892685. [45] LIU K, YU S, YE L, et al. The regenerative potential of BFGF in dental pulp repair and regeneration. Front Pharmacol. 2021;12:680209. [46] VERMA R, NEGI G, KANDWAL A, et al. Effect of autologous PRP on wound healing in dental regenerative surgeries and its correlation with PDGF levels. Asian J Transfus Sci. 2019;13(1):47-53. [47] ZHANG M, JIANG F, ZHANG X, et al. The effects of platelet-derived growth factor-BB on human dental pulp stem cells mediated dentin-pulp complex regeneration. Stem Cells Transl Med. 2017;6(12):2126-2134. [48] LI L, WANG Z. PDGF-BB, NGF and BDNF enhance pulp-like tissue regeneration via cell Homing. RSC Adv. 2016;6(111):109519-109527. [49] CAI Y, WANG Z, LIAO B, et al. Anti-inflammatory and chondroprotective effects of platelet-derived growth factor-BB on osteoarthritis rat models. J Gerontol Ser A. 2023; 78(1):51-59. [50] NIWA T, YAMAKOSHI Y, YAMAZAKI H, et al. The dynamics of TGF-β in dental pulp, odontoblasts and dentin. Sci Rep. 2018;8(1):4450. [51] DIANA R, ARDHANI R, KRISTANTI Y, et al. Dental pulp stem cells response on the nanotopography of scaffold to regenerate dentin-pulp complex tissue. Regen Ther. 2020;15:243-250. [52] CHANG MC, CHANG HH, LIN PS, et al. Effects of TGF-Β1 on plasminogen activation in human dental pulp cells: role of ALK5/Smad2, TAK1 and MEK/ERK signalling. J Tissue Eng Regen Med. 2018;12(4):854-863. [53] LIN PS, CHENG RH, CHANG MC, et al. TGF-Β1 stimulates cyclooxygenase-2 expression and PGE2 production of human dental pulp cells: role of ALK5/Smad2 and MEK/ERK signal transduction pathways. J Formos Med Assoc. 2017;116(10):748-754. [54] MOUSSA DG, APARICIO C. Present and future of tissue engineering scaffolds for dentin-pulp complex regeneration. J Tissue Eng Regen Med. 2019;13(1):58-75. [55] COLOMBO JS, MOORE AN, HARTGERINK JD, et al. Scaffolds to control inflammation and facilitate dental pulp regeneration. J Endod. 2014;40(4):S6-S12. [56] 周易,赵玉鸣.牙髓再生支架材料的研究进展[J].国际口腔医学杂志,2022,49(1): 19-26. [57] ZHANG S, THIEBES A L, KREIMENDAHL F, et al. Extracellular vesicles-loaded fibrin gel supports rapid neovascularization for dental pulp regeneration. Int J Mol Sci. 2020; 21(12):4226. [58] FIROUZI N, YAVARI HR, RAHIMI S, et al. Concentrated growth factors combined with lipopolysaccharide stimulate the in vitro regenerative and osteogenic activities of human dental pulp stem cells by balancing inflammation. Int J Dent. 2022;2022:2316666. [59] DA ROSA WLO, PIVA E, DA SILVA AF. Disclosing the physiology of pulp tissue for vital pulp therapy. Int Endod J. 2018;51(8):829-846. [60] LUO H, LIU W, ZHOU Y, et al. Concentrated growth factor regulates the macrophage-mediated immune response. Regen Biomater. 2021;8(6):rbab049. [61] TABATABAEI F, AGHAMOHAMMADI Z, TAYEBI L. In vitro and in vivo effects of concentrated growth factor on cells and tissues. J Biomed Mater Res A. 2020;108(6):1338-1350. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [3] | Bai Chen, Yang Wenqian, Meng Zhichao, Wang Yuze. Strategies for repairing injured anterior cruciate ligament and promoting graft healing [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1457-1463. |
| [4] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [5] | Wang Weiqing, Zhou Yue. Chronic inflammation regulates adipose tissue fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1307-1312. |
| [6] | Wang Ji, Zhang Min, Li Wenbo, Yang Zhongya, Zhang Long. Effect of aerobic exercise on glycolipid metabolism, skeletal muscle inflammation and autophagy in type 2 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1200-1205. |
| [7] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [8] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [9] | Xu Canli, He Wenxing, Wang Lei, Wu Fangting, Wang Jiahui, Duan Xuelin, Zhao Tiejian, Zhao Bin, Zheng Yang. Bibliometric analysis of researches on liver organoids [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1099-1104. |
| [10] | Liu Hanfeng, Wang Jingjing, Yu Yunsheng. Artificial exosomes in treatment of myocardial infarction: current status and prospects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1118-1123. |
| [11] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [12] | Sun Yukang, Song Lijuan, Wen Chunli, Ding Zhibin, Tian Hao, Ma Dong, Ma Cungen, Zhai Xiaoyan. Visualization analysis of stem cell therapy for myocardial infarction based on Web of Science in recent ten years [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1143-1148. |
| [13] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [14] | Wang Wen, Zheng Pengpeng, Meng Haohao, Liu Hao, Yuan Changyong. Overexpression of Sema3A promotes osteogenic differentiation of dental pulp stem cells and MC3T3-E1 [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 993-999. |
| [15] | Qiu Xiaoyan, Li Bixin, Li Jingdi, Fan Chuiqin, Ma Lian, Wang Hongwu. Differentiation of insulin-producing cells from human umbilical cord mesenchymal stem cells infected by MAFA-PDX1 overexpressed lentivirus [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1000-1006. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||