Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (1): 145-151.doi: 10.12307/2022.967
Previous Articles Next Articles
Biological effects of magnetic field on osteogenesis of mesenchymal stem cells
Zhang Jinglan, Zhang Binjing, Chen Yifei, Zhang Chenyue, Hu Zhiai, Hu Haikun
- State Key Laboratory of Oral Diseases, National Clinical Research Center for Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China
-
Received:2021-12-01Accepted:2022-01-28Online:2023-01-08Published:2022-06-14 -
Contact:Hu Haikun, PhD, Attending physician, State Key Laboratory of Oral Diseases, National Clinical Research Center for Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China -
About author:Zhang Jinglan, State Key Laboratory of Oral Diseases, National Clinical Research Center for Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China -
Supported by:the National Natural Science Foundation of China, No. 82001108 (to HZA); the China Postdoctoral Science Foundation, No. 2020M683331 (to HZA); Research Project of West China School of Stomatology (West China Hospital of Stomatology), Sichuan University, No. RCDWJS2022-4 (to HZA)
CLC Number:
Cite this article
Zhang Jinglan, Zhang Binjing, Chen Yifei, Zhang Chenyue, Hu Zhiai, Hu Haikun. Biological effects of magnetic field on osteogenesis of mesenchymal stem cells[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 145-151.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

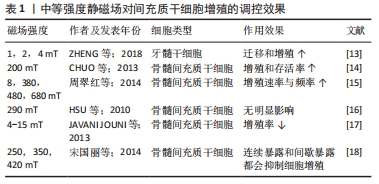
2.1.1 磁场 磁场包括静磁场和动磁场2种。静磁场是一个矢量场,其磁场强度和磁场方向均恒定不变,仅产生磁场而不产生电场。动磁场的强度或方向则会随时间变化产生电场,变化的磁场和电场紧密联系形成电磁场。根据电磁场变化规律的不同,动磁场又可进一步分为交变电磁场、脉冲电磁场以及旋转磁场,其中脉冲电磁场和静磁场的生物医学研究应用广泛,交变磁场和旋转磁场的研究相对较少。 根据磁感应强度划分,磁场可分为弱磁场(< 1 mT)、中等磁场(1 mT-1 T)、强磁场(1-5 T)和超强磁场(>5 T)[8];根据频率则一般分为低频磁场、中频磁场和高频磁场[9],而静磁场相当于频率为0的磁场。中、高频磁场更多介导热效应,生物学应用研究较少;中等磁场和低频磁场则主要表现为生物学效应,在生物医药领域研究较为广泛。 磁场具有窗口效应[10],即一定参数范围的磁场可对间充质干细胞的生物学行为产生显著的促进作用,如细胞迁移、增殖和成骨分化等[11-12]。“窗口”之外的磁场对间充质干细胞的生物学效应甚微或没有影响,甚至产生负面影响。因此,磁场参数的设置极其重要。磁场参数特征较为繁多,其中最重要的是磁场强度、磁场频率、暴露方式和暴露时间。 2.1.2 静磁场的参数特征对间充质干细胞增殖和成骨分化的影响 静磁场可通过铁磁片或通直流电的电磁铁产生,相比于复杂的动磁场,静磁场更易实现且不良反应较少。静磁场作为一种非侵入性的物理治疗手段已被广泛应用于促进骨折创口愈合、抑制骨关节炎炎症反应、减轻组织水肿和治疗骨质疏松等临床骨科疾病。磁场强度和作用时间是静磁场影响细胞生物学行为最重要的参数。 (1)磁场强度:生物体在其整个生命周期中都暴露在地磁场中。地磁场属于弱磁场,其研究集中在昼夜节律、心电活动和血压变化等方面,对间充质干细胞成骨作用的影响方面研究较少。 中等磁场能显著促进间充质干细胞的增殖。研究显示较低强度(< 100 mT)的静磁场可促进牙髓干细胞迁移和增殖[13],提高骨髓间充质干细胞的增殖速率和频率;相对较高强度(> 100 mT)的静磁场可在早期促进骨髓间充质干细胞的增殖,并显著提高间充质干细胞的存活率[14]。周翠红等[15]探究中等磁场促进增殖的原因,显示静磁场会减少静息期细胞的比例,在早期表现出对增殖速率与频率的促进,且强度越高,提高S+G2/M期比例的效果越明显;HSU等[16]认为290 mT下静磁场仅能增加S期双倍DNA含量,却无法激活G2期有丝分裂。这些研究说明,中等磁场能够通过影响细胞周期而达到促进增殖的效果。相反,部分研究发现静磁场对骨髓间充质干细胞的增殖呈负面影响。JAVANI JOUNI等[17]将骨髓间充质干细胞置于4-15 mT强度的静磁场下暴露不同的时间(24,48,72,96 h),发现强度越高、暴露时间越长,则增殖率的下降越明显。宋国丽等[18]则发现磁场的连续暴露和间歇暴露都会抑制细胞增殖。这可能与骨髓间充质干细胞的分化阶段有关,因为静磁场仅在早期表现出对细胞增殖的促进作用[15];增殖率的显著下降,可能与间充质干细胞的成骨向分化相关[19],见表1。 "
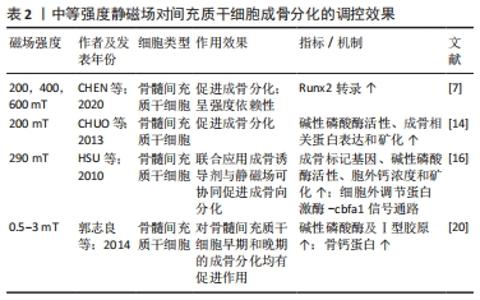
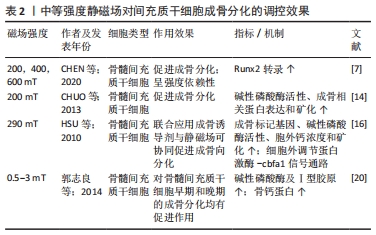
中等磁场对间充质干细胞的促成骨分化作用同样有较为明确的研究证据。CHUO等[14]发现中等磁场暴露5-7 d后,骨髓间充质干细胞的碱性磷酸酶活性、成骨相关蛋白表达和矿化明显提高;联合应用成骨诱导剂与静磁场可协同促进成骨向分化[16],且在200-600 mT范围内呈强度依赖性[7]。郭志良等[20]研究则进一步证明静磁场对骨髓间充质干细胞早期和晚期的成骨分化均有促进作用。中等磁场促进间充质干细胞成骨分化的效果明确,但值得注意的是,各研究的结果中出现了不同的促进效果峰值强度,如1.5 mT[20],1.8 mT[15],15 mT[21],这些峰值的差异可能是由磁场参数之外的变量导致,如细胞类型、来源和分化阶段,见表2。 "

由于不便投入到实际应用中,强磁场作用于间充质干细胞的相关研究较少。强磁场能够改变细胞内微管的排列方向而调节细胞贴壁生长的方向[22],使细胞平行或垂直于磁场方向排列,并存在强度依赖现象;同时通过微管取向的改变,强磁场可改变纺锤体的排布,诱导细胞分裂发生改变[22]。YAMAGUCHI-SEKINO等[23]采用高度均匀的7 T超强静磁场加载间充质干细胞后,虽然骨钙素表达显著增加,却对成骨向分化无显著影响。目前关于强磁场对间充质干细胞成骨作用的研究非常少,仍需进一步研究强磁场调控间充质干细胞的生物学行为,以及其参数设置对间充质干细胞成骨的确切影响及机制。 (2)作用时间:静磁场对间充质干细胞增殖和成骨向分化的影响均表现为时间依赖性,作用时间越长,对骨髓间充质干细胞增殖的调控效果越显著,无论效果呈现促进或是抑制[17]。随着治疗时间的增加,静磁场暴露下的牙髓干细胞中碱性磷酸酶活性增加,矿化增多[24],骨钙素水平增加,骨小梁变粗,数目增加[25]。然而,目前国内外对于静磁场作用时间的研究主要集中于总暴露天数对间充质干细胞生物学行为的影响,而不同的间歇暴露时间对间充质干细胞有何种影响,尚缺乏对比实验。研究发现去除静磁场暴露后,细胞的诱导变化得以恢复,如骨形态发生蛋白2的表达降低至正常水平[14,19],说明磁场对间充质干细胞的作用是即时性的。 综上可知,中等强度的静磁场能显著促进间充质干细胞的增殖和成骨向分化。静磁场能在早期影响细胞周期,促进间充质干细胞的增殖,并且与成骨诱导剂协同促进成骨向分化。磁场参数对间充质干细胞生理学功能的影响复杂,作用的强度峰值有待进一步探索研究;而关于作用时间,尽管目前的研究中静磁场的促进作用呈现出时间依赖性,仍然缺乏更加全面具体的相关研究。 2.1.3 脉冲电磁场的参数特征对间充质干细胞增殖和成骨分化的影响 间歇脉冲电流通入电磁铁产生脉冲磁场,变化的脉冲磁场又产生电场,并与电场相互依存,两者统称为脉冲电磁场。脉冲电磁场的磁场方向不变,直流发电机即可产生,是动磁场中研究最多的一类。交变磁场的强度与方向均发生变化,旋转磁场则常用于电能与转动机械能之间互相转换,两者均需多相交流发电机作为发动装置,不便临床应用且研究变量复杂,目前在生物医学领域的研究较少。 相较于仅能调节磁场强度与作用时间的静磁场,脉冲电磁场可根据需要同时调节变化频率、波形和峰值等参数,产生更加丰富的生物学效应,具有更为广泛的临床转化应用前景。作为一种无创性、效果良好、不良反应少且便于配合其他治疗的物理刺激方法,脉冲电磁场已被广泛用于骨科和口腔相关疾病治疗[26-27]。 (1)电磁场频率:在骨骼系统中,内源性电磁频率普遍存在,范围为1-30 Hz(姿势肌维持机体安静站立或行走的频率)或10-100 Hz(肌肉收缩功率频率)[28]。最有效的脉冲电磁场频率应与正常身体动作的频率相似,频率在1-100 Hz之间的脉冲电磁场可发挥促进骨骼修复的生物效应。目前研究涉及的用于诱导骨髓间充质干细胞增殖和成骨分化的脉冲电磁场频率便集中于该范围内。 研究揭示在脉冲电磁场强度相似的情况下,内源性频率范围内的多种脉冲电磁场均可促进间充质干细胞增殖和成骨分化。SUN等[29]发现脉冲电磁场暴露4-7 d后,碱性磷酸酶和骨钙素等表达显著增强,在成骨分化中期则开始促进矿化。TABATABAI等[30]发现50 Hz、1 mT的脉冲电磁场有利于骨髓间充质干细胞的成骨分化。LUO等[31]探究了5,25,50,75,100,150 Hz等频率下1.1 mT的脉冲电磁场对骨髓间充质干细胞成骨分化的影响,研究显示所有频率的磁场均促进了碱性磷酸酶和骨钙素等成骨分化相关蛋白的表达,其表达与暴露时间呈正相关,并且该研究证明50 Hz频率的脉冲电磁场促成骨分化效果最为显著。不同频率脉冲电磁场对骨再生的促进效应可能表现在骨代谢的不同阶段。EHNERT等[32]探索了2种频率下的成骨分化效果,发现较低频率(16 Hz)增强了骨形成,而较高频率(26 Hz)增强了骨重塑。而相比之下,显著高于骨骼内源性频率的脉冲电磁场对间充质干细胞的增殖分化产生负面影响。崔向荣等[33]针对高频脉冲电磁场展开了研究,利用380 MHz的高频脉冲电磁场作用于骨髓间充质干细胞,每次30 min,发现其可抑制骨髓间充质干细胞增殖、促进凋亡,而对骨髓间充质干细胞的成骨分化无显著影响。 (2)电磁场强度:关于脉冲电磁场强度的研究主要涉及弱磁场和中等磁场,与静磁场相似,其促进骨再生的效果较为明确。KAIVOSOJA等[34]发现15 Hz、0.1 mT 的脉冲电磁场显著提高了骨髓间充质干细胞的增殖活性,在同样参数的脉冲电磁场下JANSEN等[35]研究显示虽然骨髓间充质干细胞的增殖减缓,但多种成骨相关基因的表达显著增加,矿化能力增强。MARTINI等[36]采用1.5 mT,7.5 Hz的脉冲电磁场对骨髓间充质干细胞进行干预,实验组的碱性磷酸酶活性和骨钙素水平均显著高于对照组,且Runx2基因表达增加。WANG等[37]探究了15 Hz的脉冲电磁场在0.6,1.2,1.8,2.4,3.0 mT等不同强度情况下对牙周膜干细胞的影响,发现所有强度的脉冲电磁场均促进了牙周膜干细胞指数期增长,且1.8和2.4 mT强度的脉冲电磁场对碱性磷酸酶活性、Runx2和骨桥蛋白的表达具有非常显著的促进作用,尤其在1.8 mT强度下观察到峰值,见表3。 "


(3)作用时间:脉冲电磁场促进增殖和成骨分化的效果与总暴露时间呈正相关[37]。但在间歇暴露环境下,脉冲电磁场对间充质干细胞的生物学效应并不随着每日单次暴露时间延长而增加,而是具有明显的窗口效应。LI等[38]将间充质干细胞每天于50 Hz、10 mT的脉冲电磁场下暴露不同时间,发现暴露3 h促进细胞增殖的效果强于6 h,但在暴露16 h后促增殖效应均不明显。CECCARELLI等[39]采用2 mT、75 Hz的脉冲电磁场每天分别处理骨髓间充质干细胞和脂肪间充质干细胞5,10,30 min和1,4,8 h,持续21 d;研究发现每天10 min的脉冲电磁场刺激是促进细胞增殖的最佳时间,能够得到更高的细胞密度,同时促进成骨分化和矿物质沉积。 综上,低频、低强度的脉冲电磁场能显著促进间充质干细胞的增殖和成骨向分化,但其生物学效应并不与磁场强度和单次暴露时间呈正相关,需要对其相关性进行进一步探索研究。 2.1.4 其他因素对间充质干细胞增殖和成骨分化的影响 除了磁场参数设置,其他因素如间充质干细胞类型、分化阶段、细胞密度和成骨诱导剂等也会影响磁场的生物学效应,这可能是导致部分研究结果不一致的原因。CECCARELLI等[39]研究显示,相同的磁场参数对骨髓间充质干细胞促增殖、成骨向分化和矿物质沉积的效应较脂肪间充质干细胞更为显著。这与不同类型间充质干细胞自身的分化潜能、免疫表型、表观遗传学和对磁场敏感性的差异相关[40]。即使是同种类型的间充质干细胞,其不同供体来源的细胞存在差异,也会对磁场的作用产生影响,JANSEN等[35]则发现不同供体的骨髓间充质干细胞在相同磁场刺激下达到活性高峰的时间点不同。 细胞状态(如分化阶段和密度)也是影响磁场生物学效应的因素之一。SUN等[29]将脉冲电磁场施加于不同成骨分化阶段的骨髓间充质干细胞,发现在成骨分化早期阶段促进细胞增殖的效果较为明显,且会显著促进成骨相关基因的表达,晚期则会降低细胞增殖。KAIVOSOJA等[34]与JANSEN等[35]研究设置了相同的脉冲电磁场参数,不同的是前者选择了低密度水平接种(3 000个/cm2),发现脉冲电磁场提高了骨髓间充质干细胞的活力,对成骨诱导没有明显影响,而后者的接种密度则高4倍,发现脉冲电磁场以增殖为代价诱导了成骨分化。 2.2 磁场影响细胞生物学行为的机制 "

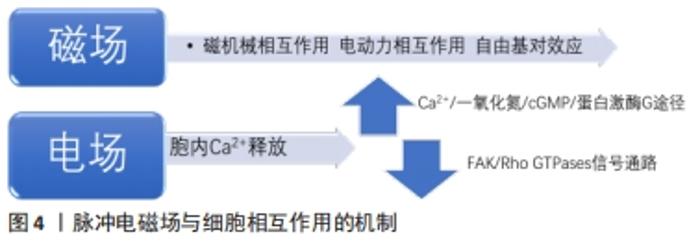
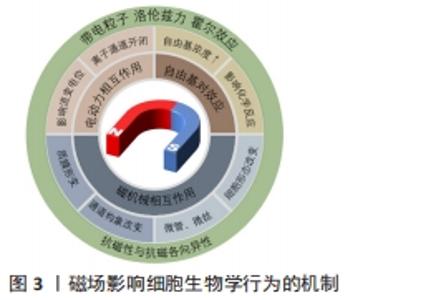
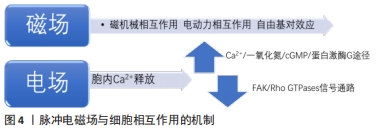
(1)磁机械相互作用:物质由原子构成,原子由位于中心的原子核及绕核运动的电子组成,每个电子具有轨道角动量和自旋角动量,且电子是带电粒子,故存在着轨道磁矩和自旋磁矩。当电子的自旋磁矩为0时,轨道磁矩在磁场中受电磁感应而产生抵抗外磁场的弱磁力,即表现为抗磁性。质膜和细胞骨架等细胞结构都具有抗磁性。此外,磷脂分子和蛋白质分子等生物大分子具有抗磁各向异性,即物质的抗磁性表现为随方向变化而变化。适宜参数的磁场可使磁各向异性的目标受到磁力矩作用而发生偏转直至整体达到稳定的取向。基于抗磁性和抗磁各向异性,磁场可影响质膜和细胞骨架等作用靶点进而产生一定的细胞生物学效应。 质膜:质膜具有抗磁各向异性,磁场作用下质膜结构发生变化,从而影响细胞的生物学性能[41]。质膜磷脂双分子层中每个单独的脂质具有抗磁各向异性,在一定的磁场环境中,所有脂质的磁化发生协同效应,形成定向的圆盘状纳米结构,如指南针一般在磁场中共同建立了定向的宏观磁矩。磷脂双分子层结构的重排或调整导致细胞表面及与质膜结构相关的离子通道和信号通路发生变化,从而影响细胞迁移、增殖、分化和凋亡等[42]。磁场加载下质膜结构调整导致细胞表面粗糙,形成边缘凸起的孔洞,孔洞的数量与大小增加,进而增加细胞膜通透性[43]。磁场下质膜发生形变,可导致离子通道的构象改变和细胞膜电位的变化[44],也有研究显示Ca2+通道被静磁场激活,Ca2+流入进而激活p38丝裂原活化蛋白激酶信号通道,从而影响细胞骨架的重组,细胞各向异性增强[42]。由于磁场效应的即时性,当磁场刺激去除后,形变的质膜上抗磁性分子将缓慢重新定向,质膜结构得以恢复,由于质膜结构变化产生的生物学效应也随之消失。 细胞骨架:微管、微丝和中间纤维共同组成了广泛存在于真核细胞中的纤维状网架体系,即细胞骨架,参与调控定向运输和细胞增殖等重要生命活动。微管和微丝都具有抗磁各向异性[45],因此磁场可直接影响到细胞骨架[46]。微管蛋白二聚体规律性平行排列形成微管多聚体,所有二聚体的数值总和即微管多聚体的抗磁各向异性,因此微管拥有较强的抗磁各向异性。研究显示磁场促进微管沿着磁场方向进行自装配[47],且磁场强度越强,微管排列方向与磁场方向的夹角越小,即越倾向于平行磁场方向。细胞形状取决于微丝形成的细胞骨架,G-肌动蛋白在磁场中装配的方向与磁场方向一致,也导致了细胞沿磁场方向伸长,细胞形态发生变化[48]。而细胞骨架的变化也是磁场产生成骨分化诱导效果的途径。YAP/TAZ(yes-associated protein/tafazzin)是一类对机械应力具有敏感性的转录共激活因子,静磁场可将YAP/TAZ募集到细胞核,上调相关基因表达,参与调控细胞增殖和凋亡,而细胞骨架抑制剂的使用将影响细胞骨架的定向运输功能,减弱了YAP/TAZ的核定位,进而导致间充质干细胞的矿化作用被抑制[13]。 (2)电动力相互作用:静磁场通过电磁感应对任何运动的带电粒子产生电动力作用,带电粒子指带有电荷的微粒,包括Na+、K+、Ca2+等重要细胞离子。基于此作用,磁场能够对离子通道产生影响。质膜内外具有电势差,带电粒子经过离子通道发生定向移动而产生感应生物电流[49],而静磁场通过霍尔效应作用于这些移动的带电粒子产生洛伦兹力,影响流变电位的产生和离子通道的开闭,进而引发信号级联反应,影响生物学功能。磁场被证实能够改变电压依赖性的Na+、K+离子通道的激活特性和失活特性[50]。细胞内的Ca2+通常被认为是将磁场信号转化为生物信号的主要因素之一,是磁场机制中主要的研究对象。通过对离子通道的影响,磁场促进Ca2+膜侧转移到胞浆内[46],提高细胞内Ca2+浓度[21]。此外,磁场的电动力作用不仅限于质膜上的离子通道,对胞浆内和胞外的运动带电粒子均可产生作用。研究显示,磁场不仅可促进Ca2+向细胞核集中[42],还可以增加细胞外Ca2+浓度,随后显著促进Ca2+沉积[16],从而影响细胞的生物学效应。 (3)自由基对效应:自由基是带有未配对电子的原子、分子或基团,带有电荷,同时产生未配对的自旋,即未抵消的磁矩,两者均可受外加磁场的影响。通过调控自由基水平,磁场可引起细胞的抗氧化防御机制[51],促进细胞增殖[52]。不同强度的磁场通过自由基的积累对细胞的增殖与分化产生促进或抑制[53-54]。 同时,基于对生物体中反应中间体的自由基对或电子自旋状态的影响,磁场可对某些化学反应的速率、产率和产物分布产生影响,且改变弱磁场或中等磁场的磁场强度可对这些影响进行调控,即自由基对效应。研究显示当磁场加载时,自由基浓度增加,这是由于磁场导致更多的自由基对分离,延长自由基重组的时间,进而导致自由基平均寿命更长,总体浓度增加。 2.2.2 脉冲电磁场与细胞相互作用的机制 见图4。静磁场是恒定的,没有矢量变化,不能产生电流,而脉冲电磁场除了磁场效应,还可诱导产生电场进而调控细胞命运。脉冲电磁场建立起随时间变化的电场,使质膜表面电荷分布变化,诱导细胞内Ca2+的释放[55],并引起下游级联反应。研究发现,脉冲电磁场引起细胞内Ca2+增加,逐级通过Ca2+/一氧化氮/cGMP/蛋白激酶G途径,促进骨髓间充质干细胞成骨向分化成熟;脉冲电磁场也可通过增加细胞内Ca2+浓度,激活FAK/Rho GTPases信号通路,细胞骨架发生改建,进而促进细胞迁移和分化[56]。脉冲电磁场能够产生磁场和电场双重作用,并且电磁场随时间变化而使影响更为复杂,其具体机制目前仍不清楚,尚需更多的研究。 "
| [1] ZHANG S, LI X, QI Y, et al. Comparison of Autogenous Tooth Materials and Other Bone Grafts. Tissue Eng Regen Med. 2021;18(3):327-341. [2] ARTHUR A, GRONTHOS S. Clinical Application of Bone Marrow Mesenchymal Stem/Stromal Cells to Repair Skeletal Tissue. Int J Mol Sci. 2020;21(24):9759. [3] SI Z, WANG X, SUN C, et al. Adipose-derived stem cells: Sources, potency, and implications for regenerative therapies. Biomed Pharmacother. 2019;114:108765. [4] GUGLIANDOLO A, FONTICOLI L, TRUBIANI O, et al. Oral Bone Tissue Regeneration: Mesenchymal Stem Cells, Secretome, and Biomaterials. Int J Mol Sci. 2021;22(10):5236. [5] SUI BD, HU CH, LIU AQ, et al. Stem cell-based bone regeneration in diseased microenvironments: Challenges and solutions. Biomaterials. 2019;196:18-30. [6] PARATE D, KADIR ND, CELIK C, et al. Pulsed electromagnetic fields potentiate the paracrine function of mesenchymal stem cells for cartilage regeneration. Stem Cell Res Ther. 2020;11(1):46. [7] CHEN G, ZHUO Y, TAO B, et al. Moderate SMFs attenuate bone loss in mice by promoting directional osteogenic differentiation of BMSCs. Stem Cell Res Ther. 2020;11(1):487. [8] MARYCZ K, KORNICKA K, RÖCKEN M. Static Magnetic Field (SMF) as a Regulator of Stem Cell Fate - New Perspectives in Regenerative Medicine Arising from an Underestimated Tool. Stem Cell Rev Rep. 2018;14(6):785-792. [9] 张灵玉,江静怡,樊瑜波,等.磁场在骨生物学领域:研究与应用中明确和未明确问题[J].中国组织工程研究,2019,23(4):584-590. [10] LEAL-JUNIOR ECP, DE OLIVEIRA MFD, JOENSEN J, et al. What is the optimal time-response window for the use of photobiomodulation therapy combined with static magnetic field (PBMT-sMF) for the improvement of exercise performance and recovery, and for how long the effects last? A randomized, triple-blinded, placebo-controlled trial. BMC Sports Sci Med Rehabil. 2020;12:64. [11] ZHANG Y, LI W, LIU C, et al. Electromagnetic field treatment increases purinergic receptor P2X7 expression and activates its downstream Akt/GSK3β/β-catenin axis in mesenchymal stem cells under osteogenic induction. Stem Cell Res Ther. 2019;10(1):407. [12] 王彦蒽,汪沛,王晟磊,等.低频脉冲电磁场增强骨形态发生蛋白9诱导牙周膜干细胞成骨分化作用[J].第二军医大学学报,2020, 41(8):855-863. [13] ZHENG L, ZHANG L, CHEN L, et al. Static magnetic field regulates proliferation, migration, differentiation, and YAP/TAZ activation of human dental pulp stem cells. J Tissue Eng Regen Med. 2018;12(10): 2029-2040. [14] CHUO W, MA T, SAITO T, et al. A Preliminary Study of the Effect of Static Magnetic Field Acting on Rat Bone Marrow Mesenchymal Stem Cells during Osteogenic Differentiation In Vitro. J Hard Tissue Biol. 2013; 22(2):227-232. [15] 周翠红,张小云,张宇,等.不同强度静磁场间歇曝磁对骨髓间充质干细胞增殖及细胞周期的影响[J].中国骨质疏松杂志,2014,20(1): 105-109. [16] HSU SH, CHANG JC. The static magnetic field accelerates the osteogenic differentiation and mineralization of dental pulp cells. Cytotechnology. 2010;62(2):143-155. [17] JAVANI JOUNI F, ABDOLMALEKI P, MOVAHEDIN M. Investigation on the effect of static magnetic field up to 15 mT on the viability and proliferation rate of rat bone marrow stem cells. In Vitro Cell Dev Biol Anim. 2013;49(3):212-219. [18] 宋国丽,周翠红,张宇,等.静磁场对骨髓间充质干细胞增殖及骨向分化的影响[J].中国康复理论与实践,2014,20(4):322-326. [19] SADRI M, ABDOLMALEKI P, ABRUN S, et al. Static Magnetic Field Effect on Cell Alignment, Growth, and Differentiation in Human Cord-Derived Mesenchymal Stem Cells. Cell Mol Bioeng. 2017;10(3):249-262. [20] 郭志良,滕海军,王亮,等.恒磁场对培养的骨髓间充质干细胞成骨分化的影响及机制[J].第三军医大学学报,2014,36(12):1255-1259. [21] KIM EC, LEESUNGBOK R, LEE SW, et al. Effects of moderate intensity static magnetic fields on human bone marrow-derived mesenchymal stem cells. Bioelectromagnetics. 2015;36(4):267-276. [22] 张磊,李志元,张欣.稳态磁场对真核生物细胞骨架的影响[J].科学通报,2019,64(8):748-760. [23] YAMAGUCHI-SEKINO S, KIRA T, SEKINO M, et al. Effects of 7 T static magnetic fields on the expression of biological markers and the formation of bone in rats. Bioelectromagnetics. 2019;40(1):16-26. [24] 夏阳,陈慧敏,胡姝颖,等.静磁场连续曝磁对牙髓干细胞增殖和分化的影响[J].南京医科大学学报(自然科学版),2020,40(2):191-194. [25] 刘阳,李善昌,王长振,等.静磁场对大鼠下颌骨骨折愈合的研究[J].口腔医学研究,2020,36(6):548-553. [26] ROSS CL, ANG DC, ALMEIDA-PORADA G. Targeting Mesenchymal Stromal Cells/Pericytes (MSCs) With Pulsed Electromagnetic Field (PEMF) Has the Potential to Treat Rheumatoid Arthritis. Front Immunol. 2019;10:266. [27] NAYAK BP, DOLKART O, SATWALEKAR P, et al. Effect of the Pulsed Electromagnetic Field (PEMF) on Dental Implants Stability: A Randomized Controlled Clinical Trial. Materials (Basel). 2020;13(7): 1667. [28] ROSS CL, ZHOU Y, MCCALL CE, et al. The Use of Pulsed Electromagnetic Field to Modulate Inflammation and Improve Tissue Regeneration: A Review. Bioelectricity. 2019;1(4):247-259. [29] SUN LY, HSIEH DK, LIN PC, et al. Pulsed electromagnetic fields accelerate proliferation and osteogenic gene expression in human bone marrow mesenchymal stem cells during osteogenic differentiation. Bioelectromagnetics. 2010;31(3):209-219. [30] TABATABAI TS, HAJI GHASEM KASHANI M, MASKANI R, et al. Synergic effects of extremely low-frequency electromagnetic field and betaine on in vitro osteogenic differentiation of human adipose tissue-derived mesenchymal stem cells. In Vitro Cell Dev Biol Anim. 2021;57(4):468-476. [31] LUO F, HOU T, ZHANG Z, et al. Effects of pulsed electromagnetic field frequencies on the osteogenic differentiation of human mesenchymal stem cells. Orthopedics. 2012;35(4):e526-e531. [32] EHNERT S, VAN GRIENSVEN M, UNGER M, et al. Co-Culture with Human Osteoblasts and Exposure to Extremely Low Frequency Pulsed Electromagnetic Fields Improve Osteogenic Differentiation of Human Adipose-Derived Mesenchymal Stem Cells. Int J Mol Sci. 2018; 19(4):994. [33] 崔向荣,苏伟,黄钊,等.高频脉冲电磁场对骨髓间充质干细胞增殖和成骨分化的影响[J].中国组织工程研究与临床康复,2011, 15(10):1715-1720. [34] KAIVOSOJA E, SARIOLA V, CHEN Y, et al. The effect of pulsed electromagnetic fields and dehydroepiandrosterone on viability and osteo-induction of human mesenchymal stem cells. J Tissue Eng Regen Med. 2015;9(1):31-40. [35] JANSEN JH, VAN DER JAGT OP, PUNT BJ, et al. Stimulation of osteogenic differentiation in human osteoprogenitor cells by pulsed electromagnetic fields: an in vitro study. BMC Musculoskelet Disord. 2010;11:188. [36] MARTINI F, PELLATI A, MAZZONI E, et al. Bone Morphogenetic Protein-2 Signaling in the Osteogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells Induced by Pulsed Electromagnetic Fields. Int J Mol Sci. 2020;21(6):2104. [37] WANG T, WANG P, CAO Z, et al. Effects of BMP9 and pulsed electromagnetic fields on the proliferation and osteogenic differentiation of human periodontal ligament stem cells. Bioelectromagnetics. 2017;38(1):63-77. [38] LI X, ZHANG M, BAI L, et al. Effects of 50 Hz pulsed electromagnetic fields on the growth and cell cycle arrest of mesenchymal stem cells: an in vitro study. Electromagn Biol Med. 2012;31(4):356-364. [39] CECCARELLI G, BLOISE N, MANTELLI M, et al. A comparative analysis of the in vitro effects of pulsed electromagnetic field treatment on osteogenic differentiation of two different mesenchymal cell lineages. Biores Open Access. 2013;2(4):283-294. [40] ZHOU W, LIN J, ZHAO K, et al. Single-Cell Profiles and Clinically Useful Properties of Human Mesenchymal Stem Cells of Adipose and Bone Marrow Origin. Am J Sports Med. 2019;47(7):1722-1733. [41] HAYASHI S, KAKIKAWA M. Exposure to 60 Hz magnetic field can affect membrane proteins and membrane potential in human cancer cells. Electromagn Biol Med. 2021;40(4):459-466. [42] LEW WZ, HUANG YC, HUANG KY, et al. Static magnetic fields enhance dental pulp stem cell proliferation by activating the p38 mitogen-activated protein kinase pathway as its putative mechanism. J Tissue Eng Regen Med. 2018;12(1):19-29. [43] LIU Y, QI H, SUN RG, et al. An investigation into the combined effect of static magnetic fields and different anticancer drugs on K562 cell membranes. Tumori. 2011;97(3):386-392. [44] ZABLOTSKII V, POLYAKOVA T, DEJNEKA A. Modulation of the Cell Membrane Potential and Intracellular Protein Transport by High Magnetic Fields. Bioelectromagnetics. 2021;42(1):27-36. [45] GE S, LI J, HUANG D, et al. Strong static magnetic field delayed the early development of zebrafish. Open Biol. 2019;9(10):190137. [46] LEW WZ, FENG SW, LIN CT, et al. Use of 0.4-Tesla static magnetic field to promote reparative dentine formation of dental pulp stem cells through activation of p38 MAPK signalling pathway. Int Endod J. 2019;52(1):28-43. [47] INABA H, YAMADA M, RASHID MR, et al. Magnetic Force-Induced Alignment of Microtubules by Encapsulation of CoPt Nanoparticles Using a Tau-Derived Peptide. Nano Lett. 2020;20(7):5251-5258. [48] WOSIK J, CHEN W, QIN K, et al. Magnetic Field Changes Macrophage Phenotype. Biophys J. 2018;114(8):2001-2013. [49] ZHANG J, DING C, REN L, et al. The effects of static magnetic fields on bone. Prog Biophys Mol Biol. 2014;114(3):146-152. [50] ZHENG Y, DOU JR, GAO Y, et al. Effects of 15 Hz square wave magnetic fields on the voltage-gated sodium and potassium channels in prefrontal cortex pyramidal neurons. Int J Radiat Biol. 2017;93(4):449-455. [51] EHNERT S, FENTZ AK, SCHREINER A, et al. Extremely low frequency pulsed electromagnetic fields cause antioxidative defense mechanisms in human osteoblasts via induction of •O2- and H2O2. Sci Rep. 2017; 7(1):14544. [52] SONG K, IM SH, YOON YJ, et al. A 60 Hz uniform electromagnetic field promotes human cell proliferation by decreasing intracellular reactive oxygen species levels. PLoS One. 2018;13(7):e0199753. [53] VAN HUIZEN AV, MORTON JM, KINSEY LJ, et al. Weak magnetic fields alter stem cell-mediated growth. Sci Adv. 2019;5(1):eaau7201. [54] ZHANG J, DING C, MENG X, et al. Nitric oxide modulates the responses of osteoclast formation to static magnetic fields. Electromagn Biol Med. 2018;37(1):23-34. [55] KIM YM, LIM HM, LEE EC, et al. Synergistic effect of electromagnetic fields and nanomagnetic particles on osteogenesis through calcium channels and p-ERK signaling. J Orthop Res. 2021; 39(8):1633-1646. [56] ZHANG Y, YAN J, XU H, et al. Extremely low frequency electromagnetic fields promote mesenchymal stem cell migration by increasing intracellular Ca2+ and activating the FAK/Rho GTPases signaling pathways in vitro. Stem Cell Res Ther. 2018;9(1):143. |
| [1] | Dai Xianglin, Zhang Wenfeng, Yao Xijun, Shang Jiaqi, Huang Qiujin, Ren Yifan, Deng Jiupeng. Barium titanate/polylactic acid piezoelectric composite film affects adhesion, proliferation, and osteogenic differentiation of MC3T3-E1 cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 367-373. |
| [2] | Liu Huan, Li Han, Ma Yunhao, Zhong Weijian, Ma Guowu. Osteogenic capacity of partially demineralized dentin particles in the maxillary sinus lift [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 354-359. |
| [3] | Li Rui, Liu Zhen, Guo Zige, Lu Ruijie, Wang Chen. Aspirin-loaded chitosan nanoparticles and polydopamine modified titanium sheets improve osteogenic differentiation [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 374-379. |
| [4] | Ning Ziwen, Wang Xu, Shi Zhengliang, Qin Yihua, Wang Guoliang, Jia Di, Wang Yang, Li Yanlin. Meniscal injury repair methods for non-blood supply area [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 420-426. |
| [5] | Zong Mingrui, Liu Haiyan, Li Bing, Wu Xiuping. Application of carboxymethyl chitosan in tissue engineering of stomatology [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 447-452. |
| [6] | Ma Munan, Xie Jun, Sang Yuchao, Huang Lei, Zhang Guodong, Yang Xiaoli, Fu Songtao. Electroacupuncture combined with bone marrow mesenchymal stem cells in the treatment of chemotherapy-induced premature ovarian insufficiency in rats [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 1-7. |
| [7] | Zhang Yujuan, Yuan Yitong, Du Ruochen, Tian Feng, Fu Yuan, Wang Chunfang. miR-31 promotes the proliferation and migration of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 66-71. |
| [8] | Liu Siqi, Wu Mingrui, Qiao Lingran, Xie Liying, Chen Siyu, Han Zhibo, Zuo Lin. Effects of hydrogel loaded with human umbilical cord mesenchymal stem cells on diabetic wound repair in mice [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 21-27. |
| [9] | Wei Yanzhao, Zheng Xiaohan, Gao Shijun, Huang Ting, Wei Xufang, Chen Xinxu, Zhao Zhenqiang. Expression of autocrine macrophage migration inhibitory factor and its receptors of human embryonic stem cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 34-41. |
| [10] | Yang Yan, Wang Jingxian, Zhang Ronghong, Li Chen, Fan Anran, Cui Dongbing, Wu Shumei. Effects of conditioned media of different sources on the proliferation of human dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 49-53. |
| [11] | Lan Qian, Gu Yangcong, Xiao Xin, Bi Xueting, Li Na. Human periodontal ligament stem cells-derived exosomes interfere with the proliferation and differentiation of MC3T3-E1 cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 54-58. |
| [12] | Feng Hao, Zhang Bin, Wang Jianping. Bone marrow mesenchymal stem cell transplantation can improve bone metabolism in osteoporotic rats [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 72-75. |
| [13] | Liu Runyuan, Dong Ming, Han Wenqing, Dong Juhong, Niu Weidong. Application and progress of small extracellular vesicles in periodontal and pulp regeneration [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 83-90. |
| [14] | Liu Zhuoran, Jiang Ming, Li Yourui. Extracellular vesicles in chronic periodontitis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 99-104. |
| [15] | Huang Bin, Zheng Jinxu, Zhang Jun. Progress of non-coding RNAs in stem cell abnormality of idiopathic pulmonary fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 130-137. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||