肿瘤干细胞
-
图1|HepG2细胞分选前后生长情况

结果:经过多次实验优化,此次先采用免疫磁珠筛选CD133+HepG2细胞,然后又经干细胞培养基诱导、扩增的方案,能达到纯化的预期值。显微镜下观察磁珠分选前后HepG2细胞的生长状态,见图1。与分选前相比,分选后的细胞在倒置荧光显微镜下观察到聚合生长、悬浮成球的现象,并表现为透亮度增强。
图4|β-catenin-shRNA 慢病毒的感染效率(×100)

结果:慢病毒或慢病毒空载体转染CD133+HepG2细胞后,应用RT-PCR方法检测3种RNAi稳定干扰β-catenin的情况,结果显示RNAi-a以及RNAi-c的封闭效果达到90%,见图3,后续实验采用干扰能力最佳的RNAi-c干扰序列。病毒稳定感染获得β-catenin基因沉默的CD133+HepG2细胞(病毒干扰组)和病毒对照CD133+HepG2-shNC细胞(病毒空载组),转染72 h后通过倒置荧光显微镜观察细胞中病毒所带荧光的发光比例,见图4。此次实验显示β-catenin-shRNA 慢病毒的感染效率约90%,病毒转染效果良好,进行扩增、提纯后用于后续实验。
图5|β-catenin沉默后CD133+HepG2细胞克隆形成情况
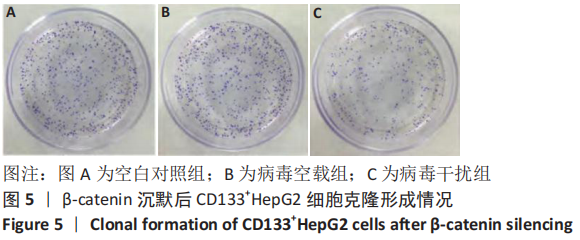
结果:利用平板细胞克隆形成实验检测各组CD133+HepG2细胞的增殖情况,见图5。与空白对照组、病毒空载组相比,病毒干扰组的克隆形成能力明显降低。利用流式细胞术检测各组CD133+HepG2细胞的细胞周期,见图6。与空白对照组、病毒空载组相比,病毒干扰组G0/G1期细胞百分比明显增多,S期细胞百分比和G2/M期细胞百分比降低(P < 0.05),见表2。
β-catenin基因沉默对肝癌干细胞干性转录因子的影响
发布日期: 2022-10-18 浏览:
449