干细胞与外泌体
-
图1|大鼠骨髓间充质干细胞鉴定结果
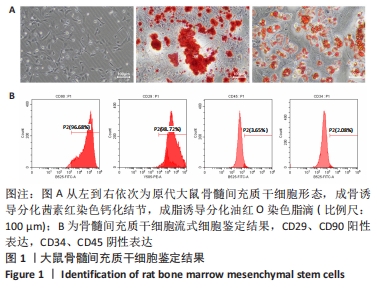
结果:通过组织块贴壁法提取了大鼠骨髓间充质干细胞,在原代培养24 h后可见有细胞从骨组织块中分离并贴壁。光学显微镜观察单个细胞形态呈梭形,成骨分化培养第25天,茜素红染色可见被染成红色的钙化结节,成脂分化培养第28天,油红O染色显示细胞内可见大量橙红色脂滴,见图1A。流式细胞仪检测显示骨髓间充质干细胞表面抗原CD29、CD90的阳性表达率分别为98.72%和96.68%,CD34和CD45的阳性表达率分别为2.08%和3.65%,见图1B。
图2|骨髓间充质干细胞来源外泌体鉴定结果
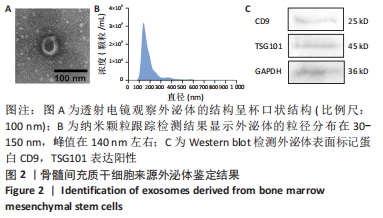
结果:透射电子显微镜观察显示外泌体呈杯口状结构,符合外泌体的基本特征,见图2A。纳米颗粒跟踪测定结果显示外泌体的粒径分布在30-150 nm之间,峰尺寸在140 nm左右,见图2B。Western blot检测进一步证实外泌体表面蛋白CD9和TSG101表达阳性,见图2C。这些结果表明已成功分离出骨髓间充质干细胞来源外泌体。
图3|成肌细胞摄取骨髓间充质干细胞来源外泌体(比例尺:20 μm)

结果:PKH26标记的外泌体与成肌细胞共同培养24 h,通过激光共聚焦显微镜观察发现成肌细胞的细胞核被DAPI标记呈蓝色,细胞骨架被Phalloidin标记为绿色,而大量被红色荧光PKH26标记的外泌体则出现在成肌细胞核的周围,这表明了成肌细胞能够摄取骨髓间充质干细胞来源外泌体,见图3。
图4|不同浓度氯化钴对成肌细胞增殖活性的影响
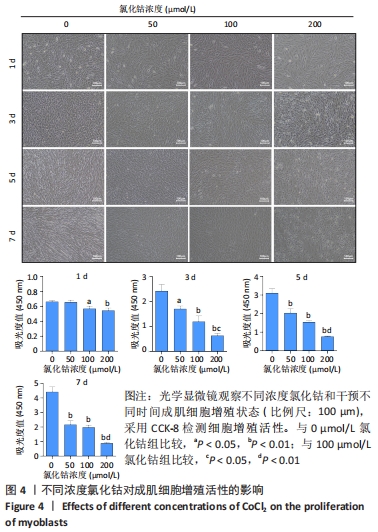
结果:分别用0,50,100,200 μmol/L氯化钴处理成肌细胞,在1,3,5,7 d后进行观察。如图4所示,与0 μmol/L 氯化钴组相比,100 μmol/L氯化钴和200 μmol/L 氯化钴处理成肌细胞1 d后细胞活性降低(P < 0.05),50 μmol/L 氯化钴组细胞活性未发生改变(P > 0.05),处理 3 d后所有氯化钴组细胞活性均显著降低,并且随着时间的延长,成肌细胞活性下降更加明显(P < 0.05)。与100 μmol/L 氯化钴组相比,200 μmol/L 氯化钴处理成肌细胞1 d后细胞活性无显著变化(P > 0.05),处理成肌细胞3 d后细胞活性显著下降(P < 0.05)。
图5|不同浓度氯化钴对成肌细胞分化的影响

结果:各组成肌细胞诱导分化5 d后,qRT-PCR统计结果显示,与0 μmol/L 氯化钴组比较,50,100,200 μmol/L 氯化钴组的成肌分化基因MyHC,MyoD,MyoG表达水平均显著性下降(P < 0.01)。用改良的吉姆萨染色试剂对分化5 d的成肌细胞进行肌管染色,结果显示0 μmol/L氯化钴组分化的肌管细胞质为蓝色,紫红色的细胞核呈线状排列,50,100,200 μmol/L 氯化钴组成肌细胞融合现象不明显,见图5。
图6|不同浓度氯化钴对成肌细胞活性氧和凋亡的影响
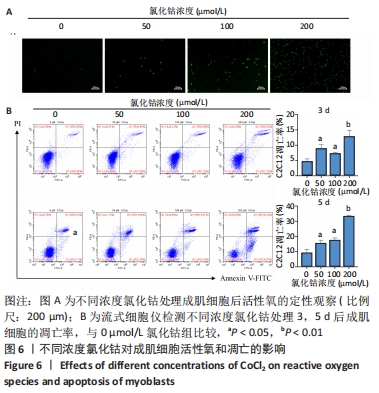
结果:流式细胞检测结果显示,干预3 d后0,50,100,200 μmol/L氯化钴组凋亡率分别为(4.40±1.13)%,(8.67±1.53)%,(7.03±0.63)%,(12.67±2.17)%;干预5 d后0,50,100,200 μmol/L氯化钴组凋亡率分别为(8.62±3.03)%,(15.09± 2.52)%,(17.16±1.88)%,(32.92±1.075)%。与0 μmol/L 氯化钴组相比,50,100,200 μmol/L 氯化钴组在干预3,5 d后均能显著增加成肌细胞的凋亡率(P < 0.05),见图6。0,50,100,200 μmol/L 氯化钴处理成肌细胞3 d后进行了活性氧定性观察,发现200 μmol/L氯化钴组活性氧检测的荧光相较于其他组产生了相对的变化,为后续实验垫定基础,见图6。综合考虑,后续实验选择200 μmol/L氯化钴处理成肌细胞3 d。
图7|外泌体降低成肌细胞活性氧水平和凋亡
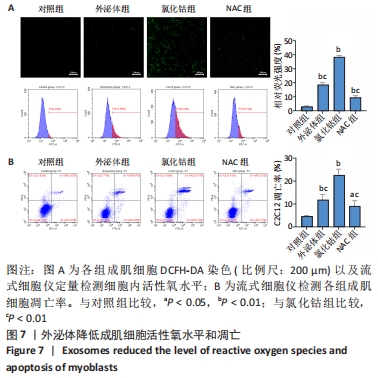
结果:与对照组、外泌体组、NAC组比较,氯化钴组中的成肌细胞凋亡率增加更明显(P < 0.01)。与氯化钴组比较,外泌体组和NAC组成肌细胞凋亡率显著降低(P < 0.01),这说明了外泌体组中的外泌体和NAC组中的NAC能够降低200 μmol/L氯化钴所诱导的成肌细胞缺氧凋亡。此外,结合荧光显微镜对成肌细胞内活性氧定性观察和流式细胞仪定量检测结果,氯化钴能够显著增加细胞内活性氧水平,外泌体和抗氧化剂NAC可以降低活性氧水平,见图7。