中国组织工程研究 ›› 2017, Vol. 21 ›› Issue (8): 1236-1240.doi: 10.3969/j.issn.2095-4344.2017.08.015
• 组织构建实验造模 experimental modeling in tissue construction • 上一篇 下一篇
大鼠骨质疏松伴颅骨极量缺损模型的建立
黄 馗1,罗道文1,王 雷1,罗世洪1,姚志浩1,李 勇1,肖金刚1,2
- 西南医科大学附属口腔医院,1口颌面修复重建和再生实验室, 2口腔颌面外科,四川省泸州市 646000
Establishing a rat model of osteoporosis with critical-size calvarial defects
Huang Kui1, Luo Dao-wen1, Wang Lei1, Luo Shi-hong1, Yao Zhi-hao1, Li Yong1, Xiao Jin-gang1, 2
- 1Orofacial Reconstruction and Regeneration Laboratory, 2Department of Oral and Maxillofacial Surgery, the Affiliated Stomatology Hospital of Southwest Medical University, Luzhou 646000, Sichuan Province, China
摘要:
文章快速阅读:
.jpg) 文题释义:
骨质疏松:是以骨量的减少、骨组织微细结构改变为主要特征,伴有骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨量减少是指骨矿物质如钙、磷和骨基质(骨胶原)的比例降低,表现为骨强度降低,在轻微外力作用下即可发生骨折。其最常见的症状是疼痛,其中以腰背痛最为常见,其次为驼背、身长缩短,更为严重者可发生骨折,甚至导致死亡。
骨极量缺损:又称之为临界骨缺损,是指动物依靠自身修复能力终身不能恢复的大型骨缺损,其可以最大程度地减少因为动物年龄、种系、骨缺损所在部位不同等因素对骨缺损愈合的影响,排除自身干扰,建立的骨缺损动物模型更可靠。颅骨极量缺损模型常成为评价骨缺损修复作用的首选,并且Schmiz等确定大鼠颅骨临界骨缺损为8 mm。
文题释义:
骨质疏松:是以骨量的减少、骨组织微细结构改变为主要特征,伴有骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨量减少是指骨矿物质如钙、磷和骨基质(骨胶原)的比例降低,表现为骨强度降低,在轻微外力作用下即可发生骨折。其最常见的症状是疼痛,其中以腰背痛最为常见,其次为驼背、身长缩短,更为严重者可发生骨折,甚至导致死亡。
骨极量缺损:又称之为临界骨缺损,是指动物依靠自身修复能力终身不能恢复的大型骨缺损,其可以最大程度地减少因为动物年龄、种系、骨缺损所在部位不同等因素对骨缺损愈合的影响,排除自身干扰,建立的骨缺损动物模型更可靠。颅骨极量缺损模型常成为评价骨缺损修复作用的首选,并且Schmiz等确定大鼠颅骨临界骨缺损为8 mm。
.jpg) 文题释义:
骨质疏松:是以骨量的减少、骨组织微细结构改变为主要特征,伴有骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨量减少是指骨矿物质如钙、磷和骨基质(骨胶原)的比例降低,表现为骨强度降低,在轻微外力作用下即可发生骨折。其最常见的症状是疼痛,其中以腰背痛最为常见,其次为驼背、身长缩短,更为严重者可发生骨折,甚至导致死亡。
骨极量缺损:又称之为临界骨缺损,是指动物依靠自身修复能力终身不能恢复的大型骨缺损,其可以最大程度地减少因为动物年龄、种系、骨缺损所在部位不同等因素对骨缺损愈合的影响,排除自身干扰,建立的骨缺损动物模型更可靠。颅骨极量缺损模型常成为评价骨缺损修复作用的首选,并且Schmiz等确定大鼠颅骨临界骨缺损为8 mm。
文题释义:
骨质疏松:是以骨量的减少、骨组织微细结构改变为主要特征,伴有骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨量减少是指骨矿物质如钙、磷和骨基质(骨胶原)的比例降低,表现为骨强度降低,在轻微外力作用下即可发生骨折。其最常见的症状是疼痛,其中以腰背痛最为常见,其次为驼背、身长缩短,更为严重者可发生骨折,甚至导致死亡。
骨极量缺损:又称之为临界骨缺损,是指动物依靠自身修复能力终身不能恢复的大型骨缺损,其可以最大程度地减少因为动物年龄、种系、骨缺损所在部位不同等因素对骨缺损愈合的影响,排除自身干扰,建立的骨缺损动物模型更可靠。颅骨极量缺损模型常成为评价骨缺损修复作用的首选,并且Schmiz等确定大鼠颅骨临界骨缺损为8 mm。摘要
背景:骨质疏松伴骨缺损疾病逐渐成为一个重要的社会健康问题。建立动物模型是研究该疾病的基础,且目前还没有关于建立该疾病动物模型的报道。
目的:建立骨质疏松伴颅骨极量缺损SD大鼠模型。
方法:将20只雌性SD大鼠随机分为2组,实验组行双侧卵巢切除,12周后再造8 mm颅骨极量缺损;对照组只摘除双侧卵巢周围同等质量的脂肪组织,12周后再造8 mm颅骨极量缺损。颅骨极量缺损后12周,检测离体股骨近端、胫骨远端三维骨矿含量、骨密度及血清碱性磷酸酶水平,并进行颅骨组织切片病理观察。
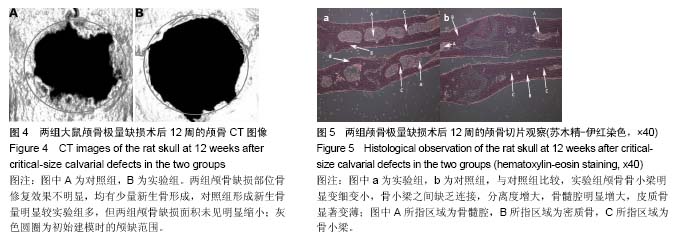
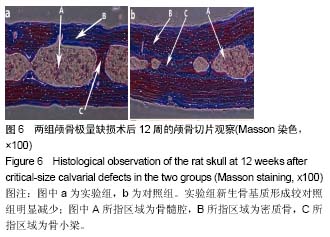
结果与结论:两组大鼠颅骨缺损区均未完全愈合,并且骨修复效果不明显,对照组形成新生骨量较实验组多;实验组股骨近端、胫骨远端的三维骨矿含量和骨密度均较对照组显著降低(P < 0.05),血清碱性磷酸酶水平较对照组明显升高(P < 0.05);与对照组比较,实验组颅骨骨小梁明显变细变小,骨髓腔明显增大,皮质骨显著变薄,新生骨基质形成明显减少。结果表表明,骨质疏松伴颅骨极量缺损SD大鼠模型建立成功。
中国组织工程研究杂志出版内容重点:组织构建;骨细胞;软骨细胞;细胞培养;成纤维细胞;血管内皮细胞;骨质疏松;组织工程
ORCID: 0000-0003-1300-7191(肖金刚)
中图分类号:

.jpg)
.jpg) 文题释义:
骨质疏松:是以骨量的减少、骨组织微细结构改变为主要特征,伴有骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨量减少是指骨矿物质如钙、磷和骨基质(骨胶原)的比例降低,表现为骨强度降低,在轻微外力作用下即可发生骨折。其最常见的症状是疼痛,其中以腰背痛最为常见,其次为驼背、身长缩短,更为严重者可发生骨折,甚至导致死亡。
骨极量缺损:又称之为临界骨缺损,是指动物依靠自身修复能力终身不能恢复的大型骨缺损,其可以最大程度地减少因为动物年龄、种系、骨缺损所在部位不同等因素对骨缺损愈合的影响,排除自身干扰,建立的骨缺损动物模型更可靠。颅骨极量缺损模型常成为评价骨缺损修复作用的首选,并且Schmiz等确定大鼠颅骨临界骨缺损为8 mm。
文题释义:
骨质疏松:是以骨量的减少、骨组织微细结构改变为主要特征,伴有骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨量减少是指骨矿物质如钙、磷和骨基质(骨胶原)的比例降低,表现为骨强度降低,在轻微外力作用下即可发生骨折。其最常见的症状是疼痛,其中以腰背痛最为常见,其次为驼背、身长缩短,更为严重者可发生骨折,甚至导致死亡。
骨极量缺损:又称之为临界骨缺损,是指动物依靠自身修复能力终身不能恢复的大型骨缺损,其可以最大程度地减少因为动物年龄、种系、骨缺损所在部位不同等因素对骨缺损愈合的影响,排除自身干扰,建立的骨缺损动物模型更可靠。颅骨极量缺损模型常成为评价骨缺损修复作用的首选,并且Schmiz等确定大鼠颅骨临界骨缺损为8 mm。