设计:随机对照动物实验。
时间及地点:实验于2009年8月至2010年5月在天津医科大学总医院研究所完成。
材料:
|
人端粒酶反转录酶表达的骨髓间充质干细胞移植治疗大鼠糖尿病实验所用主要试剂:
|
|
试剂
|
来源
|
|
胎牛血清、L-DMEM培养基
|
Hyclone公司
|
|
胰蛋白酶
|
Gibco BRL公司
|
|
链脲霉素、谷氨酞胺
|
Sigma公司
|
|
反转录病毒PLXSN-hTERT
|
Santa cruz公司,美国
|
|
0.01 mol/L pH7.2 PBS(粉剂)
|
福州迈新生物技术开发公司
|
|
RT-PCR两步法试剂盒
|
北京赛百盛基因技术有限公司
|
|
AMV反转录试剂盒
|
北京天根生化有限公司
|
|
耐热性TaqDNA 聚合酶
|
杭州博日科技有限公司
|
|
EDTA
|
天津市化学试剂一厂
|
|
人端粒酶反转录酶
|
美国Hyclone公司
|
|
PE标记的抗大鼠 CD31抗体、PE标记的抗大鼠 CD45抗体
|
KPL公司,美国
|
|
山羊抗兔抗体
|
美国BD公司
|
|
实验动物:1月龄健康雌性SD大鼠60只,雄性SD大鼠3只,体质量200-250 g,购自中国医学科学院动物实验室,动物质量合格证号:SCXK(津)20050002,实验中对动物处置方法符合动物伦理学要求。
实验方法:
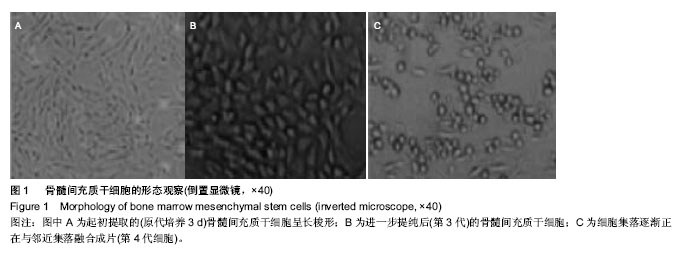
大鼠骨髓间充质干细胞的培养:取1月龄雄性SD大鼠处死,全身浸入体积分数为75%乙醇中消毒约10 min。无菌条件下分离双侧胫骨和股骨,剪除骨端,10号注射器抽取1 mL DMEM完全培养基自一端冲洗出骨髓,通过1.073 g/mL Percoll分离液离心30 min,制成单细胞悬液,以 3×107 L-1细胞浓度接种至100 mL低糖DMEM培养瓶中(含体积分数10%的胎牛血清、2 mmol/L L-谷氨酰胺、 10 g/L青霉素和链霉素),于37 ℃、体积分数为5% CO2饱和湿度孵箱内培养,24 h后完全弃去非贴壁细胞,以后每 3 d换液1次,倒置显微镜下观察细胞生长情况及形态变化,并按 1∶2比例传代,逐日观察细胞的生长情况。原代细胞培养8-10 d后基本铺满单层,待细胞相融合达到培养瓶底80%时,按3×107 L-1的细胞浓度传3代以上进行移植实验。
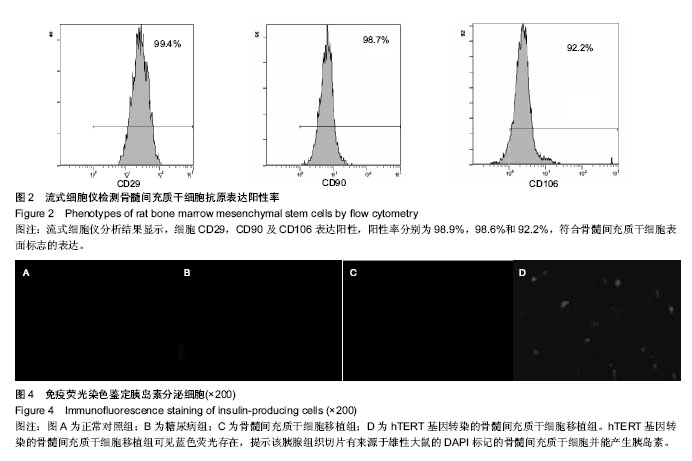
骨髓间充质干细胞的标记:第3代及第3代以后的骨髓间充质干细胞融合80%左右时,倒出培养瓶中液体,PBS洗2次,将DAPI染色液与含体积分数为10%胎牛血清的LG-DMEM按1∶1比例加入培养瓶中,放入37 ℃,体积分数为5%CO2培养箱中过夜。次日,PBS洗6次,以去掉多余的未结合的DAPI。倒置于荧光显微镜下观察骨髓间充质干细胞的标记情况。
PLXSN-hTERT转染:采用反转录病毒PLXSN介导的方法进行hTERT基因转染,将DAPI标记后的骨髓间充质干细胞以6×104/孔的密度接种于96孔板中,每孔加培养液至100 mL,置饱和湿度,体积分数为5%CO2,37 ℃恒温密闭式培养箱中常规培养,培养72 h后进行反转录病毒PLXSN-hTERT转染:待细胞融合率达到80%,弃掉上清液,并置无血清培养基中培养24 h后之后按感染倍数为105加入携带hTERT基因的反转录病毒载体(PLXSN-hTERT) 200 μL,使其彻底覆盖细胞培养面积,在37 ℃恒温下孵育2 h,之后分别加入适量胎牛血清和L-DMEM培养基,继续培养。
糖尿病大鼠模型制备及实验分组:60只雌性SD大鼠中随机取15只作为正常对照组,一次性注射等体积的生理盐水。余45只SD大鼠禁食12 h后,按45 mg/kg的剂量腹腔一次性经尾静脉注射链脲霉素(用前溶于柠檬酸盐缓冲液,pH 4.5),注射后1周内连续2次、间隔至少2 d测尾静脉血糖,血糖连续2次超过16.7 mmol/L,且具有多饮、多食、多尿,体质量减轻者为糖尿病造模成功。将糖尿病大鼠随机分为hTERT基因转染的骨髓间充质干细胞移植组、骨髓间充质干细胞移植组和糖尿病组,每组15只,造模后3 d分别通过大鼠尾静脉注射移植hTERT基因转染的骨髓间充质干细胞(细胞浓度为1×107 L-1)0.2 mL、骨髓间充质干细胞(细胞浓度为1×107 L-1)0.2 mL,生理盐水0.2 mL。
RT-PCR检测hTERT mRNA表达:基因转染前后第4代骨髓间充质干细胞经4 ℃离心弃去上清液后PBS冲洗3次,通过TRIzol法提取总RNA,RNA的含量应用紫外分光光度计测定,按照反转录合成试剂盒说明书进行反转录。引物序列设计为:hTERT上游引物为5’-CTG AAG TGT CAC AGC CTG TTT-3’,下游引物为5’-CAC ACA TGC GTG AAA CCT GTA-3’,产物大小111 bp;β-actin上游引物为5’-TAT CGG ACG CCT GGT TAC-3’,下游引物为5’-CTC AGC CTT GAC TGT GCC-3’,产物大小151 bp。PCR反应条件:95 ℃变性5 min,94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,循环36周期,72 ℃延伸7 min。产物于4 ℃保存。每一PCR反应重复3次。取5 mL的PCR产物进行电泳,以β-actin作为内参照,紫外透射反射仪观察扩增产物的大小及亮度并摄影,电泳后置GDSS000凝胶自动成像仪上拍照提取图像,Image-Pro Plus8.0软件分析hTERT条带与β-actin条带的灰度相对比值,进行mRNA半定量分析
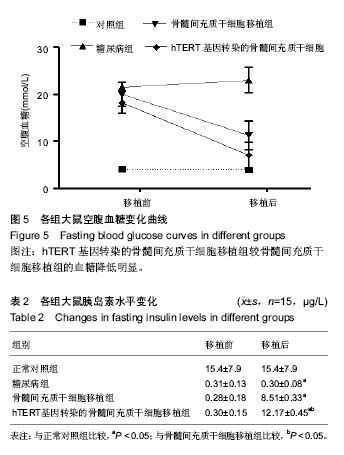
hTERT基因转染的骨髓间充质干细胞移植后功能学检测:移植后使用血糖仪纸片法尾静脉采血测定空腹血糖,每3 d测1次。移植后第14天,采集各组大鼠眶周血0.5 mL,离心以20 ℃保留血清,使用 ELISA 法检测血清中胰岛素水平。
hTERT基因转染的骨髓间充质干细胞对胰岛细胞再生的影响:hTERT基因转染的骨髓间充质干细胞移植后30 d以颈椎脱臼法处死大鼠,取出胰腺组织用PBS清洗后即冻于-70 ℃超低温冰箱中,做5 mm厚(用冰冻切片机)的连续切片,在倒置荧光显微镜下观察胰腺组织冰冻切片中DAPI标记的细胞分布情况。
主要观察指标:①骨髓间充质干细胞的形态学观察。②大鼠血糖及胰岛素水平变化。
统计学分析:采用SPSS 13.0软件包进行处理。计量资料以x±s表示,两组间连续变量比较用t 检验,以P < 0.05为差异有显著性意义。